心脏瓣膜病是心脏外科的常见疾病,瓣膜狭窄或关闭不全均可导致心脏负荷加重,导致心功能不全。长时间心房负荷过重,尤其是左心房扩大的患者,易出现心律失常,其中以心房颤动(atrial fabrillation,AF)为多见。AF是瓣膜病患者常见的并发症。可引起多种相关并发症,如心房血栓形成、脑卒中、周围动脉栓塞、心力衰竭等。55岁以上男、女患者AF的终生风险分别为为23.8%和22.2%[1]。心房扩大后,心房心肌细胞出现变形甚至纤维化,既使已行瓣膜置换手术,仍不能恢复窦性心律,并且药物治疗效果较差。导管射频消融手术是目前针对AF的较为普遍的治疗方法[2],通过介入心内膜射频消融可使部分AF患者能够转复为窦性心律,但从远期效果来看,复发率较高。外科迷宫手术可在直视下从心外膜进行射频消融,对于AF的治疗效果略优于导管消融,但对于部分AF相关的重要部位难以充分消融,难以保证治疗的有效性,仍存在较高的复发率。基于上述情况,学者们开始寻找更为有效的治疗措施,杂交手术的理念为AF的治疗提供了新的思路,通过内、外科手术结合,可使射频消融更为彻底,是否可提高AF的治愈率,近年来临床研究越来越广泛。本研究通过选取对瓣膜病变合并AF患者在行瓣膜病手术治疗同时分别进行杂交手术、单纯迷宫手术以及杂交手术,观察术后AF治疗效果,进一步评价杂交手术治疗AF的临床应用价值。
1 资 料 与 方 法
1.1 一般资料 选取2015年1月—2017年12月保定市第一中心医院收治的瓣膜病变需行瓣膜置换手术合并持续性AF的患者79例为研究对象。所有患者均行全身麻醉体外循环下瓣膜置换或成形手术,根据对于AF的治疗方式分为杂交手术组、单纯迷宫手术组及单纯介入消融组。3组一般资料比较差异无统计学意义(P>0.05),见表1。
表1 3组一般资料比较
Table 1 Comparison of general data in three groups of patients ![]()
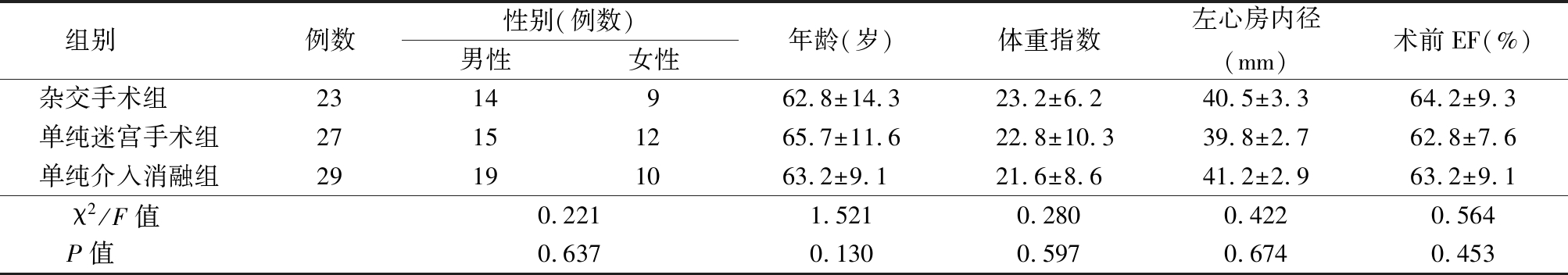
组别 例数性别(例数)男性女性年龄(岁)体重指数左心房内径(mm)术前EF(%)杂交手术组 2314962.8±14.323.2±6.240.5±3.364.2±9.3单纯迷宫手术组27151265.7±11.622.8±10.339.8±2.762.8±7.6单纯介入消融组29191063.2±9.121.6±8.641.2±2.963.2±9.1χ2/F值 0.2211.5210.2800.4220.564P值 0.6370.1300.5970.6740.453
EF:射血分数
1.2 纳入标准和排除标准 纳入标准:①心功能正常,可耐受手术治疗的心脏瓣膜病合并持续性AF患者;②无严重脑血管疾病;③不伴有需外科处理的严重冠状动脉狭窄;④3个月内无出血性疾病患者。排除标准:①有严重心功能不全,不能耐受手术的患者;②伴有较严重的脑血管疾患,围手术期脑血管意外风险较高的患者;③冠状动脉造影提示严重三支病变,或局限性狭窄>75%,需同期行冠状动脉搭桥手术的患者;④3个月内曾患有出血性疾病,如脑出血、消化道出血等,或3个月内曾发生脑梗死患者。
1.3 手术方法
1.3.1 杂交手术组 患者全身麻醉后,常规开胸,建立体外循环,主动脉根部灌注停跳液,心脏停跳后,无需进行电生理标测,按照既定的迷宫手术路径进行直视下双房射频消融,应用双极射频消融钳按照Cox-MazeⅢ的消融路线,充分游离左右上下肺静脉,切断Mershall韧带,分别在肺静脉入左心房开口处、左心耳以Atricure双极射频消融钳进行射频消融,隔离肺静脉。自右心耳至近下腔静脉处剪开右房壁,用再用双极射频消融仪分别向上下腔静脉、上下腔静脉连线中点、三尖瓣前瓣环中点行迷宫状透射频消融,再沿左心房房间沟切开左心房,分别向左心耳、二尖瓣后瓣环中点、垂直于左右肺静脉连线中点等部位行左房壁迷宫状透壁射频消融术,专用切割闭合器切除左心耳,闭合左心房。以上消融路径各进行3~5次消融不等,总时间20~30 min,射频消融完成后进行常规瓣膜置换或成形手术。手术操作完成后复温,心脏复跳良好后,逐步停体外循环,留置起搏导线,关胸,术毕。术后恢复良好出院后,于术后3个月,无论是否维持窦性心律,均于心内科就诊,通过经皮介入导管进行心内膜标测,对外科难以消融到的二尖瓣峡部、三尖瓣峡部以及外科治疗后尚未完全透壁消融部位进行补消融。术后规律口服胺碘酮片1个月。
1.3.2 Cox-Maze组 具体方法同杂交手术组外科手术部分,不再详述。术后同样需口服胺碘酮片1个月。
1.3.3 单纯介入消融组 全身麻醉后,常规开胸,建立体外循环,主动脉根部灌注停跳液,心脏停跳后不再进行射频消融的治疗,直接进行瓣膜置换或成形手术,术后复温、撤除体外循环,术后恢复良好后出院。并在术后3个月时就诊于心内科,行导管射频消融治疗。应用三维标测系统,利用磁场定位技术进行电解剖标测和指导消融。以冠状静脉窦近端电极A波为系统时间参考。在被标测心腔内逐点移动冷盐水灌注导管,应用三维电解剖标测系统构建被标测心腔三维构型,明确解剖标志,如上、下腔静脉、冠状窦和房室环等。分别显示电压标测、激动标测的结果。确定心动过速的类型和消融的关键部位,预设消融线径。应用冷盐水灌注导管,功率15~40 W,温度43~45 ℃。治疗结束后继续规律口服胺碘酮片1个月。
1.4 观察指标 对3组的手术时间、体外循环时间、外科术后24 h引流量、术后呼吸机辅助时间、内科介入手术时间、术后随访各个时间点AF治愈率、心功能等指标进行比较。
1.5 统计学方法 应用SPSS 20.0统计软件分析数据。计量资料比较采用独立样本的t检验、单因素方差分析和重复测量的方差分析;计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 3组术中情况比较 3组均在体外循环下完成瓣膜置换手术,手术过程相似,并且由于射频消融手术径线固定,无需术中进行标测,3组的手术时间、体外循环转机时间、主动脉阻断时间、术后引流量以及术后呼吸机辅助时间比较差异无统计学意义(P>0.05),见表2。杂交手术组内科介入手术时间短于单纯介入消融组,差异有统计学意义(P<0.05)。3组手术均成功,无手术死亡,其中杂交手术组1例患者因开胸手术后引流较多,二次开胸止血,二次手术后恢复良好,并顺利于术后3个月进行介入治疗。术后出现低心排患者2例,其中杂交手术组1例,单纯迷宫手术组1例,均经药物治疗好转,后心功能恢复良好。无应用主动脉球囊反搏病例。
表2 3组术中情况比较
Table 2 Intraoperative comparison of three groups ![]()
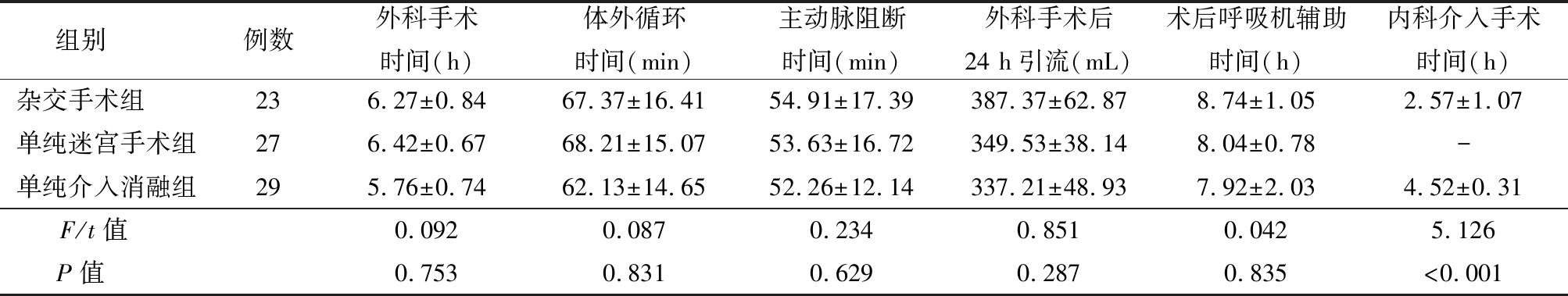
组别 例数外科手术时间(h)体外循环时间(min)主动脉阻断时间(min)外科手术后24 h引流(mL)术后呼吸机辅助时间(h)内科介入手术时间(h)杂交手术组 236.27±0.8467.37±16.4154.91±17.39387.37±62.878.74±1.052.57±1.07单纯迷宫手术组276.42±0.6768.21±15.0753.63±16.72349.53±38.148.04±0.78-单纯介入消融组295.76±0.7462.13±14.6552.26±12.14337.21±48.937.92±2.034.52±0.31F/t值 0.0920.0870.2340.8510.0425.126P值 0.7530.8310.6290.2870.835<0.001
2.2 3组AF治愈率的比较 所有患者术后1年内无失访,分别瓣膜置换术后3,6,9,15个月(即杂交手术组及单纯介入消融组介入术后1,3,6,12个月)时复查心电图,3个月时,HR及Cox-Maze组患者均可维持为窦性心律,单纯介入消融组有1例患者再次转为AF心律,后各组患者维持窦性心律患者数量逐渐减少,至15个月时心电图维持为窦性心律的患者:杂交手术组为19例,Cox-Maze组为21例,单纯介入消融组为17例。杂交手术组9个月及15个月AF治愈率高于单纯迷宫手术组和单纯介入消融组,单纯迷宫手术组9 个月及15个月AF治愈率高于单纯介入消融组,差异有统计学意义(P<0.05)。见表3。
表3 3组AF治愈率的比较
Table 3 Comparison of cure rates of AF in three groups (例数,%)
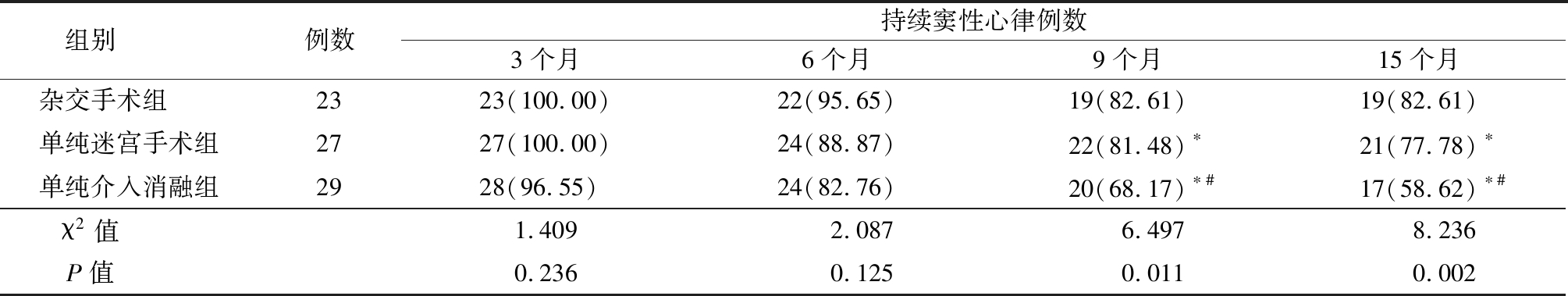
组别 例数持续窦性心律例数3个月6个月9个月15个月杂交手术组 2323(100.00)22(95.65)19(82.61)19(82.61)单纯迷宫手术组2727(100.00)24(88.87)22(81.48)∗21(77.78)∗单纯介入消融组2928(96.55) 24(82.76)20(68.17)∗#17(58.62)∗#χ2值 1.4092.0876.4978.236P值 0.2360.1250.0110.002
*P值<0.05与杂交手术组比较 #P值<0.05与单纯迷宫手术组比较(χ2检验)
2.3 3组术后随访12个月的心功能情况 所有患者每次复查超声心动图,并记录射血分数(ejection fraction,EF)值,术后随访期内患者心功能呈逐渐上升趋势,3组时点间、组间·时点间差异有统计学意义(P<0.05)。见表4。
表4 3组术后随访12个月的心功能情况
Table 4 The heart function of the three groups of patients at 12-month follow-up ![]()
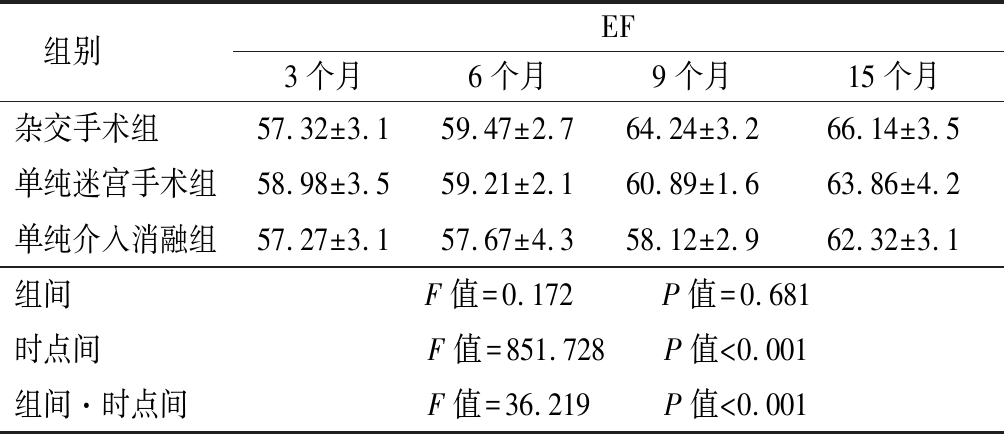
组别 EF3个月6个月9个月15个月杂交手术组 57.32±3.159.47±2.764.24±3.266.14±3.5单纯迷宫手术组58.98±3.559.21±2.160.89±1.663.86±4.2单纯介入消融组57.27±3.157.67±4.358.12±2.962.32±3.1组间 F值=0.172 P值=0.681时点间 F值=851.728 P值<0.001组间·时点间 F值=36.219 P值<0.001
3 讨 论
AF是临床最为常见的心律失常,心脏瓣膜病变合并AF的比例可达到60%以上,并且随着年龄增长,其发病率逐渐增高[3],由于AF导致心脏内部血流动力学发生明显变化,极其容易形成左心房血栓,血栓脱落导致动脉栓塞及脑卒中风险大大增加。另外,由于心动节律的改变,导致心内结构,心肌收缩力发生变化,容易导致心脏排血量减低,尤其是在行心脏瓣膜置换手术的患者中,AF可明显增加术后出现心力衰竭的发生率,对心脏手术患者的术后恢复造成严重影响[4]。因此针对AF的治疗越来越受到人们的关注,对于AF发病基础及临床研究有了较大的进展[5]。通常对于AF的药物治疗效果并不理想[6],在药物抗凝预防栓塞方面具有一定的意义[7]。内科导管射频消融术是目前针对AF治疗比较普遍的方法,并且随着治疗经验的增加,对于阵发性AF治疗的成功率逐渐增加,但对于持续性AF效果欠佳[8],常需要多次反复进行治疗。分析原因可能为某些对于AF维持的重要解剖结构位于心外膜,如Marshall韧带、心脏脂肪垫等,射频消融无法彻底损毁这部分结构[9],外科对于AF治疗迷宫手术最早由Cox于1991年报道,其方法是在开胸,建立体外循环后,对心脏表面特定的路径进行切割及缝合。此种治疗可获得较高的治愈率,并且手术可以同时切除左心耳,降低日后发生卒中的风险。但手术难度大,对术者的技术要求较高,并且因为需要对心脏进行切割及缝合,出血相关并发症发生概率明显升高,因此这种手术方式未能得到广泛应用。随着技术的不断发展,人们逐渐发现,相对于冷冻、微波、高强度聚焦超声等方法,射频消融最为可靠有效,并且在全世界范围内应用最为广泛。射频消融技术应用于外科领域,可大大降低手术的出血风险,通过射频技术改良后的迷宫手术,除了具有治愈率高的优点外[10],出血风险的降低促使改良迷宫手术得以在临床推广。但对于二尖瓣峡部、三尖瓣峡部等AF相关的重要部位难以充分消融[11],并且虽双极射频消融钳的出现可提高消融的透壁性,但仍难以达到100%的透壁。有研究证实,内科射频消融术后AF复发的主要原因是由于心脏电重构过程中左心房-肺静脉间电连接恢复或产生新的非肺静脉起源的异位灶[12],如前所述,通过介入进行射频消融的方法,虽然创伤小、恢复快,但其最大的缺点在于,很难做到每一条消融线都能达到彻底的双向阻滞,并且内科射频消融对于膈神经的损伤[13-14]而这种缺陷是可以通过外科技术来弥补的。在外科手术过程中在直视下对于膈神经附近的消融径线进行彻底消融,可以轻松避开膈神经,避免膈神经的损伤。因此,为进一步提高手术疗效,学者们逐渐尝试将内科射频消融及外科改良迷宫手术两者相结合的杂交手术,该手术融合了内外科技术上各自的优点,相互取长补短,避免了内科射频消融复发率高、外科治疗创伤大并且无电生理支持的缺点,更重要的是对于各个路径可以达到最为彻底,透壁的消融,进而达到最大程度降低复发率的目的[15]。
本研究显示,治疗初级,各组均有较高的治愈率,但随着时间的延长,各组的治愈率均有不同程度降低,其中以单纯介入消融组降低最为明显,至1年时杂交手术组仍可保持约84.31%的治愈率,明显高于其他两组(分别为77.78%及58.62%),这一结果与其他研究结果相当[16],杂交手术对于AF尤其是对于持续AF的治疗效果更好。如前所述,因为AF会导致心脏出现心内结构以及心肌收缩力的变化,尤其是反复出现快速AF的患者,很容易出现心功能不全,纠正AF对于预防远期的心功能不全有着显著的意义。本次研究通过对患者术后心功能恢复情况的比较我们能够发现,手术后3个月内,各组之间心功能相似,但随着时间的延长,对于AF治愈率较高的杂交手术组其EF值高于其他两组,因此我们可以得出结论,对于AF的患者接受杂交手术治疗对于其远期心功能的恢复会有更大的益处。
杂交手术从手术时间上来分可以分为同期杂交手术及分期杂交手术[17]。同期杂交手术需要专门的杂交手术室,对医疗设备要求比较高,并且需要心内科及心外科医生良好的合作,随着医疗技术的发展,国内越来越多的心脏中心开始开展这种治疗方式,我院目前尚未有专门的杂交手术室进行同期杂交手术,有待于日后的进一步开展。另一种为分期杂交,也就是我们本次研究所用的手术方案,先进性外科手术,术后3个月在于心内导管室进行内科射频消融,在时间轴上达到“杂交”的目的及效果。如单纯的AF患者,无需瓣膜置换手术,也可以根据患者的具体情况,在外科和内科治疗先后顺序进行选择。但分期杂交手术效果是否与同期杂交手术治疗相当,由于条件限制我们目前尚无法进行相应研究,并且本次研究的样本量较少,有待于日后扩大样本量进一步探讨。
综上所述,内外科杂交手术为瓣膜病合并AF的患者针对AF的治疗提供了更好的选择。这种治疗方式可以更有效的治愈AF,通过与单一的外科手术及内科射频消融对比,它的远期复发率明显降低。并且通过对AF治愈率的提高,患者远期心功能可以得到更好的恢复,明显降低远期心功能不全的发生概率。是一种新型、有效的治疗方法,它是新型医疗技术及医疗理念的融合及革新,随着微创治疗理念的不断深入人心,这项技术可不断更新,随着医疗技术的发展,杂交手术治疗AF将更广泛地应用于临床。
[1] 曾莉钧,姜运秋,田颖,等.持续性心房颤动内外科杂交消融手术进展[J].心血管病学进展,2017,38(1):1-3.
[2] 师静,米惠茹,张炜冉.心房颤动患者经导管射频消融治疗的围术期护理[J].河北医科大学学报,2016,37(6):731-733.
[3] 李岩,胡继强,林谦,等.51例房颤射频消融患者证候分析[J].中国中医基础医学杂志,2016(10):1363-1365.
[4] 赖轶权,匡锋,郭宏伟,等.瓣膜置换同期双极射频消融治疗心房颤动的早期疗效分析[J].福建医科大学学报,2018,52(1):29-32.
[5] 曹永科,曹勇,李小芳,等.外科射频消融改良迷宫术治疗大左心房心脏瓣膜病并发心房颤动的临床疗效[J].中国循环杂志,2018,33(3):266-269.
[6] 朱锦富,黄浩彬,吴延虎.同期房颤外科消融的围术期安全性研究——基于倾向值匹配分析[J].南京医科大学学报(自然科学版),2018,38(2):236-238.
[7] 张萍,张虹.利伐沙班在房颤患者抗凝治疗中的应用研究进展[J].山东医药,2016,56(48):109-112.
[8] 任訾娟,徐健.房颤患者射频消融的临床疗效及术后早期复发的危险因素[J].山东医药,2018,58(33):21-24.
[9] 李浩杰,郑哲,孟颖,等.胸腔镜下外科消融和复合技术治疗持续性心房颤动的病例对照研究[J].中国胸心血管外科临床杂志,2018,25(10):26-30.
[10] 陈德海,张培喜.瓣膜置换同期房颤射频消融术后心律失常的防治[J].中国医药科学,2016,6(6):140-142.
[11] 王岩,孟纯阳.杂交手术治疗心房颤动的研究进展[J].上海医药,2016,37(19):51-53.
[12] Pallisgaard JL,Gislason GH,Hansen J,et al. Temporal trends in atrial fibrillation recurrence rates after ablation between 2005 and 2014:a nationwide Danish cohort study[J]. Eur Heart J,2018,39(6):442-449.
[13] 王竟悟,鲍正宇.射频消融术后膈神经损伤及远期恢复1例报道[J].现代医药卫生,2016,32(20):3259-3260.
[14] 陶文其,孙育民,曹宾,等.心房颤动射频导管消融术后致右侧膈神经损伤一例[J].中华心律失常学杂志,2017,21(1):78.
[15] 罗晓康,张冬,张宏,等.杂交手术技术治疗心房颤动的研究进展[J].中华心血管病杂志,2017,45(5):454-456.
[16] 郭志刚.杂交技术在心脏外科中的应用进展[J].天津医药,2018,46(5):449-453.
[17] 梅举,姜兆磊,刘兴鹏,等.微创外科-导管杂交消融术在长程持续性房颤治疗中的应用及疗效[J].中华胸心血管外科杂志,2018,34(12):724-728.