食管癌(esophageal cancer, EC)是临床常见的恶性肿瘤之一, 进行性吞咽困难为典型症状。食管癌患者行肿瘤病灶切除仍是可切除食管癌的有效治疗方法,然而术后患者局部复发或远处转移率高达40%~60%,是导致食管癌患者病死率的主要原因。肿瘤炎性微环境可以促进肿瘤的增殖、迁移、转移和血管生成[1]。滤泡辅助性T细胞( T follicular helper cell,Tfh) 属于CD4+ T细胞亚群,是肿瘤间质浸润性炎性细胞的重要组成部分[2]。Tfh细胞表达CXC趋化因子受体5(CXC chemokine receptor type 5, CXCR5)、趋化因子(CXC基元)配体13(CXC chemokine ligand 13,CXCL-13)、程序性细胞死亡1(programmed cell death-1,PD-1)等表面分子, 并且分泌白细胞介素21( interleukin-21,IL-21),在B细胞的分化成熟、分泌高亲和力抗体及建立长期体液免疫等过程中扮演重要角色。研究发现,Tfh细胞参与了免疫风湿性疾病,过敏性疾病及免疫缺陷型疾病的发生发展过程[3-6],近年来,众多学者开始探索其在肿瘤领域的应用,尤其是在肿瘤炎性微环境中的功能。目前Tfh细胞在食管癌领域的研究尚不够深入,通过对Tfh细胞及相关因子的研究,可以增进对食管癌炎性微环境及免疫逃逸机制的认识,并为食管癌早期诊断及复发监测提供依据。前期研究发现,食管鳞状细胞癌患者血清中Tfh细胞相关因子PD-1水平较正常人增高[7-8]。本研究采用酶联免疫吸附(enzyme-linked immunosorbent assay,ELISA)方法,收集初诊收治的食管鳞状细胞癌患者及同时期的健康人作为研究样本,通过对比分析食管鳞状细胞癌患者及健康人对照组外周血中Tfh细胞相关分子可溶性CXCR5(soluble CXCR5,sCXCR5)、可溶性CXCL-13(soluble CXCL-13,sCXCL-13)及IL-21的表达水平,并结合临床病理特征及手术干预分析其对sCXCR5、sCXCL13及IL-21的影响,探讨Tfh细胞相关因子在食管鳞状细胞癌疾病发病机制上的意义。
1 资 料 与 方 法
1.1 一般资料 选取我院2016年6月—2017年4月收治的原发性食管鳞状细胞癌患者65例,男性48例,女性17例。入选标准:①经组织病理检查确诊为食管鳞状细胞癌的患者;②未接受化放疗及免疫靶向治疗者;③无免疫系统疾病及严重感染或器官功能受损的病例者,收集同期我院体检中心性别和年龄相匹配的30名健康体检者为对照组,其中男性20例,女性10例,年龄53~72岁。
本研究经医院伦理委员会批准,患者及家属知情同意并签署知情同意书。
1.2 主要试剂及仪器 人sCXCR5、sCXCL13及IL-21 ELISA试剂盒。
1.3 方法
1.3.1 标本的收集及处理 普通促凝真空管收集食管鳞状细胞癌患者及正常对照组清晨空腹血5 mL,手术患者术后第5天继续采血5 mL。室温静置30 min,离心后取上清液置于-80 ℃冰箱冻存备用。
1.3.2 血清中sCXCR5、sCXCL13及IL-21检测 ELISA法检测患者及正常对照组血清sCXCR5、sCXCL13及IL-21的含量,操作步骤严格按照试剂盒说明书进行。
1.4 统计学方法 应用SPSS 24.0统计软件分析数据。计量资料比较采用t检检;不同病理特征组之间表达差异采用χ2检验;sCXCR5、sCXCL13及IL-21相关性分析采用Spearman方法。P<0.05为差异有统计学意义。
2 结 果
2.1 食管鳞状细胞癌组与正常对照组血清中sCXCR5、sCXCL13及IL-21表达水平 食管鳞状细胞癌组血清sCXCR5、sCXCL13及IL-21水平高于正常对照组,差异有统计学意义(P<0.05)。见表1。
表1 食管鳞状细胞癌实验组与健康人对照组血清中
sCXCR5,sCXCL13及IL-21表达水平比较
Table 1 Levels of circulating serum sCXCR5, sCXCL13 and IL-21 between ESCC and healthy group ![]()
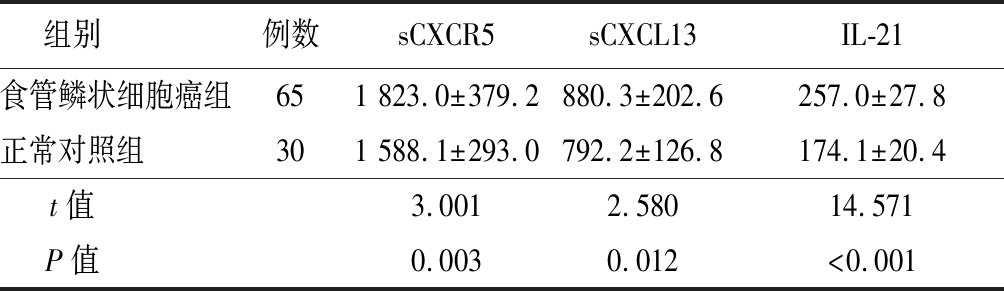
组别 例数sCXCR5sCXCL13IL-21食管鳞状细胞癌组651 823.0±379.2880.3±202.6257.0±27.8正常对照组 301 588.1±293.0792.2±126.8174.1±20.4t值 3.0012.58014.571P值 0.0030.012<0.001
2.2 食管鳞状细胞癌组手术前后血清中sCXCR5,sCXCL13及IL-21表达水平 食管鳞状细胞癌组手术前后血清中sCXCR5、sCXCL13及IL-21表达水平差异无统计学意义(P>0.05)。见表2。
表2 食管鳞状细胞癌组手术前后患者血清中
sCXCR5、sCXCL13及IL-21表达水平比较
Table 2 Levels of circulating serum sCXCR5,sCXCL13 IL-21 before and after operation in ESCC group ![]()
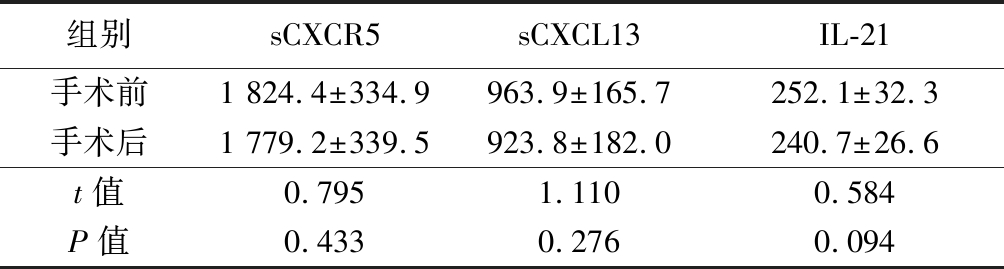
组别sCXCR5sCXCL13IL-21手术前1 824.4±334.9 963.9±165.7252.1±32.3手术后1 779.2±339.5923.8±182.0240.7±26.6t值0.7951.1100.584P值0.4330.2760.094
2.3 食管鳞状细胞癌组血清中sCXCR5、sCXCL13及IL-21表达水平与临床病理特征的关系 血清中sCXCL13和IL-21的表达水平与临床病理特征无明显相关(P>0.05),sCXCR5的表达水平肿瘤体积大小相关(P<0.05)。见表3。
表3 食管鳞状细胞癌组患者血清中sCXCR5、sCXCL13及
IL-21在不同病理特征组之间表达的比较
Table 3 Comparison of the expression of sCXCR5,sCXCL13 and IL-21 in the serum of patients with esophageal squamous cell carcinoma between groups with different pathological characteristics
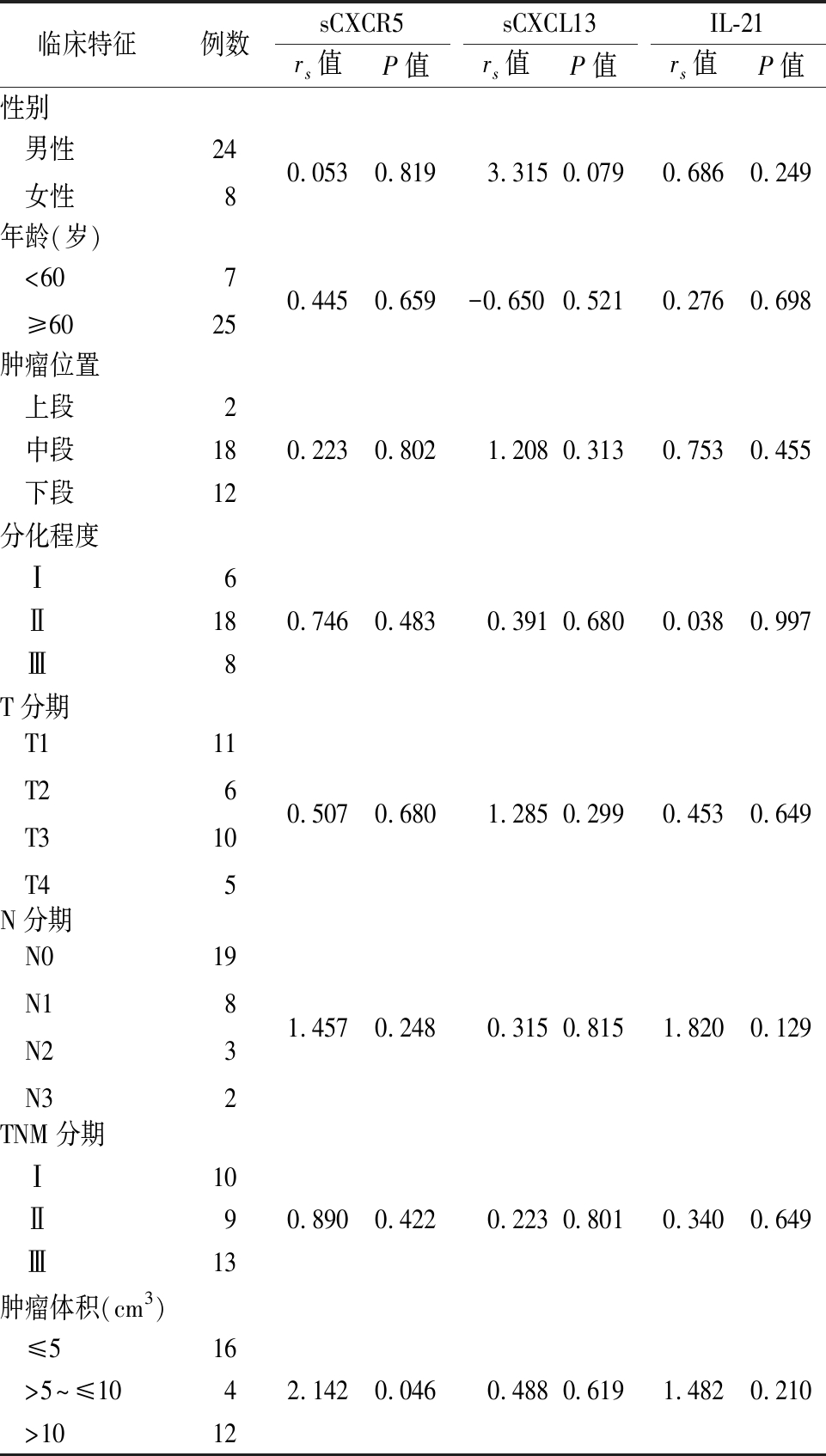
临床特征例数sCXCR5 rs值P值sCXCL13rs值P值IL-21rs值P值性别 男性 女性2480.053 0.819 3.315 0.0790.686 0.249 年龄(岁) <60 ≥607250.445 0.659-0.650 0.5210.276 0.698 肿瘤位置 上段2 中段180.223 0.802 1.2080.3130.7530.455 下段12分化程度 Ⅰ6 Ⅱ180.7460.483 0.3910.6800.0380.997 Ⅲ8T分期 T1 T2 T3 T41161050.507 0.680 1.2850.2990.4530.649N分期 N0 N1 N2 N3198321.4570.248 0.3150.8151.8200.129TNM分期 Ⅰ10 Ⅱ90.8900.422 0.2230.8010.3400.649 Ⅲ13肿瘤体积(cm3) ≤516 >5~≤1042.1420.046 0.4880.6191.4820.210 >1012
2.4 食管鳞状细胞癌组血清中sCXCR5,sCXCL13及IL-21相关性分析 食管鳞状细胞癌患者外周血清中sCXCR5、sCXCL13及IL-21所得数据呈非正态分布,故行Spearman相关性分析,结果所示,sCXCR5与sCXCL13无相关性(r=-0.152,P>0.05);sCXCR5与IL-21无相关性(r=0.112,P>0.05);IL-12与sCXCL13无相关性(r=0.263,P>0.05)。
3 讨 论
最新的研究数据表明,食管癌在世界常见恶性肿瘤排名中位于第8位,其病死率居第6位[9]。我国属于食管癌高发国家,其发病率在恶性肿瘤中约为第6位,病死率居第4位。食管鳞状细胞癌为最主要组织病理学类型,其百分比占食管癌发病率的90%以上[10-11]。目前食管癌的治疗方式主要为手术、内镜切除及放化疗,但预后仍然较差,病死率未得到根本改善。加深对食管癌免疫逃逸机制的探索,深入开展食管癌免疫微环境的基础研究,成为食管癌治疗的当务之急。与胃肠道肿瘤研究类似,食管癌分子机制的主要研究集中在肿瘤细胞本身,即致癌基因的活化(如cyclin D1和EGFR)和抑癌基因的失活(如TP53,p120catenin,E-钙黏蛋白)[12-14]。但是,越来越多的证据表明,肿瘤细胞所处的微环境也是食管癌发生的必要因素。这些外环境中包括免疫细胞、活性成纤维细胞、脂肪细胞、细胞外基质、内皮细胞、血管周细胞、神经元等,这些因素构成了肿瘤赖以生存的微环境。肿瘤微环境在抑制肿瘤细胞凋亡,诱导免疫逃避,促进肿瘤细胞增殖,血管生成,侵袭和转移等方面起到了一定促进作用[15-16]。
Tfh细胞是辅助性CD4+T细亚群,属于肿瘤微环境中免疫细胞的重要组成部分,能持续分泌CXCR5,后者与趋化因子CXCL13结合后使Tfh细胞迁移至滤泡区参与生发中心的形成。在可诱导共刺激分子(inducible T cell co-stimulator,ICOS)与CD40L共同作用下,Tfh细胞分泌效应因子IL-21发挥重要的免疫作用。Tfh细胞不仅与自身免疫性疾病、感染性疾病及免疫缺陷型疾病相关,目前越来越多的学者也开始探索其在肿瘤领域的应用。研究表明,在淋巴系统肿瘤中,浸润性的Tfh细胞与较差的预后相关,然而在非淋巴系统肿瘤中Tfh细胞与较好的预后相关[17-19]。
已有研究表明,Tfh细胞趋化因子CXCR5及其配体CXCL13在肿瘤细胞的增殖及发展中具有重要影响。Qi等[20]研究发现,在结直肠癌晚期患者中,CXCR5及CXCL13的表达水平与结直肠肿瘤的远处转移、TNM分期、分化程度、神经浸润等因素密切相关。Duan等[21]研究指出肝细胞癌患者血清中游离的CXCL13上升,与肝癌术后的复发率存在一定相关性。Ohandjo等[22]研究表明,CXCR5及CXCL13的表达水平与前列腺癌患者病情严重程度呈正相关性。Stolfi等[23]研究表明,IL-21可增强炎性微环境并促进了结肠炎相关结肠癌的发展,阻断IL-21可能会降低结肠炎相关结肠癌的发病风险。本研究结果发现,食管鳞状细胞癌组血清中sCXCR5、sCXCL13、IL-21水平较正常对照组增高,这与上述学者的研究观点大致相同。同时,发现食管癌术后患者,血清中sCXCR5、sCXCL13及IL-21未发生明显改变,这可能与患者术后第5天机体仍依然处于应激有关。针对食管鳞状细胞患者的临床病理特征与sCXCR5、sCXCL13及IL-21表达水平相关性分析,发现血清中sCXCR5表达水平与食管鳞状细胞患者的肿瘤体积大小相关,提示sCXCR5表达水平与肿瘤负荷情况有一定相关性。
本研究还有许多不足:只监测了患者术后第5天外周血清中sCXCR5、sCXCL13及IL-21表达情况,应进一步延长监测时间,了解患者免疫状态,观察与患者病情变化的关系;检测食管鳞状细胞癌患者组织中sCXCR5、sCXCL13及IL-21的水平,追踪观察患者的生存期,明确是否与外周血清中sCXCR5、sCXCL13及IL-21表达有相关性,可否作为预后指标;增加检测手段进行论证,如流式细胞术、Western蛋白水平及PCR基因水平的检测。
近年来,滤泡调节性T细胞(T follicular regulatory cell,Tfr)在自身免疫性疾病与肿瘤的研究中成为热点。Tfr细胞属于Treg细胞亚型,来源于天然Treg细胞。Tfr细胞不仅可以表达Treg细胞相关的抑制性调节因子,还具有Tfh细胞的特性,可表达CXCR5、ICOS等因子。在功能方面,Tfr细胞通过抑制Tfh和B细胞来特异性地控制生发中心的应答[24]。研究表明,Tfh与Tfr在非小细胞肺癌、乳腺癌、卵巢癌、淋巴瘤等癌种的疾病进展中发挥重要作用[25-28]。相信通过对食管鳞状细胞癌中Tfh与Tfr的深入研究,可以加深对食管鳞状细胞癌炎性微环境的理解,为食管鳞状细胞癌的治疗提供新的方向。
[1] Wu T,Dai Y. Tumor microenvironment and therapeutic response[J]. Cancer Lett,2017,387:61-68.
[2] Rawal S,Chu F,Zhang M,et al. Cross talk between follicular helper T cells and tumor cells inhuman follicular lymphoma promotes immune evasion in the tumor microenvironment[J].J Immunol,2013,190(12):6681-6693.
[3] Kamekura R,Takano K,Yamamoto M,et al. Cutting edge:a critical role of lesional T follicular helper cells in the pathogenesis of IgG4-related disease[J]. J Immunol,2017,199(8):2624-2629.
[4] Xu B,Wang S,Zhou M,et al. The ratio of circulating follicular T helper cell to follicular T regulatory cell is correlated with disease activity in systemic lupus erythematosus[J]. Clin Immunol,2017,183:46-53.
[5] Buranapraditkun S,Pissani F,Teigler JE,et al. Preservation of peripheral T follicular helper cell function in HIV controllers[J]. J Virol,2017,91(14):e00497-17.
[6] Schulten V,Tripple V,Seumois G,et al. Allergen-specific immunotherapy modulates the balance of circulating Tfh and Tfr cells[J]. J Allergy Clin Immunol,2018,141(2):775-777.e6.
[7] 郝贺,李幸,郭晓金,等.食管鳞状细胞癌患者外周血PD-1和PD-L1的表达及其临床意义[J].中国肿瘤生物治疗杂志,2017,24(10):1118-1123.
[8] 郝贺,李幸,吴玲彦,等.PD-1,CTLA-4,BLTA在食管鳞状细胞癌患者外周血中的表达及临床意义[J].实用肿瘤学杂志,2018,32(4):303-308.
[9] Siegel RL,Miller KD,Jemal A. Cancer statistics,2019[J]. CA Cancer J Clin,2019,69(1):7-34.
[10] Siewert JR,Ott K. Are squamous and adenocarcinomas of the esophagus the same disease?[J]. Semin Radiat Oncol,2007,17(1):38-44.
[11] 毛友生,赫捷,程贵余. 我国食管癌外科治疗的现状与未来对策[J]. 中华肿瘤杂志,2010,32(6):401-404.
[12] Sunpaweravong P,Sunpaweravong S,Puttawibul P,et al. Epidermal growth factor receptor and cyclin D1 are independently amplified and overexpressed in esophageal squamous cell carcinoma[J]. J Cancer Res Clin Oncol,2005,131(2):111-119.
[13] Hollstein MC,Metcalf RA,Welsh JA,et al. Frequent mutation of the p53 gene in human esophageal cancer[J]. Proc Natl Acad Sci U S A,1990,87(24):9958-9961.
[14] Chung Y,Lam AKY,Luk JM,et al. Altered E-cadherin expression and p120 catenin localization in esophageal squamous cell carcinoma[J]. Ann Surg Oncol,2007,14(11):3260-3267.
[15] Whiteside TL. The tumor microenvironment and its role in promoting tumor growth[J]. Oncogene,2008,27(45):5904-5912.
[16] 郝贺,汪治宇.肿瘤免疫逃逸作用机制及在食管癌中的研究进展[J].中国肿瘤临床,2018,45(9):477-481.
[17] Amé-Thomas P,Le Priol J,Yssel H,et al. Characterization of intratumoral follicular helper T cells infollicular lymphoma:role in the survival of malignant B cells[J]. Leukemia,2012,26(5):1053-1063.
[18] Gu-Trantien C,Loi S,Garaud S,et al. CD4+follicular helper T cell infiltration predicts breast cancer survival[J]. J Clin Invest,2013,123(7):2873-2892.
[19] Bindea G,Mlecnik B,Tosolini M,et al. Spatiotemporal dynamics of intra tumoral immune cells reveal the immune landscape in human cancer[J]. Immunity,2013,39(4):782-795.
[20] Qi XW,Xia SH,Yin Y,et al. Expression features of CXCR5 and its ligand,CXCL13 associated with poor prognosis of advanced colorectal cancer[J]. Eur Rev Med Pharmacol Sci,2014,18(13):1916-1924.
[21] Duan Z,Gao J,Zhang L,et al. Phenotype and function of CXCR5+CD45RA-CD4+ T cells were altered in HBV-related hepatocellular carcinoma and elevated serum CXCL13 predicted better prognosis[J]. Oncotarget,2015,6(42):44239-44253.
[22] Ohandjo AQ,Liu Z,Dammer EB,et al. Transcriptome network analysis identifies CXCL13-CXCR5 signaling modules in the prostate tumor immune microenvironment[J]. Sci Rep,2019,9(1):1-13.
[23] Stolfi C,Rizzo A,Franzè E,et al. Involvement of interleukin-21 in the regulation of colitis-associated colon cancer[J]. J Exp Med,2011,208(11):2279-2290.
[24] Sage PT,Sharpe AH. T follicular regulatory cells in the regulation of B cell responses[J]. Trends Immunol,2015,36(7):410-418.
[25] Guo Z,Liang H,Xu Y,et al. The role of circulating T follicular helper cells and regulatory cells in non-small cell lung cancer patients[J]. Scand J Immunol,2017,86(2):107-112.
[26] Li L,Ma Y,Xu Y. Follicular regulatory T cells infiltrated the ovarian carcinoma and resulted in CD8 T cell dysfunction dependent on IL-10 pathway[J]. Int Immunopharmacol,2019,68:81-87.
[27] Song H,Liu A,Liu G,et al. T follicular regulatory cells suppress Tfh-mediated B cell help and synergistically increase IL-10-producing B cells in breast carcinoma[J]. Immunol Res,2019,67(4):416-423.
[28] Cha Z,Gu H,Zang Y,et al. The prevalence and function of CD4+ CXCR5+ Foxp3+ follicular regulatory T cells in diffuse large B cell lymphoma[J]. Int Immunopharmacol,2018,61:132-139.