原发性肉碱缺乏症(primary carnitine deficiency,PCD)又称肉碱转运障碍或肉碱摄取障碍,是由于细胞膜肉碱转运蛋白的编码基因SLC22A5突变致脂肪酸β氧化障碍而引发的疾病,是脂肪酸氧化代谢障碍中最常见的疾病类型,遗传方式为常染色体隐性遗传[1]。肉碱缺乏可导致中、长链脂肪酸不能从细胞质转运至线粒体内进行β氧化,进而引起一系列生化代谢异常,最终导致肝脏、心肌、骨骼肌等多系统损害[2]。PCD可于任何年龄发病,是潜在的致死性疾病。临床表现个体差异较大,主要表现为低酮型低血糖、肌无力、肝肿大以及扩张型心肌病,部分患者可终生无异常表现,发病的患者未经治疗具潜在致死性[3],左旋肉碱替代治疗的介入,使越来越多PCD患者的预后得到了改善。同时,PCD发病机制和基因突变的研究也在不断地深入。PCD患儿临床表现具有异质性及非特异性特点,易误诊或漏诊,随着串联质谱技术的应用,新生儿检出率显著提高[4-5]。本研究采用串联质谱技术对新生儿进行多种遗传代谢病筛查,统计出石家庄地区PCD患病率为1/17 785,进一步采用二代测序技术对部分患儿进行SLC22A5基因检测,发现了4种突变位点。
1 资 料 与 方 法
1.1 一般资料 收集2014年1月—2019年12月在石家庄市15个县区所辖的26个助产机构、7个市区所辖的12个助产机构分娩的160 061例活产新生儿(3~20 d)。
本研究经医院医学伦理委员会批准通过(No.202019),筛查前家长均签署知情同意书。
1.2 串联质谱筛查及基因突变检测
1.2.1 仪器与试剂 Waters TQD串联质谱仪、Waters 2777C自动进样器、Waters 1 525 μ高效液相色谱仪泵及MassLynxV4.1串联质谱筛查信息处理系统均购自美国Waters公司;微孔板恒温孵育震荡仪购自中国杭州奥盛仪器有限公司;超声波清洗机购自中国康士洁有限公司;通风柜购自中国杰瑞电气有限公司;串联质谱-非衍生化游离肉碱及酰基肉碱测定试剂盒购自中国山东英盛公司。
1.2.2 标本采集 新生儿出生72 h,充分哺乳6~8次后,于足跟两侧采集3个直径>8 mm、圆形均匀血斑,悬空自然晾干2~3 h,置于密封袋封口,最迟不超过5个工作日由各助产单位上报至妇幼机构并冷链递送至石家庄市新生儿疾病筛查中心,置于2~8 ℃冰箱密封保存待检。
1.2.3 检测方法 采用串联质谱干血滤纸片—非衍生法:用打孔器取直径3 mm高、低质控样本和待测样本血斑,置于U型底96孔微孔板中;每孔加入90 μL萃取工作液,30 ℃,700 r/min,震荡孵育45 min;转移75 μL上清液至V型底96孔板的对应位置,覆上铝箔纸以减少挥发;将V型板放入自动进样器中,建立样品列表,采用多反应监测模式进行检测,采用MassLynxV4.1串联质谱筛查信息处理系统,通过比较分析物和内标分析物的信号积分面积来进行计算待检物浓度水平。
1.2.4 质量控制 检测过程中将质控及样品共同测定,质控品的处理方法及上机检测条件与样本一致,高、低质控品的检测值在靶值±2SD范围内,实现对检测过程的质量控制,以及每年参加国家卫健委临床检验中心的室间质量评价并取得合格证书。
1.2.5 诊断方法 ①血游离肉碱水平持续低于7 μmol/L,需鉴别是否为母源性肉碱缺乏;②肉碱转运蛋白的编码基因SLC22A5检测到突变。
1.3 治疗与随访 对确诊病例采用左卡尼汀替代治疗,具体剂量依据肉碱水平进行调整。急性期静脉给药,剂量为200~400 mg·kg-1·d-1,并同时对症支持治疗;稳定期口服给药,剂量为100~200 mg·kg-1·d-1,分3次给药。此外,避免饥饿及长时间高强度运动,防止低血糖发生。治疗初期隔2~3周随访1次,血游离肉碱正常且稳定后隔1~3个月随访1次,治疗期间定期进行相关检查,及时调整治疗方案,并评估生长、智力及运动发育情况。
2 结 果
2.1 PCD患儿总体筛查情况 160 061例新生儿中,筛查阳性患儿21例,召回20例,确诊17例,其中PCD 9例,患病率为1/17 785;母源性肉碱缺乏患儿8例。
2.2 9例PCD患儿及母亲串联质谱结果 9例PCD患儿串联质谱筛查结果进行统计分析,初筛结果中游离肉碱及多种酰基肉碱水平降低,游离肉碱为4.47(1.77~6.78) μmol/L;复查结果为4.83(2.80~7.32) μmol/L;患儿母亲肉碱水平检测结果显示游离肉碱及酰基肉碱水平基本居于正常水平,游离肉碱水平为12.97(11.16~15.36) μmol/L,排除母源性,见表1。
表1 9例PCD患儿及母亲游离肉碱及酰基肉碱检测水平
Table 1 Detection levels of free carnitine and acylcarnitine in 9 neonates with PCD and their mothers [n=9,M(最低值~最高值),μmol/L]
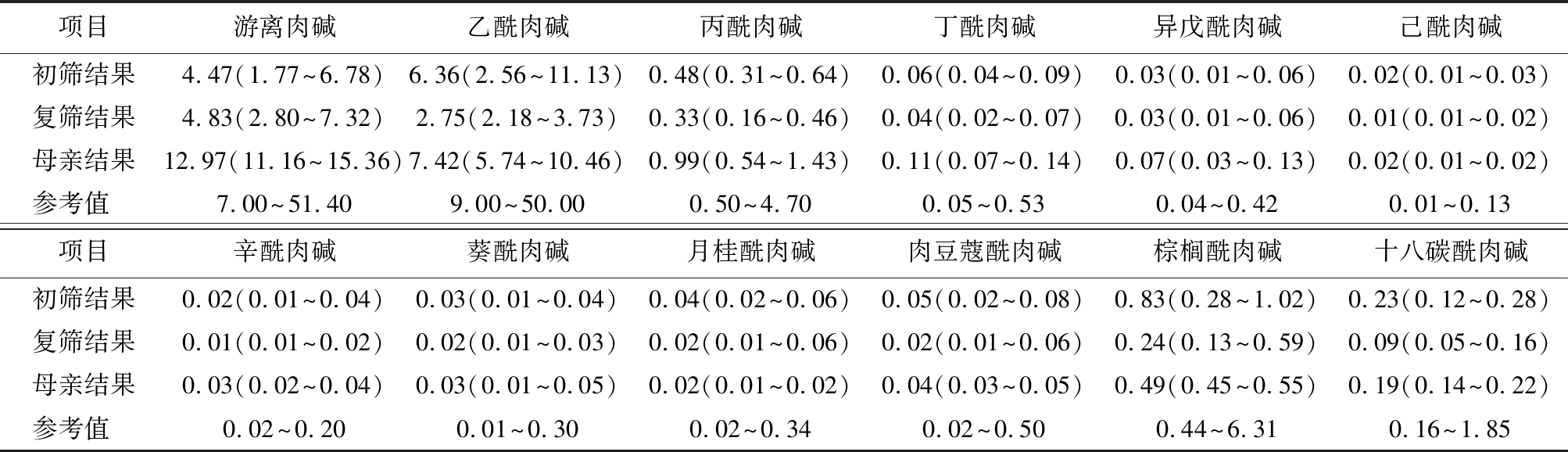
项目游离肉碱乙酰肉碱丙酰肉碱丁酰肉碱异戊酰肉碱己酰肉碱初筛结果4.47(1.77~6.78)6.36(2.56~11.13)0.48(0.31~0.64)0.06(0.04~0.09)0.03(0.01~0.06)0.02(0.01~0.03)复筛结果4.83(2.80~7.32)2.75(2.18~3.73)0.33(0.16~0.46)0.04(0.02~0.07)0.03(0.01~0.06)0.01(0.01~0.02)母亲结果12.97(11.16~15.36)7.42(5.74~10.46)0.99(0.54~1.43)0.11(0.07~0.14)0.07(0.03~0.13)0.02(0.01~0.02)参考值 7.00~51.409.00~50.000.50~4.700.05~0.530.04~0.420.01~0.13项目辛酰肉碱葵酰肉碱月桂酰肉碱肉豆蔻酰肉碱棕榈酰肉碱十八碳酰肉碱初筛结果0.02(0.01~0.04)0.03(0.01~0.04)0.04(0.02~0.06)0.05(0.02~0.08)0.83(0.28~1.02)0.23(0.12~0.28)复筛结果0.01(0.01~0.02)0.02(0.01~0.03)0.02(0.01~0.06)0.02(0.01~0.06)0.24(0.13~0.59)0.09(0.05~0.16)母亲结果0.03(0.02~0.04)0.03(0.01~0.05)0.02(0.01~0.02)0.04(0.03~0.05)0.49(0.45~0.55)0.19(0.14~0.22)参考值 0.02~0.200.01~0.300.02~0.340.02~0.500.44~6.310.16~1.85
2.3 8例母源性肉碱缺乏症患儿及母亲串联质谱结果 8例母源性肉碱缺乏症患儿串联质谱筛查结果进行统计,初筛结果游离肉碱及多种酰基肉碱水平降低,其中游离肉碱初筛结果为4.52(2.70~7.93) μmol/L;复查结果为6.09(4.14~10.04)μmol/L,较初筛水平有所升高;患儿母亲游离肉碱及酰基肉碱水平均低于正常水平,游离肉碱水平为3.46(1.50~7.86) μmol/L,见表2。
表2 8例母源性肉碱缺乏症患儿及母亲游离肉碱及酰基肉碱检测水平
Table 2 Detection levels of free carnitine and acylcarnitine in 8 cases of neonates with maternal carnitine deficiency and their mothers [n=8,M(最低值~最高值),μmol/L]
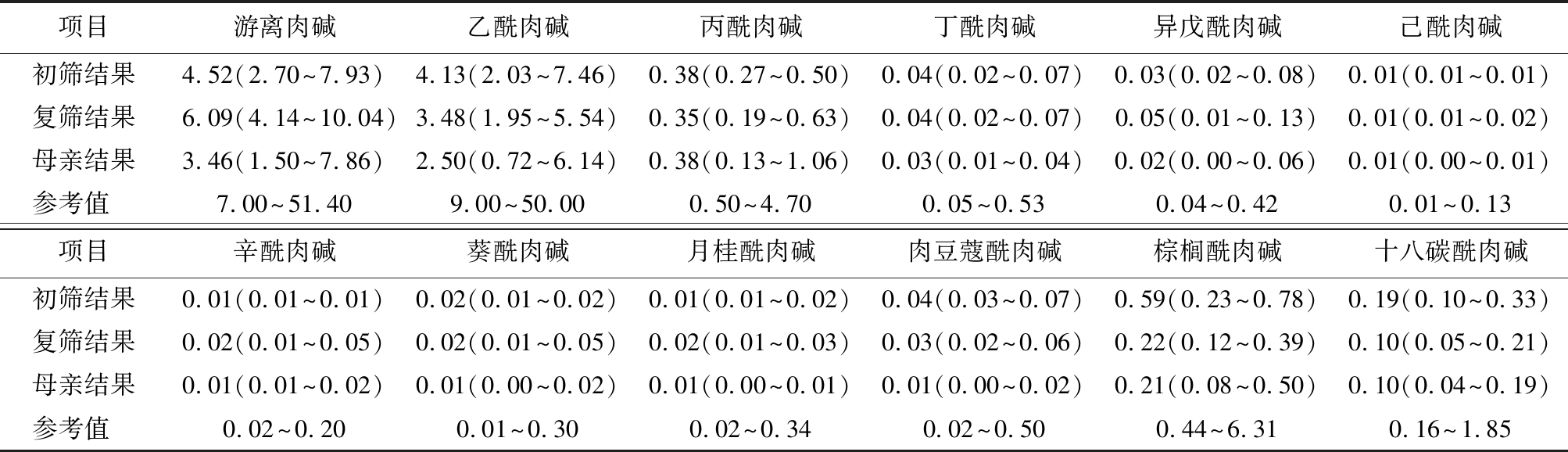
项目游离肉碱乙酰肉碱丙酰肉碱丁酰肉碱异戊酰肉碱己酰肉碱初筛结果4.52(2.70~7.93)4.13(2.03~7.46)0.38(0.27~0.50)0.04(0.02~0.07)0.03(0.02~0.08)0.01(0.01~0.01)复筛结果6.09(4.14~10.04)3.48(1.95~5.54)0.35(0.19~0.63)0.04(0.02~0.07)0.05(0.01~0.13)0.01(0.01~0.02)母亲结果3.46(1.50~7.86)2.50(0.72~6.14)0.38(0.13~1.06)0.03(0.01~0.04)0.02(0.00~0.06)0.01(0.00~0.01)参考值 7.00~51.409.00~50.000.50~4.700.05~0.530.04~0.42 0.01~0.13项目辛酰肉碱葵酰肉碱月桂酰肉碱肉豆蔻酰肉碱棕榈酰肉碱十八碳酰肉碱初筛结果0.01(0.01~0.01)0.02(0.01~0.02)0.01(0.01~0.02)0.04(0.03~0.07)0.59(0.23~0.78)0.19(0.10~0.33)复筛结果0.02(0.01~0.05)0.02(0.01~0.05)0.02(0.01~0.03)0.03(0.02~0.06)0.22(0.12~0.39)0.10(0.05~0.21)母亲结果0.01(0.01~0.02)0.01(0.00~0.02)0.01(0.00~0.01)0.01(0.00~0.02)0.21(0.08~0.50)0.10(0.04~0.19)参考值 0.02~0.20 0.01~0.300.02~0.34 0.02~0.500.44~6.31 0.16~1.85
2.4 4例PCD患儿基因突变分析 9例PCD患儿中,4例进行了SLC22A5基因检测,其中复合杂合1例、纯合1例、杂合2例,见表3。2例杂合患儿血游离肉碱和酰基肉碱水平持续下降,排除母源性。基因突变分析发现4种突变位点,分别为c.865C>T、c.1400C>G、c.428C>T和c.1462C>T,见图1。
表3 4例PCD患儿基因突变分析结果
Table 3 Results of gene mutation analysis in 4 neonates with PCD
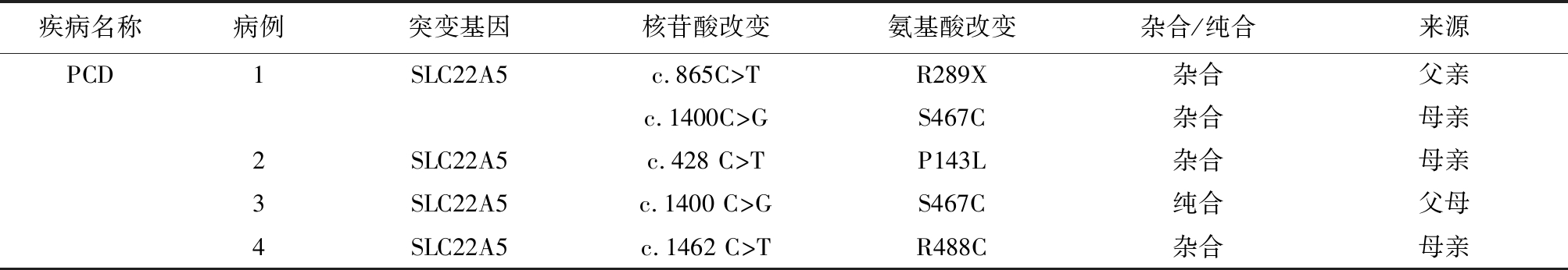
疾病名称病例突变基因核苷酸改变氨基酸改变杂合/纯合来源PCD1SLC22A5c.865C>TR289X杂合父亲c.1400C>GS467C杂合母亲2SLC22A5c.428 C>TP143L杂合母亲3SLC22A5c.1400 C>GS467C纯合父母4SLC22A5c.1462 C>TR488C杂合母亲
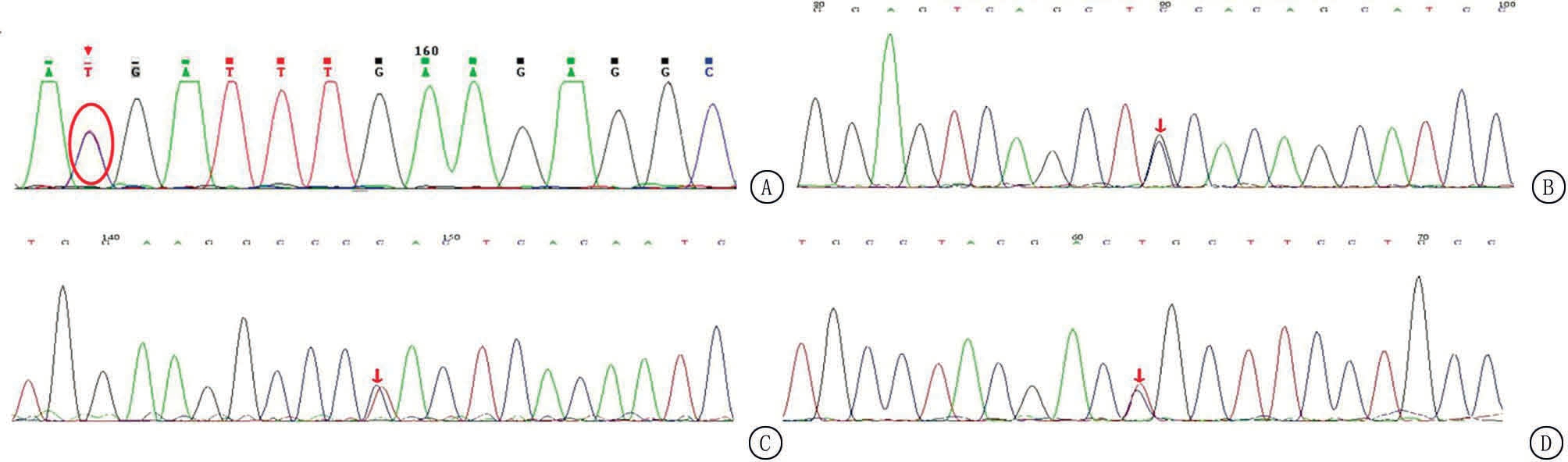
图1 SLC22A5基因突变位点
A.c.865C>T;B.c.1400C>G;C.c.428C>T;D.c.1462C>T
Figure 1 SLC22A5 gene mutations
2.5 治疗与随访结果 9例PCD患儿中6例持续接受治疗,左卡尼汀剂量为100~200 mg·kg-1·d-1,发育正常;3例患儿治疗一段时间后停药,发育正常。患儿治疗后肉碱水平见表4;治疗及发育情况见表5。
表4 9例PCD患儿治疗后游离肉碱及酰基肉碱水平
Table 4 Levels of free carnitine and acylcarnitine in 9 neonates with PCD after treatment [n=9,M(最低值~最高值),μmol/L]
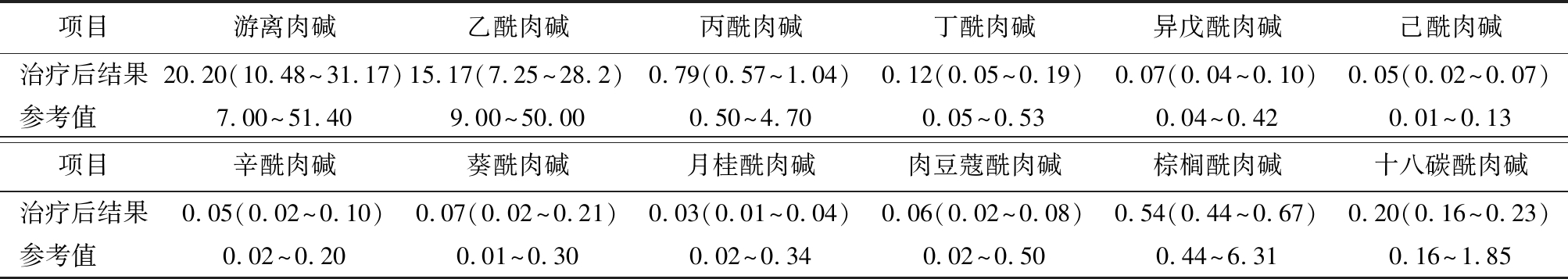
项目游离肉碱乙酰肉碱丙酰肉碱丁酰肉碱异戊酰肉碱己酰肉碱治疗后结果20.20(10.48~31.17)15.17(7.25~28.2)0.79(0.57~1.04)0.12(0.05~0.19)0.07(0.04~0.10)0.05(0.02~0.07)参考值 7.00~51.409.00~50.000.50~4.700.05~0.530.04~0.42 0.01~0.13项目辛酰肉碱葵酰肉碱月桂酰肉碱肉豆蔻酰肉碱棕榈酰肉碱十八碳酰肉碱治疗后结果0.05(0.02~0.10)0.07(0.02~0.21)0.03(0.01~0.04)0.06(0.02~0.08)0.54(0.44~0.67)0.20(0.16~0.23)参考值 0.02~0.20 0.01~0.300.02~0.34 0.02~0.500.44~6.31 0.16~1.85
表5 9例PCD患儿随访结果
Table 5 Follow-up results of 9 neonates with PCD
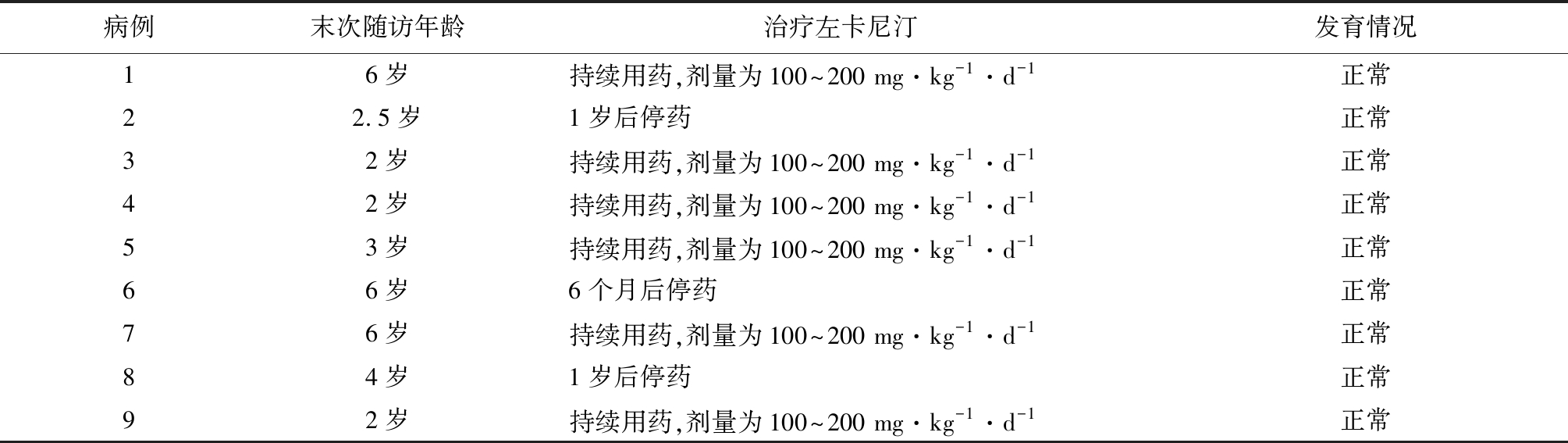
病例末次随访年龄治疗左卡尼汀发育情况16岁持续用药,剂量为100~200 mg·kg-1·d-1正常22.5岁1岁后停药正常32岁持续用药,剂量为100~200 mg·kg-1·d-1正常42岁持续用药,剂量为100~200 mg·kg-1·d-1正常53岁持续用药,剂量为100~200 mg·kg-1·d-1正常66岁6个月后停药正常76岁持续用药,剂量为100~200 mg·kg-1·d-1正常84岁1岁后停药正常92岁持续用药,剂量为100~200 mg·kg-1·d-1正常
3 讨 论
3.1 PCD筛查与诊断 串联质谱技术的应用,使得越来越多的PCD患儿可以在新生儿早期被发现,PCD的诊断主要依赖于血游离肉碱及酰基肉碱的水平以及SLC22A5基因突变分析。本研究检出的9例PCD患儿初筛血游离肉碱均低于实验室截断值(<7 μmol/L),均值只有4.47 μmol/L;9例PCD患儿母亲血游离肉碱均值为12.97 μmol/L,而8例母源性肉碱缺乏症患儿母亲血游离肉碱均值仅为3.46 μmol/L。因此,对患儿及其母亲进行血游离肉碱水平检测,可发现母亲PCD。随着二代测序技术的不断推广应用,基因检测可明确PCD患儿病因;本研究检出的9例PCD患儿中,只有4例患儿进行了基因检测。
3.2 PCD患病率 PCD患病率具有明显种族差异,据文献报道,该病在法罗群岛患病率最高,为1/300[6],美国患病率为1/20 000~1/70 000[7],日本患病率为1/40 000[8],澳大利亚的患病率为1/120 000[9],中国报道的新生儿筛查PCD患病率为1/20 000~45 000[10-11],人群中杂合子的携带率为0.5%~0.1%[12-13]。本研究共筛查新生儿160 061例,确诊PCD 9例,患病率为1/17 785,高于我国报道的新生儿筛查PCD患病率,考虑可能与地域差异和统计年限有关。
3.3 基因突变分析 PCD的致病基因为SLC22A5,该基因定位于染色体5q31.1,长约30 kb,包含10个外显子和3个内含子,其编码的肉碱转运蛋白由557个氨基酸组成[14]。目前已经发现180余种突变类型,多为错义突变,无义突变和移码突变次之[2];国内大多数研究认为c.760C>T(p.R254X)和c.1400C>G(p.S467C)是我国大陆地区的热点突变[15]。本研究4例患儿中复合杂合1例、纯合1例、杂合2例,其中c.1400C>G(p.S467C)的突变频率较高,为33.3%,与温鹏强等[14]报道的结果相符,未发现c.760C>T(p.R254X),考虑可能与病例少有关。
3.4 治疗及随访 PCD可于任何年龄发病,主要表现为扩张性心肌病、肝肿大、肌无力等,若未能及时发现和治疗,可导致死亡,因此,早期筛查、诊断及治疗是改善预后的关键。PCD的治疗原则是避免感染、长期饥饿及高强度运动,需用左卡尼汀进行替代治疗,维持血浆游离肉碱水平>15~20 μmol/L。出现能量代谢危象时,立即静脉输注葡萄糖,以维持血糖>5 mmol/L,并静脉或口服左卡尼汀200~400 mg·kg-1·d-1;病情缓解期需根据血游离肉碱水平进行个体化治疗,建议口服左卡尼汀100~300 mg·kg-1·d-1;稳定期可根据血游离肉碱水平,口服左卡尼汀100~200 mg·kg-1·d-1[3]。本研究检出的9例PCD患儿确诊后立即给予左卡尼汀替代治疗,其中3例患儿治疗一段时间后停药,其余6例患儿均持续接受药物治疗,随访结果未出现临床症状,发育正常。
采用串联质谱技术进行新生儿疾病筛查,可及早检出患儿及母亲PCD,并给予早期干预和治疗,使患儿生长、智力及运动发育正常;二代测序技术可进行相关基因突变检测;二者联合应用可明确病因,对家系提供遗传病咨询依据。
[1] 林壹明,林卫华,余科,等.八例PCDSLC22A5基因突变分析[J].中华医学遗传学杂志,2017,34(1):35-39.
[2] 谭建强,陈大宇,李哲涛,等.10例PCD新生儿的基因诊断[J].中国当代儿科杂志,2017,19(11):1150-1154.
[3] 中华预防医学会出生缺陷预防与控制专业委员会新生儿遗传代谢病筛查学组,中华医学会儿科分会出生缺陷预防与控制专业委员会,中国医师协会医学遗传医师分会临床生化遗传专业委员会,等.PCD筛查与诊治共识[J].中华医学杂志,2019,99(2):88-92.
[4] 孙云,马定远,王彦云,等.新生儿筛查发现的PCD临床与基因分析[J].临床儿科杂志,2017,35(9):666-668.
[5] 陈玉兰,杨秀芳,郑凯军,等.原发性肉碱缺乏症2例报道及其家系的SLC22A5基因突变检测[J].广州医药,2017,48(4):29-32.
[6] Rasmussen J,Nielsen OW,Janzen N,et al. Carnitine levels in 26,462 individuals from the nationwide screening program for primary carnitine deficiency in the Faroe Islands[J]. J Inherit Metab Dis,2014,37(2):215-222.
[7] Magoulas PL,El-Hattab AW. Systemic primary carnitine deficiency: an overview of clinical manifestations,diagnosis,and management[J]. Orphanet J Rare Dis,2012,18(7):68.
[8] Koizumi A,Nozaki J,Ohura T,et al. Genetic epidemiology of the carnitine transporter OCTN2 gene in a Japanese population and phenotypic characterization in Japanese pedigrees with primary systemic carnitine deficiency[J]. Human Molecular Genetics,1999,8(12):2247-2254.
[9] Wilcken B,Wiley V,Hammond J,et al. Screening newborns for inborn errors of metabolism by tandem mass spectrometry[J]. N Engl J Med,2003,348(23):2304-2312.
[10] 马平悦.50例新生儿原发性肉碱缺乏症的基因谱及临床特征分析[D].杭州:浙江大学,2015.
[11] 韩连书,叶军,邱文娟,等.原发性肉碱缺乏症17例诊治与随访[J].中华儿科杂志,2012,50(6):405-409.
[12] Karpati G,Carpenter S,Engel AG,et a1. The syndrome of systemic carnitine deficiency. Clinical,morphologic,biochemical,and pathophysiologic features[J]. Neurology,1975,25(1):16-24.
[13] Amat di San Filippo C,Taylor MR,Mestroni L,et a1. Cardiomyopathy and camitine deficiency[J]. Mol Genet Metab,2008,94(2): 162-166.
[14] 温鹏强,陈占玲,王国兵,等.原发性肉碱缺乏症患者临床特点和SLC22A5基因突变分析[J].中华内分泌代谢杂志,2017,33(3):208-214.
[15] Han L,Wang F,Wang Y,et al. Analysis of genetic mutations in Chinese patients with systemic primary carnitine deficiency[J]. Eur J Med Genet,2014,57(10): 571-575.