蒽环类抗癌药物属于广谱抗癌药,严重且不可逆心脏毒性的不良反应使其临床应用受到限制[1]。作为目前唯一获批的此类抗癌药物的心脏毒性保护剂,右雷佐生(dexrazoxane)被国内外多家指南推荐用于蒽环类药物心脏毒性的防治[2]。2013版蒽环类化疗药物心脏毒性防治指南中明确表示,每次给予蒽环类药物前均应在30 min内给予右雷佐生。右雷佐生是雷佐生的右旋体[3]。研究表明,右雷佐生对改善含蒽环类药物治疗的患者心脏功能具有积极作用[4-6]。相对单用蒽环类药物,联用右雷佐生更具有成本效果优势[7]。临床上,右雷佐生应与其自带专用溶媒(0.167 mol/L乳酸钠注射液)配合使用。专用溶媒的包装容器为25 mL安瓿,瓶体大,瓶头短小,在实际临床工作中,存在不使用专用溶媒或用一支专用溶媒溶解两支药物的情况[8]。未使用专用溶媒溶解的右雷佐生稳定性如何未见相关报道。鉴于此,参考有关文献[9-12],本试验从各组配伍液的外观、pH值、不溶性微粒数、相对百分含量变化等方面考察使用不同溶媒溶解后对右雷佐生稳定性的影响,旨在为临床合理用药提供参考。
1 仪器与试剂
Waters Acquity UPLC系统(包括四元梯度泵、恒温自动进样器、柱温箱、紫外检测器等,美国Waters公司);电子分析天平(CPA225D,德国Sartorius);微粒分析仪(GWF-8JA,天津天河医疗仪器有限公司);微处理pH计(DP24,HANNA仪器)。右雷佐生对照品(辽阳众诺化学工业有限公司,含量99.48%,批号 20170401);注射用右雷佐生(江苏奥赛康药业有限公司,规格250 mg/支,批号 E1711092);0.9%氯化钠注射液(石家庄市第四制药有限公司,批号 1712263801);5%葡萄糖注射液(石家庄市第四制药有限公司,批号 1801123803);磷酸二氢钾(分析纯,天津市永大化学试剂公司有限公司,批号 YD20170303),甲醇(色谱纯,美国Fisher,批号178338),水为二次蒸馏水,其他试剂均为分析纯。
2 方法与结果
2.1 色谱条件 色谱柱:ACQUITY UPLC BEH C18柱(2.1 mm×50 mm,1.7 μm);流动相:0.01 mol/L磷酸二氢钾水溶液-甲醇(90∶10);流速:0.4 mL/min;检测波长:209 nm;柱温:25 ℃;进样量:2 μL。
2.2 含量测定
2.2.1 对照品溶液的制备 精密称取右雷佐生对照品21 mg于100 mL量瓶中,用水溶解并定容,得214.8 mg/L的对照品溶液。
2.2.2 供试品溶液的制备 室温条件下,参照药品说明书,模拟临床常用给药剂量,将注射用右雷佐生分别用专用溶媒(0.167 mol/L乳酸钠溶液)或无菌水溶解后,再分别用5%葡萄糖注射液、0.9%氯化钠注射液稀释,混匀,得质量浓度为1 g/L的供试品溶液。
2.2.3 专属性考察 取5%葡萄糖注射液、0.9%氯化钠注射液、专用溶媒(0.167 mol/L乳酸钠注射液)和右雷佐生对照品溶液,按“2.1”项下的色谱条件进样测定,记录色谱图。结果表明,右雷佐生保留时间为1.11 min,右雷佐生峰形良好,分离完全,理论踏板数在正常范围内(图1)。

图1 UPLC色谱图
A.5%葡萄糖注射液;B.0.9%氯化钠注射液;C.专用溶媒;D.右雷佐生对照品溶液
Figure 1 UPLC chromatograms
2.2.4 线性关系 精密吸取对照品溶液1,3,5,7,9,10 mL分别于50 mL量瓶中,水稀释定容,得系列浓度的右雷佐生溶液,按“2.1”项下的色谱条件进样测定,记录色谱峰面积。以右雷佐生浓度x为横坐标,峰面积A为纵坐标进行线性回归,得回归方程A=19 615x+5 137.8(r=0.999 9,n=6)。结果表明,右雷佐生质量浓度在4.30~42.96 mg/L范围内线性关系良好。
2.2.5 精密度试验 精密吸取对照品溶液2,5,7 mL分别于50 mL量瓶中,水稀释定容,配制低、中、高3种浓度(8.59,21.48,30.07 mg/L)的右雷佐生溶液(n=3),按“2.1”项下色谱条件重复测定5次,连续测定3 d,记录峰面积,考察精密度。结果显示,各浓度溶液的日内相对标准偏差(relative standard deviation,RSD)分别为0.91%、0.95%、0.94%,日间RSD分别为1.36%、1.04%、1.31%,表明精密度良好。
2.2.6 重复性试验 精密吸取对照品溶液2,5,7 mL分别于50 mL量瓶中,水稀释定容,配制低、中、高3种浓度(8.59、21.48、30.07 mg/L)的右雷佐生溶液(n=3),按“2.1”项下色谱条件重复进样3次,记录峰面积。结果显示,各浓度溶液的RSD分别为0.75%、0.65%、0.94%,表明重复性良好。
2.2.7 回收率试验 精密吸取对照品溶液2,5,7 mL分别于50 mL量瓶中,水稀释定容,配制低、中、高3种浓度(8.59、21.48、30.07 mg/L)的右雷佐生溶液(n=3),按“2.1”项下色谱条件进样测定。标准曲线法计算浓度,所得浓度与实际浓度之比为回收率。结果显示各浓度溶液的回收率分别为101.4%,100%,99.5%,RSD分别为1.11%、0.65%、0.96%,表明回收率良好。
2.3 右雷佐生与不同载体溶媒配伍稳定性试验
2.3.1 外观变化 按“2.2.2”中供试品溶液的制备方法制备溶液(n=3),依次标记为NZ,GZ,NF,GF(N:溶媒为0.9%氯化钠注射液,G:溶媒为5%葡萄糖注射液,Z:专用溶媒溶解,F:非专用溶媒溶解),在25 ℃下放置,并于0,2,4,6,8,12,24 h用目测法观察配伍溶液的外观变化,各组配伍溶液均为透明溶液,肉眼未观察到絮状物、浑浊或沉淀产生,24 h内颜色没有改变。
2.3.2 pH值变化 取“2.3.1”项下各配伍溶液,于0,2,4,6,8,12,24 h用pH计测定其pH值。结果显示RSD值依次为0.76%、0.78%、0.54%、1.14%,结果变化趋势见图2。
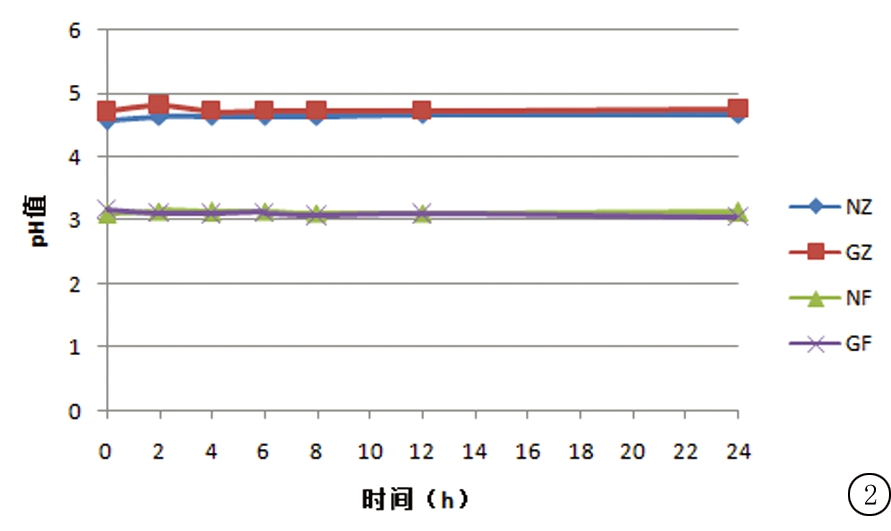
图2 注射用右雷佐生配伍后溶液pH值变化(n=3)
Figure 2 The changes in solution pH value of Dexrazoxane after dissolving(n=3)
2.3.3 相对百分含量变化 在“2.3.1”操作基础上,各组供试品溶液于0,2,4,6,8,12,24 h采用“2.1”项下色谱条件进样分析测定。将0时的右雷佐生质量浓度计为100%,计算出其余各时间点的药物相对百分含量。结果显示,前6 h内专用溶媒组右雷佐生的相对百分含量为100.00%~96.33%,RSD<2%,非专用溶媒组右雷佐生的相对百分含量为100.00%~87.80%,RSD<2%。6 h以后各配伍液的相对百分含量为100.00%~74.28%,RSD>6%,表明在前6 h内,使用专用溶媒溶解的配伍液含量无明显变化(≥95%初始浓度),而非专用溶媒组含量发生明显变化(<95%初始浓度);6 h以后,各配伍液的含量显著下降。结果变化趋势见图3。
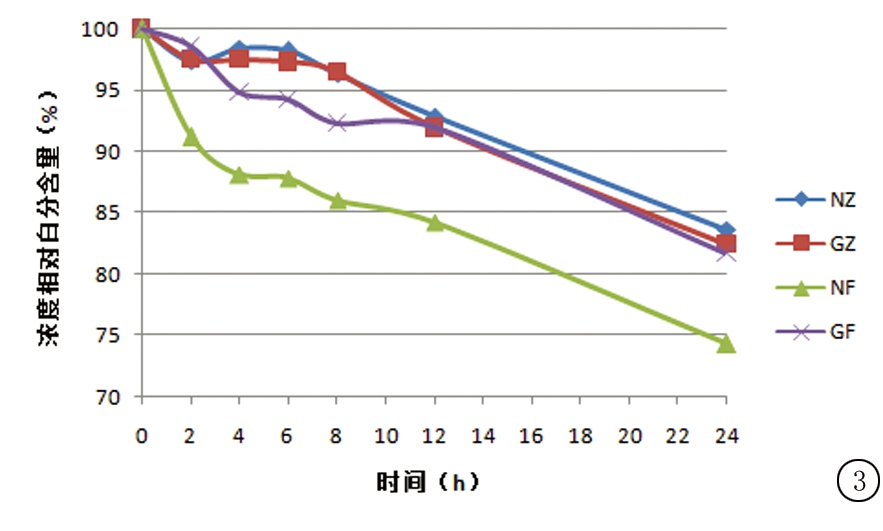
图3 注射用右雷佐生配伍后含量变化(n=3)
Figure 3 The changes in concentration of Dexrazoxane after dissolving(n=3)
2.3.4 不溶性微粒数变化 在“2.3.1”操作基础上,于0,2,4,6,8,12,24 h以微粒分析仪测定供试品溶液中粒径≥10 μm以及≥25 μm的微粒数。结果显示,使用专用溶媒溶解的配伍液,其不溶性微粒数均在规定范围内。非专用溶媒组,右雷佐生扩容至5%葡萄糖注射液中,粒径≥10 μm的不溶性微粒数超出了规定值。专用溶媒组和非专用溶媒组配伍液粒径≥25 μm的不溶性微粒数均在规定值范围内。结果变化见图4,5。
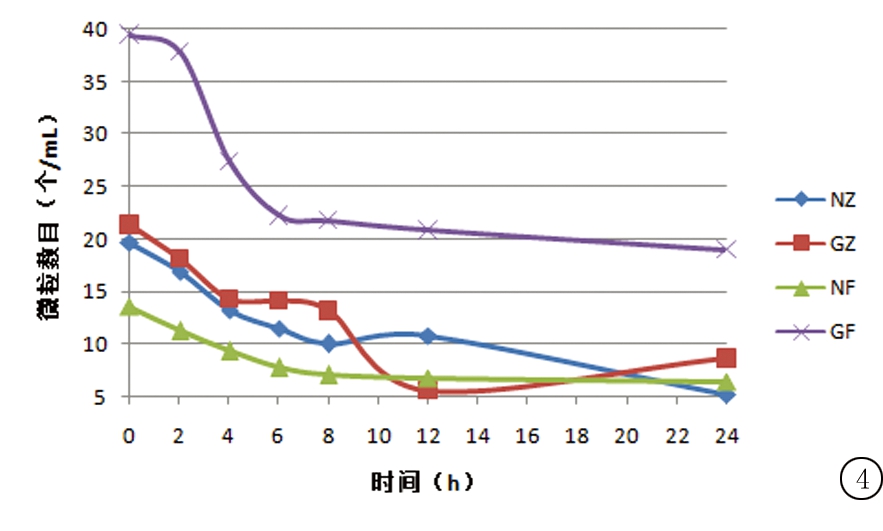
图4 注射用右雷佐生配伍后≥10 μm微粒数变化(n=3)
Figure 4 The changes in the amount of solution particles(≥10 μm)of Dexrazoxane after dissolving(n=3)
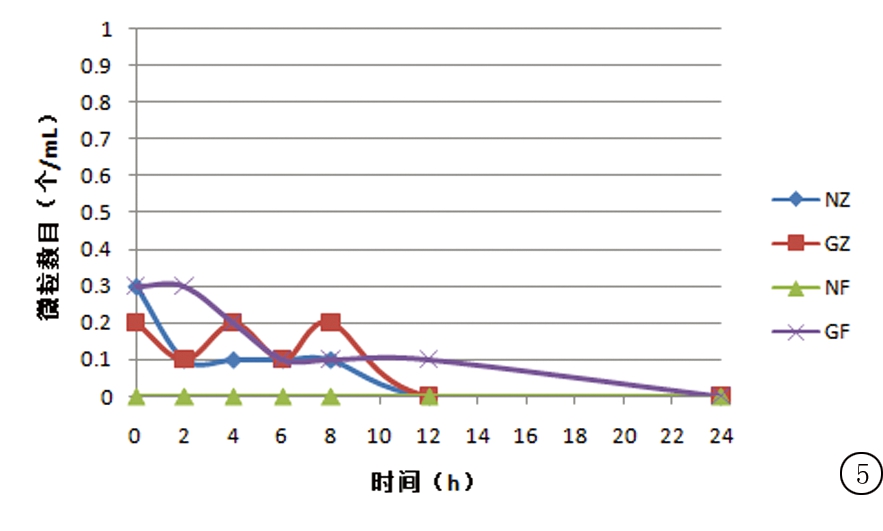
图5 注射用右雷佐生配伍后≥25 μm微粒数变化(n=3)
Figure 5 The changes in the amount of solution particles(≥25 μm)of dexrazoxane after dissolving(n=3)
3 讨 论
3.1 含量测定方法的建立 右雷佐生属于双氧代二嗪类化合物,本试验采用ACQUITY UPLC BEH C18色谱柱,该色谱柱可耐受高比例水,适合分析水溶性物质。参考右雷佐生含量HPLC方法[13-14],本实验使用超高效液相色谱仪,调整流动相为0.01 mol/L磷酸二氢钾水溶液-甲醇(90:10,V/V);流速0.4 mL/min,进样量2 μL。在上述色谱条件下,右雷佐生保留时间为1.11 min,样品分析时长为3 min,基线平稳,不受其他物质干扰,分离度良好,理论踏板数在正常范围内。故该方法可用于右雷佐生含量的快速测定。
3.2 专用/非专用溶媒溶解后不同配伍液的稳定性 静脉输液的pH值应接近体液的酸碱度,一般控制在4~9范围内。pH值在此范围外的溶液,会造成血管内皮细胞的损伤导致疼痛,并诱发血栓性静脉炎和血小板聚集,且静脉炎的严重程度与输液的pH直接相关,pH值越低,静脉炎会越严重[15]。本研究结果显示,使用非专用溶媒组溶解的右雷佐生配伍液pH值为3.1左右;使用专用溶媒溶解的右雷佐生配伍液的pH值保持在4.7左右,可以在一定程度上减轻输液时对患者的刺激性和潜在危害。专用溶媒为0.167 mol/L乳酸钠注射液,可起到调节配伍液pH值的作用。
药物含量降低会导致药物疗效降低,影响药物治疗的有效性。根据实验结果,使用专用溶媒溶解的右雷佐生溶液的药物含量下降缓慢,且在配制6 h内无明显变化,而非专用溶媒组含量下降较快;各组配伍液药物含量在配制6 h后均发生明显下降(以含量是否≥95%初始浓度为判定依据[16])。
静脉输液不溶性微粒是指不溶于输液且肉眼不可见的非代谢性颗粒杂质(粒径<50 μm),进入人体将对微循环有不同程度的影响。研究发现,不溶性微粒能够引起热源反应、炎症反应、肉芽肿及血管栓塞,严重的甚至能引起癌症[17]。据2015版《中国药典》,除另有规定外,装量>100 mL的静脉注射液,粒径≥10 μm的不溶性微粒数不得超过25粒/mL,≥25 μm的不溶性微粒数不得超过3粒/mL。上述试验结果显示,使用专用溶媒溶解后稀释的配伍液,以及使用非专用溶媒+氯化钠注射液稀释的配伍液不溶性微粒数均符合规定,而使用非专用溶媒+葡萄糖注射液的配伍液粒径≥10 μm的微粒数超出规定值。初步认为这与右雷佐生在5%葡萄糖注射液中溶解性较差,加专用溶媒可改善其溶解性能有关。
综上所述,使用专用溶媒溶解的注射用右雷佐生溶液在6 h内的含量、不溶性微粒数和pH值均在正常范围内,稳定性优于非专用溶媒组。建议,为保证药物治疗的安全性和有效性,临床在使用注射用右雷佐生时,应仔细阅读说明书,严格按照说明书要求配制使用该药并在溶解后6 h内输注完毕。
[1] 王雪清,李文新. 蒽环类药物的心脏毒性研究进展[J]. 世界最新医学信息文摘,2019,19(35):75-76,81.
[2] Kim IH,Lee JE,Youn HJ,et al. Cardioprotective effect of dexrazoxane in patients with HER2-positive breast cancer who receive anthracycline based adjuvant chemotherapy followed by trastuzumab[J]. J Breast Cancer,2017,20(1):82-90.
[3] 陈祥峰,宗垒,张静.心脏保护剂右雷佐生的合成[J].中国医药工业杂志,2018,49(9):1243-1246.
[4] Wu P,Oren O,Gertz MA,et al.Proteasome inhibitor-related cardiotoxicity:mechanisms,diagnosis,and management[J]. Curr Oncol Rep,2020,22(7):66.
[5] 胡汉,陈春洲,沈汉滨,等.右丙亚胺预处理对乳腺癌蒽环类药物化疗患者的心脏保护作用[J].武汉大学学报,2019,40(2):235-238.
[6] 姚铠涛.右丙亚胺在急性白血病化疗患者心脏保护中的应用观察[J].临床医学工程,2019,26(11):1539-1540.
[7] 郭婉婕,官海静,刘国恩,等.蒽环类药物联用右雷佐生治疗乳腺癌的药物经济学评价[J].中国卫生经济,2017,36(7):75-78.
[8] 海仁沙古丽·阿不都,贾冬梅,于彩霞.细胞毒化疗药物的集中配置的安全管理实践[J].中国农村卫生,2017,6(12):48.
[9] 刘剑,刘雪蕊,张亚坤.冷藏药品尼可地尔与不同载体溶媒配伍后的稳定性研究[J].河北医科大学学报,2019,40(5):587-591.
[10] 任进民,沈军,孙莉,等.注射用乳糖酸阿奇霉素与吸入用布地奈德混悬液的配伍稳定性考察[J].河北医科大学学报,2017,38(1):66-71.
[11] 李飞,潘东,赵志臣,等.放置时间对两种青霉素类抗菌药物微粒数的影响[J].中国抗生素杂志,2020,45(2):152-156.
[12] 林淑瑜,甘惠贞,李玉堂,等.注射用乌司他丁与2种常用溶剂在输液泵中的配伍稳定性考察[J].中国药房,2017,28(8):1041-1044.
[13] 陈祥峰,赵砚荣,刘留成.注射用右丙亚胺制备、质量控制及稳定性考察[J].中国实用医药,2010,5(13):9-11.
[14] 吕艳芹,惠恒龙,左石.RP-HPLC法测定注射用右丙亚胺的含量及有关物质[J].内蒙古中医药,2011,30(20):38-39.
[15] 周传亭.药物致输液性静脉炎的原因及防治研究进展[J/CD].实用临床护理学电子杂志,2020,5(23):197-198.
[16] Zhang YP,Myers AL,Trinh VA,et al. Physical and chemical stability of reconstituted and diluted dexrazoxane infusion solutions[J]. J Oncol Pharm Pract, 2014,20(1):58-64.
[17] 彭姝,张军,李慧芬,等.输液中不溶性微粒的危害综述[J].中国药事,2018,32(8):1058-1063.