2型糖尿病是糖尿病中最常见的类型之一,其基本病因为β细胞功能出现缺陷,胰岛素分泌不足,无法有效降低糖、血糖水平;但部分患者胰岛素分泌正常,机体对胰岛素不敏感,对胰岛素的利用率较低,产生抵抗,亦会导致血糖升高[1]。2型糖尿病患者在早期时无明显症状,不易被察觉,多在常规体检或伴随慢性并发症时发现此病;“三多一少”为典型病状,即多食、多饮、多尿,消瘦或短期内体重减少[2]。2型糖尿病患者若出现乏力、疲劳、口干等表现,则提示代谢异常,需引起重视。随着生活方式的改变以及人口老龄化的进程,糖尿病的发病率呈逐年上升的趋势,对患者的生活质量和经济带来一定压力[3]。在魏素滨[4]研究中,认为糖尿病是一种慢性且需终身服药的代谢性疾病,其主要病因为具有抵抗力的胰岛素相对缺乏。在刘晶等[5]研究中,采用胰岛素泵可模拟机体正常的胰岛素分泌过程,操作简便、安全,且疗效较好。本研究主要分析阿格列汀联合不同胰岛素强化方案对2型糖尿病患者微小RNA-144(microRNA-144,miR-144)、微小RNA-142(microRNA-142,miR-142)表达的影响,报告如下。
1 资 料 与 方 法
1.1 一般资料 选取2019年3月—2020年3月我院接诊的2型糖尿病患者106例作为研究对象,按照随机数字表法将其分为胰岛素泵组和基础治疗组各53例。胰岛素泵组男性25例,女性28例,年龄46~73岁,平均(56.53±9.65)岁,基础治疗组男性26例,女性27例,年龄44~71岁,平均(54.63±9.55)岁。两组一般资料比较差异无统计学意义(P>0.05),具有可比性。
所有研究对象及家属均知情同意且签署知情同意书,本研究经医院伦理委员会批准。
1.2 纳入标准和排除标准 纳入标准:①符合《中国2型糖尿病防治指南(2017年版)》[6]中的诊断标准;②糖化血红蛋白(hemoglobin,HbAlc)≥7.0%;③初始患者HbAlc≥9.0%或空腹血糖(fasting blood glucose,FBG)≥11.0 mmol/L。排除标准:①1型糖尿病、妊娠期糖尿病及特殊类型糖尿病者;②对研究所用药物过敏或有过敏史者;③合并糖尿病急性并发症者;④痴呆、脑血管意外、心肌梗死者;⑤入院前2年有酒依赖、神经活性药物滥用或服用镇静催眠药等药物者。
1.3 方法 两组均采用阿格列汀进行治疗,给予阿格列汀25 mg/次,1次/d,胰岛素泵组采用胰岛素泵进行治疗,门冬胰岛素持续皮下注射,初始剂量0.5 U/kg,地特胰岛素,初始剂量0.2 U/kg,后期根据患者血糖水平变化适当调整剂量。基础治疗组采用皮下胰岛素进行治疗,门冬胰岛素注射液三餐前皮下注射,初始剂量0.5 U/kg,地特胰岛素注射液睡前皮下注射,初始剂量0.2 U/kg。两组基础胰岛素是总剂量的50%,其余50%均分至三餐前给药。
1.4 指标检测
1.4.1 FBG、餐后2 h血糖(2 h blood glucose,2 hBG)、HbAlc水平、治疗总费用评价 采用上海玉研科学仪器有限公司的血糖测试仪检测FBG、2 hBG水平;采用东西仪(北京)科技有限公司的Hb201+快速血红蛋白检测仪检测HbAlc水平。统计两组治疗总费用,并做比较。
1.4.2 炎性因子水平评价 抽取两组清晨空腹静脉血3 mL,以离心半径为5 cm、以转速3 000 r/min离心处理10 min,分离上层血清,-80 ℃保存,待用。采用酶联免疫吸附法检测C反应蛋白(C-reactive protein,CRP)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素6(interleukin-6,IL-6)水平,实验步骤:将血清样本置于室温后,取出试剂盒,标记酶标板,制作标准品,以1∶2的稀释液稀释样品;在反应孔上依次加入稀释好的待测血清及标准品100 μL/孔,放置37 ℃恒温孵育箱中湿育2 h;用专用洗涤液将反应板清洗3次后,加入抗体工作液(1∶100倍稀释后)100 μL/孔,置于37 ℃恒温孵育箱中湿育45 min;继续清洗反应板4次后,在反应孔内加入TMB溶液100 μL/孔,置于37 ℃恒温孵育箱中湿育45 min后在反应孔内加入终止液100 μL/孔以终止反应,在450 nm处读OD值;以OD值为纵坐标,以标准品为横坐标,绘制标准曲线,根据血清样本的OD值可在标准曲线上查出CRP、TNF-α、IL-6水平。
1.4.3 miR-144、miR-142表达评价 采用实时荧光定量PCR法检测miR-144、miR-142表达水平,将待测miRNAs反转录成cDNA,以β-actin为内参基因,反转录反应体系:5 μL mRQ缓冲液(2×)、1.25 μL mRQ酶、3.75 μL RNA样本,反转录反应条件:37 ℃ 60 min,85 ℃ 5 min,RCR管中加入90 μL纯水稀释至100 μL,采用日本Takara Bio公司的SYBR Advantage qPCR Premix Kit试剂盒和英国Applied Biosystems公司的7500定量PCR仪进行PCR反应,定量PCR反应体积为25 μL,包括2 μL cDNA、12.5 μL SYBR Advantage预混液(2×)、0.5 μL荧光染料校正液(50×)、0.5 μL mRQ3′引物、5 μL miRNAs特异性引物和9 μL纯水,定量PCR反应条件:95 ℃ 10 s、95 ℃ 5 s,65 ℃ 20 s,循环40次,采用2-△△Ct方法计算miR-144、miR-142表达量,其中△Ct=Ct目的基因-Ct内参基因(miR-451a),实验独立重复3次。miR-144上游引物:5′-UACAGUAUAGAUGAUGUACU-3′,下游引物:5′-TACTGTATAGATGATGTACT-3′;miR-142上游引物:5′-UGUAGUGUUUCCUAC-UUUAU-GGA-3′,下游引物:5′-TGTAGTGTTT-CCTACTTTATGGA-3′;内参β-actin引物序列:上游:5′-CTGGCACCACACCTTCTACAATGAGC-3′,下游:5′-GAGGATCTTCATGAGGTAGTCA-GT-3′。
1.4.4 治疗效果评价 将治疗效果分为显效、有效、无效三个标准,其中显效为FBG、2 hBG、HbAlc水平下降至正常范围,有效为FBG、2 hBG、HbAlc水平下降超过治疗前20%,无效为未达到上述标准。总有效率=(显效+有效)例数/总例数×100%。
1.4.5 不良反应发生情况评价 观察两组腹痛、头晕、低血糖、尿路感染、急性胰腺炎等不良反应发生情况,并作比较。
1.5 统计学方法 应用SPSS 21.0统计软件分析数据。计量资料比较分别采用两独立样本t检验和配对t检验;计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 两组FBG、2 hBG、HbAlc水平、治疗总费用比较 治疗前两组FBG、2 hBG、HbAlc水平比较差异无统计学意义(P>0.05);治疗后两组FBG、2 hBG、HbAlc水平均低于治疗前,胰岛素泵组FBG、2 hBG、HbAlc水平、治疗总费用低于基础治疗组,差异有统计学意义(P<0.05),见表1。
2.2 两组炎性因子水平比较 治疗前两组炎性因子水平比较差异无统计学意义(P>0.05);治疗后两组炎性因子水平低于治疗前,胰岛素泵组炎性因子水平低于基础治疗组,差异有统计学意义(P<0.05),见表2。
表1 两组FBG、2 hBG、HbAlc水平、治疗总费用比较
Table 1 Comparison of FBG, 2 hBG, HbAlc levels and total treatment costs between two groups![]()
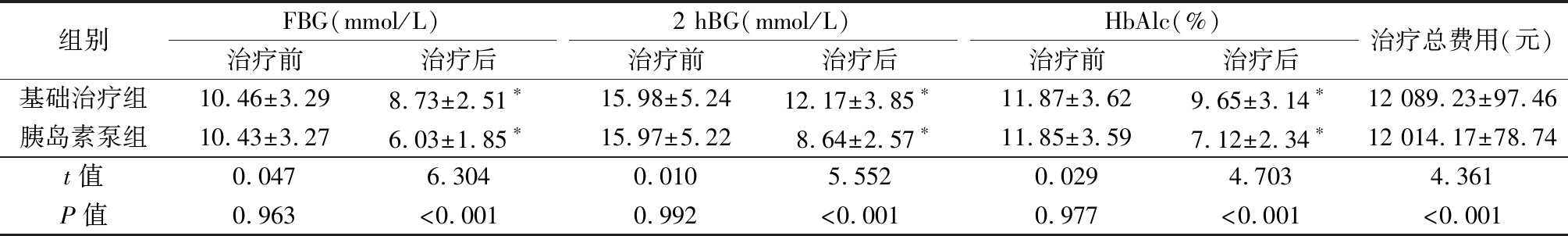
组别FBG(mmol/L)治疗前治疗后2 hBG(mmol/L)治疗前治疗后HbAlc(%)治疗前治疗后治疗总费用(元)基础治疗组10.46±3.298.73±2.51∗15.98±5.2412.17±3.85∗11.87±3.629.65±3.14∗12 089.23±97.46胰岛素泵组10.43±3.276.03±1.85∗15.97±5.228.64±2.57∗11.85±3.597.12±2.34∗12 014.17±78.74t值0.0476.3040.0105.5520.0294.7034.361P值0.963<0.0010.992<0.0010.977<0.001<0.001
*P值<0.05与治疗前比较(配对t检验)
表2 两组炎性因子水平比较
Table 2 Comparison of the levels of inflammatory factors between two groups![]()
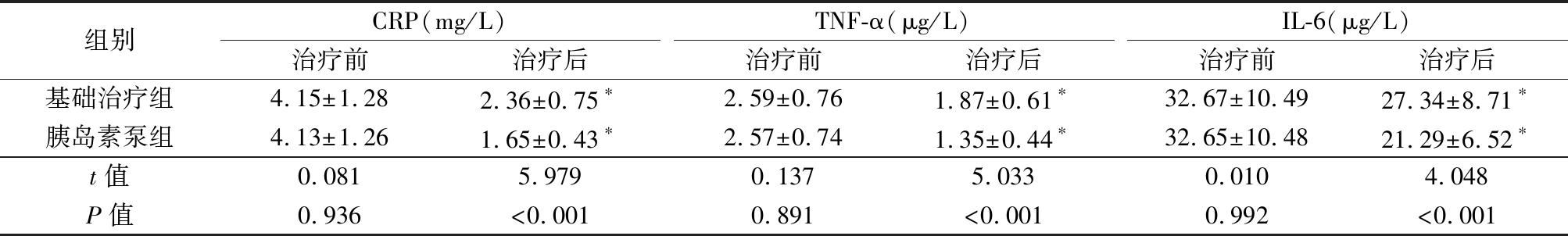
组别CRP(mg/L)治疗前治疗后TNF-α(μg/L)治疗前治疗后IL-6(μg/L)治疗前治疗后基础治疗组4.15±1.282.36±0.75∗2.59±0.761.87±0.61∗32.67±10.4927.34±8.71∗胰岛素泵组4.13±1.261.65±0.43∗2.57±0.741.35±0.44∗32.65±10.4821.29±6.52∗t值0.0815.9790.1375.0330.0104.048P值0.936<0.0010.891<0.0010.992<0.001
*P值<0.05与治疗前比较(配对t检验)
2.3 两组miR-144、miR-142表达比较 治疗前两组miR-144、miR-142表达比较差异无统计学意义(P>0.05);治疗后两组miR-144表达低于治疗前,miR-142表达高于治疗前,胰岛素泵组miR-144表达低于基础治疗组,miR-142表达高于基础治疗组,差异有统计学意义(P<0.05),见表3。
表3 两组miR-144、miR-142表达比较
Table 3 Comparison of miR-144 and miR-142 expression between two groups![]()
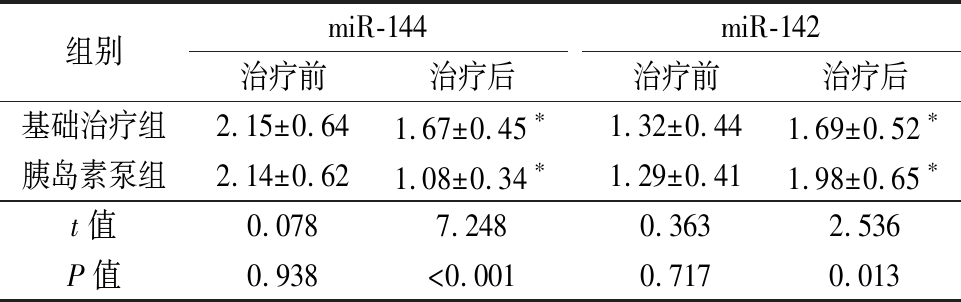
组别miR-144治疗前治疗后miR-142治疗前治疗后基础治疗组2.15±0.641.67±0.45∗1.32±0.441.69±0.52∗胰岛素泵组2.14±0.621.08±0.34∗1.29±0.411.98±0.65∗t值0.0787.2480.3632.536P值0.938<0.0010.7170.013
*P值<0.05与治疗前比较(配对t检验)
2.4 两组治疗效果比较 胰岛素泵组治疗总有效率高于基础治疗组,差异有统计学意义(P<0.05),见表4。
表4 两组治疗效果比较
Table 4 Comparison of therapeutic effect between two groups (n=53,例数,%)
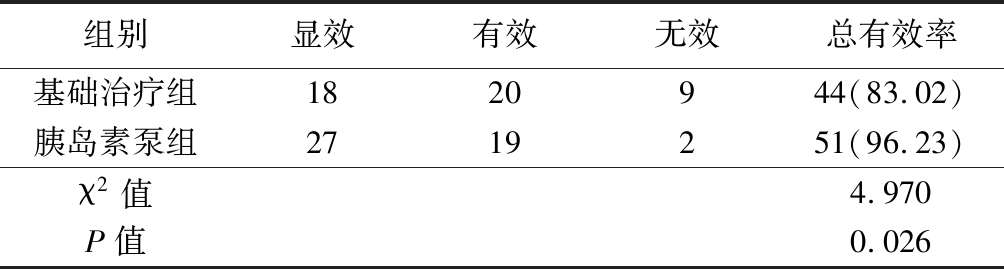
组别显效有效无效总有效率基础治疗组1820944(83.02)胰岛素泵组2719251(96.23)χ2值4.970P值0.026
2.5 两组不良反应发生情况比较 两组总不良反应发生率比较差异无统计学意义(P>0.05),见表5。
表5 两组不良反应发生情况比较
Table 5 Comparison of adverse reactions between two groups (n=53,例数,%)

组别腹痛头晕低血糖尿路感染急性胰腺炎不良反应发生率基础治疗组211217(13.21)胰岛素泵组110215(9.43)χ2值0.376P值0.540
3 讨 论
2型糖尿病发病与胰岛素的分泌和胰岛素异常相关联,其中高糖毒性、胰岛炎症、终末糖基化产物形成均会对胰岛β细胞造成损害[7]。如何有效控制或降低患者血糖、减少胰岛素抵抗、保护胰岛β细胞功能、提高患者预后,仍是目前研究热点[8]。
地特胰岛素、门冬胰岛素在2型糖尿病治疗中运用较为广泛,其中地特胰岛素可有效发挥降糖效果,增强胰岛素聚合能力,促进其与白蛋白发生可逆性结合,在使用时需控制用量,血糖波动较小;门冬胰岛素起效快且作用持续时间更短,可有效预防患者夜间出现低血糖症状[9-10]。随着医疗水平的进步,胰岛素泵在2型糖尿病的治疗中得到广泛运用,可有效改善胰岛β细胞功能,对血糖具有长期控制作用,且无需长时间使用降糖药物,在一定程度上减轻患者经济负担[11]。有研究显示,胰岛素泵可促进胰岛功能得到不同程度改善,其作用机制可能为通过对胰岛素生理分泌模式进行模拟,快速缓解并解除高糖毒性[12]。阿格列汀是非拟肽类二肽基肽酶4抑制剂,具有高选择性、高效的特点,对血糖具有显著的控制作用。本研究中,阿格列汀联合胰岛素泵可有效改善2型糖尿病患者血糖及临床相关指标,对胰岛功能具有显著的改善作用,疗效较佳。
胰岛素抵抗是糖尿病的主要病因之一,其中炎症状态会导致胰岛素抵抗并参与胰岛素抵抗的发生发展,CRP、TNF-α、IL-6等炎性因子具有协同作用,可直接增进胰岛β细胞的破坏和损伤,增加糖尿病的风险[13]。肝细胞CRP的产生依赖于TNF-α和IL-6,其中TNF-α对CRP这类急性相反应蛋白具有刺激作用,还可直接作用于胰岛β细胞,调节胰岛β细胞的胰岛素信号通路,促进2型糖尿病的延续;IL-6则可诱导血管内皮细胞黏附分子表达,进而激活炎症细胞,释放氧自由基、蛋白酶,损伤血管内皮细胞,增加血管通透性[14-15]。在刘伟等[16]研究中,他汀类药物在治疗糖尿病的过程中可有效抑制炎性因子水平,本研究与其结果一致。在周亚男等[17]研究中,TNF-α、IL-6等炎性因子水平出现非特异性升高时,会增加血管壁厚度、管腔狭窄、血管阻力等,若炎症反应持续,还会造成神经进一步损伤。本研究中,阿格列汀联合不同胰岛素强化方案可有效降低两组患者炎性因子水平,且采用胰岛素泵治疗,可有效控制炎性反应。
在梁英智等[18]研究中,应激相关miRNAs与2型糖尿病存在线性相关的关系,其中miR-144表达升高会增加2型糖尿病患病风险,miR-142表达降低会增加2型糖尿病患病风险。miR-144是一种具有多种生物活性的miRNA,可通过靶向不同基因,对细胞起调节作用;在糖尿病的发生发展中,其参与胰腺β细胞抗凋亡作用,进而参与糖尿病抵抗[19]。在刘春兴等[20]研究中,miR-144表达升高会加剧2型糖尿病的患病风险,其机制可能为miR-144可通过抑制胰岛素受体底物1表达,进而破坏胰岛素信号通路。此外,miR-144还可调节胆固醇代谢以及血浆中高密度脂蛋白水平,在肿瘤方面,可调节肿瘤细胞的增殖、分化、迁移[21]。本研究中,经治疗后miR-144表达降低、miR-142表达升高,且胰岛素泵组治疗效果更佳,说明胰岛素泵在治疗2型糖尿病中临床意义更大。
综上所述,阿格列汀联合胰岛素泵可有效改善2型糖尿病患者的临床症状,减轻机体炎症反应,降低不良反应发生率,提高预后效果,其机制可能为降低miR-144表达、升高miR-142表达。
[1] Frias PF,Frias JP. New basal insulins:a clinical perspective of their use in the treatment of type 2 diabetes and novel treatment options beyond basal insulin[J]. Curr Diab Rep,2017,17(10):91.
[2] Hernando VU,Pablo FJ. Efficacy and safety of the second generation basal insulin analogs in type 2 diabetes mellitus:A critical appraisal[J]. Diabetes Metab Syndr,2019,13(3):2126-2141.
[3] Goldenberg RM,Berard L. Adding prandial GLP-1 receptor agonists to basal insulin:a promising option for type 2 diabetes therapy[J]. Curr Med Res Opin,2018,34(1):1-10.
[4] 魏素滨.瑞格列奈联合甘精胰岛素治疗2型糖尿病的临床疗效及安全性观察[J].贵州医药,2020,44(8):1212-1213.
[5] 刘晶,赵培,陈稳,等.实时胰岛素泵治疗对2型糖尿病患者氧化应激及血管内皮功能的影响[J].河北医科大学学报,2019,40(12):1380-1383.
[6] 中华医学会糖尿病学分会.中国2型糖尿病防治指南(2017年版)[J].中华糖尿病杂志,2018,10(1):4-67.
[7] Fullerton B,Siebenhofer A,Jeitler K,et al. Short-acting insulin analogues versus regular human insulin for adult,non-pregnant persons with type 2 diabetes mellitus[J]. Cochrane Database Syst Rev,2018,12(12):CD013228.
[8] ElNaggar N,Kalra S. Switching from biphasic human insulin to premix insulin analogs:a review of the evidence regarding quality of life and adherence to medication in type 2 diabetes mellitus[J]. Adv Ther,2017,33(12):2091-2109.
[9] 李晶.糖尿乐胶囊联合地特胰岛素治疗2型糖尿病的临床研究[J].现代药物与临床,2020,35(2):313-317.
[10] 王晓燕.门冬胰岛素联合瑞格列奈治疗2型糖尿病的临床体会[J].解放军预防医学杂志,2019,37(8):110-111,114.
[11] 徐敏.短期胰岛素泵治疗对新诊断2型糖尿病患者血糖波动及超敏C-反应蛋白水平的影响[J].护理实践与研究,2020,17(10):52-54.
[12] 许桂煌,张莹,郑思远,等.不同口服降糖药对2型糖尿病胰岛素泵强化治疗患者胰岛功能及预后的影响[J].西部医学,2020,32(6):832-835.
[13] 金康,乔静敏,赵志刚,等.甘精胰岛素联合二甲双胍对2型糖尿病患者胰岛功能及炎性因子水平的影响[J].河北医药,2019,41(17):2674-2677.
[14] 王佩,郑娅红,冯秒肖,等.阿司匹林联合格列美脲对2型糖尿病的临床疗效及对血清炎性因子的影响[J].中国老年学杂志,2019,39(13):3118-3120.
[15] 高婷婷.西格列汀联合甘精胰岛素治疗老年2型糖尿病的疗效及对炎性因子的影响[J].中国药物与临床,2019,19(6):969-971.
[16] 刘伟,祝海锐,李佳,等.他汀类药物对2型糖尿病的疗效及炎性因子的影响[J].解放军医药杂志,2020,32(2):64-66.
[17] 周亚男,吴学伦,张金成,等.老年2型糖尿病患者血清炎性因子表达及与周围神经病变的相关性分析[J].解放军医药杂志,2019,31(11):56-60.
[18] 梁英智,闫宇翔.应激相关microRNA在2型糖尿病及糖尿病前期患者中的表达规律及意义研究[J].中国全科医学,2018,21(12):1419-1427.
[19] Yang ZM,Chen LH,Hong M,et al. Serum microRNA profiling and bioinformatics analysis of patients with type 2 diabetes mellitus in a Chinese population[J]. Mol Med Rep,2017,15(4):2143-2153.
[20] 刘春兴,高永辉,汤在祥.2型糖尿病患者血浆miR-144水平与吸烟状况的相关性研究[J].现代检验医学杂志,2019,34(2):17-19.
[21] Mononen N,Lyytikäinen LP,Seppälä I,et al. Whole blood microRNA levels associate with glycemic status and correlate with target mRNAs in pathways important to type 2 diabetes[J]. Sci Rep,2019,9(1):8887.