单纯性高甲硫氨酸血症是由于基因突变导致甲硫氨酸降解过程受阻,引起血液中甲硫氨酸持续升高而引发的疾病,是一种遗传代谢性疾病。甲硫氨酸又名蛋氨酸,是人体必需含硫氨基酸,主要在肝脏中通过甲硫氨酸腺苷转移酶(methionine adenosyl transferase,MAT)进行代谢,该酶有MATⅠ、MATⅡ和MATⅢ3种亚型,MATⅠ和MATⅢ均由MAT1A基因编码,主要在肝脏组织中表达;MATⅡ由MAT1A基因编码,主要在非肝组织中表达。正常情况下甲硫氨酸在MATⅠ/Ⅲ的催化下形成S-腺苷甲硫氨酸,当MATⅠ/Ⅲ酶缺陷导致活性降低时,致使甲硫氨酸不能正常代谢,在体内蓄积,导致甲硫氨酸血症的发生[1]。导致MATⅠ和MATⅢ缺乏的相关基因有MAT1A、GNMT、AHCY等,其中MAT1A最为常见,遗传方式可为常染色体显性或隐性遗传[2]。高甲硫氨酸血症是一种较罕见的疾病,文献多以病例报道为主,缺乏流行病学统计,本研究通过串联质谱技术-非衍生法对石家庄市149 094例活产新生儿进行筛查,并结合患儿基因突变结果分析,为临床诊断和遗传咨询提供依据。
1 资 料 与 方 法
1.1 一般资料 选取2014年1月—2019年7月在石家庄市15个县区所辖的26个助产机构、7个市区所辖的12个助产机构分娩的149 094例活产新生儿,经筛查中心筛查并确诊有单纯性高甲硫氨酸血症患儿12例和伴高同型半胱氨酸血症患儿1例。筛查前家长均签署知情同意书,本研究经医院伦理委员会批准实施。
1.2 串联质谱筛查及基因突变检测
1.2.1 仪器与试剂 Waters TQD串联质谱仪、Waters 2777C自动进样器、Waters1525μ高效液相色谱仪泵、MassLynxV4.1串联质谱筛查信息系统购自美国Waters公司;微孔板恒温孵育震荡仪购自杭州奥盛仪器有限公司;超声波清洗机购自中国康士洁有限公司;通风柜购自中国杰瑞电气有限公司;串联质谱-非衍生化甲硫氨酸测定试剂盒购自山东英盛公司。
1.2.2 标本采集 新生儿出生72 h后,充分哺乳6~8次,于足跟两侧采集3个直径>8 mm、圆形均匀血斑,悬空自然晾干2~3 h,置于密封袋封口,规定时间内上报至妇幼机构并冷链递送至筛查中心,置于2~8 ℃冰箱保存待检。
1.2.3 串联质谱-非衍生法 用打孔器取直径3 mm高、低质控样本和待测样本血斑,置于U型底96孔微孔板中。每孔加入90 μL萃取工作液,30 ℃,700 r/min,震荡孵育45 min。转移75 μL上清液至V型底96孔板的对应位置,覆上铝箔纸以减少挥发。将V型板放入自动进样器中,建立样品列表,采用多反应监测模式进行检测,采用MassLynxV4.1串联质谱筛查信息系统,通过比较分析物和内标分析物的信号积分面积进行计算待检物浓度水平。
1.2.4 质量控制 检测过程中采用了包括试剂盒(由山东英盛提供)的质控及样品一起测定,质控的处理方法及上机检测条件与样本一致,采用多批实验、最小20次质控值,计算并制作Levey-Jennings质控图。将12 s(1~2 s)即一个质控测定值超过X±2 s质控限作为本实验室质控图的警告限,将13 s(1~3 s)即一个质控测定值超过X±3 s质控限作为本实验室质控图的失控限,将22 s(2~2 s)即两个连续的质控测定值同时超过X-2 s或X+2 s质控限与前一规则共用作为失控限,实现对检测过程的质量控制,以及每年参加两次卫生部临检中心的室间质量评价并获得合格证书。
1.2.5 基因突变检测 经知情同意,抽取筛查阳性患儿及部分父母外周静脉血各4 mL,2%乙二胺四乙酸钠抗凝,提取DNA,采用二代测序技术进行基因突变分析。为避免假阳性,对于检测到的变异采用Sanger直接测序法进行验证。
2 结 果
2.1 串联质谱筛查结果 149 094例新生儿中,筛查可疑阳性患儿49例,召回复查后确诊13例,发病率为1/11 469。13例患儿中1例伴有高同型半胱氨酸升高,其余均为单纯性高甲硫氨酸血症。其中单纯性高甲硫氨酸血症患儿12例串联质谱初筛甲硫氨酸水平为82.38(53.14~213.74)μmol/L,复查甲硫氨酸水平为229.02(57.38~1 134.46)μmol/L;另1例伴有血同型半胱氨酸升高患儿初筛甲硫氨酸水平为54.32 μmol/L,复查为82.17 μmol/L(表1)。
表1 高甲硫氨酸血症患儿血串联质谱筛查结果
Table 1 Blood screening results of children with hypermethionine by tandem mass spectrometry (μmol/L)
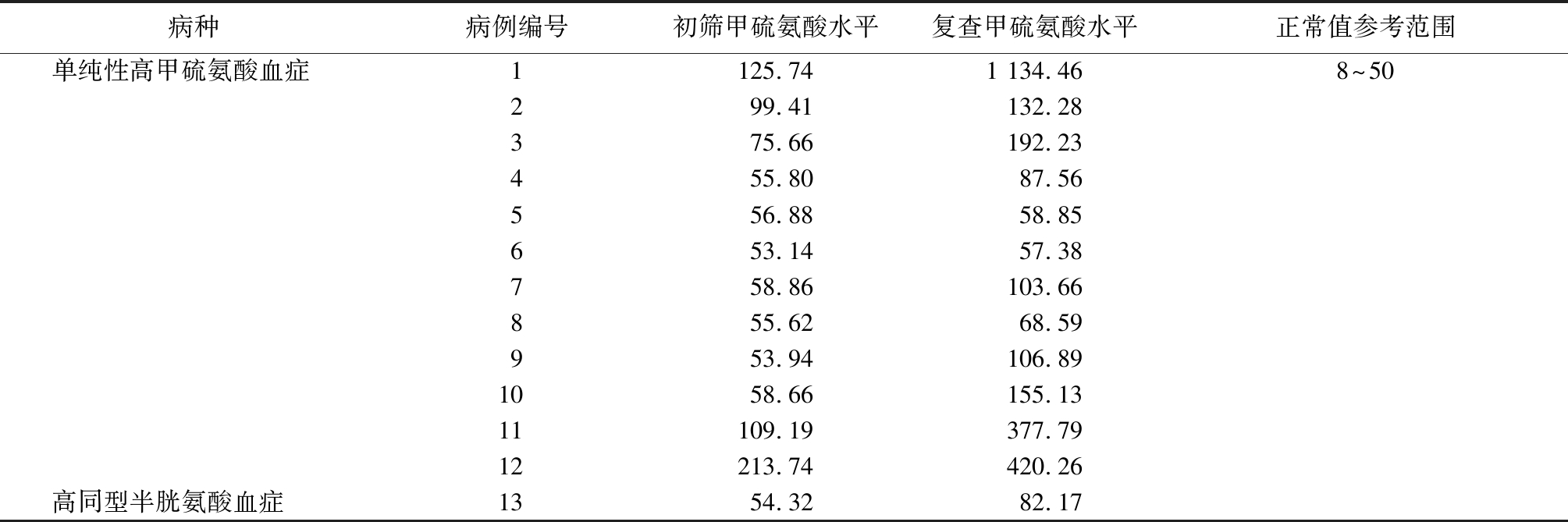
病种病例编号初筛甲硫氨酸水平复查甲硫氨酸水平正常值参考范围单纯性高甲硫氨酸血症1125.741 134.468~50299.41132.28375.66192.23455.8087.56556.8858.85653.1457.38758.86103.66855.6268.59953.94106.891058.66155.1311109.19377.7912213.74420.26高同型半胱氨酸血症1354.3282.17
2.2 基因检测结果 9例单纯性高甲硫氨酸血症患儿基因检测结果发现均携带MAT1A基因突变,其中杂合突变7例,复合杂合突变1例,基因整体杂合缺失1例(表2)。基因突变分析发现点突变9种,查阅文献发现已报道4种,分别为c.791G>A、c.769G>A、c.1070C>T和c.874 C>T(图1);未报道5种,分别为c.1086-3C>G、c.712G>A、c.188G>T、c.178T>C和c.757G>A,以及MAT1A基因整体杂合缺失1例(图2)。
2.3 随访结果 对阳性患儿13例进行随访,例10存在肝损伤,例1、例3和例10分别服用特殊奶粉或接受药物治疗几个月后停药,现所有患儿均发育正常,见表3。
表2 9例单纯性高甲硫氨酸血症患儿基因检测结果分析
Table 2 Analysis of genetic test results of 9 children with isolated hypermethioninemia
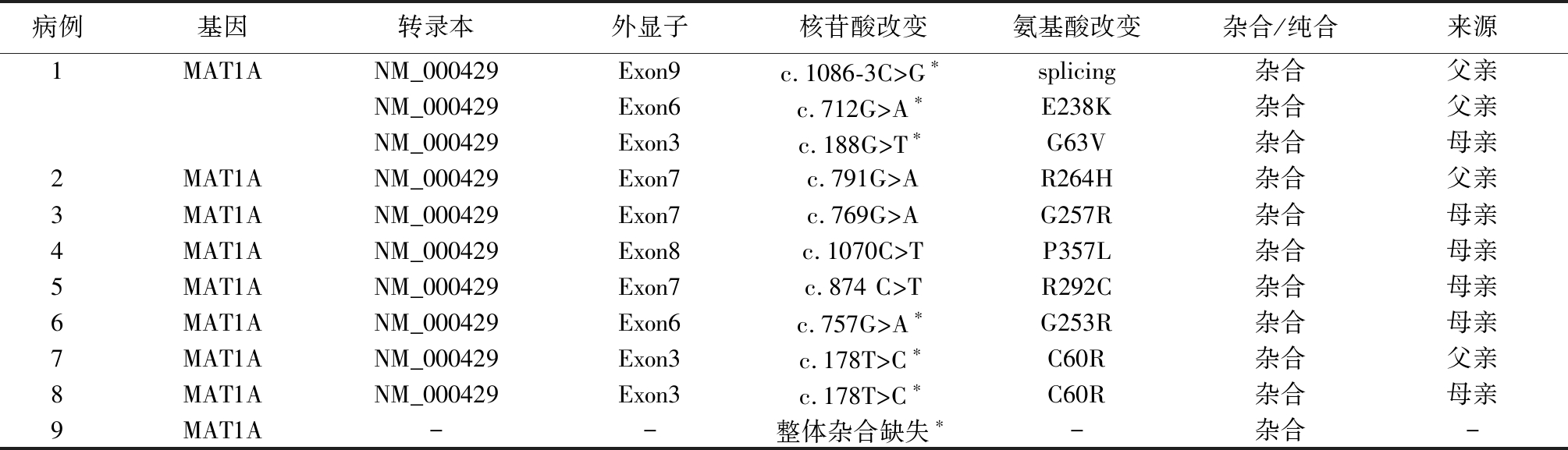
病例基因转录本外显子核苷酸改变氨基酸改变杂合/纯合来源1MAT1ANM_000429Exon9c.1086-3C>G∗splicing杂合父亲NM_000429Exon6c.712G>A∗E238K杂合父亲NM_000429Exon3c.188G>T∗G63V杂合母亲2MAT1ANM_000429Exon7c.791G>AR264H杂合父亲3MAT1ANM_000429Exon7c.769G>AG257R杂合母亲4MAT1ANM_000429Exon8c.1070C>TP357L杂合母亲5MAT1ANM_000429Exon7c.874 C>TR292C杂合母亲6MAT1ANM_000429Exon6c.757G>A∗G253R杂合母亲7MAT1ANM_000429Exon3c.178T>C∗C60R杂合父亲8MAT1ANM_000429Exon3c.178T>C∗C60R杂合母亲9MAT1A--整体杂合缺失∗-杂合-
注:*未报道 “-”代表缺失
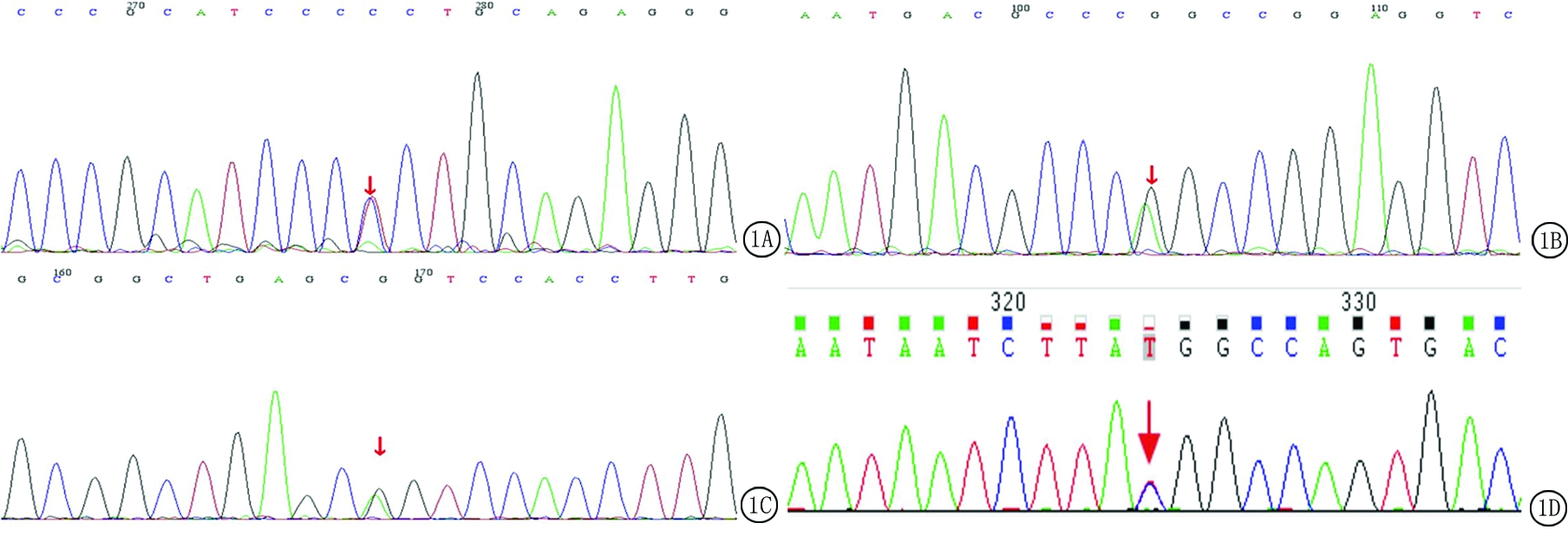
图1 已报道MAT1A基因突变
A.c.769G>A;B.c.1070C>T;C.c.874 C>T;D.c.791G>A
Figure 1 MAT1A gene mutation reported
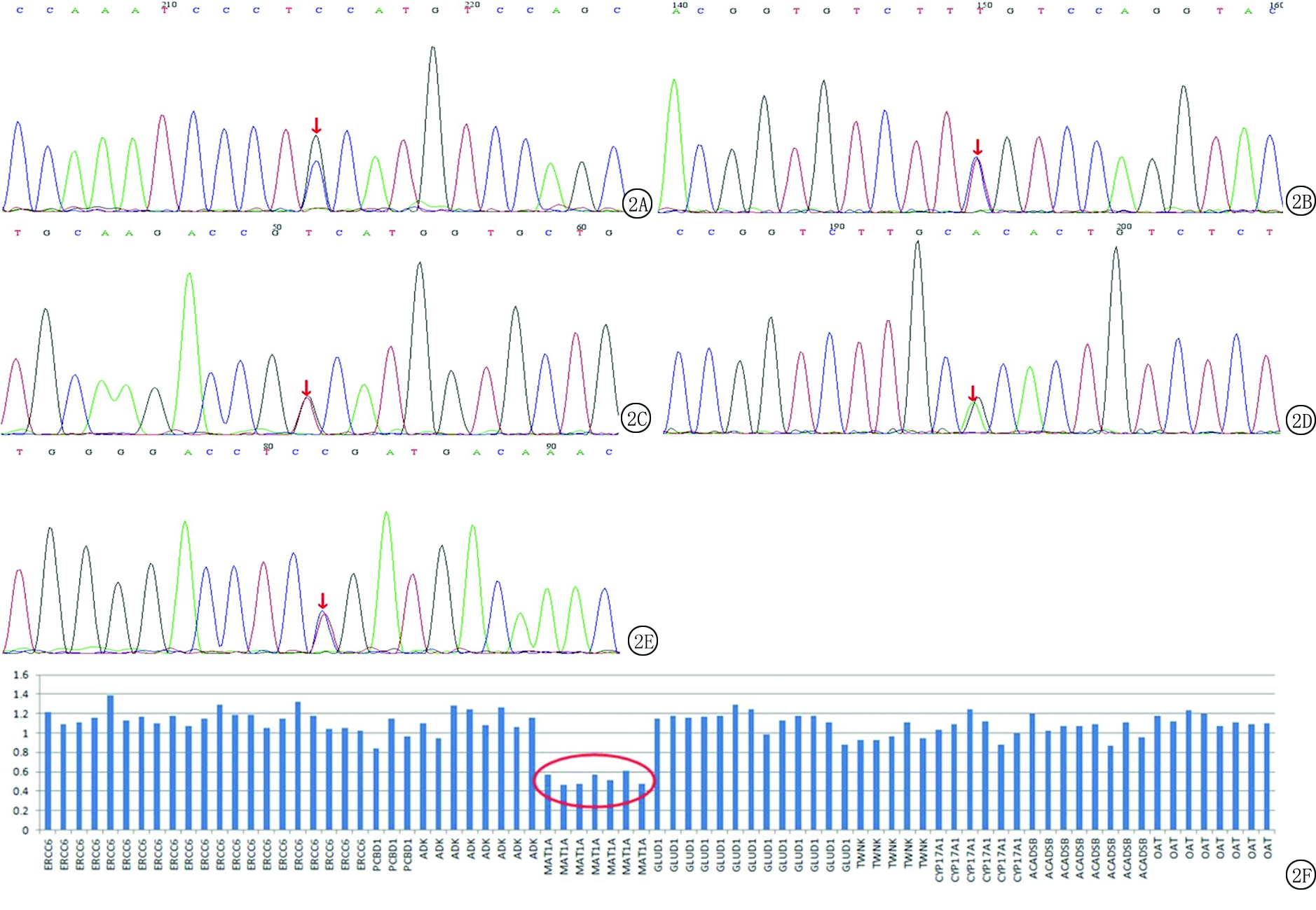
图2 未报道MAT1A基因突变及MAT1A整体杂合缺失
A.c.1086-3 C>G;B.c.712G>A;C.c.188G>T;D.c.178T>C;E.c.757G>A;F.MAT1A整体杂合缺失
Figure 2 MAT1A gene mutation unreported and MAT1A gene heterozygosity
表3 13例阳性患儿随访结果
Table 3 Follow-up results of 13 children tested positive for hypermethioninemia

病例肝功能血同型半胱氨酸治疗特殊奶粉药物发育情况例1正常正常6个月后停用无正常例2、4、5、6、7、8、9、11、12正常正常无无正常例3正常正常3个月后停用无正常 例10肝损伤正常无2个月后停用正常 例13正常升高无无正常
3 讨 论
3.1 临床表现 单纯性高甲硫氨酸血症是一种罕见的遗传病,可由遗传因素和非遗传因素引起。遗传因素主要是指由MAT1A基因突变所致,遗传方式为常染色体显性或隐性遗传;非遗传因素包括肝脏疾病、富含甲硫氨酸饮食或者早产儿/低出生体重儿、存在其他氨基酸代谢疾病引起的继发性改变导致血甲硫氨酸水平升高等,均可导致暂时性或一过性高甲硫氨酸血症的发生。对于MAT1A基因突变引起的单纯性高甲硫氨酸血症患儿中,在新生儿期多无明显临床症状,严重的MATⅠ/Ⅲ缺陷则可引起中枢神经系统并发症,包括精神发育迟滞、认知障碍、行为异常等,另有文献报道个别患儿存在生长发育迟缓、进行性脑损害等症状[3-4]。生化异常还可能会引发肌病、低血糖、红细胞形态改变伴脾脏含铁血黄素沉着症、食欲缺乏和消化系统紊乱、中枢神经系统发育异常和(或)肝脏疾病[4-6]。而这些患儿可于新生儿早期通过串联质谱筛查被确诊,因此,早期诊断和早期干预对改善预后至关重要。
3.2 发病率 原发性高甲硫氨酸血症发病率低,国内外相关报道较少,我们通过回顾分析石家庄市149 094例活产新生儿串联质谱筛查结果,统计出石家庄市此病发病率为 1/11 469,高于台湾地区报道的1/106 349[7];高于Nagao等[8]报道的日本地区此病的发病率1/107 850;以及高于某报道的西班牙地区此病的发病率1/23 469[9]。
3.3 治疗 单纯性高甲硫氨酸血症患儿是否应当进行饮食控制治疗存在争议[4,9]。对于无临床症状的患儿无需限制饮食,过度的饮食限制可导致甲硫氨酸缺乏以及蛋白质营养不良,从而对甲硫氨酸代谢途径产生影响;而过高的血甲硫氨酸水平有导致中枢系统毒性风险。因此,建议当甲硫氨酸水平>800 μmol/L,需严格限制甲硫氨酸摄入,维持血甲硫氨酸水平在500~600 μmol/L[4]。本研究检出的单纯性高甲硫氨酸血症患儿12例中,只有1例患儿甲硫氨酸水平>800 μmol/L,为1 134.46 μmol/L,服用特殊奶粉6个月后停用,现发育正常;1例患儿存在肝损伤,接受药物治疗2个月后停药,现发育正常;1例患儿接受特殊奶粉治疗3个月后停用,发育正常;其余患儿未给予治疗,发育正常。
3.4 遗传信息及基因突变 MATⅠ/Ⅲ是甲硫氨酸腺苷转移酶的两种同分异构体,Ⅰ是α1亚基的四聚体,Ⅲ是α1亚基的二聚体,仅在肝脏中表达,其编码的基因为MAT1A,定位于10q23.1,全长20 kb,包含9个外显子,编码395个氨基酸[10]。MAT1A基因突变可导致 MAT活性降低甚至完全丧失, 从而导致甲硫氨酸代谢途径受阻,在体内蓄积,引起高甲硫氨酸血症的发生。国内外已报道至少19种MAT1A基因突变与此疾病相关,如G257R、P357L、I322M、R292C、A55D、P357L、L305P、R264K、R264D、R264L、R264H、R264E、R256Q、R199C、R356Q、539insTG、827insG、G378S及1 043-1 044delTG等[11-15]。本研究采用二代测序技术对9例阳性患儿进行基因突变检测,共检出9种突变位点,其中文献已报道4种,分别为c.791G>A(R264H)、c.769G>A(G257R)、c.1070C>T(P357L)和c.874 C>T(R292C),4种突变均为错义突变;文献尚未报道5种,分别为c.1086-3C>G(splicing)、c.712G>A(E238K)、c.188G>T(G63V)、c.757G>A(G253R)和c.178T>C(C60R),除c.1086-3C>G为剪接突变外,其余突变位点均为错义突变;此外,还发现了一例存在MAT1A基因整体杂合缺失,进一步丰富了数据库。
综上所述,高甲硫氨酸血症较罕见,石家庄市新生儿发病率为 1/11 469,新生儿疾病筛查中串联质谱筛查技术的应用,使得单纯性高甲硫氨酸血症得以早期发现。此外,经新生儿疾病筛查的患儿多数无特异性临床表现,仅表现为生化异常,对于此类患儿,应定期监测血浆甲硫氨酸和生长发育情况。经基因检测发现,9例单纯性高甲硫氨酸血症患儿基因检测结果发现均携带MAT1A基因突变,其中杂合突变7例,复合杂合突变1例,基因整体杂合缺失1例。对于杂合子致病的可能原因为MAT1A基因为常染色体显性或隐性遗传,杂合子有致病的可能性,常见的如R264H[8],遗传方式为显性遗传,单等位基因突变即可导致新生儿血甲硫氨酸升高,因此对于不同病例需个体化分析,结合检测结果及临床表现进行综合判断。
[1] 顾学范.临床遗传代谢病[M].北京:人民卫生出版社,2015:57-59.
[2] 杨威,陈琼,沈凌花,等.甲硫氨酸腺苷转移酶Ⅰ/Ⅲ缺陷导致高甲硫氨酸血症1例[J].中华实用儿科临床杂志,2019,34(4):311-313.
[3] 孙云,马定远,王彦云,等.一例单纯性高甲硫氨酸血症患儿的MAT1A基因突变分析[J].中华医学遗传学杂志,2017,34(1):98-101.
[4] 王倩倩,陈志红.高甲硫氨酸血症的研究现状[J].国际儿科学杂志,2018,45(11):855-859.
[5] 王洪芹,谢春霞.青岛地区一例单纯性高甲硫氨酸血症MAT1A基因突变分析[J].中国优生与遗传杂志,2019,27(8):912-913.
[6] 沈玉燕,黎剑,肖刚.一例单纯性高甲硫氨酸血症基因突变分析[J].中国优生与遗传杂志,2018,26(6):39-40.
[7] Chien YH,Chiang SC,Huang A,et al. Spectrum of hypermethioninemia in neonatal screening[J]. Early Human Development,2005,81(6):529-533.
[8] Nagao M,Tanaka T,Furujo M. Spectrum of mutations associated with methionine adenosyltransferase Ⅰ/Ⅲ deficiency among individuals identified during newborn screening in Japan[J]. Mol Genet Metab,2013,110(4):460-464.
[9] 杨宇奇,王淮燕,江丽华,等.1例高甲硫氨酸血症基因突变分析[J].中国当代儿科杂志,2017,19(9):1020-1021.
[10] Hazelwood S,Bernardini I,Shotelersuk V,et al. Normal brain myelination in a patient homozygous for a mutation that encodes a severely truncated methionine adenosyltransferase Ⅰ/Ⅲ[J]. Am J Med Genet,1998,75(4):395-400.
[11] 马艳艳,李东晓,李溪远,等.甲硫氨酸腺苷转移酶活性缺陷致高甲硫氨酸血症3例报告[J].临床儿科杂志,2018,36(1):57-60.
[12] Mudd SH. Hypermethioninemias of genetic and non-genetic origin:a review [J]. Am J Med Genet C Semin Med Genet,2011,157 (1):3-32.
[13] Chien YH,Harvey MS,Chung LN,et al. Spectrum of hypermethioninemia in Taiwan[J]. Jpn J Inherit Metab Dis,2008,24(1):66-70.
[14] Pérez Mato I,S nchez del Pino MM,Chamberlin ME,et al. Biochemical basis for the dominant inheritance of hypermethioninemia associated with the R264H mutation of the MAT1A gene[J]. J Biol Chem,2001,276(17):13803-13809.
nchez del Pino MM,Chamberlin ME,et al. Biochemical basis for the dominant inheritance of hypermethioninemia associated with the R264H mutation of the MAT1A gene[J]. J Biol Chem,2001,276(17):13803-13809.
[15] Couce ML,Bo′ veda MD,Castineiras DE,et al. Hypermethioninemia due to methionine adenosyltransferase Ⅰ/Ⅲ(MAT Ⅰ/Ⅲ) deficiency:diagnosis in an expanded neonatal screening programme[J]. J Inherit Metab Dis,2008,31:233-239.