生长激素缺乏症(growth hormone deficiency,GHD)又称垂体性矮小症,是生长激素缺乏引起的内分泌疾病。文献报道,GHD发生率为(20~25)/10万[1]。重组人生长激素(recombinant human growth hormone,rhGH)是GHD的特效治疗药物。GHD不仅对儿童期身高的增长有影响,对青春期及成年都有不同程度的影响。rhGH治疗不仅可以增加GHD患儿的身高,还可以促进蛋白质代谢,对身体成分、肌力、骨密度、血脂和内皮功能有一定的作用[2-3]。成年GHD患者也经常出现血脂异常、腹部肥胖、胰岛素抵抗、高血压、颈动脉内膜增厚和心脏结构和功能异常[4-5]。研究显示,短期和长期rhGH治疗对腹部脂肪、血脂和内膜厚度都有一定的影响[6-7]。目前关于聚乙二醇重组人生长激素(pegylated recombinant human growth hormone,PEG-rhGH)对GHD患儿血脂影响的研究较少。故本研究以PEG-rhGH治疗6个月的GHD患儿为研究对象,探讨PEG-rhGH治疗GHD的临床效果及对脂代谢的影响。报告如下。
1 资 料 与 方 法
1.1 一般资料 选择2015年7月—2018年3月河北省儿童医院内分泌门诊收治的GHD患儿60例。均未性发育(TannerⅠ期);身高、体重低于同年龄、同性别平均值2个标准差以上;经过询问病史、详细体格检查和检查排除其他内分泌、营养、骨代谢、染色体和心理疾病等其他原因引起的矮小,经精氨酸(0.5 g/kg)和左旋多巴(0.01 g/kg)刺激试验确诊为GHD(生长激素峰值<10 μg/L)。根据随机数字表法分为观察组31例和对照组29例。2组性别、年龄、骨龄、身高、体重差异均无统计学意义(P>0.05),具有可比性。见表1。
本研究经医院医学伦理委员会批准通过。所有患者或家属知情同意并签署知情同意书。
表1 2组一般资料比较
Table 1 Comparison of general data between two groups![]()
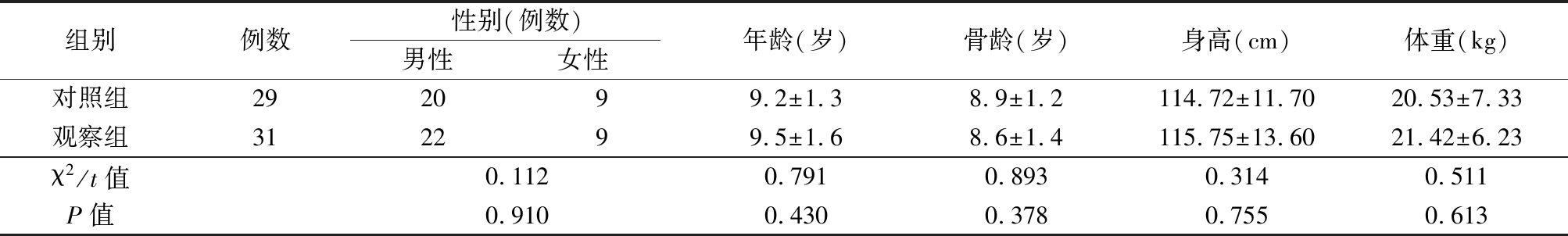
组别例数性别(例数)男性女性年龄(岁)骨龄(岁)身高(cm)体重(kg)对照组292099.2±1.38.9±1.2114.72±11.7020.53±7.33观察组312299.5±1.68.6±1.4115.75±13.6021.42±6.23χ2/t值0.1120.7910.8930.3140.511P值0.9100.4300.3780.7550.613
1.2 方法 治疗前对患儿进行常规体格检查,测量身高、体重,标记生长曲线;检测精氨酸激发试验和左旋多巴激发试验、微量元素、血尿常规、肝肾功能、甲状腺功能[促甲状腺激素(thyrotropic hormone,TSH)、游离甲状腺素(free thyroxine index,FT4)、游离三碘甲状腺原氨酸(free triiodothyronine,FT3)、总甲状腺素(thyroxine,T4)、总三碘甲状腺原氨酸(triiodothyronine,T3)]、血脂[总胆固醇(total cholesterol,T-CHO)、高密度脂蛋白胆固醇(high density liptein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density liptein cholesterol,LDL-C)、三酰甘油(triglyceride,TG)]、空腹血糖、胰岛素样生长因子1(insulin-like growth factor 1,IGF-1)、胰岛素样生长因子结合蛋白3(insulin-like growth factor binding protein 3,IGF-BP3)、脊柱正侧位、心电图、垂体MRI,女孩加测染色体;询问出生史、生长发育史、家族史。确诊为GHD,除外PEG-rhGH治疗禁忌证。对照组给予常规营养支持治疗,主要包括制定合理饮食方案,规划患者饮食,适量补充其维生素、钙质及微量元素。观察组在常规营养治疗的基础上联合PEG-rhGH注射液(长春金赛药业有限责任公司生产,国药准字S20140001,规格9 mg/支),使用剂量为每周0.16~0.17 mg/kg皮下注射,部位为脐周、大腿外侧及上臂外侧,疗程为6个月。
1.3 评价指标
1.3.1 临床效果 以治疗前后患儿的身体情况进行评价,评价指标包括身高、体重,于治疗前、治疗后6个月日晨8∶00空腹由指定人员用同一测量仪器测量患儿身高、体重。
1.3.2 甲状腺功能指标检测 治疗前和治疗6个月后于早晨空腹采集患儿静脉血2 mL,3 000 r/min离心10 min取血清,待测样本保存在-70 ℃超低温冰箱内,采用电化学发光法检测TSH、FT4、FT3、T4、T3水平。试剂盒由上海江莱生物科技有限公司提供。所有操作均严格按照试剂盒说明书和仪器操作指南。
1.3.3 血脂指标检测 治疗前、治疗后6个月于早晨空腹采集患儿静脉血2 mL,3 000 r/min离心10 min取血清,待测样本保存在-70 ℃超低温冰箱内,采用生化酶比色法检测T-CHO、HDL-C、LDL-C、TG水平。试剂盒由上海江莱生物科技有限公司提供。所有操作均严格按照试剂盒说明书和仪器操作指南。
1.3.4 IGF-1、IGF-BP3检测 治疗前、治疗后6个月于早晨空腹采集患儿静脉血2 mL,3 000 r/min离心10 min后取血清,待测样本保存在-70 ℃超低温冰箱内,采用酶联免疫吸附法测定IGF-1、IGF-BP3水平。试剂盒由上海江莱生物科技有限公司提供。所有操作均严格按照试剂盒说明书和仪器操作指南。
1.3.5 药物不良反应发生情况 治疗期间注意观察注射部位有无红肿、硬结、发热等不良反应。
1.4 统计学方法 应用SPSS 20.0统计软件分析数据。计量资料比较采用独立样本的t检验和配对t检验,计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 2组身高、体重比较 治疗前,2组身高、体重差异无统计学意义(P>0.05);治疗6个月后,观察组身高、体重明显高于治疗前,明显高于对照组,差异有统计学意义(P<0.05)。对照组身高、体重与治疗前比较差异无统计学意义(P>0.05)。见表2。
2.2 2组甲状腺功能水平比较 2组治疗前后组间和组内TSH、FT4、FT3、T4、T3水平比较差异均无统计学意义(P>0.05)。见表3。
2.3 2组血脂指标比较 治疗前,2组TG、T-CHO、HDL-C、LDL-C水平差异无统计学意义(P>0.05));治疗6个月后,观察组TG、T-CHO、LDL-C水平明显低于治疗前,且TG、T-CHO、LDL-C水平明显低于对照组,差异有统计学意义(P<0.05);观察组HDL-C与治疗前比较差异无统计学意义(P>0.05);对照组TG、T-CHO、HDL-C、LDL-C水平与治疗前比较差异无统计学意义(P>0.05)。见表4。
2.4 2组IGF-1、IGF-BP3水平比较 治疗前,2组IGF-1、IGF-BP3水平差异无统计学意义(P>0.05);治疗6个月后,观察组IGF-1、IGF-BP3水平明显高于治疗前,且IGF-1、IGF-BP3水平明显高于对照组,差异有统计学意义(P<0.05)。对照组IGF-1、IGF-BP3水平与治疗前比较差异无统计学意义(P>0.05)。见表5。
表2 2组身高、体重比较
Table 2 Comparison of height and weight between two groups![]()
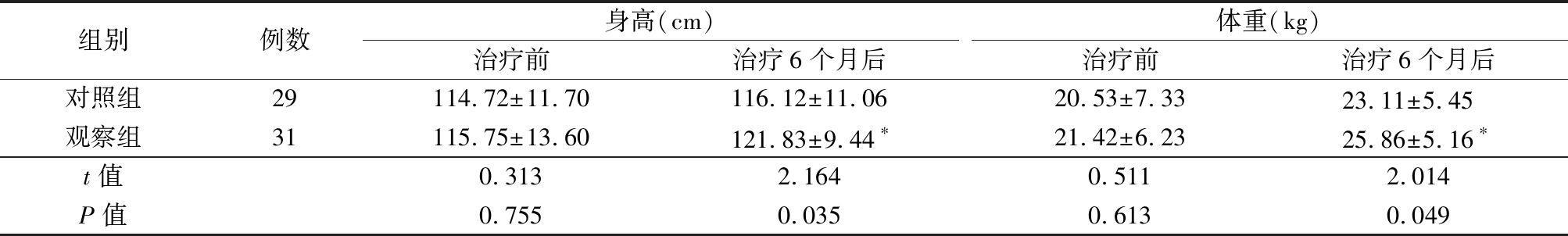
组别例数身高(cm)治疗前治疗6个月后体重(kg)治疗前治疗6个月后对照组29114.72±11.70116.12±11.0620.53±7.3323.11±5.45 观察组31115.75±13.60121.83±9.44∗21.42±6.2325.86±5.16∗t值0.3132.1640.5112.014P值0.7550.0350.6130.049
*P值<0.05与治疗前比较(配对t检验)
表3 2组甲状腺功能水平比较
Table 3 Comparison of thyroid function between two groups![]()
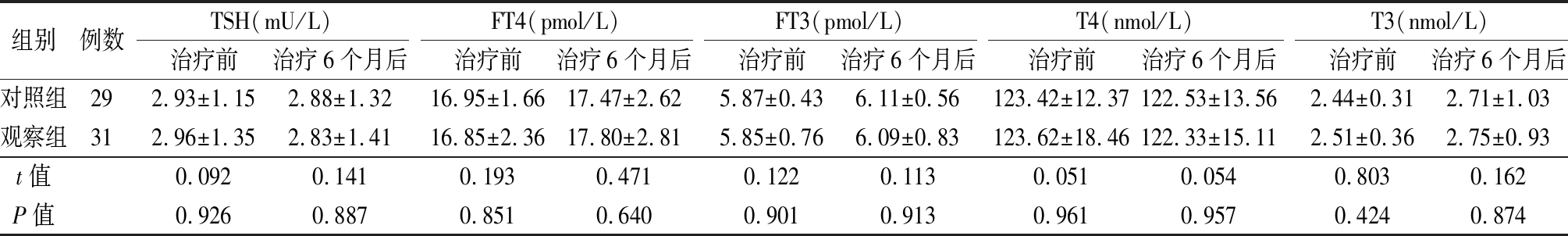
组别例数TSH(mU/L)治疗前治疗6个月后FT4(pmol/L)治疗前治疗6个月后FT3(pmol/L)治疗前治疗6个月后T4(nmol/L)治疗前治疗6个月后T3(nmol/L)治疗前治疗6个月后对照组292.93±1.152.88±1.3216.95±1.6617.47±2.625.87±0.436.11±0.56123.42±12.37122.53±13.562.44±0.312.71±1.03观察组312.96±1.352.83±1.4116.85±2.3617.80±2.815.85±0.766.09±0.83123.62±18.46122.33±15.112.51±0.362.75±0.93t值0.0920.1410.1930.4710.1220.1130.0510.0540.8030.162P值0.9260.8870.8510.6400.9010.9130.9610.9570.4240.874
表4 2组血脂指标比较
Table 4 Comparison of blood lipid indexes between two groups![]()
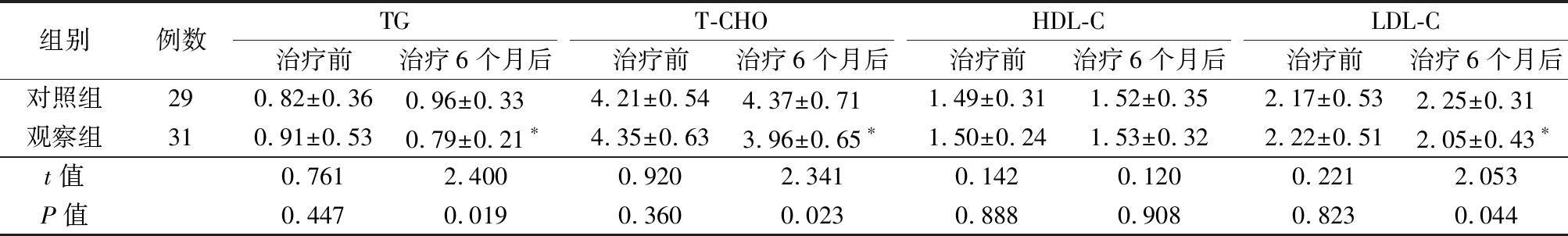
组别例数TG治疗前治疗6个月后T-CHO治疗前治疗6个月后HDL-C治疗前治疗6个月后LDL-C治疗前治疗6个月后对照组290.82±0.360.96±0.33 4.21±0.544.37±0.71 1.49±0.311.52±0.352.17±0.532.25±0.31 观察组310.91±0.530.79±0.21∗4.35±0.633.96±0.65∗1.50±0.241.53±0.322.22±0.512.05±0.43∗t值0.7612.4000.9202.3410.1420.1200.2212.053P值0.4470.0190.3600.0230.8880.9080.8230.044
*P值<0.05与治疗前比较(配对t检验)
表5 2组IGF-1、IGF-BP3水平比较
Table 5 Comparison of IGF-1 and IGF-BP3 levels between two groups![]()
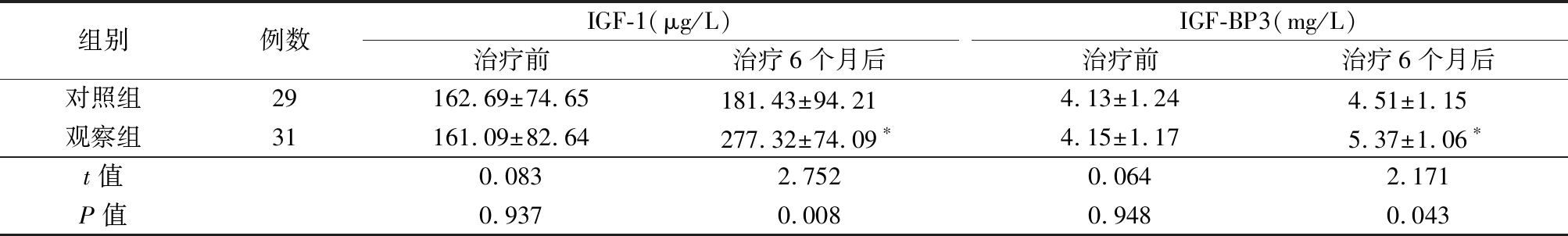
组别例数IGF-1(μg/L)治疗前治疗6个月后IGF-BP3(mg/L)治疗前治疗6个月后对照组29162.69±74.65181.43±94.21 4.13±1.244.51±1.15 观察组31161.09±82.64277.32±74.09∗4.15±1.175.37±1.06∗t值0.0832.7520.0642.171P值0.9370.0080.9480.043
*P值<0.05与治疗前比较(配对t检验)
2.5 2组药物不良反应比较 研究期间2组均未发生注射部位皮肤红肿、硬结和药物相关过敏、发热等不良反应。
3 讨 论
PEG-rhGH是近几年应用于临床的重组人生长激素,此激素的优点是可以1周注射1次,明显减少注射引起的痛苦,但是此激素临床应用时间尚短,相关研究较少。rhGH的生物效能与人体的GH有极大一致性[8]。GH生理作用广泛[9],多年临床应用表明,rhGH可以增加GHD患儿的终身高,而且rhGH治疗相对安全,但是在治疗过程中需检测血糖、血脂、甲状腺功能、IGF-1等血液指标。
rhGH可直接作用于骨骺软骨细胞加快分裂增殖的速度,从而加速骨骼生长,另外外源性rhGH还可提高与受体结合GH含量,促进肝脏IGF-1释放,促使软骨细胞增生,促进骨生长,从而明显改善患儿的身高和体重。本研究结果显示,观察组患儿应用PEG-rhGH治疗6个月后,患儿的身高、体重较治疗前均明显升高,且明显高于对照组,差异有统计学意义。说明PEG-rhGH治疗GHD患儿具有明显的促生长作用,可以明显改善患儿的终身高和体重,具有较好的临床效果,且研究期间未发现与药物相关的任何不良反应出现,说明PEG-rhGH用于治疗GHD患儿临床效果确切,且安全性较好。
有研究表明,rhGH替代治疗GHD患儿会引起一过性甲状腺功能减低,表现为在rhGH治疗后3~6个月,出现了FT3升高,FT4降低,1年后可恢复治疗前水平[10-12]。本研究结果显示,rhGH治疗前后甲状腺功能无明显变化,说明PEG-rhGH短期治疗对甲状腺功能无明显影响,短期应用比较安全,与国内其他相关研究结果一致[13]。研究表明,GH的促生长作用主要由IGF-1、IGF-BP3介导,不同剂量rhGH对特发性矮小症患儿IGF-1和IGF-BP3水平的影响存在剂量依赖性[14]。本研究结果显示,应用PEG-rhGH治疗6个月的GHD患儿IGF-1、IGF-BP3水平均较治疗前明显升高,与以往研究结果一致[14-15]。说明应用PEG-rhGH治疗GHD患儿,安全可靠,且疗效显著,IGF-1、IGF-BP3水平可作为PEG-rhGH治疗效果的重要监测指标。
研究表明,GHD患儿存在血脂代谢异常[16]。GHD患儿的T-CHO、TG及LDL-C较正常儿童水平升高,HDL-C水平降低[17]。GHD患儿接受rhGH治疗后,血脂水平有所改善[18]。Hannon等[19]研究表明,对ISS患儿进行rhGH治疗前后,T-CHO、LDLC、HDLC、TG水平差异无统计学意义。也有研究表明,对ISS患儿进行rhGH治疗对血脂代谢无明显影响,治疗前后差异无统计学意义[20-21]。可见国内外研究rhGH对脂代谢影响的结果并不一致。本研究结果显示,在应用PEG-rhGH治疗6个月后,观察组患儿T-CHO、TG、LDL-C水平较治疗前降低,差异有统计学意义,表示PEG-rhGH是有一定的降血脂、调节脂代谢紊乱的作用。GH调节血脂主要途径:①诱导肝细胞、肌细胞产生生长激素介质;②直接作用于靶细胞产生生理效应。推测GH可通过使肝脏LDL-C受体mRNA表达上调,提高肝脏摄取LDL-C能力,加速血脂代谢,使LDL-C生成率降低、消除增加,从而降低血脂。
本研究虽然发现在应用PEG-rhGH治疗6个月后观察组患儿T-CHO、TG、LDL-C均有明显下降,但HDL-C变化不明显。可能是因为样本量太小、观察时间短所致,会进一步增加样本量,延长观察时间,进一步深入研究。
综上所述,应用PEG-rhGH治疗GHD患儿临床效果明显,可促进身高、体重改善,明显促生长作用,并且可改善患儿脂代谢,对甲状腺功能无明显不良影响,安全性较高,值得临床推广应用。
[1] Wilson TA,Rose SR,Cohen P,et al. Update of guidelines for the use of growth hormone in children:the lawson wilkins pediatric endocrinology society drug and therapeutics committee[J]. J Pedistr,2017,143(4):415-421.
[2] Cohen P,Rogol AD,Deal CL,et al. Consensus statement on the diagnosis and treatment of children with idiopathic short stature:a summary of the growth hormone research society,the lawson wilkins pediatric endocrine society,and the european society for paediatric endocrinology workshop[J]. J Clin Endocrinol Metab,2018,93(11):4210-4217.
[3] Gazzaruso C,Gola M,Karamouzis I,et al. Cardiovascular risk in adult patients with growth hormone(GH) deficiency and following substitution with GH-an update[J]. J Clin Endocrinol Metab,2014,99(1):18-29.
[4] Capalbo D,Esposito A,Di Mase R,et al. Update on early cardiovascular and metabolic risk factors in children and adolescents affected with growth hormone deficiency[J]. Minerva Endocrinol,2018,37(4):379-389.
[5] Groban L,Lin M,Kassik KA, et al. Early-onset growth hormone deficiency results in diastolic dysfunction in adult-life and is prevented by growth hormone supplementation[J]. Growth Horm IGF Res,2018,21(2):81-88.
[6] Appelman-Dijkstra NM,Claessen KM,Roelfsema F, et al. Long-term effects of recombinant human GH replacement in adults with GH deficiency:a systematic review[J]. Eur J Endocrinol,2018,169(1):R1-14.
[7] De Marco S,Marcovecchio ML,Caniglia D,et al. Circulating asymmetric dimethylarginine and lipid profile in pre-pubertal children with growth hormone deficiency:effect of 12-month growth hormone replacement therapy[J]. Growth Horm IGF Res,2014,24(5):216-220.
[8] Frindik JP,Kemp SF. Managing idiopathic short stature:role of somatropin(rDNA origin) for injection[J]. Biologics,2019,4:147-155.
[9] Harvey S. Extrapituitary growth hormone[J]. Endocrine,2019,38(3):335-359.
[10] 宋娟,朱锦渊,黄秀娟,等.生长激素治疗儿童生长激素缺乏症32例临床观察[J].当代医学,2018,20(7):23-24.
[11] 王颖,梁芙蓉.儿童生长激素治疗前后甲状腺功能的变化[J].中国生育健康杂志,2017,28(2):155-157.
[12] 王颖,梁芙蓉.矮身材儿童治疗前后甲状腺功能变化研究进展[J].中华实用儿科临床杂志,2016,31(20):1595-1597.
[13] 王新莲.重组人生长激素对特发性矮小症患儿生长发育及甲状腺功能的影响[J].临床研究,2019,27(7):117-118.
[14] 李雪峰,谭华清.不同剂量r-hGH对特发性矮小患儿IGF-1和IGFBP-3水平的影响[J].中国妇幼健康研究,2019,30(12):1499-1502.
[15] 王俊慧,宋爽,王德平.血清IGF-1和IGFBP-3水平检测在评价基因重组人生长激素治疗特发性身材矮小儿童的疗效分析[J].现代检验医学杂志,2019,34(6):105-108.
[16] Capalbo D,Mattace RG,Esposito A,et al. Cluster of cardiometabolic risk factors in children with GH deficiency:a prospective,case-control study[J]. Clin Endocrinol(Oxf),2014,80(6):856-862.
[17] Chen M,Gan D,Luo Y,et al. Effect of recombinant human growth hormone therapy on blood lipid and carotid intima-media thickness in children with growth hormone deficiency[J]. Pediatr Res,2018,83(5):954-960.
[18] 王晓岩,王燕,刘利蕊.重组人生长激素对GHD和ISS患儿的促生长作用及对血脂的影响[J].承德医学院学报,2019,36(2):100-103.
[19] Hannon TS,Danadian K,Suprasongsin C,et al. Growth hormone treatment in adolescent males with idiopathic short stature:changes in body composition,protein,fat,and glucose metabolism[J]. J Clin Endocrinol Metab,2017,92(8):3033-3039.
[20] 郑方圆,王雪梅,王新利.重组人生长激素治疗对特发性矮小儿童的糖脂代谢及甲状腺功能的影响[J].中国当代儿科杂志,2019,16(12):1236-1240.
[21] 张炫炜,张满燕,沈红,等.重组人生长激素对特发性矮小儿童生长速度和糖脂代谢、骨代谢水平的影响[J].中国医师进修杂志,2018,41(10):887-891.