浅表淋巴结是外周免疫器官,也是免疫应答的发生场所,呈组群分布,颈部淋巴结是最常见的一个组群[1]。当颈部淋巴结内部细胞增生或全身性疾病侵袭淋巴结时,淋巴结会出现肿大,虽然可通过触摸发现,但是准确度不高,且不能分辨出淋巴结的良恶性[2]。超声造影技术在临床应用广泛,可清楚显示微循环状况与灌注信息,对颈部浅表淋巴结良恶性质的判断、治疗方法的选择及预后的评估均有重要意义[3]。然而超声造影花费的时间较常规超声显著长,而脱机后的图像定量分析时间更长,不符合临床快速诊断的要求。并且,目前关于超声造影定量分析与定性分析对颈部浅表淋巴结病变诊断的比较较少。基于此,本研究分析50例颈部浅表淋巴结肿大患者超声造影的定性和定量分析诊断结果,以明确超声造影的鉴别诊断价值。现报告如下。
1 资 料 与 方 法
1.1 一般资料 前瞻性选取2019年8月—2020年3月在疆维吾尔自治区喀什地区第一人民医院体检发现的颈部浅表淋巴结肿大患者50例作为研究对象,男性21例,女性29例,年龄25~78岁,平均(48.36±12.59)岁;反应性增生8例,慢性非特异性淋巴结炎9例,转移性淋巴结28例(甲状腺癌24例、肺部鳞癌2例、乳腺癌1例、鼻咽癌1例),非霍奇金淋巴瘤5个。纳入标准:①自愿超声造影定性与定量检查者;②经手术病理学证实;③淋巴结最大直径>5 mm。排除标准:①凝血功异常者;②合并严重心脏病、肺病、肾病;③不能耐受超声造影。
本研究经医院医学伦理委员会批准通过,所有患者知情同意并签署知情同意书。
1.2 方法
1.2.1 超声造影 采用迈瑞公司Resona5型彩色多普勒超声诊断仪,Ml L9-3U探头,超声造影采用对比脉冲系列成像Cadence CPS技术。超声造影检查过程中,仪器的增益补偿、机械指数(mechanical index,MI)(0.09)、探测深度(4 cm)、动态范围、焦距等参数不变。超声造影剂选用意大利Bracco公司生产的声诺维(SonoVue)。
先行二维超声检查,观察淋巴结的纵横比、边界、内部回声、淋巴门有否缺失,测量每个淋巴结在最大纵切面上的纵径(L)和横径(T)的纵横比值(L/T)(图1),为超声造影选择体积较大、形态异常的淋巴结。
造影前在患者肘静脉常规放置留置针,现场配置造影剂,加入5 mL生理盐水溶解冻干粉,用力振荡摇匀,形成乳状混悬液。抽取2.0~2.4 mL微泡悬液经肘静脉团注,随后再注入5 mL生理盐水冲管。灰阶超声造影即造影剂注射后3 s开始,连续记录、储存图像。由2名在超声造影检查岗位工作5年以上的医师分别脱机对肿大淋巴结超声造影的增强特点进行分析。观察病变区域造影灌注模式、病灶增强特点、边界清晰度、病灶达峰强度分级等特点,作为定性诊断依据。
造影后可见造影剂信号强度随时间呈动态逐步增强和减退,将感兴趣区(region of interest,ROI)放置在淋巴结近包膜下皮质内高灌注或低灌注区,采用时间-强度曲线分析软件及自动跟踪增强定量分析软件进行动态分析,获得时间-强度曲线(time intensity curve,TIC)、达峰时间(time to peak,TP)、峰值强度(peak intensity,PI)、速度参数(β)、平均渡越时间(timefrom peak to one half,mTT)。
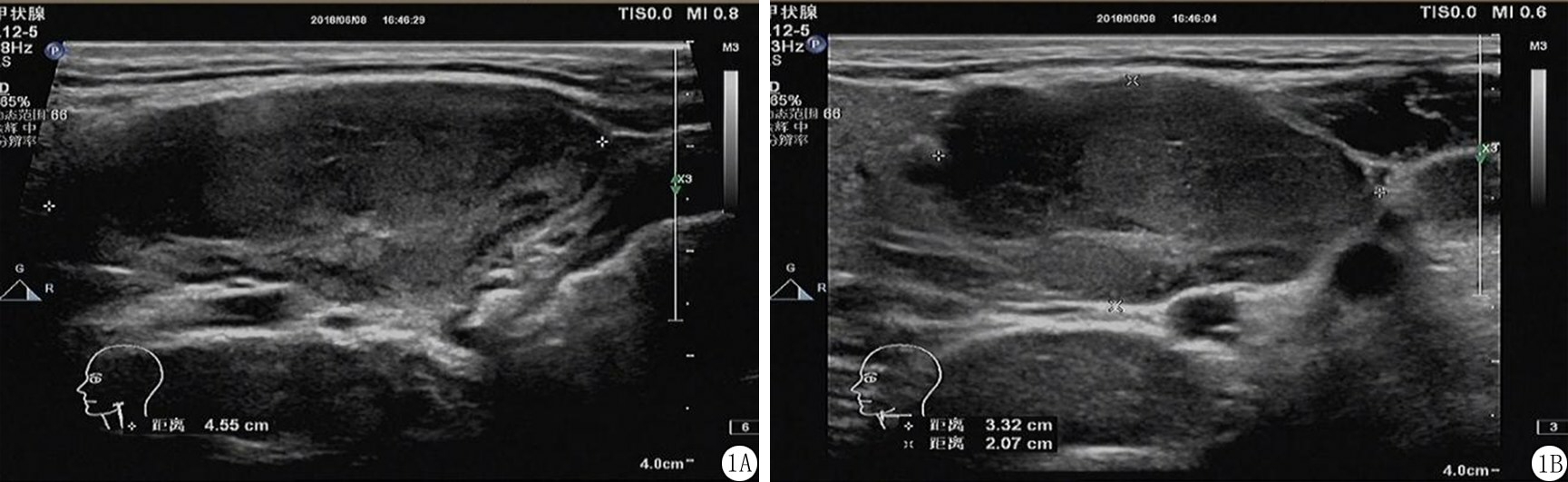
图1 左颈Ⅱ区肿大淋巴结灰阶超声纵切面及横断面图像
A.皮髓质不清,淋巴门消失,纵横比>2;B.皮髓质不清,淋巴门消失,纵横比>2
Figure 1 Longitudinal and cross-sectional images of enlarged lymph nodes in the left neck zone Ⅱ by gray-scale ultrasound
1.2.2 超声造影下细针穿刺细胞学检查 患者仰卧位,充分暴露颈部,头偏向穿刺部位另一侧,常规术区消毒、铺巾。使用2%利多卡因局部麻醉,淋巴结横断面监视下,采用23 GX 50 mm穿刺针(或20~50 mL注射器接7~9号针头),穿刺入超声造影选定好的肿大淋巴结内,反复提插,进行多点穿刺,穿刺次数一般为2~3针。将穿刺抽取的细胞分为2份,一份注入到细胞保存液中,另一份进行刮片2张,送病理科检查。细胞学分类参照甲状腺细胞病理学Bethesda报告系统推荐的分类标准,分为Ⅰ~Ⅵ级。阳性诊断标准为Bethesda System Ⅳ级。超声造影选定淋巴结标准:均匀增强模式者,在包膜下和中心区域分别取材,不均匀增强模式者,在异常增强区域取材。
1.3 统计学方法 应用SPSS22.0统计软件处理数据。计量资料比较采用独立样本t检验;计数资料比较采用χ2检验,一致性分析采用Kappa一致性检验,Kappa≥0.6表示一致性较强,0.6
2 结 果
2.1 病理诊断结果 病理诊断显示,50例浅表淋巴结中Ⅰ级9例、Ⅱ级7例、Ⅲ级1例、Ⅳ级33例,提示良性淋巴结17例,恶性淋巴结33例(图2)。超声引导下细针穿刺检查结果与手术病理检查结果一致性较强(Kappa=0.868,P<0.05)。见表1。
表1 超声引导下细针穿刺检查诊断结果与手术病理结果比较 Table 1 Comparison of diagnosis results of fine needle aspiration under the guidance of ultrasonography and surgical pathology (例数,%)
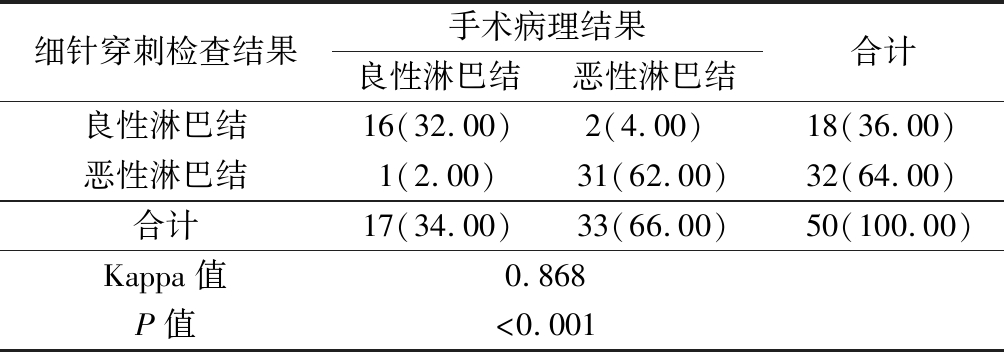
细针穿刺检查结果手术病理结果良性淋巴结恶性淋巴结合计良性淋巴结16(32.00)2(4.00) 18(36.00)恶性淋巴结1(2.00)31(62.00)32(64.00)合计17(34.00)33(66.00)50(100.00)Kappa值0.868P值<0.001
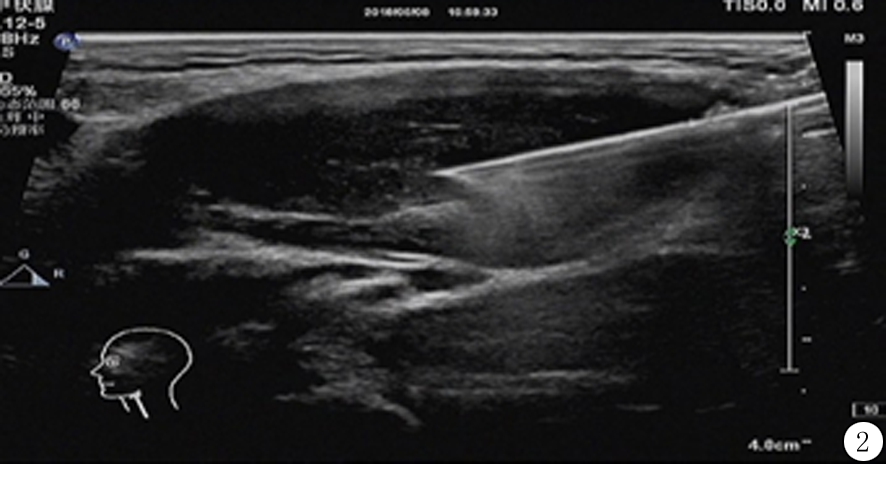
图2 超声引导下左颈Ⅱ区肿大淋巴结细针穿刺
Figure 2 Ultrasound-guided fine-needle aspiration of swollen lymph nodes in the left neck zone Ⅱ
2.2 超声造影定性比较 良性淋巴结和恶性淋巴结的造影灌注模式、病灶增强特点、边界清晰度、病灶达峰强度分级差异均有统计学意义(P<0.05)。见表2。
2.3 超声造影定量参数比较 良性组TP、PI、mTT值明显小于恶性组,差异均有统计学意义(P<0.05),2组β值差异无统计学意义(P>0.05)。见表3。
表2 超声造影定性比较
Table 2 Qualitative comparison of contrast-enhanced ultrasonography (例数,%)
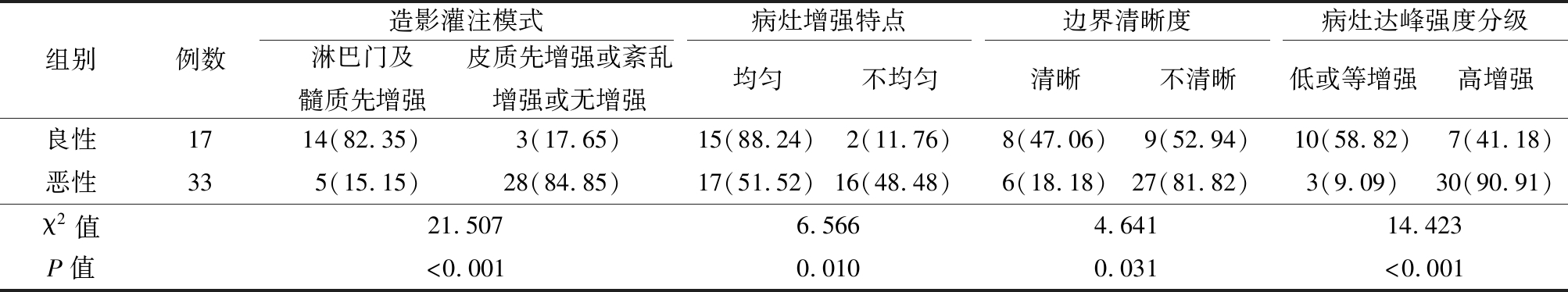
组别例数造影灌注模式淋巴门及髓质先增强皮质先增强或紊乱增强或无增强病灶增强特点均匀不均匀边界清晰度清晰不清晰病灶达峰强度分级低或等增强高增强良性1714(82.35)3(17.65)15(88.24)2(11.76)8(47.06)9(52.94)10(58.82)7(41.18)恶性335(15.15)28(84.85)17(51.52)16(48.48)6(18.18)27(81.82)3(9.09)30(90.91)χ2值21.5076.5664.64114.423P值<0.0010.0100.031<0.001
表3 超声造影定量参数比较
Table 3 Comparison of quantitative parameters of contrast-enhanced ultrasonography![]()
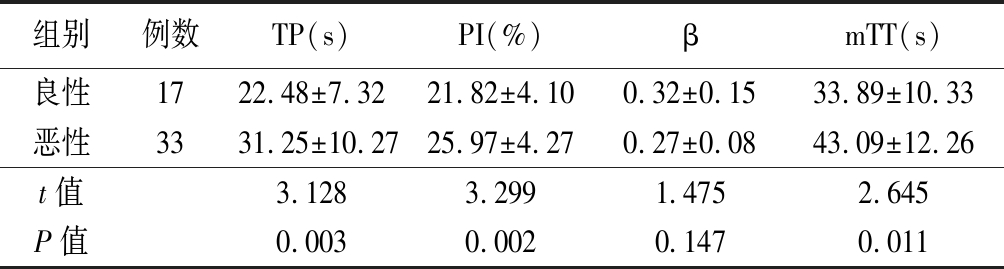
组别例数TP(s)PI(%)βmTT(s)良性1722.48±7.3221.82±4.100.32±0.1533.89±10.33恶性3331.25±10.2725.97±4.270.27±0.0843.09±12.26t值3.1283.2991.4752.645P值0.0030.0020.1470.011
2.4 定性指标的Logistic 回归分析 将造影灌注模式、病灶增强特点、边界清晰度、病灶达峰强度分级纳入Logistic 回归模型,赋值情况见表4;四项联合=造影灌注模式+(1.635/3.616)×病灶增强特点+(0.501/3.616)×边界清晰度+(3.091/3.616)×病灶达峰强度分级。见表5。
表4 变量赋值表
Table 4 Variable assignment table

变量类别变量名变量赋值自变量造影灌注模式淋巴门及髓质先增强=0;皮质先增强或紊乱增强或无增强=1病灶增强特点均匀=0;不均匀=1边界清晰度清晰=0;不清晰=1病灶达峰强度分级低或等增强=0;高增强=1因变量IMT良性=0;恶性=1
表5 定性指标的Logistic回归分析
Table 5 Logistic regression analysis of qualitative indicators
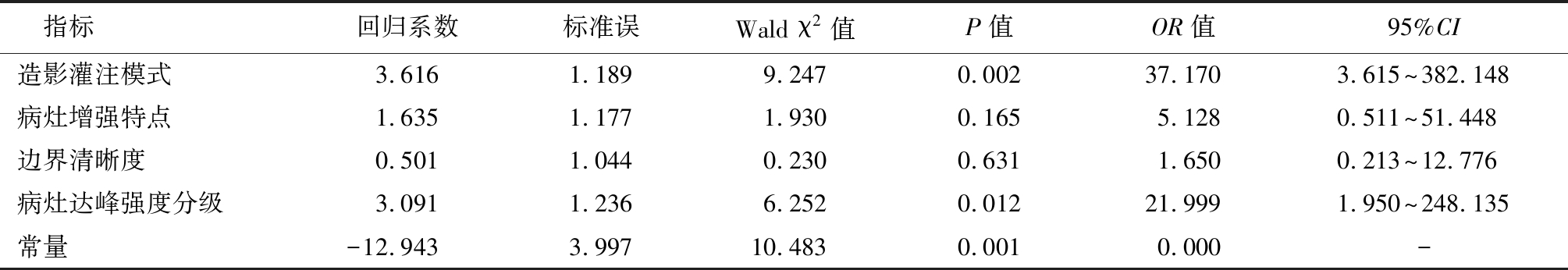
指标回归系数标准误Wald χ2值P值OR值95%CI造影灌注模式3.6161.1899.2470.00237.1703.615~382.148病灶增强特点1.6351.1771.9300.1655.1280.511~51.448边界清晰度0.5011.0440.2300.6311.6500.213~12.776病灶达峰强度分级3.0911.2366.2520.01221.9991.950~248.135常量-12.9433.99710.4830.0010.000-
2.5 定量指标的Logistic 回归分析 将因变量IMT(IMT良性赋值为“0”,恶性赋值为“1”),连续型自变量TP、PI、mTT纳入Lgistic 回归模型,赋值情况见表6,三项联合=TP+(0.136/0.077)×PI +(0.036/0.077)×mTT。见表7。
2.6 定性分析与定量诊断浅表淋巴结病变的ROC曲线分析 ROC曲线分析显示,定量分析结果诊断恶性颈部浅表淋巴结的AUC为0.829;定性分析结果诊断恶性颈部浅表淋巴结的AUC为0.939。采用Z检验定性分析结果与定量分析结果的AUC比较:Z=(0.939-0.829)/(0.034×0.034+0.064×0.064)×(0.5),P值=[1-NORMSDIST(1.518)]×2=0.129。根据最佳临界值,当定量分析结果低于85.44 时,其敏感度为84.8%,特异度为82.4%;当定性分析结果低于3.51时,其敏感度为90.9%,特异度为82.4%。见表8,图3。
表6 变量赋值表
Table 6 Variable assignment table

变量类别变量名变量赋值 自变量TP连续型变量PI连续型变量mTT连续型变量因变量IMT良性=0;恶性=1
表7 定性指标的 Logistic 回归分析
Table 7 Logistic regression analysis of qualitative indicators

指标回归系数标准误Wald χ2值P值OR值95%CITP0.0770.0423.4480.0631.0800.996~1.172PI0.1360.0862.5240.1121.1460.969~1.356mTT0.0360.0341.1030.2941.0370.969~1.109常量-6.0452.1987.5600.0060.002-
表8 定性分析与定量诊断浅表淋巴结病变的ROC曲线分析
Table 8 ROC curve analysis of qualitative analysis and quantitative diagnosis of superficial lymph node lesions

检测指标AUCCut-off值Youden指数敏感度特异度定量分析结果0.82985.440.67284.8%82.4%定性分析结果0.9393.510.73390.9%82.4%
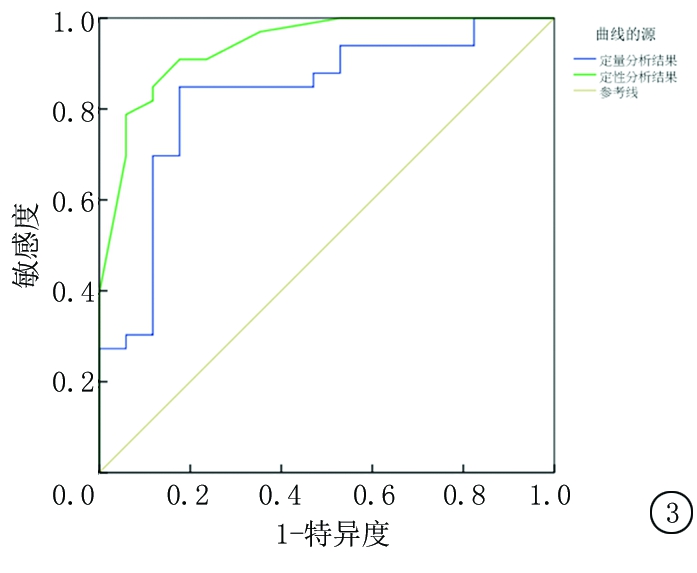
图3 定性分析与定量诊断浅表淋巴结病变的ROC曲线
Figure 3 ROC curve for qualitative analysis and quantitative diagnosis of superficial lymph node lesions
3 讨 论
颈部浅表淋巴结病变是由感染、肿瘤转移、反应性增生、组织细胞增生及代谢异常等引起的,临床可表现为良性、恶性、良恶性之间(开始为良性,可进展为恶性),良性对患者的生命不会造成严重影响,但恶性颈部浅表淋巴结可造成患者死亡[4-5]。因此对颈部浅表淋巴结的良恶性进行诊断,对制定治疗方案、评估预后意义重大。以往颈部浅表淋巴结病变的常用诊断方式为二维彩色多普勒超声,虽具有实时、无创、价格低廉、敏感度高等优点,但误诊率较高,易延误治疗的最佳时机[6]。近年来,超声造影剂和超声造影技术取得了较大进展[7]。细针穿刺为术前诊断的金标准,是评估淋巴结病变最准确、最经济的方法,其准确性与穿刺取材密切相关,超声造影可较为清楚显示出淋巴结病变情况,可较为明显的提高细胞穿刺取材的成功率[8]。本研究结果显示,超声引导下细针穿刺检查结果与手术病理检查结果一致性较强,提示穿刺取材效果较好。
本研究超声造影定性分析发现,良性淋巴结和恶性淋巴结的造影灌注模式、病灶增强特点、边界清晰度、病灶达峰强度分级差异均有统计学意义,且良性淋巴结以淋巴门及髓质先增强、均匀、清晰、低或等增强为主,而恶性淋巴结主以皮质先增强或紊乱增强或无增强、不均匀、不清晰、高增强为主。这些灌注特点不同于良恶性淋巴结病理结构有关[9]。良性淋巴结血供基本由淋巴门进入,且血管基本维持正常。恶性淋巴结的转移性癌细胞或局部自发癌细胞会侵犯肿瘤生长活跃边缘区的血管,而新血管生成则会造成皮质先增强或紊乱增强,并且在病灶中心,小动脉压力降低,静脉回流受阻,灌注量降低,灰阶超声造影时病灶组织常表现为低灌注[10-11]。为进一步了解低灌注区的特点,仍需进一步进行TIC曲线定量分析。
超声造影可通过医学的放射性示踪剂稀释原理,获得ROI的TIC,定量分析组织器官的灌注情况[12]。本研究结果显示,良性组TP、PI、mTT值明显小于恶性组,差异有统计学意义。究其原因可能为淋巴结作为一个血供丰富的器官,发生炎症等良性病变时,毛细血管、小动脉等扩张,血流量增加,造影剂可快速进入造影剂,而恶性淋巴结病变时,会对局部大量的微细管道进行破坏,而诱导形成的新生血管网管径细小,对造影剂的流入有较大阻力,从而良性淋巴结TP值减小,恶性淋巴结TP值较大[13]。PI值反映的是ROI区组织的灌注量,病灶微细管道破坏多,则PI值高。mTT为造影剂平均渡越时间,恶性淋巴结中造影剂微泡数量明显低于良性淋巴结皮质,从而在TIC量化分析时,mTT延长。目前超声造影的TIC曲线定量分析已较多应用于颈部淋巴结病变的鉴别,但由于受注射剂量、ROI的选择、仪器条件、TIC曲线的拟合等因素的影响,既往研究对良、恶性淋巴结的TIC曲线定量分析结果存在差异。张瑶等[14]在应用SonoLiver定量分析评价超声造影对眼眶淋巴瘤和炎性假瘤的鉴别诊断价值研究中发现,2组TIC定量参数mTT、RT差异均有统计学意义,本研究结果与之类似。周昀等[15]研究则显示,良恶性淋巴结造影剂TP、PI、mTT值差异无统计学意义,本研究结果与之不同。为进一步探究超声造影定性分析和定量分析对颈部浅表淋巴结良恶性病变的诊断价值,笔者进行ROC曲线分析发现,定量分析结果诊断恶性颈部浅表淋巴结的AUC(0.829)明显低于定性分析结果诊断恶性颈部浅表淋巴结的AUC(0.939)。
综上所述,超声引导下细针穿刺检查结果与手术病理检查结果一致性较强,同时超声造影定性分析对颈部浅表淋巴结良恶性病变的诊断价值略优于定量分析,且均在诊断颈部浅表淋巴结病变上提供了有价值的依据。本研究不足之处在研究样本量小,中心单一,且未进行定性分析和定量分析联合诊断价值分析,仍需开展多样本、多中心的研究进一步试验。
[1] Fujita T,Miura H,Seino H,et al. Anatomical classification of breast sentinel lymph nodes using computed tomography-lymphography[J]. Anat Sci Int,2018,93(4):487-494.
[2] 陆志峰,冯尚勇,顾学文,等.359例甲状腺癌患者临床特点及颈部淋巴结转移的相关因素[J].实用临床医药杂志,2018,22(21):69-72.
[3] 韩丕华,宋张骏,杨晓民,等.超声造影对乳腺癌腋窝良恶性淋巴结的诊断价值分析[J].实用临床医药杂志,2019,23(16):93-96.
[4] 孙媛媛,张明智.HBV感染与弥漫大B细胞淋巴瘤相关性研究进展[J].郑州大学学报(医学版),2019,54(4):534-537.
[5] 贾旭东,何文.超声造影剂SonoVue经皮穿刺注入兔肝组织超声表现的实验研究[J].河北医科大学学报,2019,40(8):924-928,993.
[6] 严佳梅,周超瑜,许伶俐,等.彩色多普勒超声诊断浅表淋巴结结核的临床研究[J].中国现代医学杂志,2019,29(8):90-93.
[7] Engjom T,Nylund K,Erchinger F,et al. Contrast-enhanced ultrasonography of the pancreas shows impaired perfusion in pancreas insufficient cystic fibrosis patients[J]. Bmc Medical Imaging,2018,18(1):14.
[8] 梁凤平,黄容,王译斌,等.超声引导下细针与粗针穿刺颈部淋巴结对诊断的价值分析[J].中国医师杂志,2019,21(2):180-183.
[9] 刘晓芳,陈武,李淳,等.超声造影联合实时弹性成像在浅表肿大淋巴结良恶性鉴别诊断中的应用价值[J].中国超声医学杂志,2019,35(5):48-51.
[10] 任玲,罗渝昆.经静脉超声造影在浅表淋巴结诊断中的应用[J].中国医学影像学杂志,2019,27(8):626-629.
[11] 贾志莺,艾秀清.常规超声联合超声造影在恶性肿瘤新发锁骨上肿大淋巴结诊断中的价值[J].肿瘤预防与治疗,2018,31(6):422-427.
[12] 姜云雯,朱凌源,彭敏霞,等.超声造影定量分析对鉴别甲状腺微钙化结节性质的研究[J].医学研究杂志,2018,47(1):99-102.
[13] 李秀芹.超声造影定量参数与甲状腺乳头状癌组织中微血管密度、颈部淋巴结转移的关系[J].临床与病理杂志,2020,40(1):52-57.
[14] 张瑶,陈文卫,黄鑫,等.应用SonoLiver定量分析评价超声造影对眼眶淋巴瘤和炎性假瘤的鉴别诊断价值[J].中国超声医学杂志,2018,34(12):1057-1060.
[15] 周昀,温朝阳,杜领娣,等.超声造影在浅表淋巴结疾病鉴别诊断中的应用价值[J/CD].中华医学超声杂志(电子版),2016,13(10):768-770.