前列腺癌是近年常见的发生于男性前列腺上皮性的恶性肿瘤之一,在欧美国家的男性疾病中发病率居于榜首[1-2]。而我国男性前列腺癌的发病率不高,但是随着年龄的增长,其发病率逐年升高。针对此病,临床上一般采取直肠指诊、血清前列腺特异抗原(prostate specific antigen,PSA)、经指肠前列腺超声和盆腔MRI检查等,并且前列腺的诊断和分级有助于患者治疗方案的选择,其对判断预后具有重要的临床价值。磁共振成像(magnetic resonance imaging,MRI)是目前最有效的前列腺癌影像学检查方法。虽然常规的T2WI及T1WI增强能够清晰地显示血管分布较多的肿瘤组织,但是因为前列腺体整体是一个富含血供的组织,因此常规MRI诊断价值不理想[3]。动态增强磁共振成像(dynamic contrast enhanced magnetic resonance imaging,DCE-MRI)具有较高的分辨率,可以定量分析组织的血流灌注及通透性情况,且能有效显示肿瘤组织的微血管特性,对恶性肿瘤具有较高的诊断价值[4]。扩散加权成像(diffusion weighted imaging,DWI)是一种诊断前列腺病变的方法,其主要通过表观系数(apparent diffusion coefficient,ADC)对病变组织的良恶性进行区分,能够定量鉴别前列腺癌和前列腺增生[5]。但目前比较DCE-MRI、ADC对前列腺癌分级诊断价值的研究甚少,基于此,本研究探讨DCE-MRI、ADC对前列腺癌分级诊断的应用比较。
1 资 料 与 方 法
1.1 一般资料 选取在2018年2月—2019年2月期间我院收治的前列腺癌患者76例进行回顾性分析。纳入标准:①患者经穿刺或手术病理学诊断为前列腺癌或前列腺增生;②所有患者在DCE-MRI、DWI检查前均未接受过前列腺疾病治疗;③血清前列腺特异抗原(prostate-specific antigen,PSA)水平>4 μg/L;④临床资料完整。排除标准:①在进行DCE-MRI、DWI检查前接受内分泌或放射治疗的患者;②合并其他部位恶性肿瘤患者;③存在精神障碍疾病等患者;④不配合检查及治疗患者。根据Gleason评分,将前列腺患者分成低中危组50例(Gleason评分<8分)及高危组26例(Gleason评分≥8分)。2组患者在年龄、病程及血清PSA水平等一般资料差异无统计学意义(P>0.05),具有可比性。见表1。
表1 2组患者的一般临床资料比较
Table 1 Comparison of general clinical data of two groups![]()
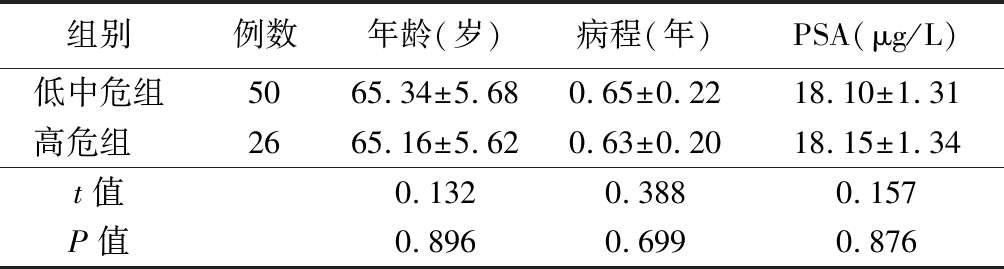
组别例数年龄(岁)病程(年)PSA(μg/L)低中危组5065.34±5.680.65±0.2218.10±1.31高危组 2665.16±5.620.63±0.2018.15±1.34t值0.1320.3880.157P值0.8960.6990.876
1.2 检查方法 所有患者均进行DCE-MRI、DWI检查。采用飞利浦Achieva 3.0T TX,首先进行大范围盆腔周围T1WI(TR 500 ms,TE 20 ms)和T2WI(TR 6 000 ms,TE 110 ms)扫描,观察肿瘤细胞是否发生转移(图1),之后在小视野中进行前列腺扫描。其中DWI扫描序列:TR 5 000 ms,TE 76 ms,扫描视野240 mm×240 mm,扩散敏感系数(b)分别为50 s/mm2、800 s/mm2,间距设置为0.5 mm,层厚为5 mm(图2,3)。DCE-MRI扫描序列:采用肝脏三维容积陕速多期动态采集(liver acquistion with volume acceleration,LAVA)序列,TR 3.84 ms,TE 1.83 ms,扫描视野295 mm×295 mm,翻转角设置为150 °,间距为0 mm,层厚 5 mm,分别采用矢状位、轴位及冠状位容积扫描。其中造影剂使用造影剂钆喷酸葡胺注射液(产品批号:KT02JB1,规格:469.01 mg/mL×15 mL),注射剂量为15 mL,以2.5 mL/s经肘正中静脉注射(图1~4)。
DWI、DCE-MRI检查生成的图像由2名高年资经验丰富的泌尿科影像学专家采用双盲法进行分析。其中之后DWI图像在处理软件上观察前列腺病灶的DWI信号特点和进行ADC值的测量,其中ADC参考Karimi等[6]测量方法,在病灶处选择感兴趣区,同时应该尽量避免囊变、坏死区域及粗大的钙化区域面积尽可能一致,重复测量3次取平均值。根据Extended Tofts模型,DCE-MRI检查图像采用PHILIPS Extended MR WorkSpace 2.6.3.4进行处理,选择多个感兴趣区分析得到容量转移常数(Ktrans)、速率常数(Kep)、血管外细胞外间隙容积分数(Ve)及血管空间容积分数(Vp)。
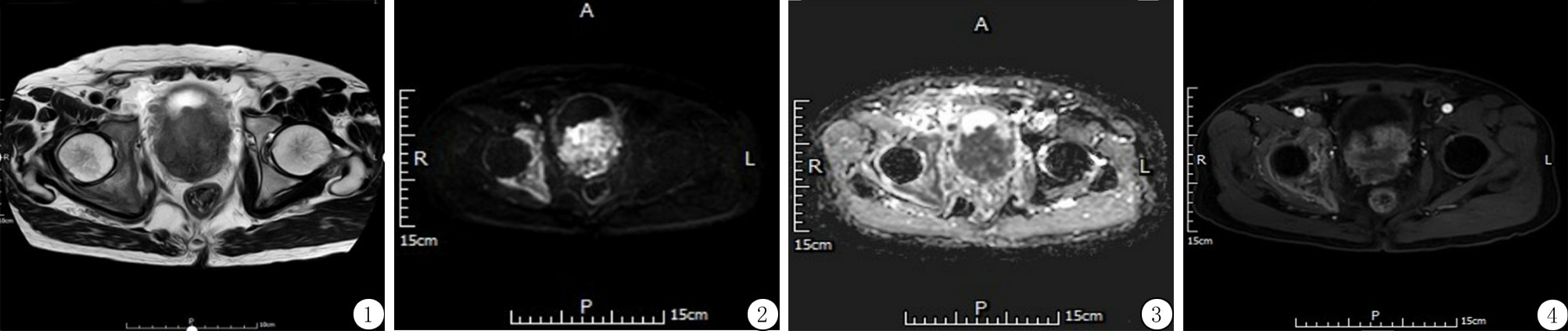
图1 T2WI示前列腺移行带占位,侵犯外周带及周围神经血管束,右侧髋骨骨转移
Figure 1 T2WI showed the prostate transition zone occupying, invading the peripheral zone and peripheral neurovascular bundles, and right hip bone metastasis
图2 前列腺占位及右侧髂骨DWI高信号,右腹股沟区小淋巴结
Figure 2 Prostate occupying and high signal on DWI of right iliac bone, right inguinal small lymph nodes
图3 ADC示前列腺占位区低信号,右侧髋骨呈内高外低信号。前列腺占位区平均ADC值为90.00×10-5mm2/s
Figure 3 ADC showed the prostate occupying area had a low signal, and the right hip bone had a high signal inside and a low signal outside. The average ADC value of the prostate occupying area was 90.00×10-5 mm2/s
图4 DCE序列示前列腺及右髂骨病变不均匀渐进式强化
Figure 4 DCE sequence showed the uneven progressive enhancement of prostate and right iliac lesions
1.3 观察指标 ①比较2组患者在不同扩散敏感系数下的DWI信号强度值和ADC;②比较2组患者的DCE-MRI参数水平。
1.4 统计学方法 应用SPSS 22.0统计软件分析数据。计数资料采用行χ2检验;计量资料采用独立样本t检验,采用受试工作特征(receiver operating characteristic,ROC)曲线分析DCE-MRI各参数、ADC对前列腺癌分级诊断的临床价值。P<0.05为差异有统计学意义。
2 结 果
2.1 2组患者在不同扩散敏感系数下的DWI信号强度值和ADC值比较 在不同扩散敏感系数下,低中危组的DWI信号强度值和ADC值显著高于高危组,差异有统计学意义(P<0.05)。见表2。
2.2 2组患者的DCE-MRI参数水平比较 低中危组患者的Kep显著高于高危组,Ve低于高危组(P<0.05),但是2组患者在Ktrans、Kep值上差异无统计学意义(P>0.05)。见表3。
表2 各组患者在不同扩散敏感系数下的DWI信号强度值和ADC值比较
Table 2 Comparison of DWI signal intensity and ADC value under different diffusion sensitivity coefficients of each group![]()
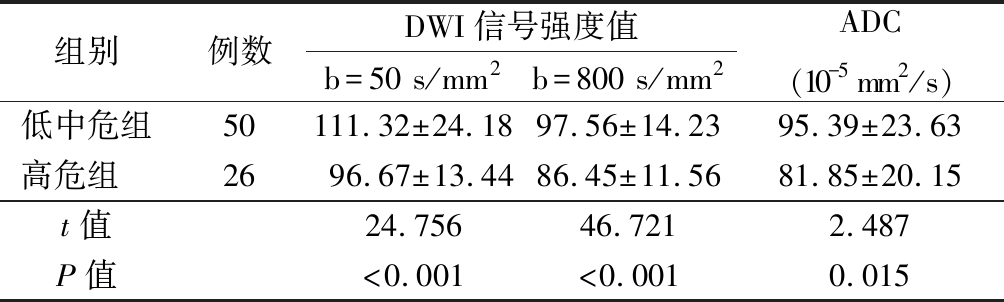
组别例数DWI信号强度值b=50 s/mm2b=800 s/mm2ADC(10-5 mm2/s)低中危组50111.32±24.1897.56±14.2395.39±23.63高危组 2696.67±13.4486.45±11.5681.85±20.15t值24.756 46.721 2.487P值<0.001<0.0010.015
表3 各组患者的DCE-MRI参数水平比较
Table 3 Comparison of DCE-MRI parameter levels of patients in each group![]()
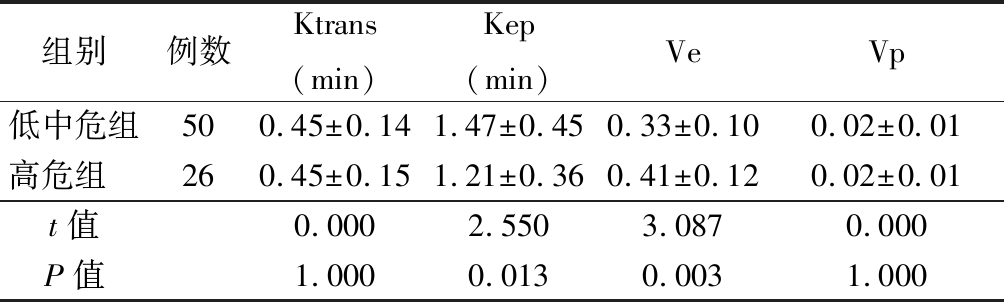
组别例数Ktrans(min)Kep(min)VeVp低中危组500.45±0.141.47±0.450.33±0.100.02±0.01高危组 260.45±0.151.21±0.360.41±0.120.02±0.01t值0.0002.5503.0870.000P值1.0000.0130.0031.000
2.3 Ktrans、Vp及ADC对前列腺癌分级的诊断价值 采用ROC曲线分析Ktrans、Vp及ADC 2组患者的水平差异,结果显示Ktrans、Vp及ADC的曲线下面积分别为0.738、0.294、0.645,最佳临界值分别为1.720 min、0.366、85.825×10-5 mm2/s,敏感度分别为92.1%、89.6%、93.1%,特异度分别为55.0%、62.7%、80.2%。见表4和图5。
表4 Ktrans、Vp及ADC对前列腺癌分级的诊断价值
Table 4 The diagnostic value of Ktrans, Vp and ADC in the classification of prostate cancer
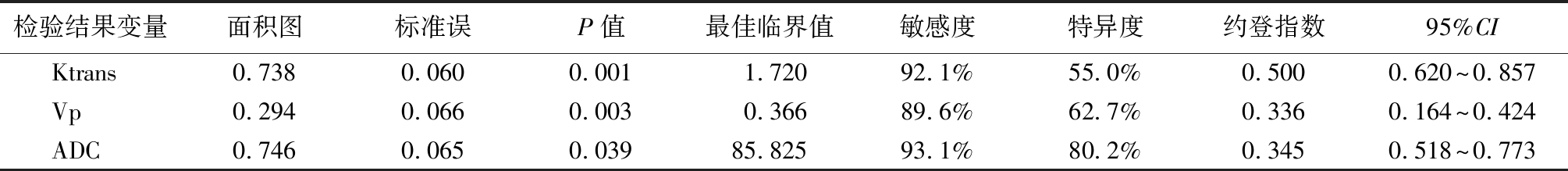
检验结果变量面积图标准误P值最佳临界值敏感度特异度约登指数95%CIKtrans0.7380.0600.0011.72092.1%55.0%0.5000.620~0.857Vp0.2940.0660.0030.36689.6%62.7%0.3360.164~0.424ADC0.7460.0650.03985.82593.1%80.2%0.3450.518~0.773
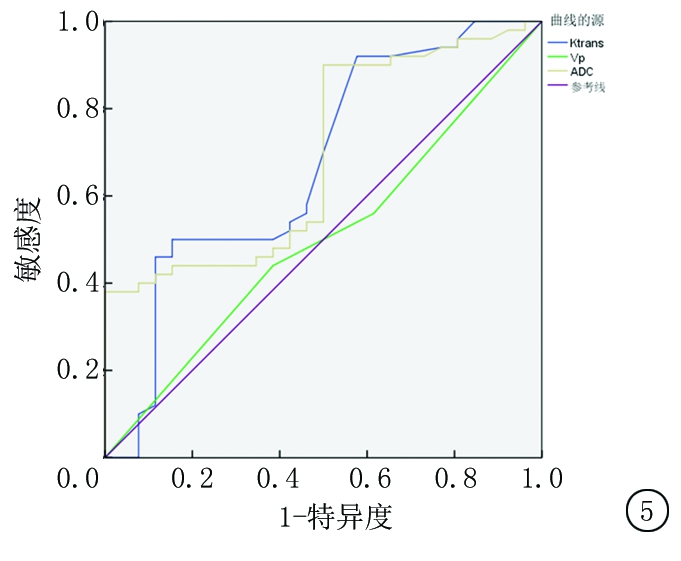
图5 Ktrans、Vp及ADC对前列腺癌分级诊断的ROC曲线
Figure 5 ROC curve of Ktrans,Vp and ADC in the classification diagnosis of prostate cancer
3 讨 论
近年来,人口老龄化现象愈发严重,前列腺癌的发病率也随之呈现升高的趋势。目前通过超声引导下的穿刺活检是诊断前列腺癌的金标准,通过穿刺所获得的Gleason评分能够识别前列腺癌的分化程度及预后状况[7-9]。但是穿刺活检存在一定的漏诊情况,每年有一定的患者检测后的穿刺结果呈现假阴性[10-12],同时患者在穿刺之后,可能发生出血、感染、尿潴留及性功能障碍等并发症,严重影响患者的健康,因此,该检测方法不适合作为长期检测的手段[13-16]。
DWI作为MRI的一种,能够更好的反映活体组织及器官中组织结构的特点及胞内外水分子一系列的运动状况等,且其成像时间较短,不需要注射造影剂[17-20]。DWI方法通过分子角度显示生物学的特性,主要是通过ADC值进行评估。其中ADC值受到细胞内外膜的通透性、温度、水的滞度及扩散敏感系数的影响。当扩散敏感系数值较小时,局部组织的微循环灌注容易影响ADC值;当扩散敏感系数值较大时,血流灌注无法影响ADC值[21-23]。宋振强等[24]认为ADC有利于中、高级前列腺癌的诊断鉴别。而本研究中在不同扩散敏感系数下,低中危组的DWI信号强度值和ADC值显著高于高危组,提示前列腺癌恶性程度越高,其扩散敏感系数值及ADC值越小。原因分析:①前列腺癌中存在少量的间质,主要是由大量紧密堆积的腺体组成,恶性肿瘤腺体内部结构发生变化,正常的含水腺内部结构被肿瘤组织替代,其恶性程度越高,替代越多[25];②对于同一腺体组织,b值大小与ADC成反比[26]。
DCE-MRI能够有效通过监测及量化前列腺组织内的血流动力学过程,清晰地反映组织结构内的微血管特性。检测中的Ktrans值用于反映血管壁通透性的变化,Vp则用于反映组织内微血管数量的变化[27]。因为毛细血管壁不完整且肿瘤血管强大的通透性特点,相比于正常的前列腺的组织,Ktrans、Kep、Ve显著高于正常前列腺组织及前列腺增生组织[28]。在本研究中低中危组患者的Kep显著高于高危组,Ve低于高危组;但是2组患者在Ktrans、Kep值上差异无统计学意义,这与徐曦等[29]研究结果一致。提示前列腺恶性程度越高,其Kep值越低,Ve水平越高。另外在本研究中Ktrans、Vp及ADC的曲线下面积分别为0.738、0.294、0.746,最佳临界值分别为1.720 min、0.366、85.825×10-5 mm2/s,敏感度分别为92.1%、89.6%、93.1%,特异度分别为55.0%、62.7%、80.2%。提示ADC值对前列腺癌分级诊断价值优于DCE-MRI。
综上所述,DCE-MRI、ADC对前列腺癌分级均具有较高的诊断价值,且ADC的诊断价值优于DCE-MRI。
[1] 陶晋,刘亦武,方志伟,等.磁共振波谱分析CC/C值对去势抵抗性前列腺癌进展的预测价值[J].郑州大学学报(医学版),2019,54(3):461-465.
[2] 施梦丽,杨萍,杨洋,等.血清TAM联合TPSA、FPSA/TPSA对前列腺癌的诊断价值[J].郑州大学学报(医学版),2019,54(4):597-599.
[3] 章莎莎,吴明灿,毛立华,等.磁共振成像与增强CT扫描用于肝癌诊断的价值比较[J].中国基层医药,2020,27(23):2817-2820.
[4] 雷立存,杜亚强,刘振宇,等.磁共振扩散加权成像对不同时期脑梗死的诊断意义[J].河北医科大学学报,2021,42(1):90-94.
[5] 邱文伟,彭雨彬,郝强.DWI-MRI在宫颈癌放化疗疗效评价中的应用[J].河北医学,2020,26(7):1175-1178.
[6] Karimi D,Nir G,Fazli L,et al. Deep learning-based gleason grading of prostate cancer from histopathology images-role of multiscale decision aggregation and data augmentation[J]. IEEE Xplore,2020,24(5):1413-1426.
[7] 勾振恒,王海屹,杜静波,等.高弥散敏感因子(b)值DWI及ADC值对前列腺癌与前列腺炎鉴别诊断的应用对比分析[J].中国中西医结合外科杂志,2020,26(2):366-370.
[8] 蔡恩明.磁共振弥散加权成像技术在肝脏良、恶性肿瘤中的鉴别诊断价值[J].实用临床医药杂志,2018,22(1):71-73.
[9] 刘三春,祁英,周之怀,等.弥散加权成像eADC值在鉴别诊断前列腺良恶性结节中的应用价值[J].中国医药导报,2020,17(4):159-162.
[10] 雷容,刘杨文易,平秦榕,等.核酸适配体在前列腺癌诊断应用的研究进展[J].重庆医学,2020,49(2):149-152.
[11] 周柱玉,张海兵,李金,等.MRI定位联合经直肠超声引导下经会阴穿刺诊断前列腺癌[J].中国介入影像与治疗学,2020,17(7):402-405.
[12] 吴慧,吴静,蔚纳,等.单指数,双指数,拉伸指数DWI模型鉴别前列腺癌与基质型前列腺增生的价值研究[J].磁共振成像,2020,11(7):546-551.
[13] 赵士玉,谢双双,郭瑜,等.基于表观扩散系数图像影像组学模型对前列腺癌与前列腺增生的鉴别诊断价值[J].中国医学影像学杂志,2020,28(5):367-371.
[14] 王宁博.1.5T磁共振多b值DWI及ADC值定量分析在前列腺癌与前列腺增生诊断的价值研究[J].中国CT和MRI杂志,2020,18(5):35-37.
[15] 缪应新,姜文容,郭明权,等.循环肿瘤细胞在前列腺癌诊断中的临床应用[J].中华检验医学杂志,2019,42(3):198-203.
[16] 肖建明,彭涛,张仕慧,等.基于磁共振纹理及定量分析提高前列腺癌诊断效能的研究[J].实用放射学杂志,2020,36(5):764-767.
[17] 李丹丹,高振森,寇光玲.经直肠前列腺超声造影靶向活检诊断前列腺癌的可行性研究[J].中国超声医学杂志,2020,36(1):63-66.
[18] 李昌松,付哲祥.CT和MRI在前列腺癌患者中的诊断效果对比观察及影像学特点研究[J].中国医疗设备,2019,34(S2):117-119.
[19] 马亚文,夏厚萍.3.0T磁共振扩散加权成像对老年前列腺癌与前列腺增生的鉴别诊断价值[J].安徽医学,2019,40(5):493-495.
[20] 容彦英,吴棘,温乔,等.前列腺癌患者经会阴超声引导下前列腺穿刺诊断中SWE结合PSA应用研究[J].实用癌症杂志,2019,34(8):1280-1282.
[21] 黄宜,王文涓,许静,等.p2PSA及其相关指标PHI在前列腺癌诊断中的应用价值[J].检验医学,2019,34(7):600-604.
[22] 龚霞蓉,吴昆华,孙昊,等.前列腺影像报告和数据系统1.0和2.0中MRI动态增强对前列腺癌诊断价值的对比研究[J].中国医学计算机成像杂志,2019,25(2):151-155.
[23] 谢少伟,董柏君,夏建国,等.前列腺前角穿刺活检在前列腺癌诊断中的价值[J].上海交通大学学报(医学版),2019,39(5):518-521.
[24] 宋振强,时宇鹏,陈淑宽,等.MRI弥散加权成像在前列腺增生和前列腺癌诊断鉴别中的应用[J].中国CT和MRI杂志,2020,18(5):31-34.
[25] 龚霞蓉,吴昆华,孙昊,等.前列腺影像报告和数据系统1.0和2.0中MRI动态增强对前列腺癌诊断价值的对比研究[J].中国医学计算机成像杂志,2019,25(2):151-155.
[26] 徐亚运,郑欢欢,刘松,等.不同b值的磁共振扩散加权成像在评估食管癌同步放化疗疗效中的价值[J].中国医疗设备,2019,34(4):104-107.
[27] 杨可乐,李响,王兴东,等.MR小肠造影与扩散加权成像表观扩散系数对Crohn病活动性的诊断价值[J].磁共振成像,2020,11(1):40-44.
[28] 周霖,曾蕾.不同表观扩散系数对前列腺癌盆腔转移性淋巴结的定性诊断价值[J].肿瘤防治研究,2019,46(3):248-252.
[29] 徐曦,张冬,黄家喜,等.体素内不相干运动成像及动态增强MRI在前列腺癌诊断及分级中的应用[J].中国医学影像学杂志,2018,26(10):58-62,66.