胎儿四肢畸形是我国常见的胎儿产前畸形,给孕妇、家庭、社会带来沉重的心理和医疗负担。成骨发育不全作为胎儿四肢畸形的病种,其Ⅱ型为常染色体显性遗传或常染色体隐性遗传,发病机制与编码胶原的基因突变有关,属严重致死型,可表现为严重的短肢畸形、骨脆性增加、肢体骨折易碎,对胎儿成骨发育不全的早期诊断有着重要的临床意义[1-2]。超声检查是孕期首选的影像学检查手段,随着产前超声诊断水平的不断提高,胎儿肢体畸形检出率也大大提高,但仍有一部分骨骼畸形因近场强带来的混响伪影、成像视野小、胎儿活动、胎儿孕周、颅骨或羊水过少及孕妇肥胖等影响,易使胎儿部分结构显示不清。此外超声扫描角度选择不恰当也可导致误、漏诊,对胎儿细微解剖结构畸形的诊断受到一定限制[2-4]。磁共振成像(magnetic resonance imaging,MRI)作为无电离辐射损害的无创性影像学检查工具,可多平面、多参数成像,软组织分辨率高,基于这些特点应用于胎儿成像可获得高质量的数字化断层影像,能避免孕妇骨骼及腹内气体的对胎儿的遮挡,近年来开始广泛应用于胎儿产前检查,胎儿MRI成像也成为研究的热点[5-6]。本研究即通过比较超声、MRI、超声联合MRI 3种方法诊断胎儿成骨不全的敏感度、特异度、准确度、阳性预测值、阴性预测值,分析超声、MRI、MRI联合超声诊断胎儿成骨发育不全的应用价值。
1 资 料 与 方 法
1.1 一般资料 回顾性分析2014年5月—2020年4月期间于我院进行产前检查孕妇50例的临床资料及影像学资料,年龄22~38岁,平均(29.22±5.37)岁;孕龄18~32周,平均(25.51±4.58)周,胎儿均经手术引产对大体标本进行最终病理诊断,其中有18例为Ⅱ型胎儿成骨不全。入组标准:MRI检查及超声检查影像资料完备。
本研究经医院伦理委员会批准。
1.2 影像学检查方法
1.2.1 超声检查 使用Vlouson E8彩色多普勒超声诊断仪,探头频率为5 MHz。首先行常规产前超声的系统检查,检查胎儿头面部、脊柱、胸腹壁及胸腹腔各脏器、四肢、胎盘、羊水、脐带等以了解胎儿生长发育情况,测量胎儿双顶径、头围、腹围、股骨长度、肱骨长度、小脑横径、羊水深度、脐动脉收缩期峰值流速/舒张期峰值流速比值、阻力指数、搏动指数等。采用连续顺序超声追踪法即双侧上下肢肢体沿长轴方向从肢体近端开始扫查至肢体末端,完整的扫查完一个肢体后再扫查其他肢体情况。观察肢体是否缺如及其内长骨的形态、数目、骨化程度、骨干弯曲/成角、骨折、姿势、运动情况,测量胎儿四肢长骨长度。以3节段法将胎儿上、下肢分为肱骨、尺桡骨、手掌及手指;股骨、胫腓骨、足及趾进行检查。手、足显示不清楚或可疑畸形则采用三维超声表面成像或骨骼成像模式进行容积扫查以确定胎儿手、足有无异常。如胎儿肢体遮挡导致显示困难,可嘱孕妇下床活动20~30 min后或适当加压探头推挤胎儿再进行检查。
1.2.2 MRI检查 对超声检查发现胎儿四肢异常的病例于2 d 内行MRI 检查。使用Siemens MAGNETOM Aera 1.5T超导型MRI扫描仪,以身体包裹线圈进行快速稳态进动采集,使用胎儿多平面T2WI单发快速自旋回波序列扫描以及T1WI梯度回波序列,主要扫描参数为T2-Haste 重复时间 (repetition time,TR)/回波时间(echo time,TE)=1 000/92 ms,带宽(band width,BW)=411 Hz;T2-Trufi TR/TE=3.9/1.7 ms,翻转角度(flip angle,FA)=70 °,获得3个切面(轴位、矢状面和冠状面),层厚3~5 mm,每次检查总时间为30 min,成像范围包括整个胎儿、胎盘和母体子宫。不给予孕妇和胎儿任何镇静剂,不进行增强检查。
1.3 影像学评价 超声影像及MRI影像由2名儿科影像医师(10年经验和15年经验)评价,当意见不一致时请另一名儿科影像医师(25年经验)评定。以大体病理检查和X线检查为金标准对超声声像图、MRI影像表现进行对比分析。Ⅱ型胎儿成骨发育不全的诊断标准参照Solopova等[7]研究:大体及X线影像显示双上肢、下肢长骨短、宽、弯曲,胸廓狭小,肋骨和(或)四肢长骨骨折和(或)畸形,颅骨密度降低等。
1.4 统计学方法 应用SPSS 22.0统计软件分析数据。以胎儿引产术后病理诊断为金标准,根据金标准比较超声、MRI、超声联合MRI 3种方法诊断胎儿成骨不全的敏感度、特异度、准确度、阳性预测值、阴性预测值。
2 结 果
MRI影像表现为:①矢状面T2WI单次快速自旋回波影像显示显著缩短和弓形弯曲的四肢(图1~2),短且宽的长骨容易在上、下肢内识别;胸部较小且呈哑铃状,T2信号强度显著降低,提示肺发育不全(图2)。②冠状面T2WI单次快速自旋回波影像显示胎儿折叠的上和/或下肢内易识别出的变短、变宽的长骨(图3),以及小哑铃状的胸部,T2信号强度明显降低(图4)。③使用Weaver等[8]的方法对胎儿肺进行体积测量,显示肺体积为10.3 mL,占年龄校正的肺体积预期值(34.2 mL)的30.1%。④胎儿颅骨因矿化不足不能清晰显示,表现出“颅骨模糊”征象(图3)。超声声像图表现为:①颅骨骨化差或不骨化,回声低于正常,厚薄不一(图5 ),颅骨柔软,颅内结构显示得异常清晰,超声下探头稍用力推压胎头时胎头易出现变形;眼眶及面部各骨骨化差,眼眶可呈低回声;②四肢短小(图6),低于预测值2倍标准差以上或者低于第5百分位时,认为肢体短小,长骨短粗并发生不规则弯曲变形,有骨折征象,骨折愈合后局部变粗、钙化差;全身骨骼回声暗淡,后方可无声影。③胸廓狭窄(图7~8),胸腹围比值稍小,胸骨、肋骨短小,矢状切面上胸廓回声呈“铃状”或“啤酒瓶状”,胸部有变形;胸腹连接处可见凹陷,肺组织声像较少;④10例(占56%)伴有羊水过多,均为孕晚期孕妇。胎儿经手术引产后的大体标本见图9。
在18例Ⅱ型胎儿成骨发育不全病例的影像学诊断中,MRI检查诊断1例误诊为胎儿软骨发育不全,1例误诊为致死性侏儒;超声检查4例误诊为胎儿软骨发育不全,3例误诊为致死性侏儒,并有2例无法明确诊断。超声联合MRI诊断Ⅱ型胎儿成骨发育不全的敏感度、准确度均高于超声检查。见表1。
表1 不同检查方法对Ⅱ型胎儿成骨发育不全的诊断效能
Table 1 Diagnostic efficacy of different examination methods for osteogenesis imperfecta type Ⅱ (例数)
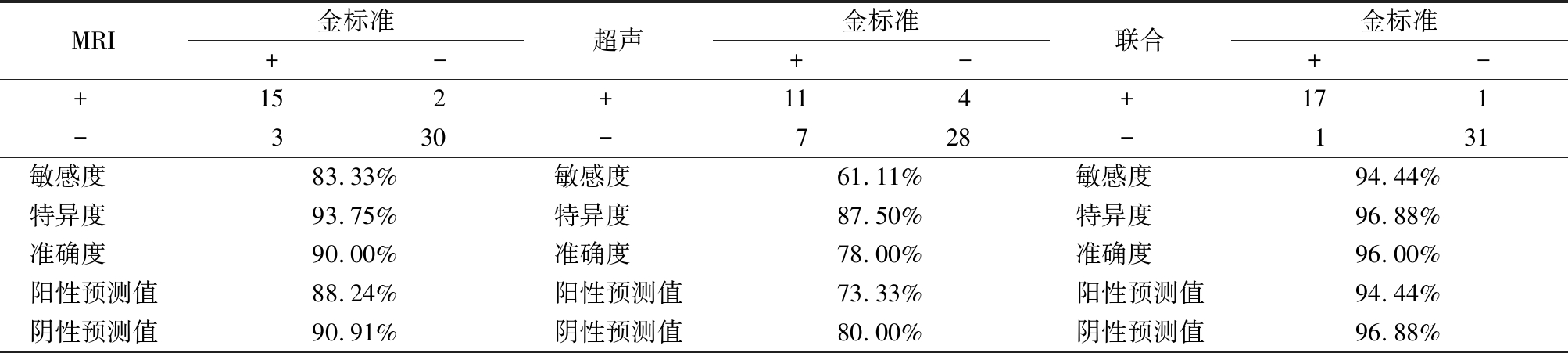
MRI金标准+-超声金标准+-联合金标准+-+ 152+ 114+ 171- 330- 728- 131敏感度 83.33%敏感度 61.11%敏感度 94.44%特异度 93.75%特异度 87.50%特异度 96.88%准确度 90.00%准确度 78.00%准确度 96.00%阳性预测值88.24%阳性预测值73.33%阳性预测值94.44%阴性预测值90.91%阴性预测值80.00%阴性预测值96.88%
3 讨 论
在本研究18例Ⅱ型胎儿成骨发育不全病例中,MRI检查准确诊断15例、超声检查准确诊断11例、超声联合MRI检查准确诊断17例,超声检查的诊断敏感度为61.11%、准确度为78.00%,MRI检查的诊断敏感度为83.33%、准确度为90.00%,综合考虑超声检查结果和MRI检查结果,超声联合MRI较超声检查的诊断敏感度上升至94.44%、准确度上升至96.00%,此结果显示超声联合MRI诊断Ⅱ型胎儿成骨发育不全具有目前影像学诊断方法中最佳的诊断效能。
胎儿成骨发育不全是一组遗传性结缔组织疾病,其基本病理是胶原蛋白成熟缺陷。胎儿成骨发育不全的发生率从20 000分之一到60 000分之一不等,在女性胎儿中更为常见[9-10]。 在95%的确诊病例中,胎儿成骨发育不全是由Ⅰ型胶原蛋白原编码基因(COL1A1和COL1A2)的显性突变引起的。同时人类Ⅰ型胶原突变数据库(www.le.ac.uk/genetics/collagen/index.thml)已发布并报道了400多种不同的因果突变[11-13]。胎儿成骨发育不全患者有25%(Ⅱ、Ⅲ型)至50%(Ⅰ、Ⅵ型)的遗传概率,健康父母如果产下胎儿成骨发育不全的后代,其下一胎发生胎儿成骨发育不全的风险来自于亲代生殖嵌合现象,其发生率估计为5%~8%[14],因此应向所有具有危险因素的孕龄妇女者提供遗传咨询及必要的产前诊断。胎儿成骨发育不全的骨异常是由于异常胶原生成而导致膜性和软骨内骨发育的普遍缺陷,包括明显变薄的颅骨和囟门延迟关闭,而胎儿虫噬状骨骼过度形成导致骨质疏松。最常见的骨骼外表现包括蓝色巩膜、牙本质发育不全、韧带过度松弛和进行性听力丧失。该疾病的临床表现差异很大:儿童可能仅表现为轻度骨质疏松症(Ⅰ型胎儿成骨发育不全),而最严重的病例可能在新生儿期的早期就具有致死性(Ⅱ型胎儿成骨发育不全)。根据使用最广泛的分类[1,6,12],胎儿成骨发育不全分为四种类型:Ⅰ~Ⅳ型。近年胎儿成骨发育不全Ⅴ型、Ⅵ型和肢根型已添加到分类中[1,12],这些新的类型是根据最近的临床和分子研究发现确定的。胎儿成骨发育不全也可分为变形性和非变形性骨病,这种随机分组可能有助于将临床表型与潜在的遗传和病理生理学发现相关联。
Ⅱ型胎儿成骨发育不全是最严重、最常见的致死类型,大多数患儿在围产期死亡,新生儿期常因感染、呼吸窘迫、心功能不全或脑损伤引起的并发症而死亡,新生儿具有柔软的颅骨骨头,奇特的三角形脸庞,鼻子喙和蓝色巩膜[1,12,15]。临床检查通常显示由于多处骨折和典型的“青蛙状”姿势而导致肢体短且形变。因此,怀孕期间尽早诊断胎儿成骨发育不全对指导怀孕和指导处置至关重要。分子测试检验如成纤维细胞RNA和蛋白质分析以及提取血液中的基因组DNA分析等方法可用于识别突变的存在,并在致命胎儿成骨发育不全(Ⅱ型)的产前诊断以及评估轻度胎儿成骨发育不全(Ⅰ型)病例中发挥作用。但并非每个医疗机构都能提供最新的分子诊断检查,并且Ⅰ型胶原基因的筛查不能涵盖胎儿成骨发育不全的整个临床类型,因为最新明确的类型(Ⅴ型、Ⅵ型、肢根型)在未知的位点上存在基因突变[12-13]。
本研究中,超声检查假阳性和假阴性的存在使胎儿成骨发育不全的超声诊断准确度为78%,分析假阳性及假阴性存在的原因为超声检查视野范围偏小,在羊水过少、母体有子宫肌瘤等情况下对胎儿病变显示欠佳,超声受到腹壁脂肪对超声波穿透力和腹腔肠道气体的干扰,易受胎位的限制等情况影响医师观察,发生错误判断。
当前胎儿成骨发育不全的产前筛查和诊断主要基于特征性超声和放射学发现。在没有胎儿成骨发育不全既往史的情况下,通过产前超声进行胎儿形态检查仍然是胎儿成骨发育不全产前诊断的首选筛选方法。该病超声检查的特征包括长骨声影的减少、明显弯曲和短缩,以及妊娠早期颈部透明层厚度的增加[16],据报道早在妊娠12~14周时,就可以作出单胎成骨发育不全的产前诊断[16-17]。Ngo等[18]的研究显示尽管在妊娠18~22周时进行超声检查检测致命骨骼发育异常的敏感度较高(对于主要肢体异常的检测可达到94%~96%),但其提供准确诊断的价值有限(30%~50%)。Tretter等[19]的研究认为尽管已经使用了几种超声检查标准(如股骨短小、弯曲和胸部狭窄)来区分非致死型和致死型骨发育异常,但仍有7.8%的胎儿发生误诊。Ngo等[18]及Teng等[20]的研究认为超声在检测轻度胎儿成骨发育不全及详细评估其他器官异常受到限制,尤其是在判定可能决定预后的肺发育不全程度方面,这些不足限制了超声的临床应用价值。
超声诊断受到限制的原因主要为胎儿体位不佳、孕妇肥胖、骨盆骨遮挡、孕妇肠气模糊、视野受限等,使用三维超声可以提高产前诊断的准确性,但超声检查的固有局限性依然无法突破,且三维产前超声也无法提供有关胎儿肺成熟的足够信息。由于辐射损害,最初用于胎儿成骨发育不全产前诊断的常规放射线照相术如今已很少使用。 Ruando等[21]报道了多排螺旋CT扫描在胎儿成骨发育不全诊断中的应用价值,它可以提供有关异常骨基质、密度和形状的详细信息,然而CT的主要局限性依然是是胎儿受到大量电离辐射(最高3 mGy)的照射,也不能提供有关肺发育不全程度的可靠信息。
MRI作为一种胎儿产前诊断的影像学新方法,具有无创、无辐射损害、多平面成像、成像范围大、能辨别组织特性、软组织对比度好、空间分辨力高、图像质量不受气体及骨骼影响等特点,因此能提供超声检查以外的更多影像学信息,特别是在超声难以确诊的情况下,MRI能发挥重要的补充作用,MRI检查最早可于孕12周后进行[1,6],早于超声检查的孕中期18周。本研究使用的快速MRI是一种相对较新的成像方式,较短的采集时间可以“冻结”胎儿而无需进行镇静,在不使用电离辐射的情况下更详细地研究胎儿解剖结构。多项研究表明胎儿MRI在产前评估复杂的中枢神经系统病理学方面具有价值,此外胎儿MRI 用于评估胎儿的胸部和腹部也具有独特优势。本研究中MRI检查的假阳性和假阴性诊断均少于超声检查,分析原因为液体和固体组织之间具有高的T2对比,加之较高的空间分辨率,可使用大视野成像,去除孕妇的肠气、腹壁脂肪、盆腔骨等解剖结构的遮挡[22],清晰观察胎儿的组织结构形态。本研究使用胎儿肺体积测量来分析肺的发育和功能,可有效诊断成骨发育不全胎儿的胸部狭窄异常。本研究使用超声联合MRI进行诊断,大幅提高了诊断效能。胎儿MRI清楚地显示出长骨的多处骨折和变形,胎儿肺体积的定量和肺信号特征的评估可用于确定胎儿存活的预后[21-23],这些发现均在产后尸检结果得到证实。
总结本研究Ⅱ型胎儿成骨发育不全的影像学诊断要点为:超声表现为严重四肢短肢畸形、多发性骨折、长骨弯曲成角、颅骨骨化不全、胸廓狭窄等;MRI表现为明显缩短弯曲的四肢,手、足可表现正常,呈哑铃状的狭窄胸廓为其特征性表现,T2信号强度明显降低,提示肺发育不全。Ⅱ型胎儿成骨发育不全的影像学诊断需与致死性侏儒、软骨发育不全等其它短肢畸形进行鉴别。致死性侏儒同样为致死性骨骼发育障碍,其形态学特征为大头颅、 “三叶草”头形、狭窄胸腔、腹部膨隆、严重的四肢长骨短小,干骺端粗大呈“听筒”状,四肢长骨均低于正常孕周值4个标准差,其四肢短小和小胸廓易与Ⅱ型胎儿成骨发育不全混淆。但致死性侏儒的胎头明显大于孕期、前额隆起、四肢极度短小,当超声检查受限时MRI影像可提供高分辨率的多平面影像进行鉴别诊断。Nelson的研究显示,在股骨长/腹围<0.16的病例中92%~96%为致死性侏儒,是预测致死性侏儒的可靠指标[24]。软骨发育不全为软骨骨化过程障碍,长骨生长缓慢,故长管骨变短并相对增粗,超声声像图表现为颅骨、椎体和四肢长骨骨化差,回声减低,四肢长骨短小,下肢较上肢明显,但其成角弯曲少见,根据此要点MRI对于椎体及长骨形态的良好显示有利于与其他短肢畸形鉴别。
本研究的局限性在于:作为一项回顾性研究样本量较小,对图像的回顾性观察未使用盲法,这可能会使解释产生偏差;尚未获得所有病例的基因检测结果数据,且研究时间跨度较大,使用的基因检测可能会发生变化。鉴于有关胎儿MRI骨发育异常的文献不足,本研究结果具一定借鉴价值。
综上所述,对于成骨性发育不全,胎儿MRI可用于确认、纠正或完善超声的产前诊断,尤其是在产前超声能区分成骨性发育不全和其他类型的骨骼发育不良时起到重要作用。需要注意的是,单独行MRI而未行超声检查违反产前筛查与诊断流程,因此MRI适用范围为超声检查难以观察或无法确诊病例,即MRI作为超声检查的有益补充。胎儿MRI联合超声诊断可大幅提高目前超声诊断的诊断敏感性及准确性,提高骨骼畸形的检出率,减少漏误诊,有利于指导临床。(本文图见封三)
[1] Ralston SH,Gaston MS. Management of osteogenesis imperfecta[J]. Front Endocrinol,2020,42(2):924-927.
[2] 周昌荣,栗河舟,李春玲.产前超声诊断成骨发育不全Ⅱ型1例[J].中国超声医学杂志,2017,34(33):1049.
[3] 李胜利,廖伊梅,Guoyang L.基于循证医学的产前超声检查对脐带螺旋结构的评价及其误区[J].中华妇产科杂志,2019,54(2):126-130.
[4] 李雪蕾,穆仲平,黄婷,等.胎儿肠扭转及肠套叠的产前超声诊断及漏误诊分析[J].中华超声影像学杂志,2019,28(8):696-699.
[5] 韩蕾,项莉亚,黄萍,等.彩色多普勒超声、MRI检查对胎儿中枢神经系统畸形的诊断效能对比[J].中国CT和MRI杂志,2019,17(6):32-34.
[6] Gilligan LA,Calvo-Garcia MA,Weaver KN,et al. Fetal magnetic resonance imaging of skeletal dysplasias[J]. Pediatr Radiol,2020,50(2):224-233.
[7] Solopova A,Wisser J,Huisman TA. Osteogenesis imperfecta type Ⅱ:fetal magnetic resonance imaging findings[J]. Fetal Diagn Ther,2008,24(4):361-367.
[8] Weaver KN,Johnson J,Beth Klineath,et al. Predictive value of fetal lung volume in prenatally diagnosed skeletal dysplasia[J]. Prena Diagn,2014,34(13):1326-1331.
[9] Liu Y,Wang L,Yang YK,et al. Prenatal diagnosis of fetal skeletal dysplasia using targeted next-generation sequencing:an analysis of 30 cases[J]. Diagnostic Pathology,2019,14(1):76-79.
[10] Tang J,Zhou C,Shi H,et al. Prenatal diagnosis of skeletal dysplasias using whole exome sequencing in China[J]. Clinica Chimica Acta,2020,507(8):187-193.
[11] Wang D,Zhang M,Guan H,et al. Osteogenesis imperfecta due to combined heterozygous mutations in both COL1A1 and COL1A2,coexisting with pituitary stalk interruption syndrome[J]. Front Endocrinol,2019,32(10):193-197.
[12] Marom R,Rabenhorst BM,Morello R. Osteogenesis imperfecta:an update on clinical features and therapies[J]. Eur J Endocrinol,2020,183(4):R95-106.
[13] 赵秀丽,高劲松,李璐璐,等.200例成骨不全症高风险胎儿的产前基因诊断[J].中华医学杂志,2019,99(42):3328-3334.
[14] Venturi G,Tedeschi E,Mottes M,et al. Osteogenesis imperfecta:clinical,biochemical and molecular findings[J]. Clin Genet,2006,70(6):131-139.
[15] Mitaka H. Osteogenesis imperfecta and blue sclera[J]. QJM,2018,111(9):665-669.
[16] Chamunyonga F,Masendeke KL,Mateveke B. Osteogenesis imperfecta and pregnancy:a case report[J]. J Med Case Rep,2019,13(1):1-4.
[17] Rossi V,Lee B,Marom R.Osteogenesis imperfecta:advancements in genetics and treatment[J]. Curr Opin Pediatr,2019,31(6):708-715.
[18] Ngo C,Viot G,Aubry MC,et al. First-trimester ultrasound diagnosis of skeletal dysplasia associated with increased nuchal translucency thickness[J]. Ultrasound Obstet Gynecol,2007,30(9):221-226.
[19] Tretter AE,Saunders RC,Meyers CM,et al. Antenatal diagnosis of lethal skeletal dysplasias[J]. Am J Med Genet,1998,75(11):518-522.
[20] Teng SW,Guo WY,Sheu MH,et al. Initial experience using magnetic resonance imaging in prenatal diagnosis of osteogenesis imperfecta type Ⅱ:a case report[J]. Clin Imaging,2003,27(3):55-58.
[21] Ruando R,Molho M,Roume J,et al. Prenatal diagnosis of fetal skeletal dysplasias by combining two-dimensional and three-dimensional ultrasound and intrauterine three-dimensional helical computer tomography[J]. Ultrasound Obstet Gynecol,2004,24(2):134-140.
[22] Canda MT,Prenatal S,Caglayan LD,et al. Diagnosis of osteogenesis imperfecta type Ⅲ[J]. J Obstet Gynaecol India,2019,69(4):374-376.
[23] Sanchis-Gimeno JA,Lois-Zlolniski S,Gonz lez-Ruiz JM,et al. Association between ribs shape and pulmonary function in patients with osteogenesis imperfecta [J]. J Adv Res,2019,21(10):177-185.
lez-Ruiz JM,et al. Association between ribs shape and pulmonary function in patients with osteogenesis imperfecta [J]. J Adv Res,2019,21(10):177-185.
[24] Nelson DB,Dashe JS,Mcintire DD,et al. Fetal skeletal dysplasias:sonographic indices associated with adverse outcomes[J]. J Ultrasound Med,2014,33(6):1085-1090.