颅脑损伤[1-2](traumatic brain injury,TBI)是发生于头皮、颅骨和脑部的一种常见外伤,具有较高的病死率,临床表现为意识障碍、头昏呕吐,重型颅脑损伤常伴随患者代谢及生命体征紊乱、脑性水肿等症状,严重影响患者的生存质量,现阶段治疗常以颅内压监护、亚低温治疗、脱水治疗等非手术治疗手段为主,仍缺乏特效的临床解决方案。骨髓间充质干细胞(bone marrow mesenchymal stem cells)是一类具有多向分化潜能的干细胞[3-4]。近年来随着干细胞移植治疗研究的发展,越来越多的证据表明干细胞治疗组在一定条件下能够改善创伤性脑组织的结构与功能[5],但对神经系统受损区域的稳定修复效果受继发性出血、缺血性细胞坏死及自由基作用的影响仍有待提升。另一方面,前期研究表明舒芬太尼[6]及丙泊酚[7-8]分别对TBI模型大鼠神经元再生、大脑缺血缺氧损伤及神经功能的发挥具有重要作用,同时,临床工作经验也表明,舒芬太尼联合丙泊酚对创伤性脑损伤具有保护作用。本研究旨在观察舒芬太尼丙泊酚静脉复合麻醉对骨髓间充质干细胞移植治疗创伤性脑损伤大鼠行为学及病理学变化的影响,探究骨髓间充质干细胞移植、舒芬太尼丙泊酚静脉复合麻醉治疗TBI大鼠的作用机制。
1 材 料 与 方 法
1.1 材料 舒芬太尼(人福医药);丙泊酚(四川国瑞药业);水合氯醛(成都科龙化工试剂厂);PBS、胎牛血清(fetal bovine serum,FBS)、DMEM高糖培养基、胰酶等购自Hyclone;多聚甲醛、DAB显色试剂盒均购自武汉博士德生物工程有限公司;电子颅脑损伤仪(Custom Design&Fabrication, Inc);电感耦合等离子发射光谱仪(上海宏达公司);原位缺口粒端标记(TUNEL)法试剂盒、S100β ELISA试剂盒(Roche);鬼比环肽(QIAGEN);RIPA裂解液、BCA蛋白定量试剂盒均购自生工;山羊抗兔IgG、白细胞介素6(interleukin 6,IL-6)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素1β(interleukin-1β,IL-1β)、Bcl2-Associated X的蛋白质(Bax)、B淋巴细胞瘤2(B-cell lymphoma 2,Bcl-2)、细胞色素C(cytochrome C,Cytc)的抗体均购自Abm;TRIzol、反转录试剂盒及荧光定量PCR试剂盒购自天根生物;PCR引物委托生工生物工程有限公司设计合成,引物序列见表1。
1.2 实验动物与分组治疗
1.2.1 实验动物 干细胞治疗组供体动物:无特定病原体(specific pathogens free, SPF)级幼年雄性Wistar大鼠5只,2~4周龄,体重(100±10) g;干细胞治疗组受体动物:SPF级成年雄性Wistar大鼠45只,体重(200±20)g,均购自新疆医科大学实验动物中心。大鼠于25~27 ℃恒温,50%~70%恒湿,每12 h昼夜戒律交替条件下分笼饲养,动物实验操作符合实验动物保护条例,适应性喂养1周后正式开始实验。
表1 引物序列
Table 1 Primer sequence

名称序列(5′→3′)长度/bpGAPDH基因上游引物:CATTGGCTACGAATACAGCA20下游引物:AGGGGCAACTGGTCTACATG20IL-6基因上游引物:AGAGACTTCCAGCCAGTTCC20下游引物:AGCCTCCGACTTGTGAAGTG20TNF-α基因上游引物:TCGTCTACTCCTCAGAGCCC20下游引物:ACTTCAGCGTCTCGTTGTT19IL-1β基因上游引物:CAGGAAGGCAGTGTCACTCA20下游引物:AAAGAAGGTGCTTGGGTCCT20
1.2.2 骨髓间充质干细胞(干细胞治疗组)的分离及培养 参照文献报道方法,分离大鼠股骨和胫骨,暴露骨髓腔。生理盐水冲洗并收集骨髓腔冲洗液,1 000 r/min 4 ℃低速离心10 min,用含质量分数10% FBS的DMEM高糖培养基1 mL重悬下层细胞沉淀并转移培养至T25培养瓶中,全程无菌操作[9]。常规培养并观察干细胞治疗组细胞生长情况,稳定传代3次后可用于后续实验操作。
1.2.3 动物分组造模及治疗方法 受试大鼠随机分为对照组、干细胞治疗组及联合治疗组3组,每组15只。各组大鼠于造模干细胞治疗组前12 h禁水禁食,以0.7 mL/kg比例给予大鼠腹腔注射5%水合氯醛麻醉,行俯卧位固定大鼠于立体定向支架上。剃毛暴露术区,75%乙醇消毒后沿头正中线切开头皮,剥离右侧顶骨后以前囟为原点,用磨钻磨开直径约5 mm骨窗使完整硬脑膜完全暴露。使用电子颅脑损伤仪(electric cortical contusion impactor,eCCI)构建重度TBI模型大鼠,eCCI打击参数设置参照文献报道方法[10]。造模完成后缝合切口并再次消毒,将大鼠放回笼中饲养。首次造模3 h后,经尾静脉给予联合治疗组1×105/mL干细胞治疗组悬液0.5 mL、舒芬太尼0.5 g/kg和丙泊酚2.0 mg/kg,复合麻醉剂量选择参照李文亮等[11]方法;干细胞治疗组给予尾静脉注射干细胞治疗组悬液0.5 mL;对照组尾静脉给予等体积生理盐水。3组每日同一时间给予上述处理1次,共治疗3周。
1.3 大鼠神经功能评定 每组各抽取6只大鼠,依据改良的神经功能缺陷评分量表(modified neurological severity scales,mNSS)[12]对大鼠治疗后3 d、7 d、14 d及21 d各阶段神经功能进行打分评定,0~18分,分数越高代表神经系统功能损害越严重,重复测定3次比较均值。
1.4 HE染色检测大鼠脑组织形态学 治疗结束后大鼠常规脱颈处死,断头分离脑组织,取视交叉位置后1 mm及6 mm处冠状切割修整组织块,制备海马组织石蜡切片,经HE染色、装片后于光学倒置显微镜下观察并记录3组脑组织形态学变化。
1.5 干湿比重法测定大鼠脑组织水含量 取脑损伤区域30 mg皮层组织置于-80 ℃快速降温冻存,提取RNA。剩余部分吸干表面水分后立即置于分析天平中称量脑组织湿重;转移至干燥玻璃培养皿中60 ℃烘干48 h称量脑组织干重。参照Elliott公式计算各组大鼠脑组织水含量,取均值比较。
1.6 大鼠脑组织总钙含量与血清S100β含量测定
1.6.1 大鼠脑组织总钙含量 取部分大鼠脑组织置于4 mL混合酸(高氯酸∶硝酸=1∶4)中,超纯水定容至7 mL,混匀,参照文献采用电感耦合等离子发射光谱仪扫描测定大鼠脑组织总钙含量[13]。
1.6.2 大鼠血清S100β含量测定 取治疗结束后活体大鼠颈静脉血1~2 mL,室温静置30 min后4 000 r/min低速离心10 min,取上层血清,参照S100β酶联免疫吸附测定试剂盒说明书操作测定S100β含量。
1.7 大鼠脑组织细胞凋亡检测
1.7.1 TUNEL法检测各组大鼠海马区神经细胞凋亡指数(apoptotic index,AI) 参照TUNEL凋亡检测试剂盒说明书对大鼠脑组织石蜡切片行抗体检测,TUNEL阳性细胞荧光显微镜下发散红色荧光,鬼比环肽标记细胞骨架呈绿色荧光定位细胞质,随机取5个视野拍照并记录细胞总数和阳性细胞数,取均值计算AI=(阳性细胞数/总细胞数)×100%。
1.7.2 Western Blot检测大鼠脑组织凋亡相关蛋白表达 取各组大鼠脑组织50 mg匀浆裂解组织蛋白30 min,裂解产物于4 ℃ 12 000 r/min低速离心15 min,收集上清。经BCA蛋白定量试剂盒定量检测蛋白含量后各取50 g蛋白,加入等量含1 mmol/L DTT的1×SDS上样缓冲液煮沸变性蛋白。行10%SDS-PAGE凝胶电泳,电泳结束后将上述蛋白转至PVDF膜,常规抗体孵育后显色曝光以GAPDH为内参,检测目的蛋白表达,所得结果为比值。
1.8 大鼠脑组织炎症因子表达检测
1.8.1 免疫组织化学检测大鼠脑组织IL-6、TNF-α、IL-1β表达分布 对大鼠脑组织石蜡切片行免疫组织化学抗体检测,DAB显色液显色反应5~10 min,显微镜下观察并用PBS冲洗终止显色。常规装片后于放大200倍的光镜下随机取5个视野观察并采集图像,观察IL-6、TNF-α、IL-1β在各组大鼠脑组织中的表达分布差异。
1.8.2 qRT-PCR检测大鼠脑组织中相关炎性因子mRNA表达 取冻存的脑组织20 mg,充分剪碎研磨参照TRIzol试剂说明书提取大鼠脑组织总RNA,逆转录获得的cDNAs,参照qRT-PCR试剂盒说明书定量检测IL-6、TNF-α、IL-1β相关mRNA表达变化。设置反应条件如下:95 ℃预变性5 min,随后按95 ℃变性1 min、55 ℃退火2 min、72 ℃延伸1 min的程序设置40次循环。循环结束后在95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s条件下做溶解曲线。以GAPDH为内参,每个样品均配3个副孔,同时做阴性对照组排除PCR污染及引物二聚体干扰。以采集到的荧光信号值(Ct值),计算2-△△Ct值分析脑水肿相关炎性因子mRNA在各组大鼠脑组织中表达水平的变化。
1.9 统计学方法 应用SPSS 19.0统计软件分析数据。计量资料比较采用单因素方差分析和SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 干细胞治疗组细胞形态学观察 干细胞治疗组新鲜提取的原代细胞贴壁后呈均匀的梭形,核居中,个别细胞呈现星形或扁平状多边形态,细胞以分散的单克隆聚集方式增殖,细胞液中漂浮有悬浮细胞,见图1A。干细胞治疗组纯化及传代培养1周后,非贴壁细胞逐渐减少,贴壁的细胞融合至密度为95%,见图1B。1∶2传代后细胞呈放射状或旋涡状集落生长趋势,细胞形态随传代次数增加逐渐稳定均一,最终稳定生长为梭形成纤维细胞样。

图1 干细胞治疗组镜下观察的细胞形态(HE ×200 )
A.新鲜提取的原代干细胞;B.纯化及传代培养1周后的细胞
Figure 1 Cell morphology was observed under microscope in stem cell treatment group(HE ×200)
2.2 3组mNSS比较 TBI造模结束后治疗3 d内,3组mNSS评分差异无统计学意义(P>0.05);治疗7 d后,联合治疗组mNSS评分显著低于对照组;治疗14 d、21 d后干细胞治疗组及联合治疗组评分均显著低于对照组,联合治疗组低于干细胞治疗组,差异有统计学意义(P<0.05),见表2。
2.3 HE染色观察脑组织形态学改变 HE染色结果显示,TBI后对照组神经元细胞胞体出现形状改变,细胞核呈现固缩、深染,细胞间间隙异常增大;神经元细胞可见排列松散,并伴有大量坏死。干细胞治疗组与联合治疗组海马组织较对照组病理学变化显著改善,且联合治疗组脑组织神经细胞密度显著恢复,海马区细胞排列整齐,细胞核完整且着色较浅,较干细胞治疗组治疗效果更佳。见图2。
表2 造模后不同时间段内3组大鼠mNSS评分比较
Table 2 Comparison of mNSS Score in different time periods after modeling among three groups![]()
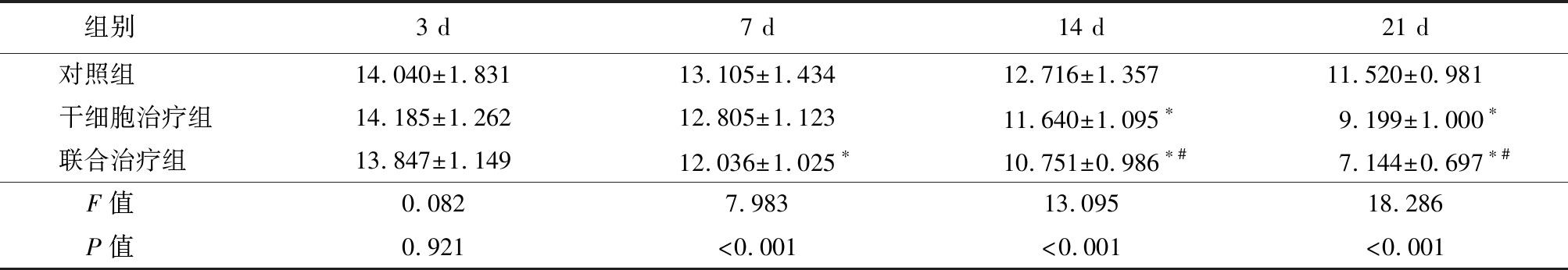
组别 3 d7 d14 d21 d对照组 14.040±1.83113.105±1.43412.716±1.35711.520±0.981干细胞治疗组14.185±1.26212.805±1.12311.640±1.095∗9.199±1.000∗联合治疗组 13.847±1.14912.036±1.025∗10.751±0.986∗#7.144±0.697∗#F值 0.0827.98313.09518.286P值 0.921<0.001<0.001<0.001
*P值<0.05与对照组比较 #P值<0.05与干细胞治疗组比较(SNK-q检验)
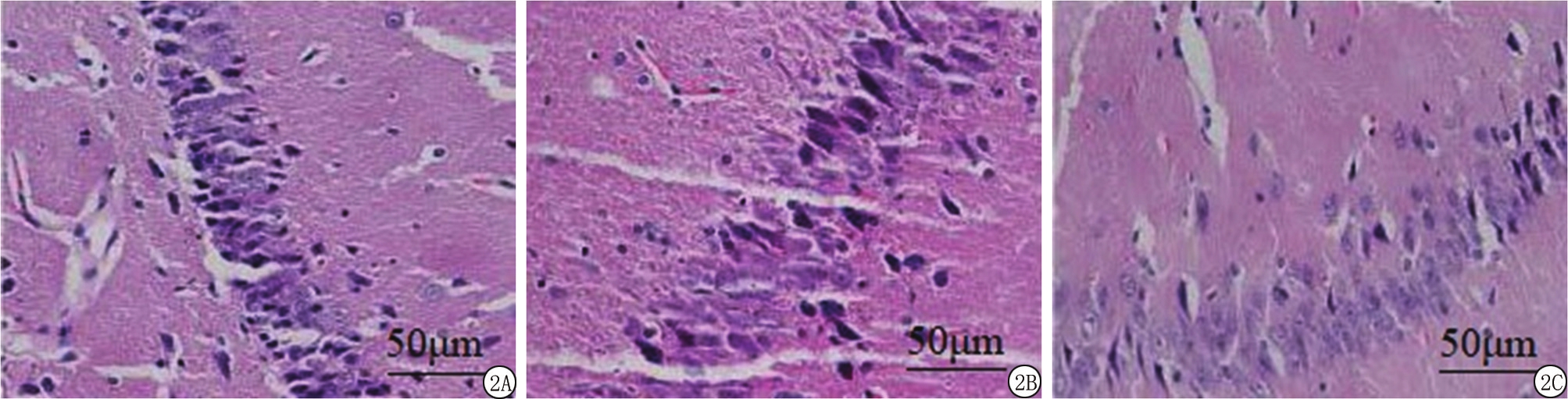
图2 HE染色观察大鼠海马组织病理变化( ×200)
A.对照组;B.干细胞治疗组;C.联合治疗组
Figure 2 Histopathological changes of hippocampus in rats were observed by HE staining( ×200)
2.4 3组脑组织含水量、总钙含量及血清S100β含量比较 干细胞治疗组及联合治疗组脑组织水含量、总钙含量及血清S100β含量均低于对照组,联合治疗组低于干细胞治疗组,差异有统计学意义(P<0.05),见表3。
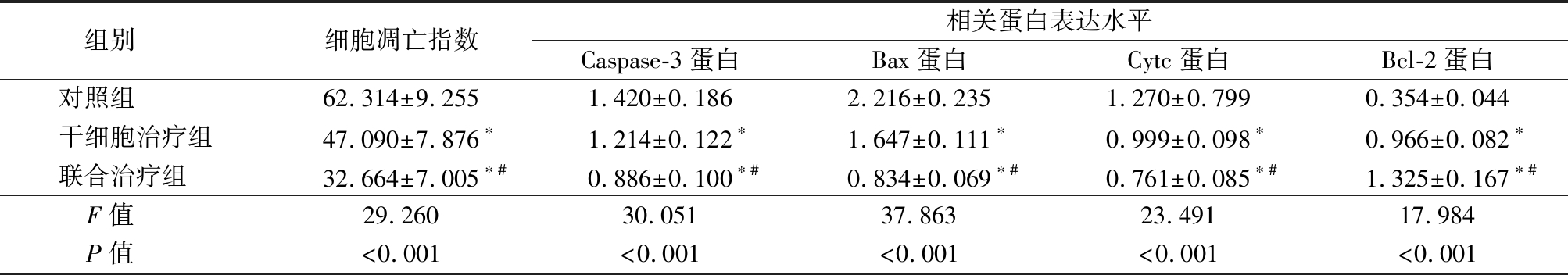
2.5 3组脑组织细胞凋亡比较 干细胞治疗组、联合治疗组脑组织细胞凋亡数目及Caspase-3、Bax、Cytc蛋白表达量低于对照组,联合治疗组低于干细胞治疗组,干细胞治疗组、联合治疗组Bcl-2蛋白表达高于对照组,联合治疗组高于干细胞治疗组,差异有统计学意义(P<0.05),见表4,图3。
2.6 3组脑组织中相关炎性因子表达比较 3组脑组织切片IL-6、IL-1β阳性产物呈棕褐色深染,于对照组大鼠脑部海马组织中密集表达分布,干细胞治疗组及联合治疗组大鼠中可见表达减少,IL-6、IL-1β阳性反应减弱;TNF-α阳性产物呈蓝紫色深染,同样在对照组组中显示出高表达弥散分布,于治疗组中表达减少,见图4。干细胞治疗组、联合治疗组IL-6、IL-1β、TNF-α mRNA表达水平均低于对照组,联合治疗组低于干细胞治疗组,差异有统计学意义(P<0.05),见表5。
表3 3组大鼠脑组织水含量、总钙含量和血清S100β含量比较
Table 3 Comparison of brain water content, total calcium content and serum S100 β content among three groups![]()
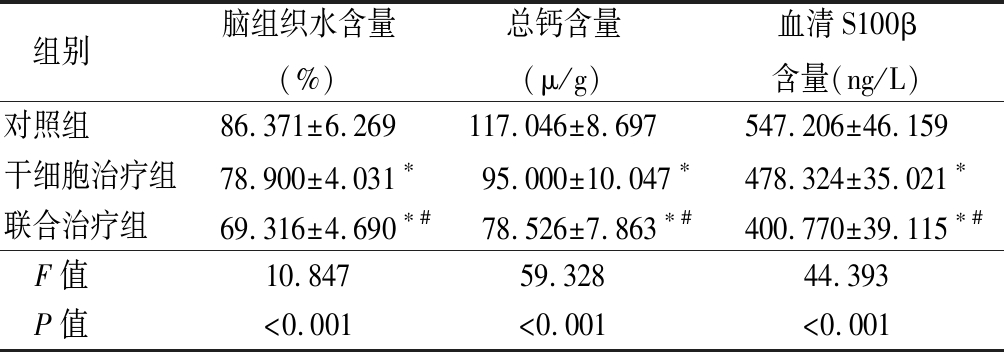
组别 脑组织水含量(%)总钙含量(μ/g)血清S100β含量(ng/L)对照组 86.371±6.269117.046±8.697547.206±46.159干细胞治疗组78.900±4.031∗95.000±10.047∗478.324±35.021∗联合治疗组 69.316±4.690∗#78.526±7.863∗#400.770±39.115∗#F值 10.84759.32844.393P值 <0.001<0.001<0.001
*P值<0.05与对照组比较 #P值<0.05与干细胞治疗组比较(SNK-q检验)
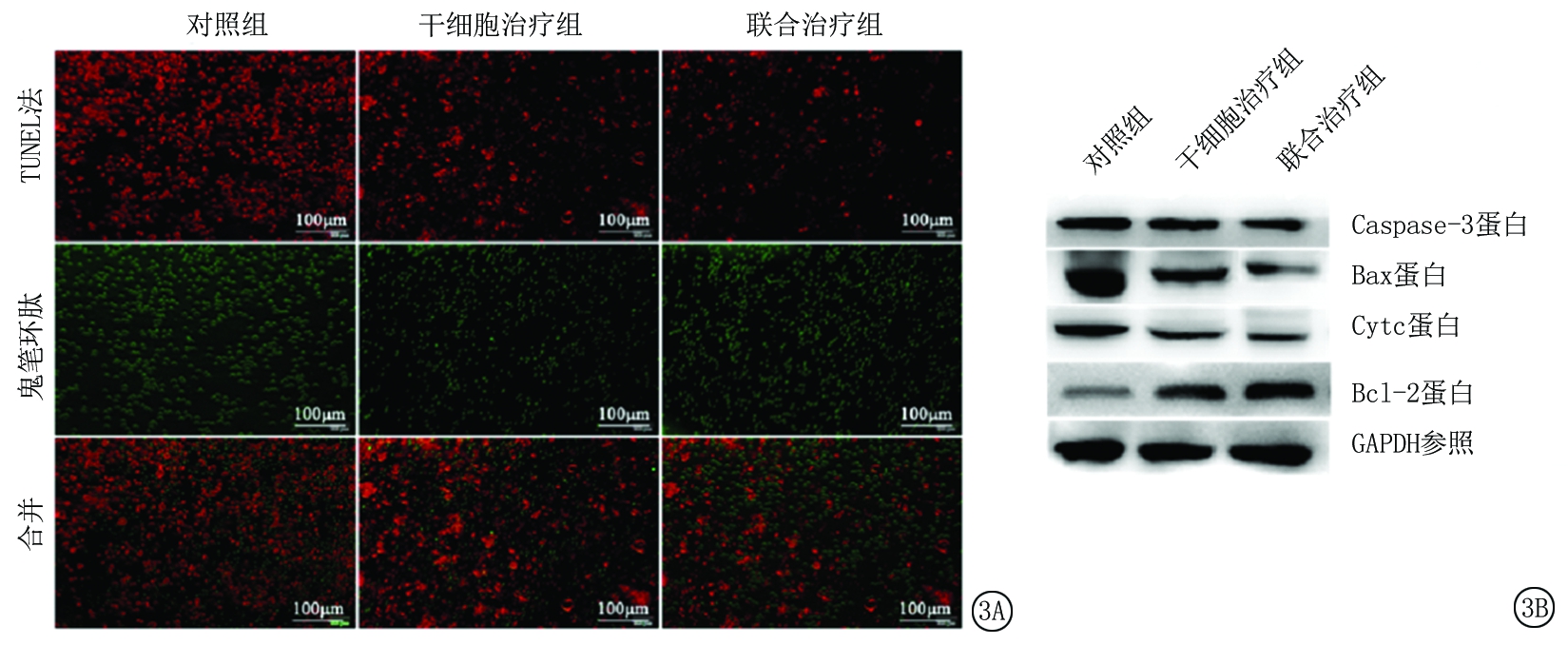
图3 3组大鼠脑组织TUNEL染色及凋亡蛋白表达
A.免疫组织化学染色( ×200);B.Western blot
Figure 3 TUNEL staining and the expression of apoptosis-related proteins in brain tissues of three groups
表4 3组大鼠脑组织细胞凋亡指数及凋亡蛋白相对表达水平比较
Table 4 Comparison of apoptosis rate and relative protein expression levels in three groups![]()
组别 细胞凋亡指数相关蛋白表达水平Caspase-3蛋白Bax蛋白Cytc蛋白Bcl-2蛋白对照组 62.314±9.2551.420±0.1862.216±0.2351.270±0.7990.354±0.044干细胞治疗组47.090±7.876∗1.214±0.122∗1.647±0.111∗0.999±0.098∗0.966±0.082∗联合治疗组 32.664±7.005∗#0.886±0.100∗#0.834±0.069∗#0.761±0.085∗#1.325±0.167∗#F值 29.26030.05137.86323.49117.984P值 <0.001<0.001<0.001<0.001<0.001
*P值<0.05与对照组比较 #P值<0.05与干细胞治疗组比较(SNK-q检验)
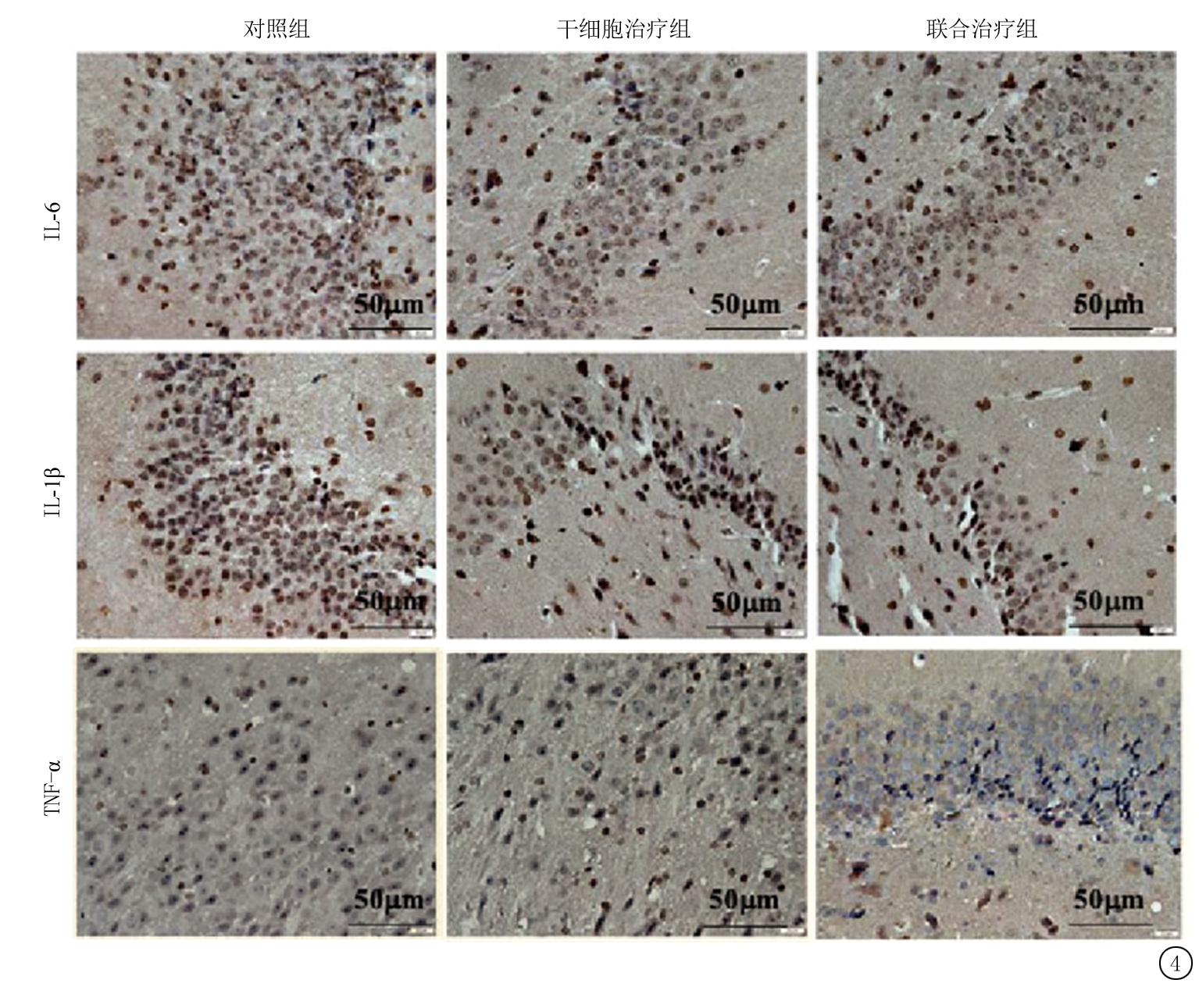
图4 3组大鼠脑组织炎性因子表达及分布(免疫组织化学 ×200)
Figure 4 Expression and distribution of inflammatory factors in three groups(immunohistochemistry ×200)
表5 3组大鼠脑组织IL-6、IL-1β、TNF-α mRNA表达比较
Table 5 Relative IL-6,IL-1β,TNF-α mRNA expression levels in three groups![]()
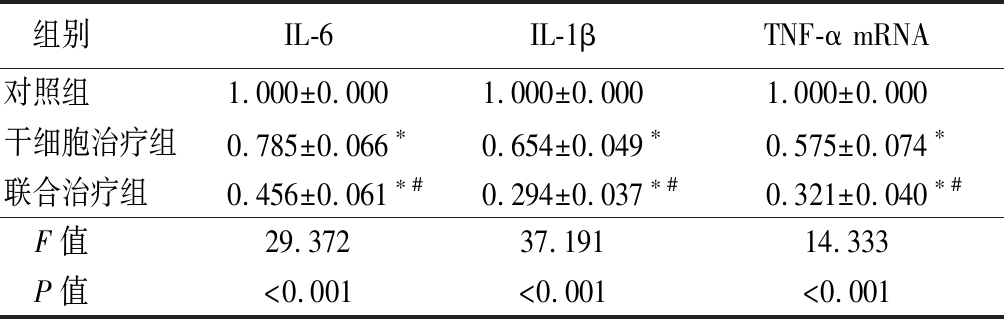
组别 IL-6IL-1βTNF-α mRNA对照组 1.000±0.0001.000±0.0001.000±0.000干细胞治疗组0.785±0.066∗0.654±0.049∗0.575±0.074∗联合治疗组 0.456±0.061∗#0.294±0.037∗#0.321±0.040∗#F值 29.37237.19114.333P值 <0.001<0.001<0.001
*P值<0.05与对照组比较 #P值<0.05与干细胞治疗组比较(SNK-q检验)
3 讨 论
骨髓间充质干细胞移植已经成为颅脑损伤治疗的研究热点,其颅内移植途径主要包括侧脑移植、静脉移植、腹腔移植、动脉移植以及鼻腔内移植[14],其中静脉移植和经腹腔移植方法以简单、不良反应小、对宿主伤害弱受到广泛应用。大量研究表明,移植至损伤脑组织区的干细胞治疗组可通过细胞分化替代宿主细胞、分泌神经生长因子(nerve growth factor, NGF)等神经营养因子、促进CXC等趋化因子分泌促进干细胞归巢、调控细胞因子表达及新生血管形成等途径对TBI发挥治疗作用[15],但真正将干细胞治疗组移植应用于TBI的临床治疗,干细胞治疗组的具体作用机制及移植治疗的安全性等问题仍有待探索。与此同时,舒芬太尼与丙泊酚作为临床经典麻醉药已被广泛应用于TBI患者的临床手术麻醉及康复治疗,其中舒芬太尼是一种新型阿片受体激动剂,能够有效抑制细胞凋亡和炎性反应过度表达对缺血后大脑损伤发挥保护作用;丙泊酚是一种γ-氨基丁酸受体激动剂,能通过调控Ca2+电压门控通道及抗氧化活性机制对受损神经起到治疗作用。本研究结果显示,干细胞治疗组移植治疗与舒芬太尼、丙泊酚等药物治疗相结合对创伤性脑损伤大鼠的综合治疗效果显著,为此,笔者对3者的联合作用机制进行了深入探究。
治疗期间由mNSS评分可知,治疗14 d后,联合治疗组较干细胞治疗组对大鼠神经功能缺陷恢复的治疗效果显著增强,舒芬太尼联合丙泊酚在干细胞治疗组单一治疗的基础上促进TBI大鼠脑损伤修复,同时HE染色可见创伤性大鼠脑部海马区病理变化得到显著改善。查阅相关文献可知,创伤性脑损伤机制及病理组织形态学的变化与脑水肿、细胞内钙荷载及血清S100β等显著相关,因此通过检测脑组织水含量可知联合治疗组大鼠脑组织水含量及总钙含量显著低于干细胞治疗组与单一治疗组,提示舒芬太尼联合丙泊酚对降低脑水肿、抑制钙超载的作用更强,促进创伤性脑损伤修复;同时治疗组脑组织总钙含量的减少表明创伤性损伤与组织细胞钙超载有关,联用舒芬太尼与丙泊酚可有效减轻脑组织总钙含量、逆转TBI脑损伤。另一方面,S100β作为神经组织蛋白之一在体内发挥营养胶质细胞、促进神经元生长的作用,可通过与游离的Ca2+结合形成稳定结合钙,诱导神经细胞的凋亡,本研究结果可知,联合治疗组治疗较干细胞治疗组显著抑制大鼠体内S100β含量,这提示干细胞治疗组联合舒芬太尼与丙泊酚治疗TBI大鼠脑损伤可能与抑制神经细胞凋亡、促进脑部炎症损伤修复相关。因此进一步检测脑组织细胞凋亡及炎性因子表达变化,结果显示联合治疗组较干细胞治疗组大鼠脑部海马组织神经细胞凋亡率显著降低,细胞内促凋亡关键因子Caspase-3、Bax、Cytc蛋白表达较干细胞治疗组显著降低,且舒芬太尼联合丙泊酚对Cytc蛋白表达抑制更为显著,提示联合治疗组可能通过抑制线粒体凋亡途径抑制受损神经细胞凋亡,同时促进抗凋亡蛋白Bcl-2表达,进而影响神经细胞形态稳定及神经元生长实现对TBI大鼠的治疗作用,进而推测舒芬太尼联合丙泊酚对干细胞治疗组治疗TBI大鼠可能受到PI3K/Akt/GSK3β信号通路级联反应的调控。另外,丙泊酚同时参与Ca2+门控通道的调节,其与舒芬太尼联用能阻断神经元神经信号传导、改善损伤区域炎症微环境,免疫组织化学结果显示联合治疗组大鼠治疗后脑部IL-6、IL-1β、TNF-α分布较干细胞治疗组显著减少,同时qPCR结果显示脑组织中IL-6、IL-1β、TNF-α mRNA表达水平与组织炎性因子分布呈正相关,为改善TBI后大鼠颅内炎症反应、组织水肿提供可能。
综上所述,舒芬太尼丙泊酚静脉复合麻醉对创伤性脑损伤大鼠神经修复具有保护作用,舒芬太尼联合丙泊酚在干细胞治疗组移植治疗中可缓解脑水肿、细胞钙超载及循环S100β的积聚,促进血液循环和微环境调节,抑制神经细胞凋亡和炎性介质的表达,促进神经元的再生及修复,改善脑组织病理变化及受损神经功能缺陷,为临床康复采用干细胞治疗组移植治疗脑损伤提供了新的思路和方法。
[1] 李春伟,伊志强,李良.重型创伤性颅脑损伤的治疗进展[J].中国微创外科杂志,2016,16(7):656-660.
[2] 刘腾飞,周建康,黄团结,等.人脐带间充质干细胞移植治疗创伤性颅脑损伤的研究进展[J]. 中华灾害救援医学,2017,5(11):655-660.
[3] Deng QJ,Xu XF,Ren J. Effects of SDF-1/CXCR4 on the repair of traumatic brain injury in rats by mediating bone marrow derived mesenchymal stem cells[J]. Cell Mol Neurobiol,2017,38(2):467-477.
[4] 王东,庞晓璐,王梁,等.间充质干细胞联合白藜芦醇对实验性自身免疫性脑脊髓炎小鼠炎症的影响[J].河北医科大学学报,2017,38(7):745-749.
[5] Darkazalli A,Ismail AA,Abad N,et al. Use of human mesenchymal stem cell treatment to prevent anhedonia in a rat model of traumatic brain injury[J]. Restor Neurol Neurosci,2016,34(3):433-441.
[6] Kinoshita K. Traumatic brain injury:pathophysiology for neurocritical care[J]. J Intensive Care,2016,4(1):29.
[7] 王立江,李政荣,刘英彦.丙泊酚配合无创颅内压监护治疗重型颅脑损伤临床研究[J].现代中西医结合杂志,2017,26(13):1444-1446.
[8] Woldegerima N,Rosenblatt K,Mintz CD. Neurotoxic properties of propofol sedation following traumatic brain injury[J]. Crit Care Med,2016,44(2):455-456.
[9] 平键,陈红云,周扬,等.骨髓间充质干细胞移植对四氯化碳大鼠肝损伤的影响及一贯煎的干预作用[J].中国中药杂志,2018,43(19):3905-3912.
[10] 郭新荣,王瑞辉,吴涛.使用eCCI仪制备大鼠TBI动物模型及血清S100B和NSE含量变化[J].实验动物科学,2013,30(5):24-27.
[11] 李文亮,佟冬怡.舒芬太尼复合丙泊酚全身麻醉在脐血间充质干细胞移植治疗脊髓损伤中的应用[J].中国组织工程研究,2016,20(45):6739-6745.
[12] Xu X,Gao W,Cheng S,et al. Anti-inflammatory and immunomodulatory mechanisms of atorvastatin in a murine model of traumatic brain injury[J]. J Neuroinflammation,2017,14(1):167.
[13] 张鲲,李曼,王力甚,等.舒芬太尼对体外循环大鼠脑损伤的保护作用[J].微循环学杂志,2014,24(1):12-14.
[14] 刘莎,宫蕊,吴明,等.hUCMSCs通过抑制星形胶质细胞活化引起的炎症因子表达改善Aβ损伤大鼠学习记忆能力[J].河北医科大学学报,2018,39(3):258-262.
[15] 郑臻,母得志.骨髓间充质干细胞治疗缺氧缺血性脑损伤的研究现状[J/CD].中华妇幼临床医学杂志(电子版),2017,13(4):373-377.