正常阴道缺失是由先天性阴道发育不良(Mayer-Rokitansky-Küstner-Hauser,MRKH综合征)或获得性疾病(例如癌症和创伤)引起的。为了满足这些患者生理及心理的需求通常需要阴道重建。重建一个最接近正常阴道形态和功能的阴道是医者遵循的原则和目标[1]。阴道重建的方法主要包括非手术的顶压法和手术治疗。非手术治疗曾被认为是先天性无阴道患者的一线治疗,但这种方法能否成功的关键在于患者会阴局部的条件及患者的依从性,需要较长时间的治疗才能达到足够的长度,治疗过程中可能给患者增加较多的心理负担。手术治疗能在短期内达到治疗效果也减少了患者的心理负担,因此成为目前常用的治疗方法。目前阴道重建最常用的方法是在膀胱和直肠之间造穴再以腹膜,皮瓣,肠管或羊膜等组织重建阴道[2-3]。但是,这些方法均不能很好的重建阴道,使用自体组织会给患者带来不必要的损伤和并发症,异体组织又可能导致排斥反应及感染外源性疾病。近年来随着组织工程技术的发展[4],各种新型支架材料被应用于阴道重建,如脱细胞真皮基质[5],防粘连膜[6],脱细胞小肠黏膜下基质[7]等,给阴道重建患者带来了新的希望,但是何种材料更优,各种材料的比较和选择又给科研工作者及临床医生提出了新的挑战。阴道重建动物模型的构建就显得尤为重要。本研究用小肠黏膜下基质(small intestinal submucosa,SIS)作衬里构建大鼠阴道重建动物模型,探讨其可能性,并通过检测相关指标研究重建效果。
1 材料与方法
1.1 实验动物及主要试剂 雌性Sprague-Dawley大鼠[河北省实验动物中心,实验动物质量合格证号1403076。许可证号:SCXY(冀)2013-1-003]。免疫组织化学试剂盒(北京中杉生物技术有限公司),二氨基联苯胺(DAB)显色试剂盒(Abgent),广谱细胞角蛋白(AE1/AE3)单克隆抗体。
1.2 实验方法
1.2.1 大鼠阴道重建动物模型的构建 选择体重200~250 g的成年雌性Sprague-Dawley大鼠用于阴道重建。1%戊巴比妥钠(30~50 mg/kg)腹腔注射麻醉后将大鼠仰卧位固定于手术台上,局部备皮消毒。在阴道黏膜下注入肾上腺素生理盐水形成水垫,从阴道黏膜和会阴皮肤交界处剪开,牵拉阴道黏膜将阴道黏膜从阴道口向上分离至阴道穹窿处,切除整个阴道,术中避免尿道和直肠的损伤。将生理盐水预湿的SIS(前期实验制备[8])包裹于模具上并缝合连接处(橡胶管自制管型阴道模具,长度为13 mm,外径为4 mm,胶管上剪数个菱形小孔,使模具既有支撑作用又减少对局部组织的压迫),置入原阴道处,上端固定于宫颈处,下端缝合于阴道外口。术后大鼠分笼喂养,术后3 d内腹腔注射抗生素预防感染。
1.2.2 标本收集及免疫组织化学检测 分别于术后14 d、1个月、3个月随机处死6只大鼠,取出阴道全层进行检测,HE染色,免疫组织化学SP法检测重建阴道组织中角蛋白(AE1/AE3 1∶100),α平滑肌激动蛋白(α-smooth muscle actin,α-SMA 1∶800)及神经纤维标记物-蛋白基因产物(PGP9.5 1∶400)的表达。4只大鼠于12周处死用于组织浴槽检测。
1.2.3 阴道组织的功能检测 将6只正常大鼠及4只实验组大鼠处死后取出整个阴道组织,横行切取阴道远端组织,使切下的组织为宽1~2 mm的环状。将环状组织连接到组织浴槽的张力传感器上,浸入含有Krebs溶液的浴槽中(实验前Krebs溶液用95%O2和5%CO2的混合气体平衡20~30 min,整个实验过程中持续通气并使液体温度维持在37 ℃)。组织固定好后调节预负荷至0.5 g并使其平衡60 min。实验前用高钾溶液(124 mmol/L)评估阴道组织的活性,有活性的组织分别给予30 Hz,60 Hz及90 Hz的电场刺激,电压均为30 V,均持续0.5 s,观察阴道组织的张力变化情况。整个实验控制在取材后6 h之内,实验过程中每15~20 min更换一次Krebs溶液以保证组织的活性。
2 结 果
2.1 重建阴道的组织学检测
2.1.1 重建阴道巨检 重建阴道14 d时,质地比较韧,没有弹性,随时间延长质地逐渐变软,至3个月时明显变软,并且有一定的弹性(图1)。
2.1.2 重建阴道的免疫组织化学结果
2.1.2.1 HE染色及AE1/AE3染色观察 14 d时HE染色可见有部分上皮样组织从阴道入口向上爬行,AE1/AE3染色阳性,伴有较多炎细胞浸润,1个月时上皮组织能覆盖整个阴道,3个月时上皮组织更加成熟,基底层可见钉状突起(箭头所示),局部可见角化上皮组织,仅有少量炎细胞浸润,与正常阴道组织大致相同(图2)。
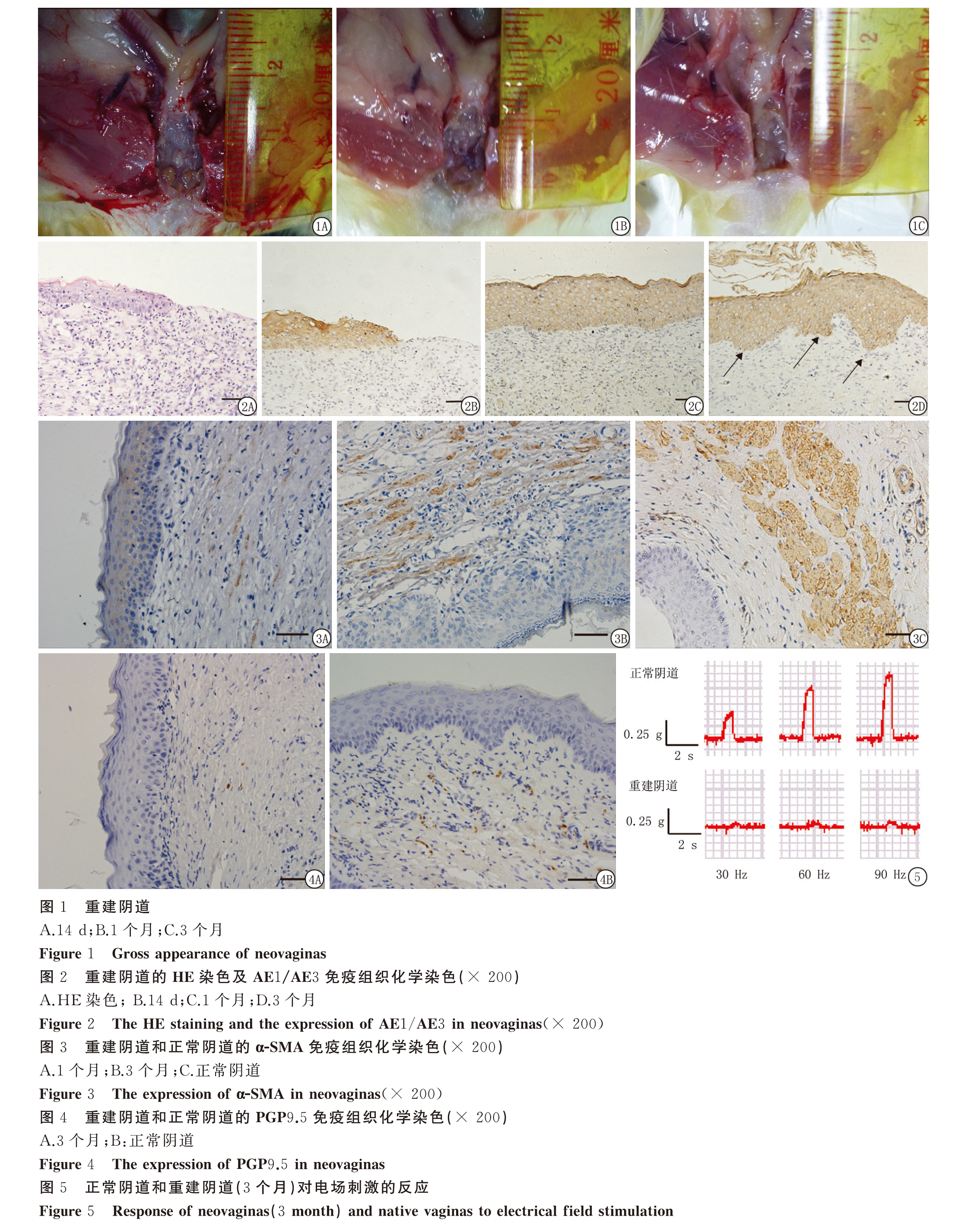
2.1.2.2 α-SMA染色观察 1个月时重建阴道组织中有少量组织表达α-SMA,提示有平滑肌的再生,3个月时α-SMA表达增多局部形成束状,但是再生的平滑肌连续性欠佳,与正常阴道平滑肌差距明显(图3)。
2.1.2.3 PGP 9.5染色观察 直到术后3个月重建阴道组中才偶见PGP9.5阳性的神经组织(图4)。
2.2 重建阴道的功能学检测 正常阴道组织在频率为30,60,90 Hz的电场刺激下收缩强度逐渐增大。重建阴道3个月时在频率为30,60,90 Hz的电场刺激下有微弱的反应,随频率增加收缩强度稍增强,但其收缩强度明显小于正常阴道(图5)。
3 讨 论
阴道重建是满足无阴道患者生理及心理需求的有效手段。近年来随着组织工程的发展,各种新型材料的应用,给无阴道患者带来了新的希望。构建阴道重建动物模型筛选最佳材料重建阴道就成为亟待解决的问题。
用于阴道重建的实验动物有绵羊、中国小型实验猪、兔子、大鼠和小鼠[9-10]。绵羊和中国小型实验猪体型较大,适于有初步研究结果后的进一步研究,不适用于初期实验,小鼠由于其体型太小不利于手术操作及术后护理。大鼠体型适中,其阴道较宽且易与周围组织分离,便于手术操作及术后护理,更适合于初期实验。虽然Zhang等[10]亦用大鼠进行了阴道重建,但他们是部分阴道切除后的重建,不能很好的模拟临床上先天性无阴道患者。课题组前期研究进行了一些初步的尝试[11],能够顺利完成手术,但术后阴道模具脱落及闭锁率较高,仅观察到术后1个月,本研究进一步改善手术操作,阴道模具及术后护理,使术后阴道模具脱落及闭锁率明显降低,还进一步完善了重建阴道的相关检测,尤其是组织浴槽对阴道功能的检测,为支架材料的筛选奠定良好的基础。
上皮组织是最先再生的组织。本研究发现大鼠重建阴道14 d时可见有部分上皮组织从阴道入口向上爬行,1个月时上皮组织能覆盖整个阴道,3个月时上皮组织进一步成熟。平滑肌的再生较慢,术后3个月时才有少量肌束形成,有研究发现平滑肌的再生可能是由成纤维细胞及来自循环中的干细胞分化而成,或是由周围正常组织中的平滑肌细胞及其祖细胞迁移而来[12]。神经组织再生最慢,术后3个月重建阴道组中才偶见PGP9.5阳性的神经组织。
阴道的收缩性决定了阴道的功能,其收缩的组织学基础就是阴道平滑肌。大鼠阴道平滑肌内层呈环行分布,外层呈纵行分布,阴道近端平滑肌层较薄,而远端平滑肌层厚度增加,至阴道口水平,环行平滑肌明显增厚形成括约肌样结构。人们使用组织浴槽的方法研究了子宫平滑肌[13],肠道平滑肌[14],气管平滑肌[15]等各种平滑肌的功能,但迄今为止,关于阴道功能的研究很少,仅少数学者用组织浴槽的方法研究了各种药物对糖尿病动物模型和卵巢切除术后阴道组织收缩功能及强度变化的影响和内源性的肽类对人类阴道组织功能的影响。基础研究发现,大鼠阴道近端的横向组织环和纵向组织条,仅对高钾溶液(K+124 mmol/L)有微弱的反应,而对EFS没有反应或反应微弱。只有阴道远端的横向组织环显示出可重复的收缩反应,这些组织环被用于进一步研究。因此,选用了阴道远端的横向组织环来评估重建阴道的功能。
实验前首先要验证组织的活性,用高钾溶液(K+124 mmol/L)检测阴道组织的收缩情况,组织有收缩反应说明活性好,可以应用于后续实验。预实验发现在电场刺激的其他条件不变电压从5 V增加到100 V时(间隔5 V),阴道的收缩强度仅轻度增加,在20~30 V时达到峰值,收缩强度变化不明显;其他条件不变频率从10 Hz增加到100 Hz(间隔为10 Hz),阴道的收缩强度逐渐增加,在80~90 Hz时达到峰值,收缩强度变化明显;其他条件不变持续时间的变化主要影响收缩波波峰的宽度,收缩强度变化不明显。总之,电场刺激的频率变化对阴道收缩强度的影响最大,因此将电压固定30 V,持续时间固定在0.5 s,选择频率为30,60和90 Hz的电场刺激来评估阴道的功能。正常阴道组织在频率为30,60和90 Hz的电场刺激下,收缩强度逐渐增强。重建阴道在频率为30 Hz的电场刺激下仅有微弱的反应,随频率增加收缩强度稍增强,与正常阴道组织有类似的变化趋势,但收缩强度差距明显。
大鼠阴道重建模型可以从组织学及功能学上评估重建阴道的功能,便于各种支架材料间的比较。但是单纯应用支架材料构建阴道仍不能达到理想的效果,组织工程除了有支架组织外还应该复合合适的种子细胞,近年研究发现复合种子细胞后能加速组织的修复与再生[16]。选择合适的种子细胞加速平滑肌的再生,促进阴道功能的恢复将是进一步研究的重点。
总之,本研究成功构建了大鼠阴道重建模型,并应用免疫组织化学及组织浴槽对重建阴道进行了组织学及功能学研究。借助大鼠阴道重建模型可以评估多种支架材料的用于阴道重建的效果,为进一步构建更好的重建阴道奠定了基础。(本文图见封三)
[1] 刘义彬,闫璐,张敬坤,等.MRKH综合征的诊治[J].中国实用妇科与产科杂志,2018,34(4):377-381.
[2] Liszewska-Kapion M,Strózik M,Kotarski L,et al. Mayer-Rokitansky-Küster-Hauser syndrome as an interdisciplinary problem[J]. Adv Clin Exp Med,2020,29(4):505-511.
[3] Wang J,Wei G,Yi Z,et al. Total laparoscopic sigmoid vaginoplasty:a novel therapeutic approach[J]. ANZ J Surg,2021,91(1/2):E20-E24.
[4] Tamadon A,Park KH,Kim YY,et al. Efficient biomaterials for tissue engineering of female reproductive organs[J]. Tissue Eng Regen Med,2016,13(5):447-454.
[5] Wang Z,Huang J,Zeng A,et al. Vaginoplasty with acellular dermal matrix after radical resection for carcinoma of the uterine cervix[J]. J Invest Surg,2019,32(2):180-185.
[6] Nagata T,Kawano A,Koyama M,et al. Efficacy of fibroblast growth factor on epithelialization of the neovagina in patients with mayer-rokitansky-kuster-hauser syndrome who underwent vaginoplasty[J]. J Pediatr Adolesc Gynecol,2017,30(3):400-404.
[7] Shen F,Zhang XY,Yin CY,et al. Comparison of small intestinal submucosa graft with split-thickness skin graft for cervicovaginal reconstruction of congenital vaginal and cervical aplasia[J]. Hum Reprod,2016,31(11):2499-2505.
[8] 张宁,秦锡静,朱玉林,等.不同处理方法对骨髓间充质干细胞与小肠黏膜下基质复合效果的影响[J].河北医科大学学报,2020,41(4):466-470.
[9] 李玢,陈俏华,沈鑫,等.绵羊肌源性干细胞负载非交联生物补片植入绵羊阴道缺损模型的组织学和在体生物力学研究[J].现代妇产科进展,2017,26(12):893-897.
[10] Zhang JK,Du RX,Zhang L,et al. A new material for tissue engineered vagina reconstruction:acellular porcine vagina matrix[J]. J Biomed Mater Res A,2017,105(7):1949-1959.
[11] Li Y,Liu F,Zhang Z,et al. Bone marrow mesenchymal stem cells could acquire the phenotypes of epithelial cells and accelerate vaginal reconstruction combined with small intestinal submucosa[J]. Cell Biol Int,2015,39(11):1225-1233.
[12] Wan X,Zheng D,Yao H,et al. An extracellular matrix-mimicking,bilayered,heterogeneous,porous,nanofibrous scaffold for anterior urethroplasty in a rabbit model[J]. Biomed Mater,2020,15(6):065008.
[13] Yim PD,Hyuga S,Wu AD,et al. Activation of an endogenous opsin 3 light receptor mediates photo-relaxation of pre-contracting late gestation human uterine smooth muscle ex vivo[J]. Reprod Sci,2020,27(9):1791-1801.
[14] Gastreich-Seelig M,Jimenez M,Pouokam E. Mechanisms associated to nitroxyl(HNO)-induced relaxation in the intestinal smooth muscle[J]. Front Physiol,2020,11:438.
[15] Topercerova J,Kolomaznik M,Kopincova J,et al. The effect of pulmonary surfactant on the airway smooth muscle after lipopolysaccharide exposure and its mechanisms[J]. Physiol Res,2019,68(Suppl 3):S275-S285.
[16] Jakubowska W,Chabaud S,Saba I,et al. Prevascularized tissue-engineered human vaginal mucosa:in vitro optimization and in vivo validation[J]. Tissue Eng Part A,2020,26(13/14):811-822.