目前肺癌仍是世界上与癌症相关的主要死因,严重影响人类健康。原发性肺癌分为小细胞肺癌和非小细胞肺癌(non-small-cell lung cancer,NSCLC),其中NSCLC占85%左右,备受世界关注,NSCLC中最主要的病理类型是腺癌和鳞癌。据统计,我国每年肺癌新发病约78.7万例,死于肺癌患者约63.1万例[1]。目前,肺癌治疗的决策以及预后预测一般基于肿瘤分期,尽管放化疗、靶向治疗和免疫治疗在临床上的应用在一定程度上提高了NSCLC的效果,但其预后仍不乐观。因此,应该在临床应用中加入更多有潜力和可推广的生物标志物,以提高NSCLC的预后预测。最近一些炎症相关参考指标大量涌现。如中性粒细胞淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR)、血小板淋巴细胞比值(platelet-to-lymphocyte ratio,PLR)与各种实体瘤(如肺癌[2]食管癌[3]肝癌[4]结直肠癌等[5])的生存有关。系统免疫-炎症指数(system immune-inflammation index,SII)更是整合了中性粒细胞、淋巴细胞和血小板的参数。据报道,SII与肺癌、乳腺癌、消化道肿瘤预后均有关[6-8]。此外,在恶性肿瘤患者中,通常存在凝血系统和纤溶系统的改变,许多研究表明,最常见的凝血指标如纤维蛋白原(fibrinogen,FIB)、D-二聚体与各种肿瘤(肺癌、膀胱癌、胃癌等)的发生发展甚至预后有关[9-11]。但是,有关SII与FIB对NSCLC预后价值的报道较少。本研究通过回顾性分析NSCLC患者的临床资料,旨在评估患者治疗前SII、FIB对NSCLC患者的临床意义及预后价值。
1 资料与方法
1.1 一般资料 选择2014年1月—2018年8月在河北省人民医院就诊的并通过病理确诊的首发NSCLC患者84例的完整病例资料。纳入标准:①细胞学或病理学确诊为肺腺癌、鳞癌;②未出现感染征象或者有感染性疾病;③有完整的病历和随访资料。排除标准:①确诊后未接受过系统性全身抗癌治疗;②急性炎性反应或感染性疾病及相关并发症;③其他恶性肿瘤、血液系统及自身免疫疾病史;④近半个月内使用过激素治疗。
本研究经医院医学伦理委员会审查通过。
1.2 方法 主要化疗方案为以铂类为基础的联合化疗,化疗周期为4~6个周期。放疗总剂量为50~60 Gy,1.8~2.0 Gy/次,5次/周。治疗前3~7 d采集所有患者清晨空腹静脉血检测临床指标。应用全自动血细胞分析仪检测血常规、生化及凝血功能。计算SII=外周血血小板计数(×109 g/L)×外周血中性粒细胞计数(×109 g/L)/外周血淋巴细胞计数(×109 g/L)。KPS评分是Karnofsky(卡氏,KPS,百分法)功能状态评分标准,总分为100分,评分越高,身体状况越好。体重减轻状况是初诊时临床医师通过询问患者及家属近半年来的体重情况。
1.3 随访 评估的主要研究终点为总生存期(overall survival,OS),即从确诊至死亡或末次随访时间。采用电话与门诊相结合的方式进行随访,确诊2年内对患者每3个月随访1次,2年后每6个月随访1次。截止随访时间为2018年8月。
1.4 统计学方法 应用SPSS 24.0统计软件分析数据。计数资料比较采用χ2检验。以患者死亡为终点,利用受试者工作特征(receiver operating characteristic,ROC)曲线确定SII和FIB分组的最佳临界值。采用Kaplan-Meier 法计算累积生存率,预后危险因素分析采用Cox多因素回归分析。采用Spearman相关分析SII与FIB的相关性。P<0.05为差异有统计学意义。
2 结 果
2.1 截断值的选取 通过受试者工作曲线计算约登指数,找出最大值为截断值(图1),治疗前SII的AUC为0.748,最佳截断值为743.384,敏感度为57.1%,特异度为90.5%;治疗前FIB的AUC为0.812,最佳截断值为3.070 g/L,敏感度为85.7%,特异度为64.3%。
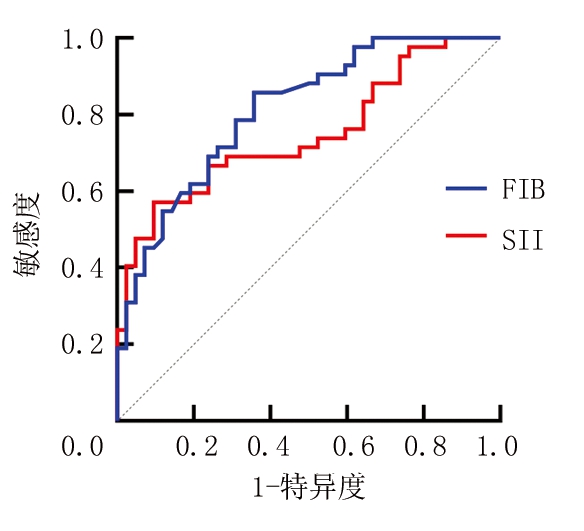
图1 以疾病死亡为终点,FIB、SII评估患者生存的ROC曲线
Figure 1 ROC curve of FIB and SII in evaluation of patient survival,with death from diseases as an end point
2.2 治疗前不同SII、FIB水平NSCLC患者临床特征比较 SII>743.384组和SII≤743.384组NSCLC患者肿瘤分化程度较低、TNM分期晚、KPS评分低、体重减轻率差异有统计学意义(P<0.05)。见表1。FIB>3.070 g/L组和FIB≤3.070 g/L组NSCLC患者年龄、KPS评分、体重减轻差异有统计学意义(P<0.01)。见表2。
表1 不同SII水平NSCLC患者临床特征比较
Table 1 Comparison of clinical characteristics of NSCLC patients with different SII levels (例数,%)
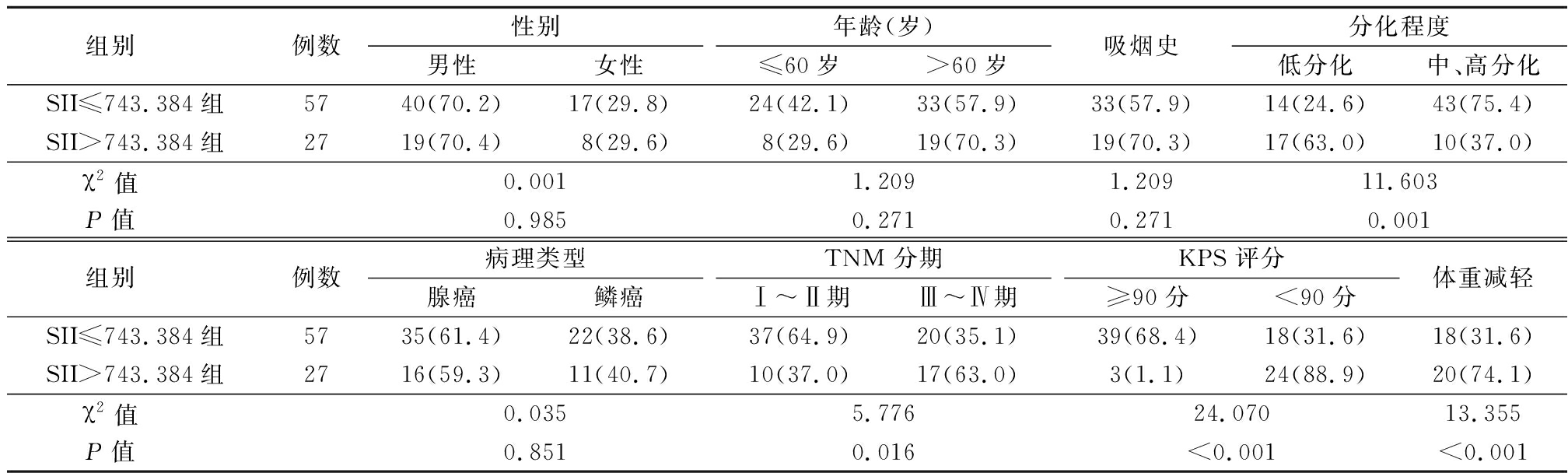
组别 例数性别男性女性年龄(岁)≤60岁>60岁吸烟史分化程度低分化中、高分化SII≤743.384组5740(70.2)17(29.8)24(42.1)33(57.9)33(57.9)14(24.6)43(75.4)SII>743.384组2719(70.4)8(29.6)8(29.6)19(70.3)19(70.3)17(63.0)10(37.0)χ2值 0.0011.2091.20911.603P值 0.9850.2710.2710.001组别 例数病理类型腺癌鳞癌TNM 分期 Ⅰ~Ⅱ期Ⅲ~Ⅳ期KPS 评分≥90分<90分体重减轻SII≤743.384组5735(61.4)22(38.6)37(64.9)20(35.1)39(68.4)18(31.6)18(31.6)SII>743.384组2716(59.3)11(40.7)10(37.0)17(63.0)3(1.1)24(88.9)20(74.1)χ2值 0.0355.77624.07013.355P值 0.8510.016<0.001<0.001
表2 不同FIB水平NSCLC患者临床特征比较
Table 2 Comparison of clinical characteristics of NSCLC patients with different FIB levels (例数,%)
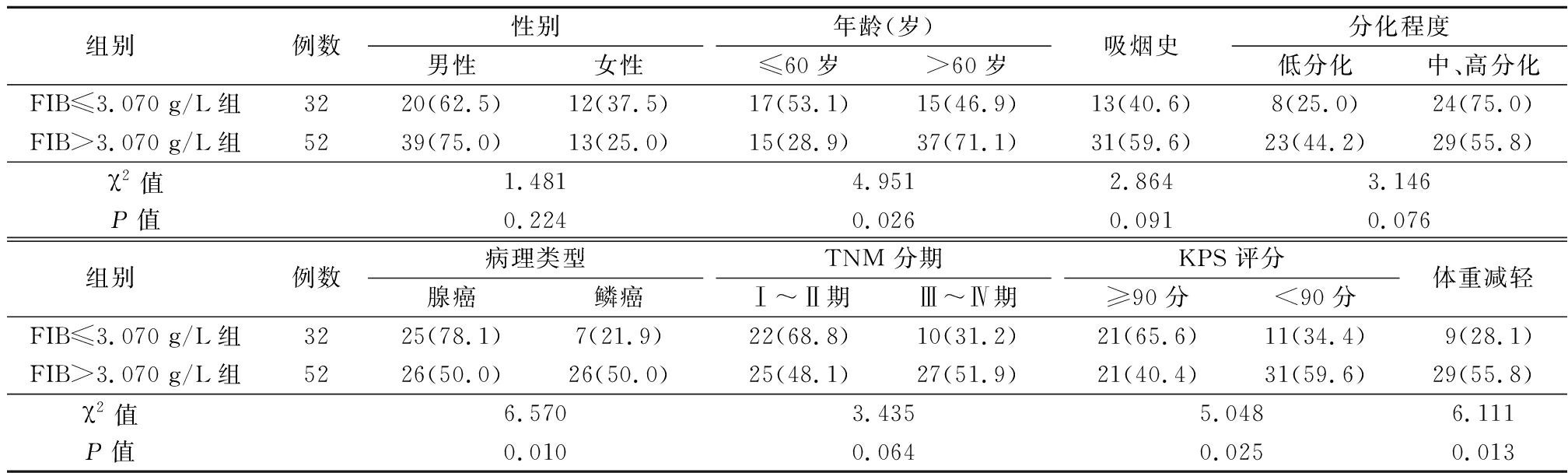
组别 例数性别男性女性年龄(岁)≤60岁>60岁吸烟史分化程度低分化中、高分化FIB≤3.070 g/L组3220(62.5)12(37.5)17(53.1)15(46.9)13(40.6)8(25.0)24(75.0)FIB>3.070 g/L组5239(75.0)13(25.0)15(28.9)37(71.1)31(59.6)23(44.2)29(55.8)χ2值1.4814.9512.8643.146P值0.2240.0260.0910.076组别 例数病理类型腺癌鳞癌TNM 分期 Ⅰ~Ⅱ期Ⅲ~Ⅳ期KPS 评分≥90分<90分体重减轻FIB≤3.070 g/L组3225(78.1)7(21.9)22(68.8)10(31.2)21(65.6)11(34.4)9(28.1)FIB>3.070 g/L组5226(50.0)26(50.0)25(48.1)27(51.9)21(40.4)31(59.6)29(55.8)χ2值 6.5703.4355.0486.111P值 0.0100.0640.0250.013
2.3 治疗前不同SII、FIB水平NSCLC患者生存曲线比较 利用K-M生存曲线统计,84例患者总生存时间为3~49个月,中位生存时间为12个月。SII≤743.384组和SII>743.384组的中位生存时间分别为34个月和10个月,差异有统计学意义(P<0.01)(图2)。FIB≤3.070 g/L组未到中位生存期,FIB>3.070 g/L组的中位生存时间为14个月,差异有统计学意义(P<0.01)(图3)。
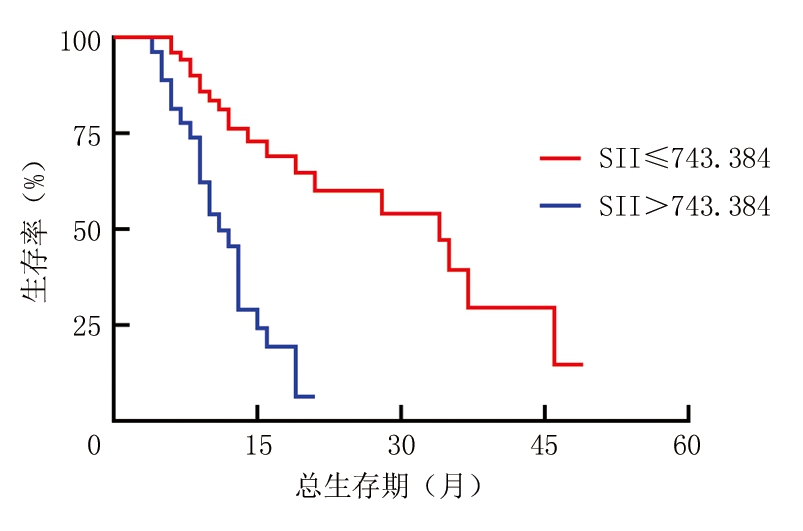
图2 以疾病死亡为终点,不同水平SII生存曲线比较
Figure 2 Comparison of survival curves at different levels of SII with death from diseases as an end point
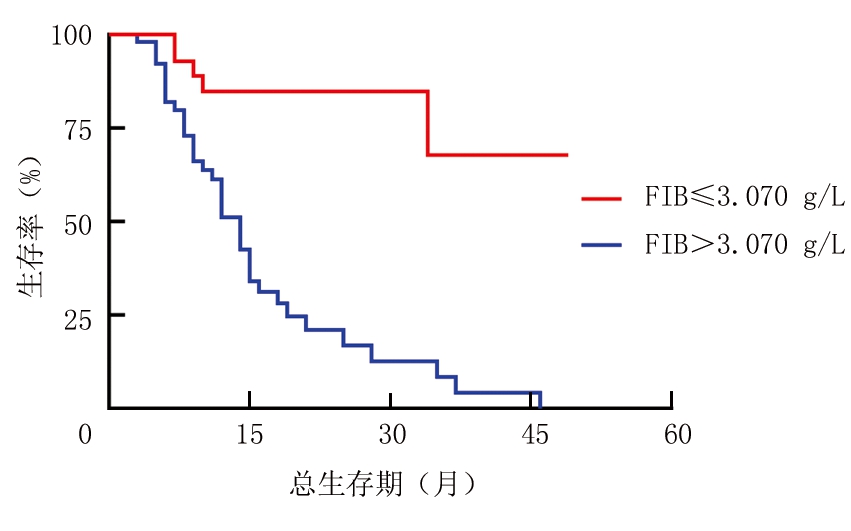
图3 以疾病死亡为终点,不同水平FIB生存曲线比较
Figure 3 Comparison of survival curves at different levels of FIB with death from diseases as an end point
2.4 联合检测治疗前SII和FIB水平患者生存曲线比较 将84例患者分为3组,2个指标均不高为1组28例,只升高1个指标为2组3例,2个指标均升高为3组23例。结果显示:2个指标均升高组的生存期短于1个指标升高组和2个指标均不高组,差异有统计学意义(P<0.01)(图4)。
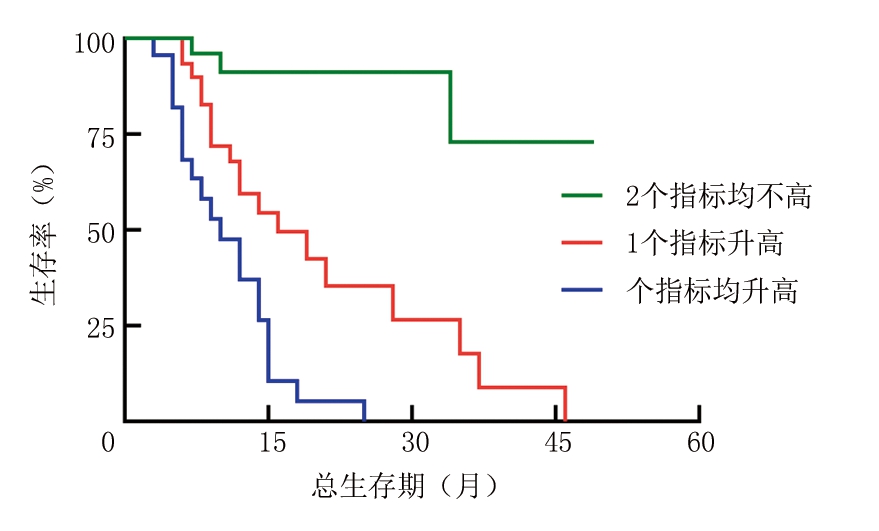
图4 以疾病死亡为终点,SII和FIB联合预测生存曲线比较
Figure 4 Comparison of survival curves of combined detection of SII and FIB in predicting survival of patients, with death from diseases as an endpoint
2.5 NSCLC患者预后的Cox多因素回归分析 以NSCLC生存状态(存活=0;死亡=1)为因变量,分化程度(低分化=0;中高分化=1)、TNM分期(Ⅰ~Ⅱ期=0;Ⅲ~Ⅳ期=1)、KPS评分(≥90分=0;<90分=1)、体重减轻(无=0;有=1)、SII(≤743.384=0;>743.384=1)、FIB(≤3.070 g/L=0;>3.070 g/L=1)为自变量,纳入Cox多因素回归模型进行分析,结果显示,体重减轻、治疗前FIB是NSCLC预后的危险因素(P<0.05),见表3。
表3 Cox多因素回归分析
Table 3 Cox multivariate regression analysis
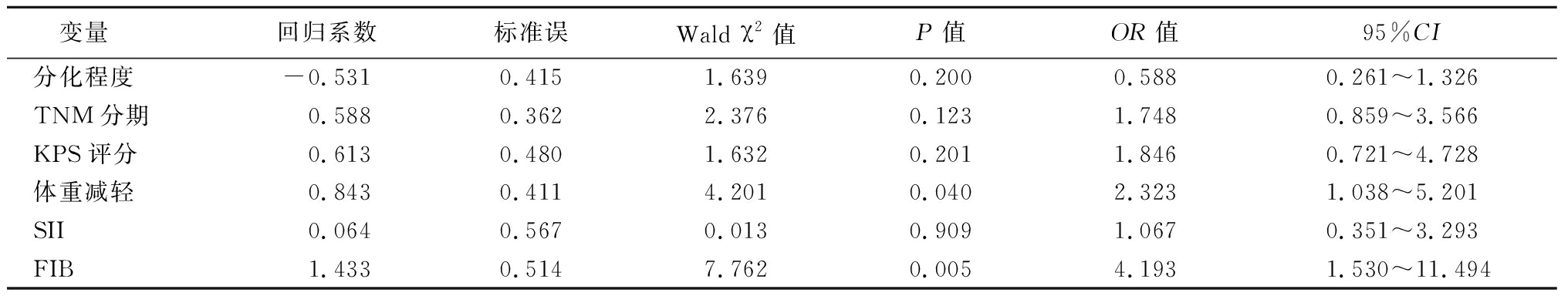
变量回归系数标准误Wald χ2值P值OR值95%CI分化程度-0.5310.4151.6390.2000.5880.261~1.326TNM分期0.5880.3622.3760.1231.7480.859~3.566KPS评分0.6130.4801.6320.2011.8460.721~4.728体重减轻0.8430.4114.2010.0402.3231.038~5.201SII0.0640.5670.0130.9091.0670.351~3.293FIB1.4330.5147.7620.0054.1931.530~11.494
2.6 SII与FIB相关性分析 Spearman相关分析结果提示,SII和FIB有微弱的正相关关系(rs=0.330,P=0.002)。
3 讨 论
近年来,随着对肿瘤认识的深入,认为肿瘤的发生发展及侵袭转移与肿瘤微环境密切相关。炎症是肿瘤微环境重要组成部分,全身炎症的血液学标志物应作为肿瘤反应的预测和预后因素进行研究。SII综合了血小板、中性粒细胞及淋巴细胞的指标,是一个更强的炎症相关的预后预测因子。而Berardi等[12]对311例接受一线化疗或者靶向治疗的局部晚期或转移性NSCLC患者的SII进行报道研究,通过设计2种不同的预后模型,显示出高SII水平与患者的低生存率有关。本研究通过K-M生存分析,发现低水平SII的NSCLC患者中位生存时间较长,不同SII水平患者肿瘤分化程度、TNM分期、KPS评分、体重减轻差异有统计学意义(P<0.05),但Cox多因素回归分析结果提示,SII不是NSCLC预后的危险因素,分析其可能是样本量小、数据差异等多方面原因造成的。本研究结果显示,SII的临界值为743.384。其他研究中SII临界值在250~1 000之间变化,每一种类型的肿瘤SII截断值没有一个标准,这可能影响了SII的临床适用性。SII的差异也反映了其在不同类型癌症中的作用。研究指出,SII的截断值可能与肿瘤转移有关[13]。目前,高SII导致肿瘤患者生存率降低的机制仍不可知。高SII可以认为高中性粒细胞、高血小板和低淋巴细胞,其中,中性粒细胞可以产生多种炎症细胞因子(肿瘤抑制素、白细胞介素6、和肿瘤坏死因子等),激活内皮细胞和实质细胞,促进肿瘤远处转移,中性粒细胞能释放活性氧及一氧化氮,抑制T细胞激活,从而帮助肿瘤细胞逃避免疫监视,促进肿瘤的侵袭、增殖能力。同时,循环血管内皮生长因子在粒细胞中,尤其是存在于中性粒细胞中,因此,中性粒细胞能促进血管生成[14]。血小板是促凝因子,可以同肿瘤细胞直接接触,释放血管内皮生长因子,促进肿瘤血管生成,影响肿瘤的生长及侵袭能力,血小板还通过调节免疫炎症因子保护肿瘤细胞免受免疫破坏,同时与中性粒细胞循环增加,促进肿瘤转移能力[15]。除此之外,血小板是循环中转化生长因子β的主要来源,以各种方式促进肿瘤的发生[16]。淋巴细胞在免疫系统中发挥重要作用。肿瘤浸润淋巴细胞与预后良好相关,而肿瘤浸润淋巴细胞与外周血循环中的淋巴细胞相关。一旦淋巴细胞减少,就会弱化免疫系统从而为癌细胞的扩散和转移创造了有利时机。总而言之,高SII可能与肿瘤血管生成、侵袭和转移有关。结果显示,治疗前高SII水平患者较低SII水平患者中位生存期减少了24个月。SII可以反映机体炎症与宿主免疫反应的关系,有助于临床治疗的疗效预测[17-18]。诊断时,高SII往往可以反映肿瘤患者的身体状况,对于肿瘤治疗方案的决策具有重要指导意义。因此,可以认为,SII是NSCLC患者诊断治疗及预后预测的有效指标。同样期待,未来在肿瘤治疗方面,抗炎治疗可以有助于改善患者生活质量,降低病死率。
恶性肿瘤与凝血系统的关系受到广泛关注,据报道,凝血和纤溶系统激活常常与肿瘤的转移、侵袭及预后不良有关[19]。FIB是一种由肝脏合成的,具有凝血功能的蛋白质,是血浆中含量最高的凝血因子。其相对分子质量约为340 000。FIB水平与肿瘤患者预后之间的确切关系目前尚不清楚。FIB是一种多功能蛋白,可以通过各种细胞因子(血管内皮生长因子、血小板衍生生长因子等)促进肿瘤的增殖及转移[20]。本研究结果显示,FIB的临界值为3.070 g/L,分成FIB>3.070 g/L组和FIB≤3.070 g/L组,FIB>3.070 g/L组总生存期明显短于FIB≤3.070 g/L组(P<0.01)。Cox多因素分析结果表明,治疗前FIB水平是NSCLC患者预后的危险因素(P<0.05)。肿瘤的转移及侵袭是一个复杂的过程。转移的癌细胞离开原发灶,在血流中迁移和循环,黏附在靶器官的血管上,侵入周围组织,并在新的转移部位建立血液供应。凝结的血浆和血小板通过血栓形成稳定在血液循环中的癌细胞,促进这些细胞在靶器官血液循环系统中的黏附和扩散[21]。FIB是血浆中重要的凝血因子和全身炎症标志物之一,通过多种可能的机制促进癌细胞的转移和侵袭能力。FIB沉积在癌细胞周围,形成支架,支持各种生长因子(成纤维细胞生长因子2和血管内皮生长因子)与肿瘤细胞结合,促进肿瘤细胞增殖及血管生成。此外,肿瘤细胞表面存在大量的FIB受体,FIB作为肿瘤细胞和宿主细胞的桥梁,帮助癌细胞栓在靶器官血管上黏附,导致转移[22]。另外,抗凝药物具有抗肿瘤作用[23]。马宇辰等[24]指出对于早期NSCLC手术患者术后适当给予抗血小板及降低FIB药物,有助于提高患者生存质量并延长生存期。本研究的结果也可以支持这一结论,或许抗FIB治疗可以成为一种新的辅助抗肿瘤的方式。
众所周知,炎症反应系统与凝血系统是肿瘤微环境的重要组成部分。本研究结果显示,治疗前FIB水平与SII具有微弱的正相关关系。Hong等[25]研究指出,FIB与系统炎症参数如C反应蛋白和改良的格拉斯哥预后评分具有明显正相关关系。而Wen等[19]也指出,血浆FIB是一种急性蛋白,在恶性肿瘤或全身炎症时水平升高。联合检测治疗前SII和FIB,两者均升高的NSLCL患者预后更差。因此,或许可以通过联合检测SII和FIB来提高预测NSCLC患者预后的准确性。
总之,SII是一种炎症指标,FIB是一种凝血因子,均可以作为肿瘤病情评估、预后监测的标志物应用于临床。同时,还可以对降低肿瘤患者的病死率及改善患者生存提供一定的临床价值。本研究的不足:本研究是一项回顾性研究,在数据选择和分析上容易产生偏差;本研究样本量小,仍需要大规模的前瞻性研究来证实研究结果。
[1] 孙可欣,郑荣寿,张思维,等.2015年中国分地区恶性肿瘤发病和死亡分析[J].中国肿瘤,2019,28(1):4-14.
[2] Deng M,Ma X,Liang X,et al. Are pretreatment neutrophil-lymphocyte ratio and platelet-lymphocyte ratio useful in predicting the outcomes of patients with small-cell lung cancer?[J]. Oncotarget,2017,8(23):37200-37207.
[3] Tanoglu A, Karagoz E, Yiyit N, et al. Is combination of neutrophil to lymphocyte ratio and platelet lymphocyte ratio a useful predictor of postoperative survival in patients with esophageal squamous cell carcinoma?[J]. Onco Targets Ther,2014,7:433-434.
[4] Chen K,Zhan M,Hu B,et al. Combination of the neutrophil to lymphocyte ratio and the platelet to lymphocyte ratio as a useful predictor for recurrence following radiofrequency ablation of hepatocellular carcinoma[J]. Oncol Lett,2018,15(1):315-323.
[5] Ishizuka M,Nagata H,Takagi K,et al. Combination of platelet count and neutrophil to lymphocyte ratio is a useful predictor of postoperative survival in patients with colorectal cancer[J]. Br J Cancer,2013,109(2):401-407.
[6] Wang C,Jin S,Xu S,et al. High systemic immune-inflammation index(SII) represents an unfavorable prognostic factor for small cell lung cancer treated with etoposide and platinum-based chemotherapy[J].Lung,2020,198(2):405-414.
[7] Murthy P,Zenati M,Al A,et al. Prognostic value of the systemic immune-inflammation index(SII) after neoadjuvant therapy for patients with resected pancreatic cancer[J]. Ann Surg Oncol,2020,27(3):898-906.
[8] Liu J,Shi Z,Bai Y,et al. Prognostic significance of systemic immune-inflammation index in triple-negative breast cancer[J]. Cancer Manag Res,2019,11:4471-4480.
[9] Ying Z,Longhui Z,Haoran Z,et al. Stroma-derived fibrinogen-like protein 2 activates cancer-associated fibroblasts to promote tumor growth in lung cancer[J]. Int J Biol Sci,2017,13(6):804-814.
[10] Xing L,Kunpeng S,Jun Z,et al. Preoperative plasma fibrinogen and D-dimer as prognostic biomarkers for non-muscle-invasive bladder cancer[J]. Clin Genitourin Cancer,2020,18(1):11-19.
[11] Yamamoto M,Kurokawa Y,Kobayashi N,et al. Prognostic value of the combined index of plasma fibrinogen and the neutrophil-lymphocyte ratio in gastric cancer[J]. World J Surg,2020,44(1):207-212.
[12] Berardi R,Santoni M,Rinaldi S,et al. Pre-treatment systemic immune-inflammation represents a prognostic factor in patients with advanced non-small cell lung cancer[J]. Ann Transl Med,2019,7(20):572.
[13] Wang D,Guo D,Shi F,et al. The predictive effect of the systemic immune-inflammation index for patients with small-cell lung cancer[J]. Future Oncol,2019,15(29):3367-3379.
[14] Wu L,Saxena S,Singh R,et al. Neutrophils in the tumor microenvironment[J]. Adv Exp Med Biol,2020,1224:1-20.
[15] Olsson AK,Cedervall J. The pro-inflammatory role of platelets in cancer[J]. Platelets,2018,29(6):569-573.
[16] Rachidi S,Metelli A,Riesenberg B,et al. Platelets subvert T cell immunity against cancer via GARP-TGFβ axis[J]. Sci Immunol,2017,2(11):eaai7911.
[17] 刘倩倩,杨卫华.系统免疫-炎性反应指数与小细胞肺癌脑转移患者预后的关系[J].肿瘤,2019,39(8):649-657.
[18] Lin Y,Liu Z,Qiu Y,et al. Clinical significance of plasma D-dimer and fibrinogen in digestive cancer:a systematic review and meta-analysis[J]. Eur J Surg Oncol,2018,44(10):1494-1503.
[19] Wen J,Yang Y,Ye F,et al.The preoperative plasma fibrinogen level is an independent prognostic factor for overall survival of breast cancer patients who underwent surgical treatment[J]. Breast,2015,24(6):745-750.
[20] 于秀艳,万广财,孙洪帅,等. 纤维蛋白原与乳腺癌患者预后关系的Meta分析[J].吉林大学学报(医学版),2019,45(5):1092-1097.
[21] Fahham D,Merquiol E,Gilon T,et al. Insoluble fibrinogen particles for harvesting and expanding attachment-dependent cells and for trapping suspended cancer cells in the presence of blood[J]. Biomed Mater,2015,10(2):25010.
[22] Schneider G,Bryndza E,Poniewierska-Baran A,et al. Evidence that vitronectin is a potent migration-enhancing factor for cancer cells chaperoned by fibrinogen:a novel view of the metastasis of cancer cells to low-fibrinogen lymphatics and body cavities[J]. Oncotarget,2016,7(43):69829-69843.
[23] Sheng L,Luo M,Sun X,et al. Serum fibrinogen is an independent prognostic factor in operable nonsmall cell lung cancer[J]. Int J Cancer,2013,133(11):2720-2725.
[24] 马宇辰,张华,张彬,等.术前血小板及血浆纤维蛋白原对早期非小细胞肺癌的预后价值[J].中国肿瘤临床,2018,45(5):222-227.
[25] Hong T,Shen D,Chen X,et al. Preoperative plasma fibrinogen,but not D-dimer might represent a prognostic factor in non-metastatic colorectal cancer:a prospective cohort study[J]. Cancer Biomark,2017,19(1):103-111.