特发性膜性肾病(idiopathic membranous nephropathy,IMN)是目前我国北方和东北地区成人原发性肾小球疾病(primary glomerular nephropathy, PGN)的第一大常见病理类型,2015年全国原发性肾小球肾炎患者中IMN占比:河北省最高(27.86%),是全国平均水平(7.2%)的近4倍[1]。蛋白尿持续不缓解是终末期肾病(end-stage renal disease,ESRD)唯一的独立危险因素[2],蛋白尿水平越高,预后越差[3]。蛋白尿持续存在或复发者肾预后差[4],降低蛋白尿可明显改善肾预后[5]。免疫抑制剂治疗IMN比非免疫抑制剂治疗可明显提高完全缓解(complete remission,CR)率和部分缓解(partial remission,PR)率,环孢素(cyclosporine A,CsA)耐受性好、缓解率高[6]。钙调磷酸酶抑制剂(CsA和他克莫司)诱导IMN缓解与环磷酰胺相似,但复发率较高。持续每日应用钙调磷酸酶抑制剂(calcineurin inhibitor,CNI)可维持IMN缓解,但长期治疗的结果未知[7]。近期文献报道他克莫司(tacrolimus,TAC)联合糖皮质激素(glucocorticoid,GC)3个月时缓解率明显高于环磷酰胺联合GC组,而且不良反应较少,认为TAC联合GC可能是IMN患者更好的选择[8]。那么,CsA或TAC治疗IMN患者,疗效和不良反应究竟有无差别?本研究随访观察了以肾病综合征为表现且应用CsA或TAC治疗的IMN患者139例,比较疗效、复发率和不良反应的差异,以期为临床选择治疗方案提供依据。
1 资料与方法
1.1 一般资料 选取2014年11月1日—2019年8月31日期间经住院肾活检和临床确诊IMN肾病综合征且需要应用激素和免疫抑制剂治疗的患者,符合入组条件者139例,其中CsA/GC组78例(男性患者49例),TAC/GC组61例(男性患者44例),随访中位时间(13.5 vs 16.0)个月,两组均以中青年男性为主。每1~3个月遵医嘱河北医科大学第二医院肾内科门诊专人规律随访,随访时间≥6个月。排除继发性膜性肾病:乙型或丙型病毒相关性肾炎、Ⅴ型狼疮性肾炎、类风湿性关节炎、自身免疫性甲状腺疾病、干燥综合征等系统性疾病;感染后肾炎;药物(青霉胺、金制剂、卡托普利、氯吡格雷及非甾体类抗炎药等)或汞中毒;恶性肿瘤;肾衰竭、血栓或栓塞、妊娠或备孕或不能规律随访者。
本研究经医院伦理委员会审核通过,患者知情同意并签署知情同意书。
1.2 方法
1.2.1 资料的收集 收集患者住院肾活检的相关临床和肾病理资料,以及每次门诊随访资料:性别、年龄、身高、体重、24 h尿蛋白定量(24 hour urinary protein,24 hUP)、血白蛋白(serum albumin, sALB)、血肌酐(serum creatinine,SCr)、血尿酸(serum uric acid,UA)、总胆固醇(total cholesterol,TC)等。以患者开始接受CsA或TAC治疗为基线值[无糖代谢异常病史的患者,检测餐后2 h血糖或75 g葡萄糖耐量试验(oral glucose tolerance test ,OGTT)],收集患者基线、治疗后3、6、9、12个月及随访结束时临床症状、体征及24 hUP、sALB、SCr、TC及血CsA、TAC浓度和抗磷脂酶A2受体抗体(抗PLA2R-Ab)等资料。比较两组随访期间缓解率、累计复发率和不良反应发生情况。
1.2.2 治疗方案 根据患者具体情况和意愿,CsA/GC组按照既往的治疗方案[9]。TAC(0.05~0.01 mg·kg-1·d-1)[10]联合泼尼松(0.15~0.4 mg·kg-1·d-1)。治疗半个月后测血TAC浓度,调整用量直至血药浓度达标(目标值:5~10 μg/L)。用法:TAC早10点、晚10点服药。PR后,泼尼松每隔4~8周(起始量小者减量间隔时间长)减量5 mg直至停用。TAC剂量调整:CR后每3~6个月减少的20%~25%,直至停药;若减量过程中蛋白尿增多则恢复至减量前剂量;需较大剂量(CsA≥100 mg/d 、TAC≥2 mg/d)维持缓解或SCr升高者,根据患者病情和意愿减少CsA或TAC用量的同时加用其他免疫抑制剂;若患者无原因(如:应用肾损伤的药物,血栓、栓塞,血压急剧波动,感染等因素)可以解释的SCr较基线增加30%,减少CsA或TAC剂量25%,同时加用其他免疫抑制剂;如果SCr持续不降,则停用。所有患者随访期间血压控制在130/80 mmHg(1 mmHg=0.133 kPa)以下,血压不达标者:依次选用肾素-血管紧张素系统阻滞剂(如果SCr升高则减少用量)、钙离子拮抗剂、利尿剂及β受体阻滞剂;均接受包括低盐低脂饮食、戒烟、降脂、抗凝、RASI及对症治疗。
1.3 疗效标准 ①CR:24 hUP<0.3 g,ALB>35 g/L,肾功能正常,尿蛋白定性阴性;②PR:0.3 g<24 hUP<3.5 g;或24 hUP比基线水平下降50%且肾功能稳定,ALB>30 g/L,肾功能稳定;③NR:当CsA或TAC血药浓度在靶目标值持续半年以上,24 hUP持续>3.5 g,且下降幅度小于基线水平的50%。④复发(relapse):经治疗缓解后患者重新出现24 hUP>3.5 g[11]。⑤TR=CR+PR。NR者随访结束时化验值为停用环孢素时的化验指标,随访期间按NR计算。
1.4 不良反应 ①肾损害:无原因可以解释的SCr升高30%[12],轻度、中度和重度(SCr升高130%~149%、150%~199%和SCr翻倍),且SCr高于正常值上限。②肝功能异常:丙氨酸转氨酶(alanine aminotransferase,ALT)或天冬氨酸转氨酶(aspartate transaminase,AST)超过正常值上限2.0倍;③用药期间任何疾病本身以外的症状、体征和化验检查异常,主要包括肾损害、感染、新发糖尿病、新发高血压、肝功能异常、多毛、齿龈增生、胃肠道反应等。
1.5 统计学方法 应用SPSS 13.0软件处理数据。计量资料组间比较采用独立样本的t检验或秩和检验。计数资料比较采用χ2检验或Fisher精确概率检验。P<0.05为差异有统计学意义。
2 结 果
2.1 患者治疗情况 两组CsA每日最大剂量:2.78 mg·kg-1·d-1,TAC用量:0.05 mg·kg-1·d-1;CsA/GC组泼尼松每日最大用量高于TAC/GC组[(0.29 vs 0.22)mg·kg-1·d-1, P<0.05]。需要较大剂量CNI维持缓解的患者比:CsA组38.5%明显高于TAC组21.3%(P=0.030);需维持缓解剂量:CsA 0.22 mg·kg-1·d-1、TAC 0.04 mg·kg-1·d-1,为维持缓解两组均有1/3的患者加用其他免疫抑制剂;两组分别随访13.5和16个月(均P>0.05)。失访率:CsA/GC组2例(2.6%,分别于随访9和12个月时部分缓解和完全缓解后)失访;TAC/GC组没有失访患者。随访结束时两组抗PLA2R-Ab阳性率均明显下降(CsA/GC组检测67例,其中20.9%阳性;TAC/GC组检测 49例,24.5%阳性,P>0.05);治疗后血PLA2R-Ab滴度和阳性率均明显降低(均P<0.05)。见表1。
表1 患者激素、免疫抑制剂用量及随访时间的比较
Table 1 Comparison of patients hormone and immunosuppressant dosage and follow-up time
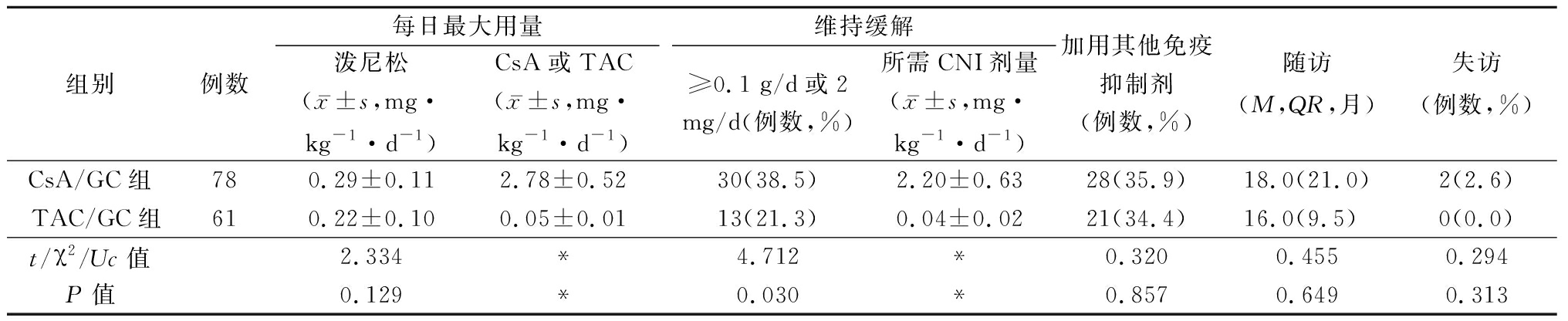
组别例数每日最大用量泼尼松(x-±s,mg·kg-1·d-1)CsA或TAC(x-±s,mg·kg-1·d-1)维持缓解≥0.1 g/d或2 mg/d(例数,%)所需CNI剂量(x-±s,mg·kg-1·d-1)加用其他免疫抑制剂(例数,%)随访(M,QR,月)失访(例数,%)CsA/GC组780.29±0.112.78±0.5230(38.5)2.20±0.6328(35.9)18.0(21.0)2(2.6)TAC/GC组610.22±0.100.05±0.0113(21.3)0.04±0.0221(34.4)16.0(9.5)0(0.0)t/χ2/Uc值2.334*4.712*0.3200.4550.294P值0.129*0.030*0.8570.6490.313
*CsA和TAC因为药物本身剂型不同,所以在药品总用量上无法相互比较
2.2 疗效 ①两组分别应用CNI治疗(13.5 vs 15.0)个月,CsA/GC组治疗时间和随访时间相等,而TAC/GC组治疗时间短于随访时间,因随访结束时2例CR后已停用TAC。CR及其所需时间、TR、复发率及CNI减量至复发时间的差异无统计学意义(P均>0.05)。CsA/GC组达PR所需时间长于TAC/GC组(分别8.5 vs 6个月,P=0.014)。②既往泼尼松联合环磷酰胺治疗无效的患者应用CsA/GC或TAC/GC治疗后CR、总有效率差异无统计学意义(50%和71.4% vs 33%和66.7%,P=0.642和1.000)。 ③随访结束时2组总缓解率差异无统计学意义(89.7% vs 85.4%,P=0.422)。见表2。
表2 随访结束时缓解率、达缓解所需时间及复发情况
Table 2 Remission rate, time to remission and recurrence at the end of follow-up
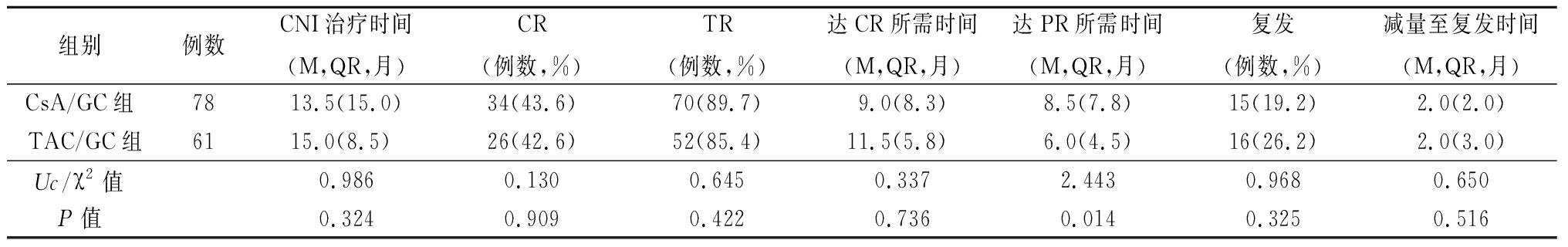
组别例数CNI治疗时间(M,QR,月)CR(例数,%)TR(例数,%)达CR所需时间(M,QR,月)达PR所需时间(M,QR,月)复发(例数,%)减量至复发时间(M,QR,月)CsA/GC组7813.5(15.0)34(43.6)70(89.7)9.0(8.3)8.5(7.8)15(19.2)2.0(2.0)TAC/GC组6115.0(8.5)26(42.6)52(85.4)11.5(5.8)6.0(4.5)16(26.2)2.0(3.0)Uc/χ2值0.9860.1300.6450.3372.4430.9680.650P值0.3240.9090.4220.7360.0140.3250.516
2.3 不良反应 CsA/GC组总体肾损害发生率、不同肾损害程度发生率及SCr翻倍发生率的差异均无统计学意义(P=0.890、0.340和0.140)。需住院治疗的感染共8例,两组间差异无统计学意义(P=0.466)。血栓、药物性糖尿病及肝酶升高两组间的差异无统计学意义(P=0.466)。但是牙龈增生的不良反应仅见于CsA组,TAC组无该不良反应(P<0.05)。见表3。
表3 两组随访期间不良反应
Table 3 Adverse reactions during follow-up of the two groups (例数,%)
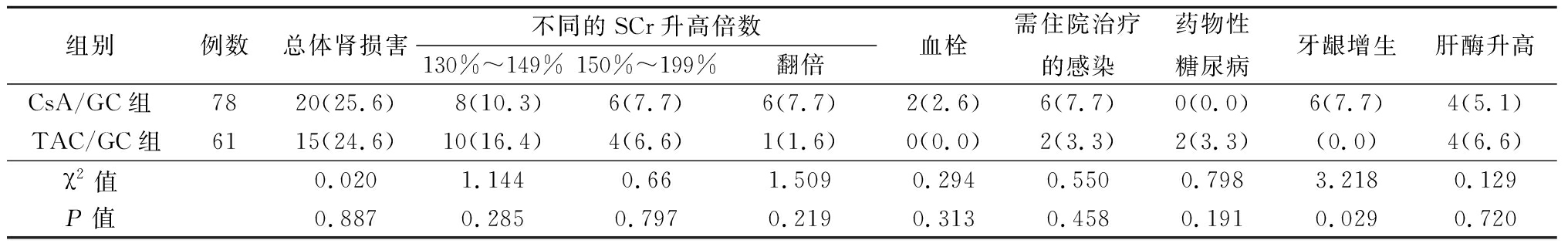
组别例数总体肾损害不同的SCr升高倍数130%~149%150%~199%翻倍血栓需住院治疗的感染药物性糖尿病牙龈增生肝酶升高CsA/GC组7820(25.6)8(10.3)6(7.7)6(7.7)2(2.6)6(7.7)0(0.0)6(7.7)4(5.1)TAC/GC组6115(24.6)10(16.4)4(6.6)1(1.6)0(0.0)2(3.3)2(3.3)(0.0)4(6.6)χ2值0.0201.1440.661.5090.2940.5500.7983.2180.129P值0.8870.2850.7970.2190.3130.4580.1910.0290.720
3 讨 论
两组患者以中青年为主,尿蛋白均值>8 g/24 h,血白蛋白<25 g/L伴高脂血症,应用CsA和TAC前平均病程(16和18)个月;41.0%和36.1%的患者伴高血压,24例糖代谢异常患者中10例(41.7%)有已知病史,住院期间OGTT试验新发现了另外59.3%糖代谢异常(4例DM和10例IGR)患者,证实既往的研究单纯检测FPG将漏诊2/3的糖代谢异常[13],故应用激素和(或)CNI的患者应该查基线OGTT,以确定患者是否存在糖代谢异常,避免漏诊。
CsA/GC组治疗13.5个月后总缓解率87.9%,且既往应用激素联合环磷酰胺治疗无效的复治患者,换用CsA联合激素治疗总缓解率71.4%,优于文献报道[14]的52%的缓解率(单用CsA治疗12个月),与既往文献[9]中剂量激素联合CsA治疗6个月时87.5%相似。CsA治疗减量后复发率19.2%,低于文献报道[14]的32%(CsA治疗12个月停药后1年内的复发率),高于另一文献报道[15] 的6%[缓解后CsA长期小剂量(0.35~0.70 mg·kg-1·d-1)维持5.5年的复发率]。TAC/GC组治疗15个月后总缓解率85.4%,优于文献报道[16]的63%[TAC(0.03~0.06 mg·kg-1·d-1)联合泼尼松0.5 mg·kg-1·d-1 12个月的总缓解率];与文献他克莫司(0.1 mg·kg-1·d-1)联合泼尼松(0.5 mg·kg-1·d-1)12个月治疗,缓解率72.4%[17]相似;TAC治疗既往应用激素联合环磷酰胺治疗无效的复治患者6例中4例缓解,总缓解率66.7%,与55例初治患者48例缓解(87.3%)差异无统计学意义(P=0.177)。治疗减量后复发率26.2%,与文献[17] 的21.1%相似(TAC联合激素治疗缓解后12个月复发率)。本文患者复发均发生于CNI减量后中位2个月,因此,有些患者需长期较大剂量应用CNI以维持疗效,以致患者需长期暴露于较高剂量用药和较多药物不良反应、医疗资源和心理负担沉重的状态。TAC/GC组需较大剂量维持缓解患者的比例明显低于CsA/GC组(21.3% vs 38.5%,P=0.030);提示TAC/GC组患者维持治疗期可能会更短(不必长时间较大剂量维持缓解)。两组完全缓解和部分缓解率相似(43.6%和89.7% vs 42.6%和85.4%,均P>0.05)。两组达完全缓解所需中位时间相似(9.0 vs 11.7)个月;而达部分缓解所需时间TAC/GC组短于CsA/GC组(6.0 vs 8.5)个月,P=0.014);提示TAC/GC起效更快。CsA/GC组CsA平均每日剂量(2.78±0.52)mg·kg-1·d-1,低于指南推荐(3.5~5.0)mg·kg-1·d-1;TAC平均每日剂量(0.05±0.01)mg·kg-1·d-1是指南推荐有效剂量的低值(0.05~0.075)mg·kg-1·d-1[18];再则,有些药物影响CNI代谢,比如五酯软胶囊[0.5 g,3次/d,可以升高TAC血谷浓度(3.051±0.774) ng/mL][19],说明及时监测CNI血药浓度并根据靶目标值随时调整药物剂量非常重要,以避免浪费医疗资源,并减少患者由于高血药浓度所致的高不良反应。
CNI治疗IMN,肾损害是其主要不良反应之一,甚至有患者停药后肾功能仍不能完全恢复;以至于“环孢素 A 治疗肾小球疾病的应用共识”强调:使用CsA时,若SCr较基础值升高30%,则应考虑减量(每次调整0.5~1.0 mg·kg-1·d-1) [12]。本研究CsA/GC组和TAC/GC组患者治疗13.5和15.0个月时,两组肾损害总体发生率相似25.6% vs 24.9%,与文献报道26%肾损害[14]相当。本文不同程度肾损害(轻度、中度)的发生率和SCr翻倍组间差异无统计学意义。虽然,TAC治疗肾-胰联合移植患者示,早期免疫介导的肾小管损伤少;移植后第1年急性轻度肾内小动脉病变、条纹状间质纤维化、肾小球充血和肾小管微钙化的发生率低,但慢性肾内小动脉毒性TAC和CsA相当[20];然而,本文TAC组肾损害并不低于CsA,或许与随访时间短、样本量小有关。CsA组肾活检组织中废弃肾小球占肾活检肾小球的比例明显低于TAC组(12.5% vs 14.5%,P<0.05);但主要影响肾脏预后的新月体形成、肾小管间质病变、伴FSGS样病变和肾内小动脉病变[21]两组相似。
合并需要住院治疗的感染与肝酶升高患者两组间相似。应用TAC/GC组2例(3.3%)出现药物性糖尿病,与文献TAC/GC治疗致新发糖调节异常2.2%相当[22]。用药过程中密切监测患者餐后、尤其是中、晚餐后2 h血糖(基线糖代谢正常者,激素所致的糖代谢异常,首先是中、晚餐后2 h血糖),注意夜间低血糖,以便及时发现和处理治疗药物所致的糖代谢异常。尤其是肥胖者应控制主食量、适当运动、指导患者减重。
本研究通过回顾性队列研究显示:低剂量环孢素或他克莫司联合糖皮质激素治疗IMN患者有效,两组完全缓解和总缓解率方面、复发率及不良事件发生率差异无统计学意义。与环孢素组相比,他克莫司达到部分缓解较快、需要应用较大剂量维持缓解的患者比例明显低,没有牙龈增生,但对糖代谢的影响应该引起临床关注,也必须注意及时诊断和治疗其他药物相关的不良反应。
[1] Li J,Cui Z,Long J,et al. Primary glomerular nephropathy among hospitalized patients in a national database in China[J]. Nephrol Dial Transplant,2018,33(12):2173-2181.
[2] Wang HY,Cui Z,Xie LJ,et al. HLA Class Ⅱ alleles differing by a single amino acid associate with clinical phenotype and outcome in patients with primary membranous nephropathy[J]. Kidney Int,2018,94(5):974-982.
[3] Chen X,Chen Y,Ding X,et al. Baseline proteinuria level is associated with prognosis in idiopathic membranous nephropathy[J]. Ren Fail,2019,41(1):363-369.
[4] Huh H,Lee H,Lee JP,et al. Factors affecting the long-term outcomes of idiopathic membranous nephropathy[J].BMC Nephrol,2017,18(1):104.
[5] Yamaguchi M,Ando M,Katsuno T,et al. Urinary protein and renal prognosis in idiopathic membranous nephropathy:a multicenter retrospective cohort study in Japan[J]. Ren Fail,2018,40(1):435-441.
[6] Ren S,Wang Y,Xian L,et al.Comparative effectiveness and tolerance of immunosuppressive treatments for idiopathic membranous nephropathy:a network meta-analysis[J].PLoS One,2017,12(9):e0184398.
[7] Floege J,Barbour SJ,Cattran DC,et al. Management and treatment of glomerular diseases(part 1):conclusions from a kidney disease:improving global outcomes(KDIGO) controversies conference[J].Kidney Int,2019,95(2):268-280.
[8] Zou H,Jiang F,Xu G.Effectiveness and safety of cyclophosphamide or tacrolimus therapy for idiopathic membranous nephropathy[J]. Ren Fail,2019,41(1):673-681.
[9] 刘芳,付淑丽,张春霞,等.不同剂量激素联合环孢素治疗特发性膜性肾病的临床研究[J].中华肾脏病杂志,2016,32(12):905-912.
[10] Liang Q,Li H,Xie X,et al. The efficacy and safety of tacrolimus monotherapy in adult-onset nephrotic syndrome caused by idiopathic membranous nephropathy[J]. Ren Fail,2017,39(1):512-518.
[11] 中国成人肾病综合征免疫抑制治疗专家组.中国成人肾病综合征免疫抑制治疗专家共识[J]. 中华肾脏病杂志,2014,30(6):467-474.
[12] 《环孢素 A 在肾内科的应用》专家协作组.环孢素 A 治疗肾小球疾病的应用共识[J]. 中华肾脏病杂志,2005,21(9):556-557.
[13] 李芸,傅淑霞,段建召,等.肾小球疾病患者糖代谢改变相关因素探讨[J]. 中国糖尿病杂志,2011,19(12):920-923.
[14] Fervenza FC,Appel GB,Barbour SJ,et al. Rituximab or cyclosporine in the treatment of membranous nephropathy[J]. N Engl J Med,2019,381(1):36-46.
[15] Hassan K,Kristal B. Improving long-term outcomes in idiopathic membranous nephropathy using a distinctivecy closporine regimen[J]. Minerva Urol Nefrol,2016,68(3):293-301.
[16] Qin HZ,Liu L,Liang SS,et al. Evaluating tacrolimus treatment in idiopathic membranous nephropathy in a cohort of 408 patients[J]. BMC Nephrology,2017,18(1):2.
[17] Di J,Qian Q,Yang M. Effcacy and safety of long course tacrolimus treatment for idiopathic membranous nephropathy[J]. Exp Ther Med,2018,16(2):979-984.
[18] Kidney Disease:Improving Global Outcomes(KDIGO) Glomerulo nephritis Work Group.KDGIO clinical practice guideline for glomerulonephritis[J]. Kidney Int Suppl,2012,2:139-274.
[19] Zhang Z,Lu X,Dong L,et al. Clinical observation on the effect of Wuzhi soft capsule on FK506 concentration in membranous nephropathy patients[J]. Medicine (Baltimore),2019,98(48):e18150.
[20] Nankivell BJ,P′Ng CH,O′Connell PJ,et al. Calcineurin inhibitor nephrotoxicity through the lens of longitudinal histology:comparison of cyclosporine and tacrolimus eras[J].Transplantation,2016,100(8):1723-1731.
[21] He HG,Wu CQ,Ye K,et al. Focal segmental glomerulosclerosis,excluding atypical lesion,is a predictor of renal outcome in patients with membranous nephropathy:a retrospective analysis of 716 cases[J]. BMC Nephrol,2019,20(1):328-337.
[22] Zhang XJ,Ji CF,Yuan JZ,et al. Efficacy and safety of tacrolimus-based treatment for nephrotic idiopathic membranous nephropathy in young adults:A retrospective study[J]. Kaohsiung J Med Sci,2019,35(10):633-639.