肺结核是严重危害人类健康的慢性呼吸道传染病,因传播途径易于实现,目前已成为影响人类健康的全球性公共卫生问题[1]。我国是肺结核高发国家,防控形势十分严峻[2]。近年随抗结核药物的广泛使用,结核病蔓延趋势得到一定控制,但在抗结核治疗过程中,因抗结核药物品种多及用药时间长等特点,患者可能会出现各种不同程度的药物不良反应,严重者可危及生命。国内报道显示,约20%的肺结核患者因抗结核治疗不良反应而停药或改变最佳治疗方案,少部分患者因药物不良反应引起组织器官功能损害甚至死亡[3]。而抗结核治疗不良反应会直接影响肺结核患者治疗依从性,还可导致中断治疗、复发及产生耐药,并增加家庭及社会的经济负担。本研究回顾性分析我院确诊并完成规范化治疗的初治涂阳肺结核患者280例的资料,旨在探讨抗结核治疗不良反应的发生现状及其相关影响因素,以期及早发现并给予针对性干预措施,提高患者治疗依从性,减少不良反应发生。报告如下。
1 资料与方法
1.1 一般资料 选取2017年2月—2019年1月于我院确诊并完成规范化治疗的初治涂阳肺结核患者280例,所有患者完成规范化治疗后随访至今均无复发。
1.2 纳入标准和排除标准 纳入标准:①符合肺结核诊断标准[4],且痰涂片检查阳性;②使用标准化疗方案治疗的初治患者;③肝肾功能正常;④未伴糖尿病、心脏病、高血压病、高脂血症者;⑤无免疫抑制剂应用史者;⑥无精神疾病史者;⑦具有咳嗽、低热、盗汗、乏力等典型症状者;⑧临床资料完整者。排除标准:①哺乳期和妊娠期妇女;②心、肝、肾功能不全者;③伴严重胃肠疾病者;④有精神疾病史者;⑤聋哑和智力障碍者;⑥有放化疗禁忌证者;⑦患严重心脏病、肝肾疾病、代谢功能紊乱者;⑧有抗高血压药、降糖药、抗高脂血症药物、免疫功能抑制剂应用史者;⑨临床资料欠缺者。
1.3 治疗方法 据“中国结核病防治规划实施工作指南(2008年版)”[5],280例患者均给予2HRZE(异烟肼、利福平、吡嗪酰胺、乙胺丁醇)/4HR(异烟肼、利福平)方案治疗。强化期给予异烟肼300 mg、利福平600 mg,吡嗪酰胺1 500 mg,乙胺丁醇750 mg,每天早晨顿服,为期2个月;继续期给予异烟肼300 mg、利福平600 mg顿服,1次/d,为期4个月。异烟肼购自上海新亚药业有限公司(国药准字:H31020343);利福平购自开封制药(集团)有限公司(国药准字:H41021799);吡嗪酰胺购自江苏四环生物制药有限公司(国药准字:H32024174);乙胺丁醇购自东北制药集团股份有限公司(国药准字:H21020434)。
1.4 研究方法 回顾性分析280例的详细病案及随访资料,统计抗结核治疗不良反应发生情况,包括发生率、发生时间、类型等。然后根据有无抗结核药物不良反应发生将280例患者分为不良反应组和非不良反应组,比较2组性别、年龄、体重指数、职业、既往病史等一般资料,寻找初治涂阳肺结核患者抗结核治疗不良反应发生的影响因素。
1.5 抗结核治疗不良反应判定标准 据《药品不良反应报告和监测工作手册》,药物不良反应指合格药物在正常用法用量下出现的与用药目的无关的有害反应,判断标准:①用药与异常表现发生有无合理时间关系;②停药或减量后异常表现是否减轻或消失;③再次用可疑药物是否出现同样异常表现;④异常表现能否用联合用药、结核病进展及其他原因解释。并分为肯定、很可能、可能、可能无关等关联性评价,其中将肯定和很可能判定为抗结核治疗不良反应[6]。
1.6 统计学方法 应用SPSS 19.0统计软件处理数据。计数资料比较采用χ2检验;采用多因素Logistic回归分析寻找初治涂阳肺结核患者抗结核治疗不良反应发生的影响因素。P<0.05为差异有统计学意义。
2 结 果
2.1 抗结核治疗不良反应
2.1.1 不良反应发生情况 280例患者共发生抗结核治疗不良反应67例(不良反应组),未发生213例(非不良反应组),抗结核治疗不良反应发生率为23.93%。其中出现1种不良反应者60例(89.55%),出现2种及其以上者7例(10.45%),出现的抗结核治疗不良反应以单一症状不良反应为主。
2.1.2 不良反应发生时间及类型 抗结核治疗不良反应52例(77.61%)出现在强化期内(1~8周),仅15例(22.39%)出现在继续期内(8周后),抗结核治疗不良反应以强化期发生率为高。67例不良反应类型中以骨关节损害、肝功能损害、血液系统异常及胃肠道反应为主,发生率为31.34%、29.85%、29.85%、28.36%。见表1。
表1 67例初治涂阳肺结核患者抗结核治疗
不良反应发生情况
Table 1 Incidence of adverse reactions of anti-tuberculosis
treatment in 67 patients with newly-treated
smear-positive pulmonary tuberculosis
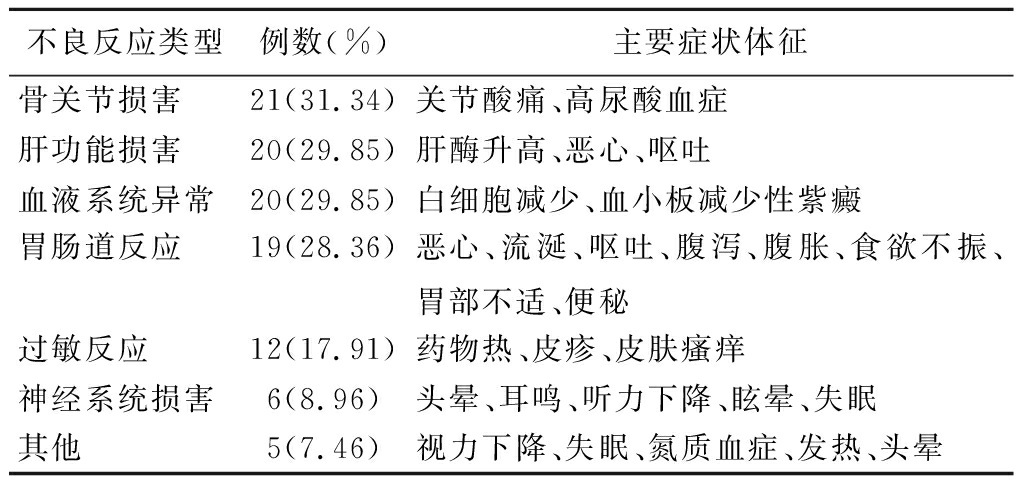
不良反应类型例数(%)主要症状体征骨关节损害21(31.34)关节酸痛、高尿酸血症肝功能损害20(29.85)肝酶升高、恶心、呕吐血液系统异常20(29.85)白细胞减少、血小板减少性紫癜胃肠道反应19(28.36)恶心、流涎、呕吐、腹泻、腹胀、食欲不振、胃部不适、便秘过敏反应12(17.91)药物热、皮疹、皮肤瘙痒神经系统损害6(8.96)头晕、耳鸣、听力下降、眩晕、失眠其他5(7.46)视力下降、失眠、氮质血症、发热、头晕
2.1.3 不良反应处置 仅1例肝功能损害者给予积极护肝降酶治疗未见好转,暂停抗结核治疗,待肝功能恢复正常后再继续抗结核治疗;余患者经对症治疗均坚持服药至疗程结束。
2.2 抗结核药物不良反应发生影响因素
2.2.1 2组观察指标比较 2组年龄、体重指数、吸烟史、饮酒史、肝病史差异有统计学意义(P<0.05,P<0.01);2组性别、户籍、职业、文化程度、婚姻状况、月家庭总收入差异无统计学意义(P>0.05)。见表2。
表2 2组观察指标比较
Table 2 Comparison of observation indexes between two groups (例数,%)
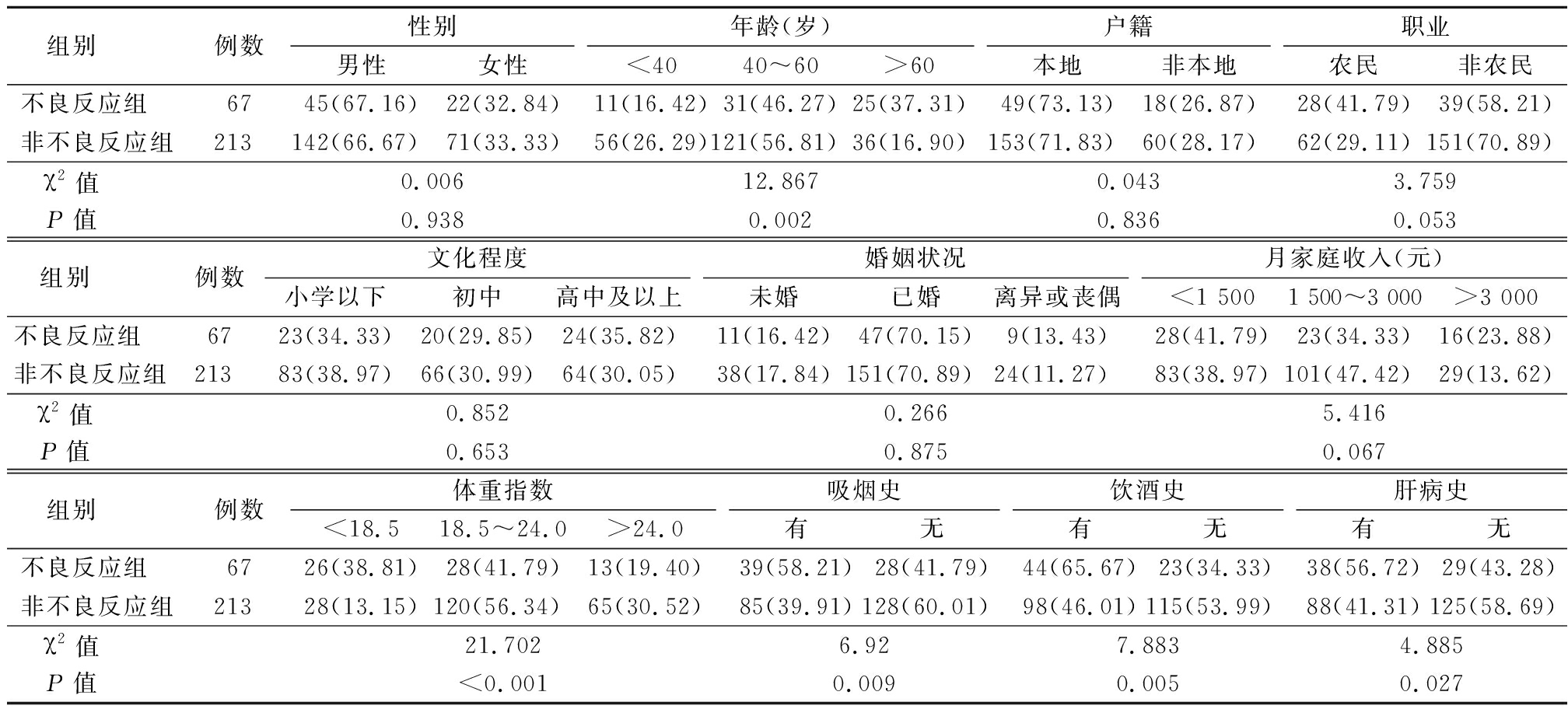
组别 例数性别男性女性年龄(岁)<4040~60>60户籍本地非本地职业农民非农民不良反应组 6745(67.16)22(32.84)11(16.42)31(46.27)25(37.31)49(73.13)18(26.87)28(41.79)39(58.21)非不良反应组213142(66.67)71(33.33)56(26.29)121(56.81)36(16.90)153(71.83)60(28.17)62(29.11)151(70.89)χ2值 0.00612.8670.0433.759P值 0.9380.0020.8360.053组别 例数文化程度小学以下初中高中及以上婚姻状况未婚已婚离异或丧偶月家庭收入(元)<1 5001 500~3 000>3 000不良反应组 6723(34.33)20(29.85)24(35.82)11(16.42)47(70.15)9(13.43)28(41.79)23(34.33)16(23.88)非不良反应组21383(38.97)66(30.99)64(30.05)38(17.84)151(70.89)24(11.27)83(38.97)101(47.42)29(13.62)χ2值 0.8520.2665.416P值 0.6530.8750.067组别 例数体重指数<18.518.5~24.0>24.0吸烟史有无饮酒史有无肝病史有无不良反应组 6726(38.81)28(41.79)13(19.40)39(58.21)28(41.79)44(65.67)23(34.33)38(56.72)29(43.28)非不良反应组21328(13.15)120(56.34)65(30.52)85(39.91)128(60.01)98(46.01)115(53.99)88(41.31)125(58.69)χ2值 21.7026.927.8834.885P值 <0.0010.0090.0050.027
2.2.2 多因素Logistic回归分析 以初治涂阳肺结核患者抗结核治疗不良反应发生情况(有=1,无=0)以因变量,以年龄(>60岁=1,≤60岁=0)、体重指数(<18.5=1,≥18.5=0)、吸烟史(有=1,无=0)、饮酒史(有=1,无=0)、肝病史(有=1,无=0)为自变量,进行多因素Logistic回归分析,结果显示,年龄>60岁、体重指数<18.5、吸烟史、饮酒史、肝病史是初治涂阳肺结核患者抗结核治疗不良反应发生的危险因素(P<0.05)。见表3。
表3 初治涂阳肺结核患者抗结核治疗不良反应发生多因素Logistic回归分析
Table 3 Multivariate Logistic regression analysis of adverse reactions of anti-tuberculosis treatment in patients with
newly-treated smear-positive pulmonary tuberculosis
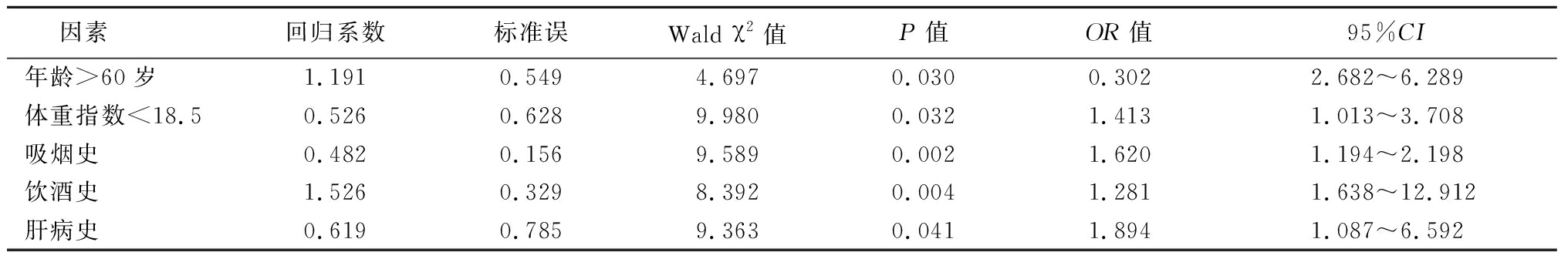
因素 回归系数标准误Wald χ2值P值OR值95%CI年龄>60岁1.1910.5494.6970.0300.3022.682~6.289体重指数<18.5 0.5260.6289.9800.0321.4131.013~3.708吸烟史0.4820.1569.5890.0021.6201.194~2.198饮酒史1.5260.3298.3920.0041.2811.638~12.912肝病史0.6190.7859.3630.0411.8941.087~6.592
3 讨 论
我国是全球22个结核病流行较严重国家之一,其中肺结核因感染率及病死率高、发现率及转诊率低的特点,成为严重社会公共卫生问题[7]。肺结核治疗原则为早期、联合、规律适量、全程,这就要求初治涂阳肺结核患者需规律联合抗结核治疗至少半年,本研究纳入患者根据“中国结核病防治规划实施工作指南(2008年版)”要求,采用2HRZE4HR方案治疗,所有患者完成规范化治疗后随访至今均无复发。但在患者治疗过程中可能出现各种不同程度的药物不良反应,不仅影响治疗依从性,甚至中断治疗,影响治疗效果。本研究选取确诊并完成规范化治疗的初治涂阳肺结核患者为研究对象,分析抗结核治疗不良反应的发生情况,并分析其发生的相关影响因素,以利于早期准确判定抗结核治疗不良反应并及时合理处理,提高治疗依从性,减少抗结核治疗中断率、提高治愈率。
3.1 抗结核治疗不良反应分析 罗汉杰[8]对接受抗结核治疗的初治涂阳肺结核患者监测显示,抗结核治疗不良反应发生率为33.47%。Singh等[9]报道204例正接受抗结核治疗的肺结核患者,结果发现抗结核治疗不良反应发生率为45.1%。本研究结果显示,抗结核治疗不良反应发生率为23.93%(67/280),说明在初治涂阳肺结核患者抗结核治疗过程中出现治疗相关不良反应较普遍,临床需加以重视,不良反应发生率较上述文献报道结果稍高,可能原因与药物不良反应判定标准、纳入病例数较少且范围单一、化疗方案、观察方法等有关。
本研究结果显示,抗结核治疗不良反应52例(77.61%)出现在强化期内(1~8周),仅15例(22.39%)出现在继续期内(8周后),提示抗结核治疗不良反应以强化期发生率为高,临床应对强化期内患者加强抗结核治疗不良反应观察和监测。67例发生抗结核治疗不良反应者以骨关节损害、肝功能损害、血液系统异常及胃肠道反应为主,发生率分别为31.34%、29.85%、29.85%、28.36%;且仅出现1种不良反应者60例(89.55%),出现2种及以上者7例(10.45%),提示出现的抗结核治疗不良反应以单一症状不良反应为主,与郑智清等[10]研究报道相符。
3.2 影响因素分析 复习文献发现,抗结核治疗不良反应发生与性别、年龄、营养状态、肝病史、嗜酒、糖尿病等有关[11-12],但报道结论不一。本研究多因素Logistic回归分析结果显示,年龄>60岁、体重指数<18.5、饮酒史、吸烟史、肝病史是其抗结核治疗不良反应发生的危险因素(P<0.05)。
3.2.1 年龄与不良反应 有学者研究显示,老年肺结核患者抗结核治疗不良反应发生率为62%,显著高于青壮年肺结核患者的抗结核治疗不良反应发生率[13]。分析原因为老年肺结核患者新陈代谢减慢,器官功能减退,机体抵抗力差、营养吸收不良,体内蛋白合成与分解明显差于青壮年患者,且老年患者血液蛋白含量降低,抗结核药物代谢能力低,因此抗结核治疗不良反应出现率升高。故对于老年初治涂阳肺结核患者要合理选择治疗方案,必要时个体化选择抗结核药物种类及剂量,尽可能降低抗结核治疗不良反应发生率,提高治疗依从性及患者治愈率。
3.2.2 饮酒史与不良反应 廖斌等[14]研究指出,饮酒特别是长期饮酒会一定程度影响机体肝脏,发生一些适应性反应。酒精能促使微粒体酶P450分泌,其与药物代谢相关,可增加毒性中间代谢产物形成。而抗结核药物也可影响肝脏,H、R在肝内代谢需乙酰化转移酶形成酰胺化合物,使肝毒性增强。R为肝微粒体酶诱导剂,可促使H代谢加快,毒性增强[15]。故长期饮酒的肺结核患者应用抗结核药物时会加重肝脏负担,使得治疗相关不良反应尤其是肝功能损害发生率升高。本研究67例抗结核治疗不良反应中肝功能损害发生率为29.85%,排名第二;且有饮酒史者抗结核治疗不良反应发生率高于无饮酒史者,多因素Logistic回归分析显示,饮酒史是其发生危险因素(P<0.01)。
3.2.3 吸烟史与不良反应 研究结果显示,有吸烟史的肺结核患者发生抗结核治疗不良反应的风险是无吸烟史者的近2倍[16]。可能原因是吸烟导致患者呼吸功能受损,免疫功能下降,较易发生治疗相关不良反应,尤其是抗结核治疗连用时可加重呼吸系统负担,使得治疗相关不良反应增多。本研究结果显示:有吸烟史者抗结核治疗不良反应发生率高于无吸烟史者,多因素Logistic回归分析结果显示,吸烟史是其发生危险因素(P<0.01)。故对于有长期吸烟史的初治涂阳肺结核患者在抗结核治疗期间应向其解释吸烟的危害及其与结核病的关系,鼓励其戒烟,以减少治疗相关不良反应的发生,确保足量、全程治疗。
3.2.4 体重指数与不良反应 体重指数低的肺结核患者常伴其他基础疾病,对抗结核药物的代谢能力较差,易导致治疗相关不良反应的发生。研究表明,38.5%~70.9%肺结核患者同时合并营养不良,使得体重指数低下,而体重指数低下者药物性肝功能异常发生率是正常者的2.3倍[17]。
3.2.5 肝病史与不良反应 因抗结核药物主要经肝脏代谢,故肝功能较差(有肝病史)者的蛋白合成能力下降,机体抵抗力差,可影响药物代谢能力,进而提高抗结核治疗不良反应发生率。本研究结果显示,有肝病史者抗结核治疗不良反应发生率高于无肝病史者,多因素Logistic回归分析结果显示,肝病史是其发生危险因素(P<0.05)。提示对于有肝病史的初治涂阳肺结核患者,在予以规律联合抗结核治疗期间,要密切关注治疗相关不良反应的发生,及早发现并予针对性干预措施,以提高治疗依从性及治愈率,防止中断治疗。
综上所述,在初治涂阳肺结核患者规律抗结核治疗期间,治疗相关不良反应时常发生,其中以单一症状不良反应为主,大部分出现在强化期内,以骨关节损害、肝功能损害、血液系统异常及胃肠道反应为主;年龄>60岁、体重指数<18.5、吸烟史、饮酒史、肝病史是抗结核治疗不良反应发生的危险因素,临床需密切关注有上述危险因素者,减少或防止治疗相关不良反应的发生,提高治疗依从性并提高治愈率。
[1] 嘎玛德吉.老年肺结核临床特征及肺结核影像学特点[J].中国保健营养,2020,30(25):101.
[2] 曾继清.肺结核的流行病学特征及其控制对策分析[J].基层医学论坛,2019,23(35):5149-5150.
[3] 张竞美,赵鹏,王超,等.肺结核患者抗结核药物治疗不良反应及影响因素分析[J].国际医药卫生导报,2020,26(2):213-215.
[4] 中华医学会结核病学分会.肺结核诊断和治疗指南[J].中国实用乡村医生杂志,2013,20(2):7-11.
[5] 林叶清,郭崇川.关于《中国结核病防治规划实施工作指南2008版》的改进思考[J].医学信息,2015,28(6):336.
[6] 韩珂卿,栾飞,刘道恒,等.结核病专科医院药品不良反应回顾性分析[J].临床肺科杂志,2019,24(8):1459-1462.
[7] 杨海峰,梁爽,王政,等.128例菌阳肺结核临床特点分析[J].医学动物防制,2018,34(8):768-770.
[8] 罗汉杰.初治涂阳肺结核患者抗结核药物不良反应发生率和影响因素研究[J].医药前沿,2017,7(31):229-230.
[9] Singh G,Patrikar S,Basannar DR,et al. Health technology assessment of fixed-dose combination regimen in treatment of newly diagnosed smear-positive pulmonary tuberculosis:A meta-analysis[J]. Med J Armed Forces India,2020,76(2):192-200.
[10] 郑智清,汤锦文,张添林.初治涂阳肺结核化疗不良反应及影响因素[J].海峡预防医学杂志,2016,22(5):99-101.
[11] 李雪秋,李红秋,刘健雄,等.261例结核患者抗痨药物所致不良反应及其危险因素分析[J].热带医学杂志,2020,20(6):803-805,819.
[12] 熊姿,白丽琼,王孝君,等.115例初治涂阳肺结核患者抗结核药物不良反应发生率和影响因素研究[J].实用预防医学,2015,22(5):537-540.
[13] 万书舟.对接受抗结核治疗的老年肺结核患者发生不良反应影响因素的研究[J].当代医药论丛,2018,16(14):152-154.
[14] 廖斌,曾斌,刘茂生,等.长期饮酒者肝脏和胰腺早期损害状况和相关性[J].赣南医学院学报,2019,39(11):1160-1163.
[15] 刘芳,臧珊珊,刘永梅,等.抗结核治疗致肺结核患者药物性肝损伤的危险因素分析[J].解放军医药杂志,2019,31(9):56-59.
[16] El Hamdouni M,Ahid S,Bourkadi JE,et al. Incidence of adverse reactions caused by first-line anti-tuberculosis drugs and treatment outcome of pulmonary tuberculosis patients in Morocco[J]. Infection,2020,48(1):43-50.
[17] 马艳,谢忠尧,张丽娜,等.涂阳肺结核患者抗结核药物不良反应发生影响因素分析[J].中国人兽共患病学报,2016,32(12):1070-1076.