膝关节骨性关节炎(knee osteoarthritis,KOA)是一种常见的骨关节慢性退行性疾病。膝关节腔注射糖皮质激素(glucocorticoids,GCs) 是治疗KOA的常用方法,可以消除滑膜炎症反应,减轻疼痛症状[1-2]。GCs局部使用后会发生全身作用[3]。国内外以往的研究较多针对膝关节腔注射GCs的效果,注射后造成的全身影响尚未见报道。复方倍他米松和地塞米松棕榈酸酯是关节腔内常用的糖皮质激素。本研究拟观察膝关节腔注射不同剂量的复方倍他米松或地塞米松棕榈酸酯对糖代谢、脂代谢及下丘脑-垂体-肾上腺皮质轴(hypothalamus pituitary adrenal axis,HPA轴)的影响,为临床工作提供理论依据。
1 资料与方法
1.1 一般资料 选择2016年1—6月期间在我院疼痛科门诊就诊的KOA患者60例,参照中华医学会风湿病学会2010年骨关节炎诊断及分类标准[4]。年龄45~70岁,性别不限,体重指数(body mass index,BMI) 18.5~32.0,疼痛视觉模拟评分(visual analogue scale,VAS)≥7分。采用随机数字法分为4组(n=15):BL组(复方倍他米松3.5 mg)、BH组(复方倍他米松7 mg)、DL组(地塞米松棕榈酸酯 4 mg)和DH组(地塞米松棕榈酸酯8 mg)。排除标准:①糖尿病患者;②脂代谢异常者;③存在HPA轴相关疾病患者;④各种继发性关节炎;⑤治疗前2个月内曾接受GCs治疗者;⑥凝血功能异常者。四组患者性别、年龄、BMI、治疗前VAS评分差异无统计学意义(P>0.05),具有可比性,见表1。
表1 4组患者一般情况比较
Table 1 Comparison of demographic and clinical
characteristics at the baseline between four groups![]()
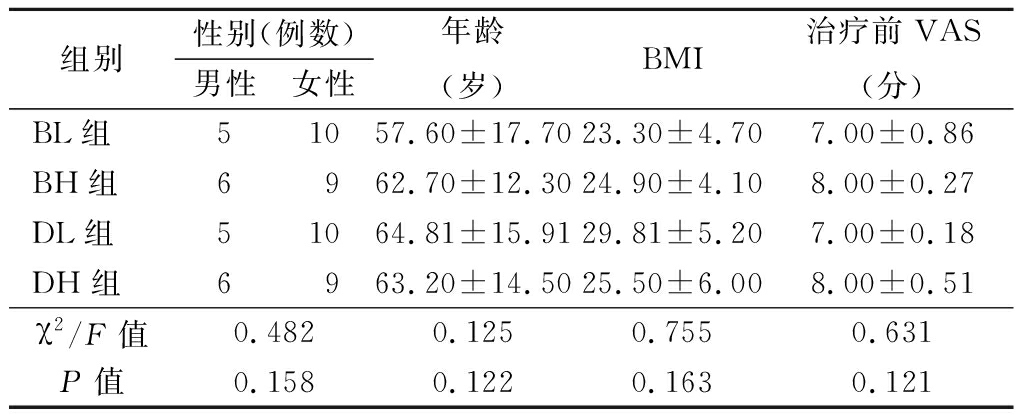
组别性别(例数)男性女性年龄(岁)BMI治疗前VAS(分)BL组51057.60±17.7023.30±4.707.00±0.86BH组6962.70±12.3024.90±4.108.00±0.27DL组51064.81±15.9129.81±5.207.00±0.18DH组6963.20±14.5025.50±6.008.00±0.51χ2/F值0.4820.1250.7550.631P值0.1580.1220.1630.121
本研究已获医院伦理委员会批准,并与患者及家属签署知情同意书。
1.2 方法 所有患者行膝关节腔注射治疗,患者坐位,膝关节屈曲90 °,选取髌骨外下为进针点,常规消毒后进针至关节腔,若关节积液,则先抽吸关节液,之后注入药物。BL组注射复方倍他米松3.5 mg、利多卡因40 mg和0.9%氯化钠注射液共5 mL药液;BH组注射复方倍他米松7 mg、利多卡因40 mg和0.9%氯化钠注射液共5 mL药液;DL组注射地塞米松棕榈酸酯4 mg、利多卡因40 mg和0.9%氯化钠混合液共5 mL药液;DH组注射含有地塞米松棕榈酸酯8 mg、利多卡因40 mg和0.9%氯化钠注射液共5 mL药液。采用VAS评分评估患者疼痛程度,0表示无痛,10表示剧痛。记录4组患者注射前(T0)与注射后第2天(T1)、第4天(T2)、第6天(T3)、第14天(T4)及第21天(T5)的VAS评分。
抽取T0、T1、T2、T3、T4及T5晨空腹肘静脉血,测定空腹血糖(fasting blood glucose,FBG)、总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、皮质醇和促肾上腺皮质激素(adrenocorticotropic hormone,ACTH),晨餐后2 h抽取肘静脉血测定餐后血糖(2-hour postprandial blood glucose,2 hPG)。
1.3 统计学方法 应用SPSS 21.0统计分析软件,正态分布的计量资料比较采用重复测量的方差分析,组间比较采用单因素方差分析。计数资料比较采用χ2 检验。P<0.05为差异有统计学意义。
2 结 果
2.1 四组患者各时点VAS比较 与T0比较,4组患者T1、T2、T3、T4及T5时点的VAS评分降低,4组患者在时点间差异有统计学意义(P<0.05)。4组患者组间以及组间·时间点交互作用差异均无统计学意义(P>0.05)。见表2。
表2 4组患者治疗前后VAS评分比较
Table 2 Comparison of VAS scores before and after treatment in four groups ![]() 分)
分)
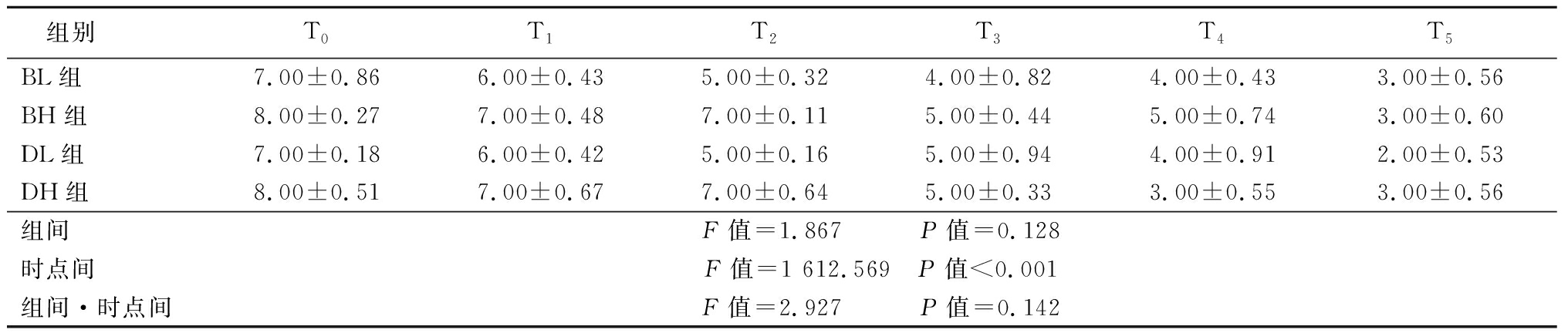
组别T0T1T2T3T4T5BL组7.00±0.866.00±0.435.00±0.324.00±0.824.00±0.433.00±0.56BH组8.00±0.277.00±0.487.00±0.115.00±0.445.00±0.743.00±0.60DL组7.00±0.186.00±0.425.00±0.165.00±0.944.00±0.912.00±0.53DH组8.00±0.517.00±0.677.00±0.645.00±0.333.00±0.553.00±0.56组间F值=1.867 P值=0.128时点间F值=1 612.569 P值<0.001组间·时点间F值=2.927 P值=0.142
2.2 4组患者FBG比较 与T0比较,4组患者FBG组间、时点间、以及组间·时点间交互作用差异均无统计学意义(P>0.05)。见表3。
表3 4组患者治疗前后FBG的比较
Table 3 Comparison of fasting blood glucose before and after treatment in four groups![]()
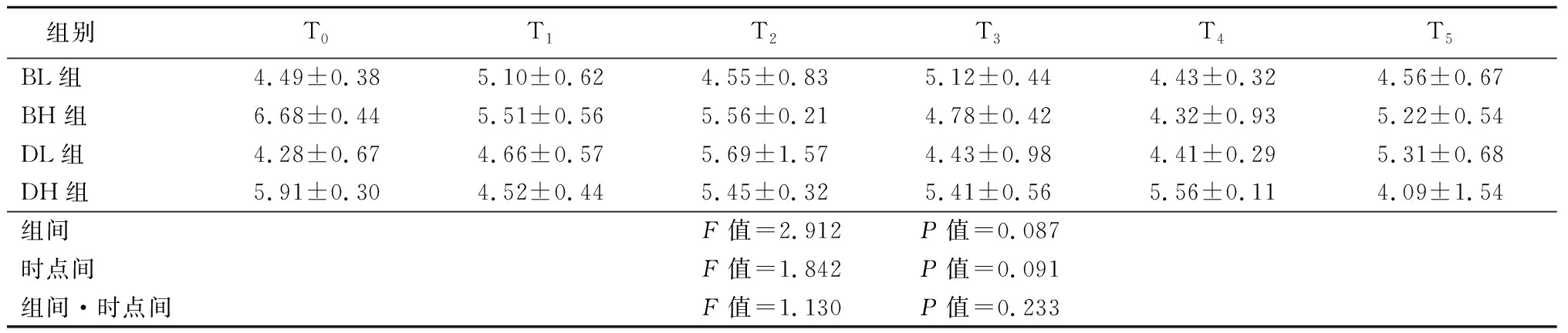
组别T0T1T2T3T4T5BL组4.49±0.385.10±0.624.55±0.835.12±0.444.43±0.324.56±0.67BH组6.68±0.445.51±0.565.56±0.214.78±0.424.32±0.935.22±0.54DL组4.28±0.674.66±0.575.69±1.574.43±0.984.41±0.295.31±0.68DH组5.91±0.304.52±0.445.45±0.325.41±0.565.56±0.114.09±1.54组间F值=2.912 P值=0.087时点间F值=1.842 P值=0.091组间·时点间F值=1.130 P值=0.233
2.3 4组患者2 hPG比较 与T0比较,4组患者T1、T2、T3及T4时点的2 hPG升高,时间点差异有统计学意义(P<0.05);T3时点,BL组2 hPG高于BH组,DL组高于DH组,组间比较差异有统计学意义(P<0.05),T4时点,BH组2 hPG高于BL组,DH组高于DL组,组间比较差异有统计学意义(P<0.05);四组患者组间·时点间交互作用差异无统计学意义(P>0.05)。见表4。
表4 四组患者治疗前后2 hPG比较
Table 4 Comparison of 2 h-postprandial serum glucose before and after treatment in four groups![]()
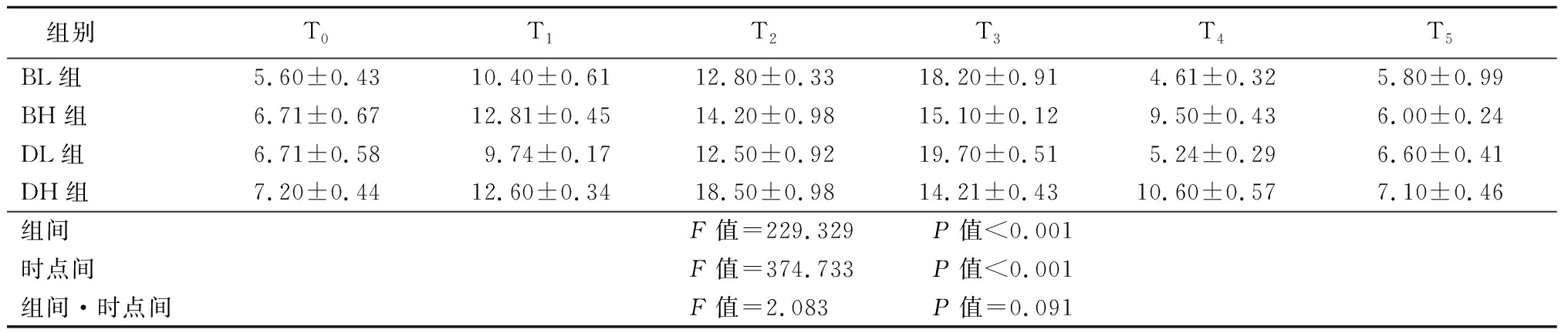
组别T0T1T2T3T4T5BL组5.60±0.4310.40±0.6112.80±0.3318.20±0.914.61±0.325.80±0.99BH组6.71±0.6712.81±0.4514.20±0.9815.10±0.129.50±0.436.00±0.24DL组6.71±0.589.74±0.1712.50±0.9219.70±0.515.24±0.296.60±0.41DH组7.20±0.4412.60±0.3418.50±0.9814.21±0.4310.60±0.577.10±0.46组间F值=229.329 P值<0.001时点间F值=374.733 P值<0.001组间·时点间F值=2.083 P值=0.091
2.4 四组患者TC及TG的比较 4组患者TC及TG,组间、时点间、组间·时点间交互作用差异无统计学意义(P>0.05)。见表5~6。
表5 四组患者治疗前后血浆TC的比较
Table 5 Comparison of the levels of plasma cholesterol before and after treatment in four groups![]()
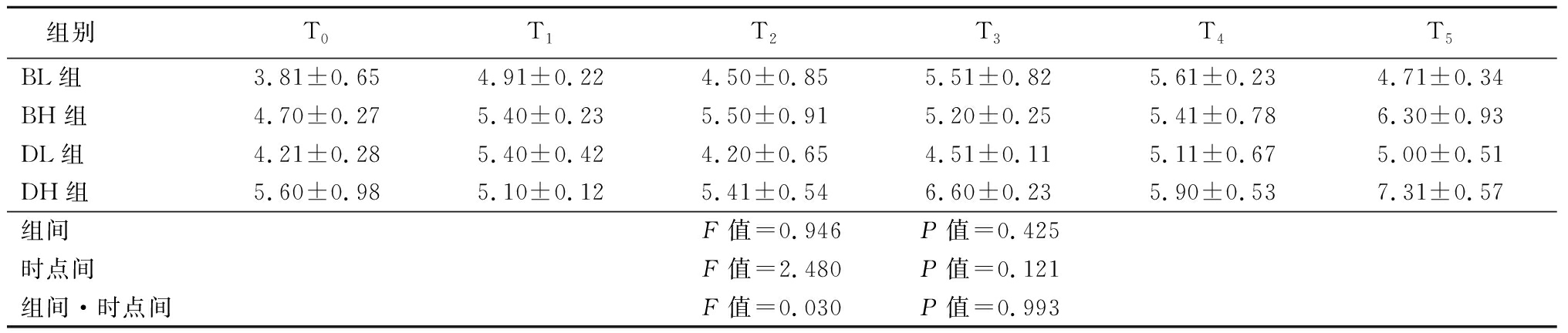
组别T0T1T2T3T4T5BL组3.81±0.654.91±0.224.50±0.855.51±0.825.61±0.234.71±0.34BH组4.70±0.275.40±0.235.50±0.915.20±0.255.41±0.786.30±0.93DL组4.21±0.285.40±0.424.20±0.654.51±0.115.11±0.675.00±0.51DH组5.60±0.985.10±0.125.41±0.546.60±0.235.90±0.537.31±0.57组间F值=0.946 P值=0.425时点间F值=2.480 P值=0.121组间·时点间F值=0.030 P值=0.993
表6 四组患者治疗前后血浆TG比较
Table 6 Comparison of the levels of plasma triglyceride before and after treatment in four groups![]()
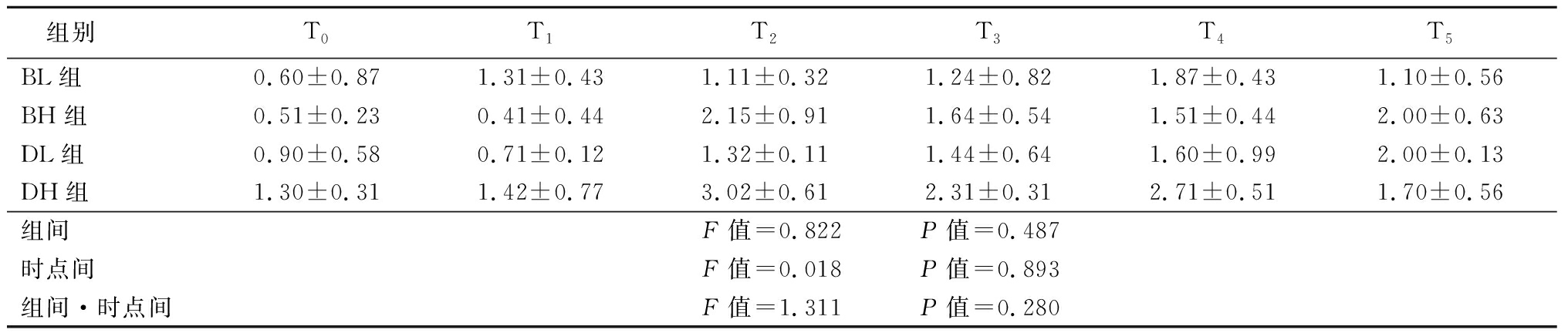
组别T0T1T2T3T4T5BL组0.60±0.871.31±0.431.11±0.321.24±0.821.87±0.431.10±0.56BH组0.51±0.230.41±0.442.15±0.911.64±0.541.51±0.442.00±0.63DL组0.90±0.580.71±0.121.32±0.111.44±0.641.60±0.992.00±0.13DH组1.30±0.311.42±0.773.02±0.612.31±0.312.71±0.511.70±0.56组间F值=0.822 P值=0.487时点间F值=0.018 P值=0.893组间·时点间F值=1.311 P值=0.280
2.5 四组患者皮质醇及ACTH比较 与T0比较,4组患者T1时点的皮质醇及ACTH降低,T2、T3 、T4 和T5时间恢复,时点间差异有统计学意义(P<0.05);4组患者组间以及组间·时间点交互作用差异均无统计学意义(P>0.05)。见表7~8。
表7 四组患者治疗前后皮质醇比较
Table 7 Comparison of the levels of cortisol before and after treatment in four groups![]()
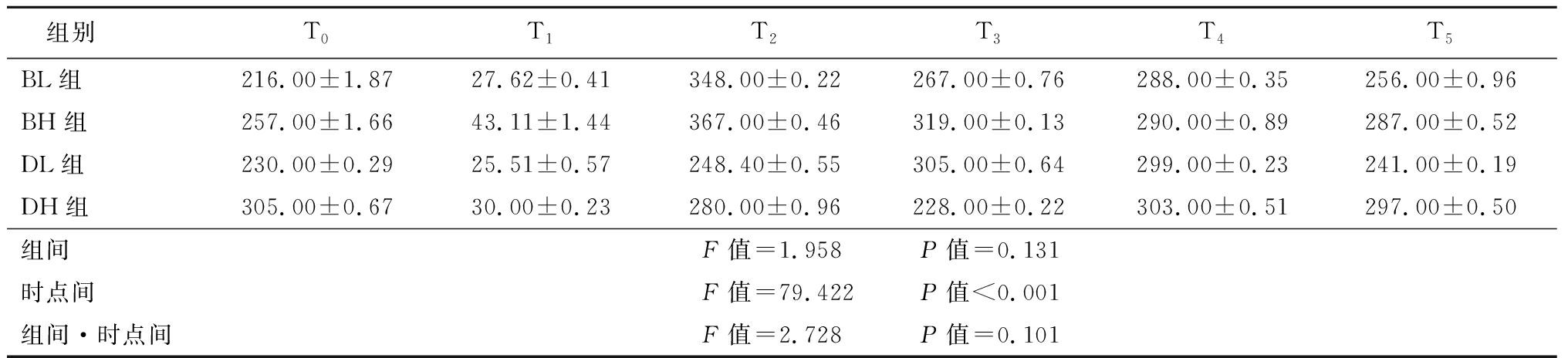
组别T0T1T2T3T4T5BL组216.00±1.8727.62±0.41348.00±0.22267.00±0.76288.00±0.35256.00±0.96BH组257.00±1.6643.11±1.44367.00±0.46319.00±0.13290.00±0.89287.00±0.52DL组230.00±0.2925.51±0.57248.40±0.55305.00±0.64299.00±0.23241.00±0.19DH组305.00±0.6730.00±0.23280.00±0.96228.00±0.22303.00±0.51297.00±0.50组间F值=1.958 P值=0.131时点间F值=79.422 P值<0.001组间·时点间F值=2.728 P值=0.101
表8 四组患者治疗前后血浆ACTH比较
Table 8 Comparison of the levels of plasma ACTH before and after treatment in four groups![]()
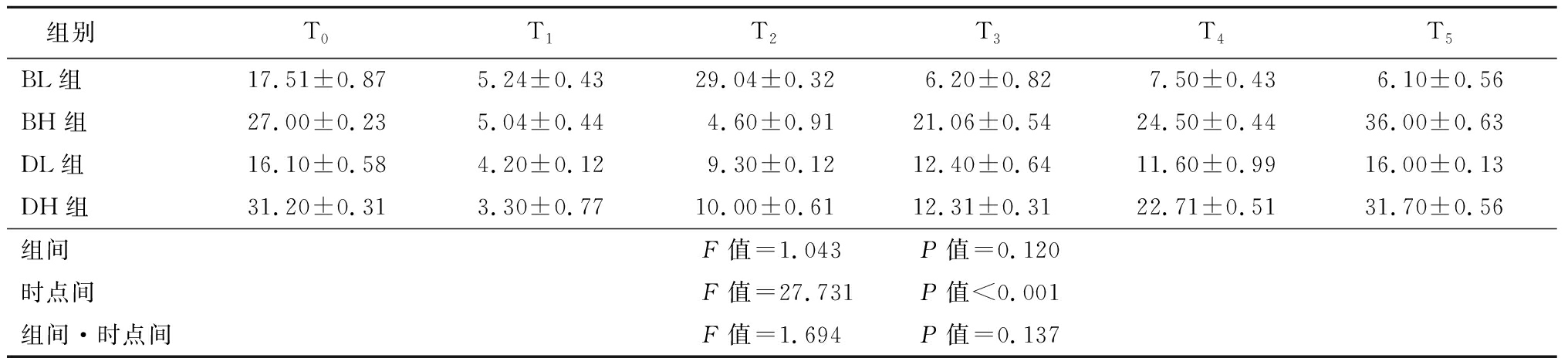
组别T0T1T2T3T4T5BL组17.51±0.875.24±0.4329.04±0.326.20±0.827.50±0.436.10±0.56BH组27.00±0.235.04±0.444.60±0.9121.06±0.5424.50±0.4436.00±0.63DL组16.10±0.584.20±0.129.30±0.1212.40±0.6411.60±0.9916.00±0.13DH组31.20±0.313.30±0.7710.00±0.6112.31±0.3122.71±0.5131.70±0.56组间F值=1.043 P值=0.120时点间F值=27.731 P值<0.001组间·时点间F值=1.694 P值=0.137
3 讨 论
KOA是中老年人最常见的一种关节疾病,疼痛症状严重影响患者的生活质量。关节腔注射GCs可以减轻炎症反应,改善膝关节疼痛[5]。研究发现,GCs可以通过基因调控减轻应激反应,抑制促炎因子激活蛋白1(activator protein-1 AP-1)和核因子κB(nuclear factor,NF-κB)的转录[6],但对于局部注射带来的全身影响研究较少。地塞米松棕榈酸酯和复方倍他米松是关节腔注射最常用的GCs。地塞米松棕榈酸酯是溶入于脂肪乳糜微粒中的合成GCs,在临床中广泛反应于自身免疫系统疾病。地塞米松棕榈酸酯被巨噬细胞吞噬后,在体内经酯酶水解成具有活性的地塞米松而发挥作用,膝关节腔注射后作用时间可持续2~4周。复方倍他米松是一种微晶体混悬液,由二丙酸倍他米松和倍他米松磷酸钠组成;前者在组织中吸收缓慢,作用时间长,在注射4周后通过同位素标记等方法仍可被检测到;后者吸收迅速起效快,可迅速达到最大血药浓度[7]。
本研究结果显示,四组患者膝关节腔注射不同剂量的复方倍他米松和地塞米松棕榈酸酯后VAS评分均明显降低,表明复方倍他米松两种剂量和地塞米松棕榈酸酯两种剂量均能够有效治疗KOA的疼痛症状。复方倍他米松两种剂量和地塞米松棕榈酸酯两种剂量各时点VAS评分存在差异,说明高剂量组效果优于低剂量组。
GCs可以抑制胰岛素的降糖作用,干扰正常的血糖调节,主要与胰岛素抵抗(insulin resistance,IR)密切相关。由外源性GCs导致的血糖调节异常,与使用时间及剂量密切相关。研究表明,膝关节腔注射GCs 7 d后,胰岛素处理葡萄糖的能力降低25%[8]。HPA轴在生理状态下受较高水平的血糖调节,HPA轴功能亢进同样可以造成IR。GCs会造成FBG升高,并且升高的程度与应激强度具有明显相关性[9-10]。本研究中,与治疗前相比,四组患者治疗后FBG未见升高。本研究中4组患者晨FBG差异无统计学意义,提示膝关节注射复方倍他米松3.5 mg或7 mg和地塞米松棕榈酸酯4 mg或8 mg对患者的FBG影响较小。这与Poddubnyy等[11]和Wang等[12]的研究结果相同,他们认为GCs通过诱导糖耐量异常,干扰血糖调节,以升高2 hPG为主。本研究中,治疗后2周之内2 hPG明显增高,证实复方倍他米松3.5 mg或7 mg和地塞米松棕榈酸酯4 mg或8 mg在2周之内会升高2 hPG,提示糖尿病患者在接受膝关节腔注射GCs后2周内,应当监测血糖,合理调整口服药物或者胰岛素剂量,避免血糖波动。
GCs可导致脂肪重新分布和库欣综合征。GCs促进脂肪动员,减少脂肪生成,同时GCs可以升高血糖,促进胰岛素分泌,胰岛素具有强大的促进脂肪合成的能力,可促使TG增高;小剂量GCs可以导致TG含量升高,增加心血管疾病的危险度,也可以通过免疫抑制作用引起患者脂代谢紊乱[13]。大剂量GCs增加血清中TC含量,增加IR并造成高密度脂蛋白降低,低密度脂蛋白升高。研究表明,GCs可以直接抑制胰岛素的分泌引起IR,也可以间接使游离脂肪酸增高引起IR[13],从而干扰血脂代谢。一篇关于类风湿性关节炎长期使用激素的研究表明,使用10 mg/d泼尼松治疗超过2年的患者,平均体重增加了2.9 kg[14]。本研究中,4组患者在接受膝关节腔注射后TC与TG含量差异无统计学意义,证实短期使用复方倍他米松3.5 mg或7 mg和地塞米松棕榈酸酯4 mg或8 mg对患者的脂代谢无明显影响。
HPA轴是体内神经内分泌系统的重要组成部分,传入信息刺激下丘脑室旁核,使其合成并分泌促肾上腺皮质激素释放激素(corticotropin releasing hormone,CRH),通过体液循环作用于腺垂体细胞,促使ACTH的分泌,最终使GCs分泌增加[15]。研究发现,海马中存在大量盐皮质激素受体(mineralocorticoid receptor,MR)和糖皮质激素受体(glucocorticoid receptor,GR)[16]。GCs与MR的结合力较强,并且二者存在竞争性抑制,GCs与MR结合后可以维持正常的生理活动及新陈代谢,而GCs与GR结合后,主要通过负反馈调节作用,维持HPA轴的稳定。故GCs通过调节与MR和GR的结合能力来维持HPA轴的稳定作用。CRH是HPA轴的 “中枢启动子”,在生理状态下,外界刺激会促进CRH的分泌与释放,促使ACTH的分泌增加,最终导致肾上腺大量分泌GCs,产生生理效应。在该过程中,GR却受到抑制,表现为活性降低,表达能力下降。人体在受到外界刺激时,由CRH分泌增加所介导的应激反应,会促使GR下调[17]。GCs可以增加细胞核对GR的通透性,使GR更易进入细胞核,减少在包浆中与GCs结合的机会,同时,GCs还可以干扰GR基因的转录,使GR含量降低。CRH同样也具有类似GCs的作用,对GR的活性同样具有抑制作用。CRH通过抑制腺苷酸环化酶信号系统,减弱GR基因的表达,使相关蛋白合成减少。研究表明,GR对HPA轴同样具有反馈调节作用[18]。当体内GR数量减少或功能失调时,可促进ACTH的分泌,而血浆中CRH的含量并没有明显变化。而GR可以降低肾上腺皮质的敏感性,使GCs的分泌量减少,减弱对下丘脑的抑制作用,间接引起CRH的释放。在病理状态下,尤其是长期接受GCs治疗的患者,肾上腺皮质萎缩,HPA轴功能失调,皮质醇的分泌失去昼夜节律性,对人体造成不可逆的损害[19]。本研究中患者接受复方倍他米松3.5 mg、7 mg或地塞米松棕榈酸酯4 mg、8 mg注射后1周内皮质醇及ACTH显著降低,第3周恢复至注射前水平,表明即使关节腔单次注射复方倍他米松3.5 mg、7 mg或地塞米松棕榈酸酯4 mg、8 mg在2周内能够抑制机体皮质醇及ACTH水平。
膝关节腔注射复方倍他米松(3.5 mg或7 mg)和地塞米松棕榈酸酯(4 mg或8 mg)均可有效缓解膝关节骨性关节炎造成的疼痛,在2周内能够增高2 hPG,降低皮质醇和ACTH。对FBG与脂代谢无明显影响。
[1] Al Argan R,Saskin A,Yang JW,et al. Glucocorticoid resistance syndrome caused by a novel NR3C1 point mutation[J]. Endocr J,2018,65(11):1139-1146.
[2] Kiilerich P,Triqueneaux G,Christensen NM,et al. Interaction between the trout mineralocorticoid and glucocorticoid receptors in vitro[J]. J Mol Endocrinol,2015,55(1):55-68.
[3] Vitellius G,Trabado S,Bouligand J,et al. Pathophysiology of glucocorticoid signaling[J]. Ann Endocrinol,2018,79(3):98-106.
[4] 中华医学会风湿病学分会.骨关节炎诊断及治疗指南[J].中华风湿病杂志,2010,14(6):416-419.
[5] Liaudat AC,Rodriguez N,Chen S,et al. Adrenal response of male rats exposed to prenatal stress and early postnatal stimulation[J]. Biotech Histochem,2015,90(6):432-438.
[6] Kowalski ML,Wojciechowski P,Dziewonska M,et al. Adrenal suppression by inhaled corticosteroids in patients with asthma: A systematic review and quantitative analysis[J]. Allergy Asthma Proc,2016,37(1):9-17.
[7] Zheng HB,Fu YT,Pan ZX,et al. The effect of mesenchymal stem cells on the p53 methylation in irradiation-induced thymoma in C57BL/6 mice[J]. J Cancer Res Ther,2015,11(2):403-408.
[8] Barnes PJ. Glucocorticosteroids[J]. Handb Exp Pharmacol,2017,237:93-115.
[9] Munoz-Cobo I,Erburu MM,Zwergel C,et al. Nucleocytoplasmic export of HDAC5 and SIRT2 downregulation: two epigenetic mechanisms by which antidepressants enhance synaptic plasticity markers[J]. Psychopharmacology,2018,235(10):2831-2846.
[10] Vogt MA,Pfeiffer N,Le Guisquet AM,et al. May the use of different background strains ′strain′ the stress-related phenotype of GR(+/-) mice?[J] . Behav Brain Res,2017,335:71-79.
[11] Poddubnyy D,Fedorova A,Listing J,et al. Physical function and spinal mobility remain stable despite radiographic spinal progression in patients with ankylosing spondylitis treated with TNF-alpha inhibitors for up to 10 years[J]. J Rheumatol,2016,43(12):2142-2148.
[12] Wang CH,Feng Y,Ren Z,et al. Performance of ultrasound to monitor achilles enthesitis in patients with ankylosing spondylitis during TNF-α antagonist therapy[J].Clin Rheumatol,2015,34(6):1073-1078.
[13] Moisan MP,Castanon N. Emerging role of corticosteroid-binding globulin in glucocorticoid-driven metabolic disorders[J]. Front Endocrinol,2016,7:160.
[14] Sato H,Ito S,Nagai S,et al. Atypical severe central serous chorioretinopathy in a patient with systemic lupus erythematosus improved with a rapid reduction in glucocorticoid[J]. Modern Rheumatol,2013,23(1):172-174.
[15] Yang QF,Chen BL,Zhang QS,et al. Contribution of MDR1 gene polymorphisms on IBD predisposition and response to glucocorticoids in IBD in a Chinese population[J]. J Digest Dis,2015,16(1):22-30.
[16] Karner CM,Long F. Glucose metabolism in bone[J]. Bone,2018,115:2-7.
[17] Kanazawa I. Osteocalcin as a hormone regulating glucose metabolism[J]. Word J Diabetes,2015,6(18):1345-1354.
[18] Meijer OC,Koorneef LL,Kroon J. Glucocorticoid receptor modulators[J]. Ann Endocrinol,2018,79(3):107-111.
[19] Stirrat LI,O′Reilly JR,Barr SM,et al. Decreased maternal hypothalamic-pituitary-adrenal axis activity in very severely obese pregnancy:associations with birthweight and gestation at delivery[J]. Psychoneuroendocrinology,2016,63:135-143.