1型糖尿病(type 1 diabetes mellitus,T1DM)是遗传易感性儿童在环境因素和自身免疫系统发生的复杂的相互作用下形成的器官特异性自身免疫性疾病[1]。然而环境因素如病毒感染[2]、配方奶[3]、疫苗[4]、早产[5]、维生素D[6]、化学毒素等,对1型糖尿病的发生和发展起着重要的作用。大量研究表明柯萨奇病毒(Coxsackie virus,CV)感染作为重要的环境因素与1型糖尿病的的发生有密切关系[2,7-29]。柯萨奇病毒为小RNA病毒科肠道病毒属,分为A、B两组,A组包括24型,B组包括1~6型,其中B组与T1DM的起病有明显相关性[30]。一些研究认为柯萨奇病毒B(Coxsackie virus B,CVB)感染促进机体免疫系统产生胰岛β细胞相关抗体,破坏胰腺β细胞促进T1DM的发生或者CVB病毒血症直接破坏胰岛细胞[31],但是另外一些研究认为CVB感染产生的抗体可以保护病毒对胰腺的损伤作用[32]。但所有的结果都是在小样本或动物实验的基础上得出的结论且缺乏循证医学的客观评价。笔者采用Meta分析的方法,全面检索数据库中关于CV感染与T1DM相关性的研究并进行统计学分析,以期为T1DM的临床预防提供科学的、有效的、可靠的临床证据。
1 资料与方法
1.1 遵循的原则 本研究系统评价和Meta分析写作和报告遵循PRIAMS(the Preferred Reporting Items for Systematic Reviews andMeta-Analyses)[33]原则和MOOSE(Meta-analysis OfObservational Studies in Epidemiology)[34]规范。
1.2 检索方法 通过全面检索中国知网、万方数据库、维普网、Pubmed、Embase、SinoMed中关于柯萨奇病毒和1型糖尿病的所有文献,检索时间自建库截至2020年5月28日。检索中文主题词为[糖尿病,1型]和[柯萨奇病毒感染](主题词通过SinoMed获取);英文主题词为Diabetes Mellitus,Type 1[Mesh]、Coxsackievirus Infections[mesh](Pubmed),′insulin dependent diabetes mellitus′/exp、′coxsackie virus infection′/exp(EmBase)。
1.3 纳入标准和排除标准 纳入的文献必须符合以下标准:①纳入文献为回顾性研究或前瞻性队列研究;②病例必须使用实验室检测方法确诊CV感染,对照组无CV感染;③病例组最终确诊为T1DM;④每篇纳入文献报道了病毒感染率。排除标准:①综述、系统评价、动物实验、社论、述评、观点等文献;②重复数据,无对照研究等不严谨实验设计的研究;③血清胰岛相关抗体(ICA/IAA/GAD)阳性而未患T1DM。
1.4 研究质量评估 对所有纳入的文献进行方法学质量评估采用Cochrane协作组[35]推荐的Newcastle Ottawa Scale(NOS)文献质量评价表。NOS量表包括8条项目,最多可得9颗星,0~3颗星为低质量研究;4~6颗星为中等质量研究;7~9颗星为高质量研究。质量评估由2名研究员(杨森、代晓玲)单独评价,若有异议由第三名研究员(崔岚巍)判决。
1.5 统计学方法 应用Revman5.3.0软件处理数据,进行Meta分析。二分类变量采用比值比(odd ratios,OR)为合并统计量,记录95%CI(confidence interval,CI)。检验分析研究间的异质性,并绘制森林图和漏斗图。统计异质性用χ2检验(P≤0.1) 及I2评估。各研究采用I2 评价异质性高低,0≤I2<25%为无异质性,25%≤I2<50%为低度异质性,50%≤I2<75%为中度异质性,I2≥75%为高异质性。对于没有或轻度异质性的评价结果用固定效应模型进行合并,中高度异质性采用随机效应模型合并。当异质性≥50%,亚组分析或敏感性分析寻找异质性来源 ,P<0.05为差异有统计学意义。
2 结 果
2.1 纳入文献 全面且系统性地检索柯萨奇病毒感染和1型糖尿病的相关性文献,获得465篇相关文献。其中PubMed 145篇,EmBase 159篇,SinoMed 18篇,CNKI 65篇,万方数据库64篇,维普网14篇。剔除重复发表的93篇文献,剩余372篇文献。随后,阅读标题和摘要后剔除不符合纳入标准或主题不相关的文献,排除综述、系统评价、动物实验、社论、述评、观点等文献数量312篇。阅读剩余全文,剔除排除实验设计不严谨的研究36篇。最终,本Meta分析纳入24篇文献,其中1篇无可利用数据,文献筛选过程见图1。
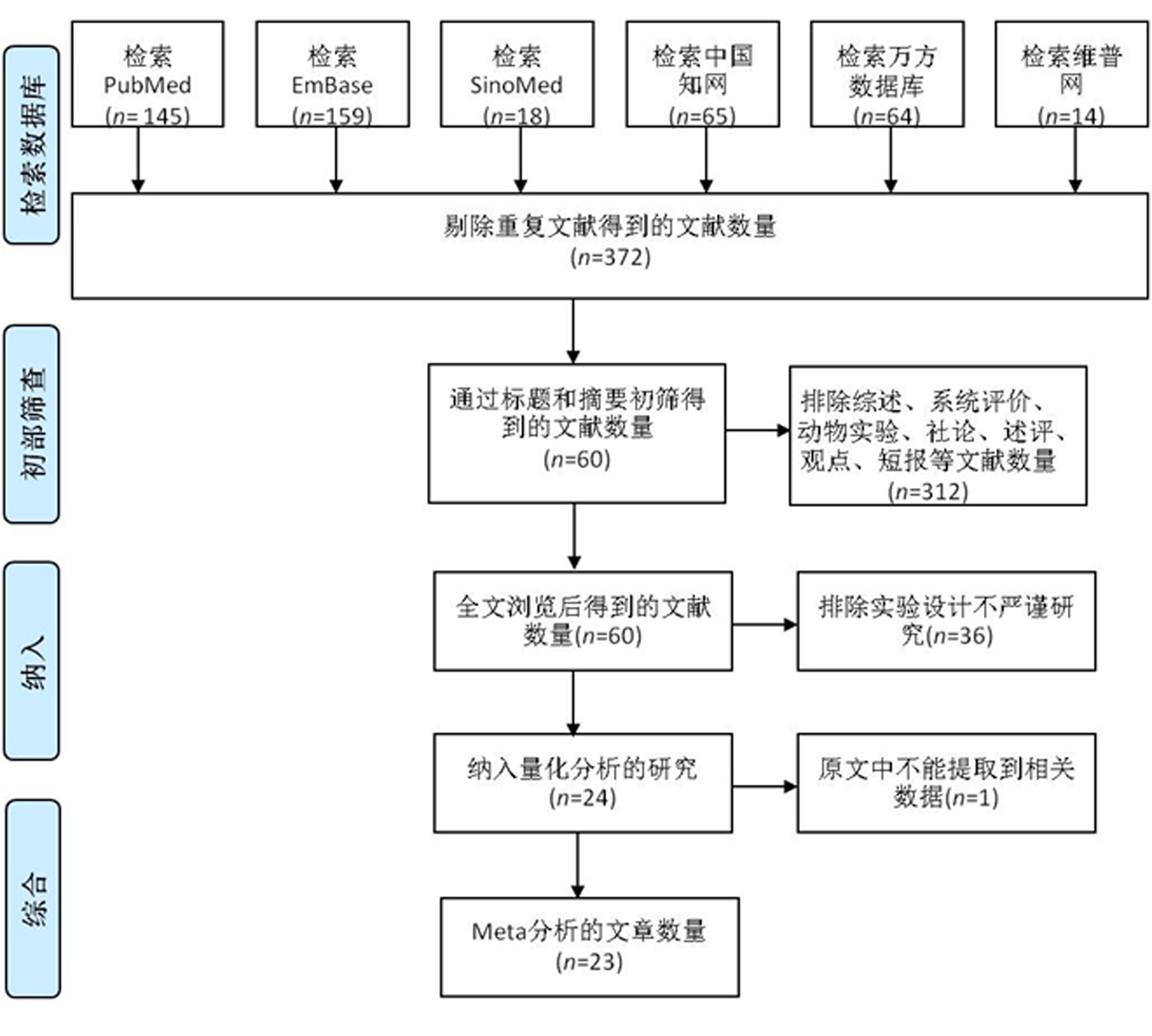
图1 文献检索流程图
Figure 1 Flowchart of literature search
2.2 纳入文献的基本特征 24篇文献均为病例对照研究[2,7-29],纳入Meta分析有23篇[2,7-15,17-29],其中部分文献对CVB各亚组感染与T1DM风险进行了分析[7,8,15,17,19,23,25-26,28]。23项研究的总共参与者为3 306例,其中病例组总共1 693例,对照组总共1 613例。检测抗CVB抗体研究对象有3 166例,检测病毒核酸的研究对象有371例,使用酶联免疫吸附测定检测抗CVB抗体的研究对象有730例,使用中和试验检测抗CVB抗体的研究对象有1 700例,使用放射免疫法检测抗CVB抗体的研究对象有299例,使用凝集素检测抗CVB抗体的研究对象有229例。检测CVB1型的样本有1 434例,检测CVB2的样本有1 516例,检测CVB3样本有1 545例,检测CVB4的样本有1 845例,检测CVB5有1 357例,检测CVB6有1 227例。7项研究来自中国,日本、美国、埃及各自有一项研究,14项研究来自欧洲。文献基本特点见表1。
表1 纳入研究的临床资料总结和质量评估
Table 1 Characteristic of included studies and assessment of quality
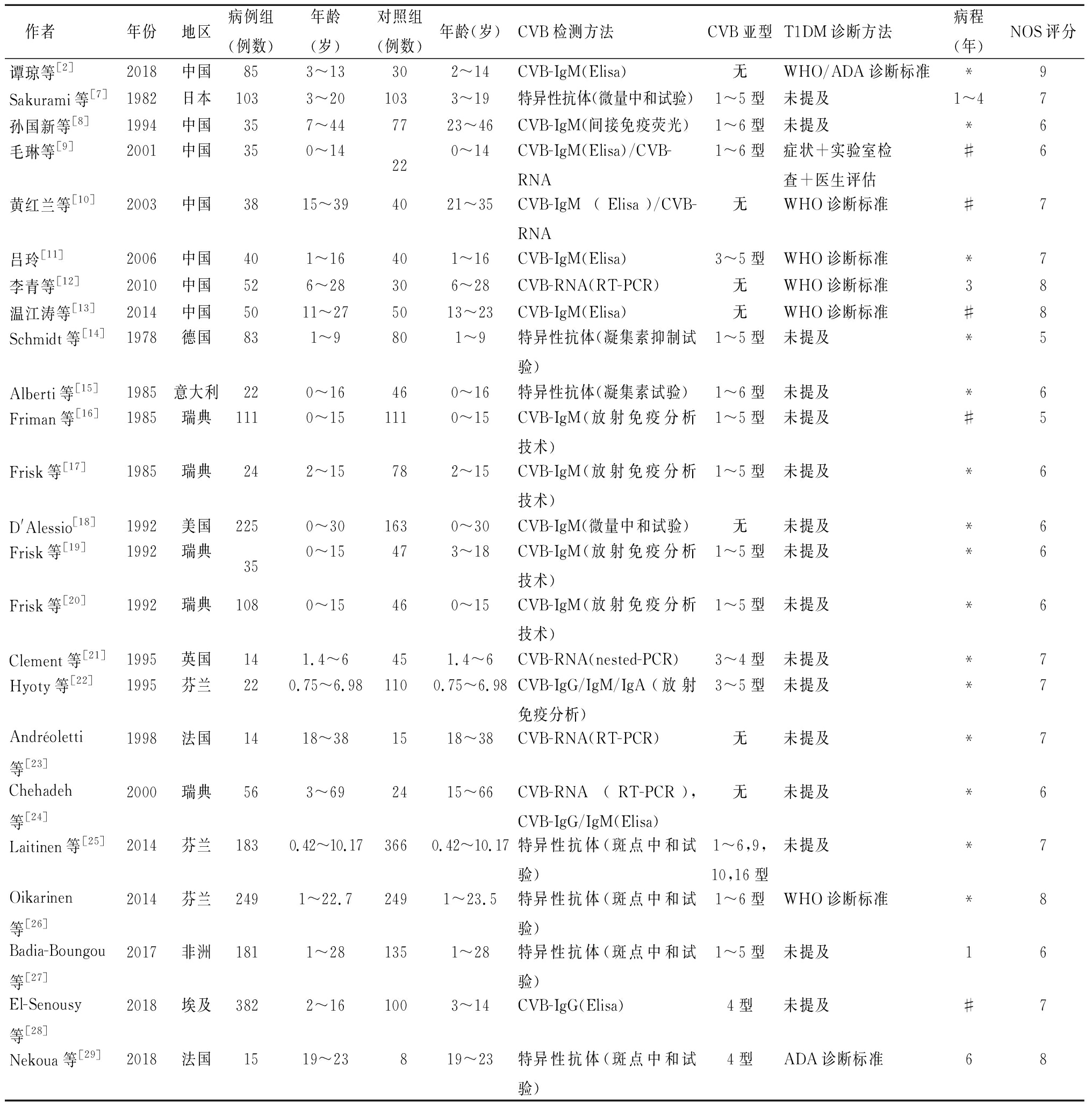
作者年份地区病例组(例数)年龄(岁)对照组(例数)年龄(岁)CVB检测方法CVB亚型T1DM诊断方法病程(年)NOS评分谭琼等[2]2018中国853~13302~14CVB-IgM(Elisa)无WHO/ADA诊断标准*9Sakurami等[7]1982日本1033~201033~19特异性抗体(微量中和试验)1~5型未提及1~47孙国新等[8]1994中国357~447723~46CVB-IgM(间接免疫荧光)1~6型未提及*6毛琳等[9]2001中国350~14220~14CVB-IgM(Elisa)/CVB-RNA1~6型症状+实验室检查+医生评估#6黄红兰等[10]2003中国3815~394021~35CVB-IgM(Elisa)/CVB-RNA无WHO诊断标准#7吕玲[11]2006中国401~16401~16CVB-IgM(Elisa)3~5型WHO诊断标准*7李青等[12]2010中国526~28306~28CVB-RNA(RT-PCR)无WHO诊断标准38温江涛等[13]2014中国5011~275013~23CVB-IgM(Elisa)无WHO诊断标准#8Schmidt等[14]1978德国831~9801~9特异性抗体(凝集素抑制试验)1~5型未提及*5Alberti等[15]1985意大利220~16460~16特异性抗体(凝集素试验)1~6型未提及*6Friman等[16]1985瑞典1110~151110~15CVB-IgM(放射免疫分析技术)1~5型未提及#5Frisk等[17]1985瑞典242~15782~15CVB-IgM(放射免疫分析技术)1~5型未提及*6D'Alessio[18]1992美国2250~301630~30CVB-IgM(微量中和试验)无未提及*6Frisk等[19]1992瑞典350~15473~18CVB-IgM(放射免疫分析技术)1~5型未提及*6Frisk等[20]1992瑞典1080~15460~15CVB-IgM(放射免疫分析技术)1~5型未提及*6Clement等[21]1995英国141.4~6451.4~6CVB-RNA(nested-PCR)3~4型未提及*7Hyoty等[22]1995芬兰220.75~6.981100.75~6.98CVB-IgG/IgM/IgA(放射免疫分析)3~5型未提及*7Andréoletti等[23]1998法国1418~381518~38CVB-RNA(RT-PCR)无未提及*7Chehadeh等[24]2000瑞典563~692415~66CVB-RNA(RT-PCR),CVB-IgG/IgM(Elisa)无未提及*6Laitinen等[25]2014芬兰1830.42~10.173660.42~10.17特异性抗体(斑点中和试验)1~6,9,10,16型未提及*7Oikarinen等[26]2014芬兰2491~22.72491~23.5特异性抗体(斑点中和试验)1~6型WHO诊断标准*8Badia-Boungou等[27]2017非洲1811~281351~28特异性抗体(斑点中和试验)1~5型未提及16El-Senousy等[28]2018埃及3822~161003~14CVB-IgG(Elisa)4型未提及#7Nekoua等[29]2018法国1519~23819~23特异性抗体(斑点中和试验)4型ADA诊断标准68
所有纳入的研究都是病例对照研究.所有的参与者都是在医院收集,大部分研究没有详细1型糖尿病的诊断细节或参考标准;*:代表患者为首次发病;#:代表文章中未提及病程长短的时间
2.3 Meta分析结果
2.3.1 柯萨奇病毒与T1DM患病率Meta分析结果 共检索到24篇文献,其中1篇不能提取到相关数据。最终,对23篇文献进行Meta分析。经异质性检验I2=85%,说明各研究间存在较高异质性,采用随机效应模型。总样本量为3 306例,病例组1 693例(CVB感染占811例),对照组1 613例(CVB感染占457例)。结果显示T1DM患者感染CVB的风险是对照组的5倍(OR=4.49,95%CI:2.69~7.50),差异有统计学意义(P<0.05),提示CVB感染与T1DM存在统计学相关性,CVB可能是T1DM的病因或促进了T1DM的发生(图2)。
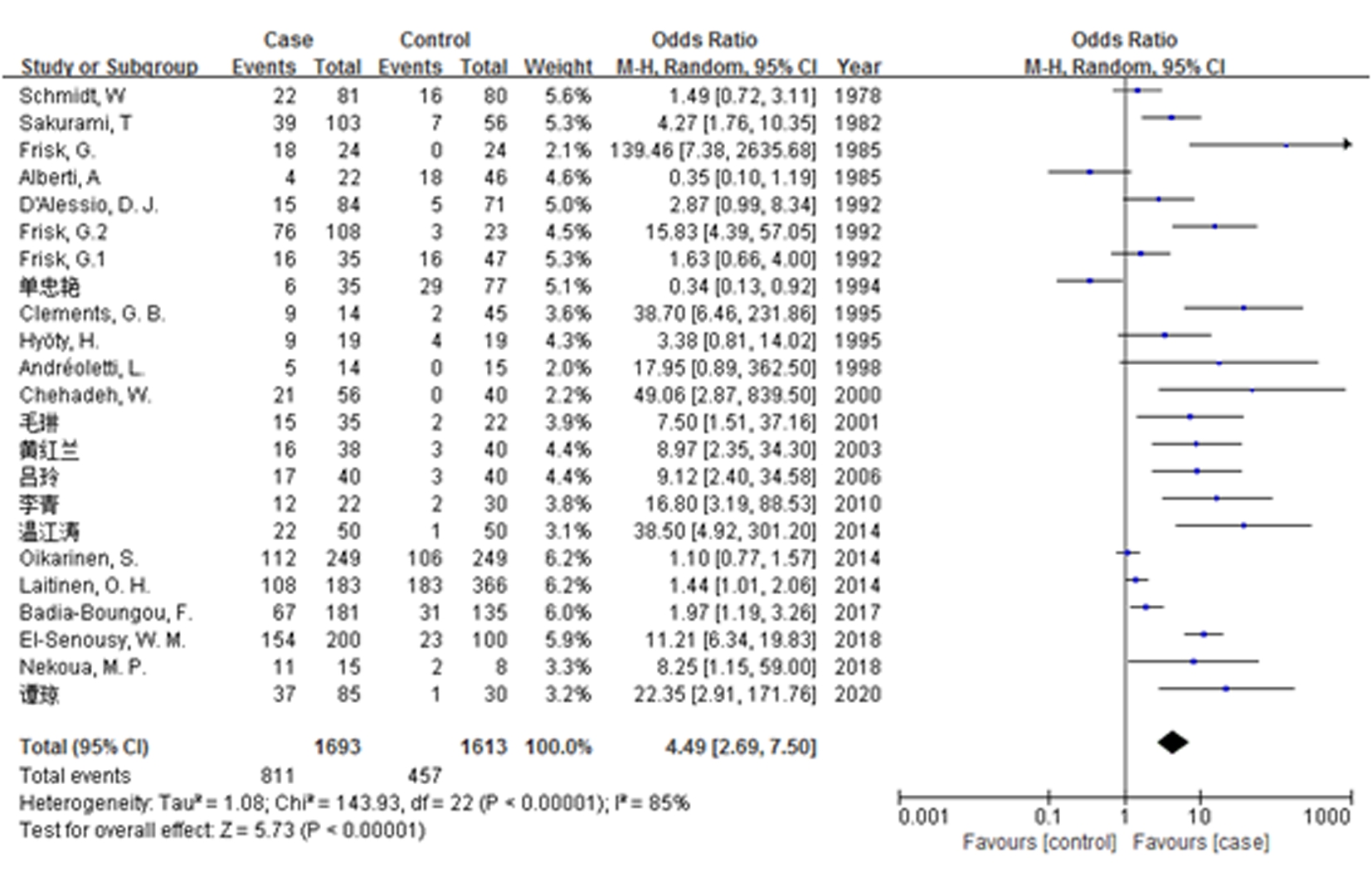
图2 CVB感染和T1DM风险相关性
Figure 2 CVB infection and risk of T1DM
2.3.2 纳入研究的亚组和亚型分析 对 23篇文献进行Meta分析后经异质性检验,提示各文献存在较高异质性(I2=85%)。当异质性≥50%,采用亚组分析或敏感性分析,寻找异质性来源。本文对研究地区,病毒检测方法,研究对象的年龄进行了亚组分析(表2),结果显示:病毒检测方法对研究结果影响较大。对研究地区进行亚组分析,中国地区研究分析结果显示T1DM感染CVB风险比对照组高7倍(OR=7.66,95%CI:1.87~31.37),I2=84%。其它地区研究分析结果显示T1DM感染CVB风险比对照组高4倍(OR=3.66,95%CI:2.10~6.38),I2=85%。
基于病毒的检测方法进行亚组分析(表2)。3 166例样本进行了抗CVB 抗体检测,结果显示T1DM感染CVB风险比对照组高4倍(OR=3.80,95%CI:2.24~6.45),I2=85%。1 700例样本使用中和抗体法检测CVB,结果显示T1DM感染CVB风险比对照组高2倍(OR=1.91,95%CI:1.26~2.89),I2=63%。299例样本采用放射免疫法检测CVB,结果显示T1DM感染CVB风险比对照组高7.40倍(OR=7.40,95%CI:1.52~35.94),I2=80%。371例样本进行了CVB核酸检测,结果显示T1DM感染CVB风险比对照组高15倍(OR=14.58,95%CI:7.00~30.38),I2=0%。730例样本采用的酶联免疫吸附测定法检测CVB,结果显示T1DM感染CVB风险比对照组高13倍(OR=12.09,95%CI:7.64~19.14),I2=0%。229例样本采用凝集素法检测CVB,分析结果显示T1DM感染CVB风险比对照组高1倍(OR=0.78,95%CI:0.19~3.26),I2=75%。根据样本的年龄进行亚组分析,儿童和青少年有2 500例,结果显示T1DM感染CVB风险比对照组高4倍(OR=4.23,95%CI:2.28~7.81),I2=87%。成年人有710例样本,结果显示T1DM感染CVB风险比对照组高5倍(OR=4.62,95%CI:1.55~13.74),I2=81%。
同时,本Meta分析对CVB各亚型与T1DM风险相关性进行了分析(表2)。检测CVB1的样本数为1 434例,结果显示T1DM感染CVB1风险比对照组高2倍(OR=1.56,95%CI:1.20~2.03),I2=0%。检测CVB2的样本数为1 516例,结果显示T1DM感染CVB2风险比对照组高1倍(OR=0.75,95%CI:0.75~1.20),I2=19%。检测CVB3的样本数为1 545例,结果显示T1DM感染CVB3风险比对照组高1倍(OR=1.57,95%CI:0.80~3.07),I2=63%。检测CVB4的样本数为1 845,结果显示T1DM感染CVB4风险比对照组高2倍(OR=1.61,95%CI:0.61~4.22),I2=92%。检测CVB5的样本数为1 357,结果显示T1DM感染CVB5风险比对照组高1倍(OR=1.18,95%CI:0.64~2.19) ,I2=51%。检测CVB6的样本数为1 227例,结果显示T1DM感染CVB6风险比对照组高1倍(OR=0.89,95%CI:0.63~1.26),I2=41%。因各种CVB检测方法或CVB亚型文献数量过少,所以未能将I2≥50%的文献进行下一步分析异质性来源。只有T1DM感染CVB1风险与对照组比较差异有统计学意义(P<0.05),T1DM感染其他CVB亚型与对照组的比较差异无统计学意义(P>0.05),但是总体上T1DM感染CVB及各亚型风险性相较于对照组增高。
2.4 敏感度分析 依次把每一篇文章剔除之后进行Meta分析,Meta分析结果前后差异不大,表明23篇研究的合并Meta分析结论是稳定的。
2.5 质量评价 10项研究属于中等质量研究,14项研究属于高质量研究,提示纳入meta分析的文章总体方法学质量良好(表2)。
表2 纳入研究的亚组和亚型分析
Table 2 Subgroup analysis of included studies and CVB subtype 1-6 and risk of T1DM
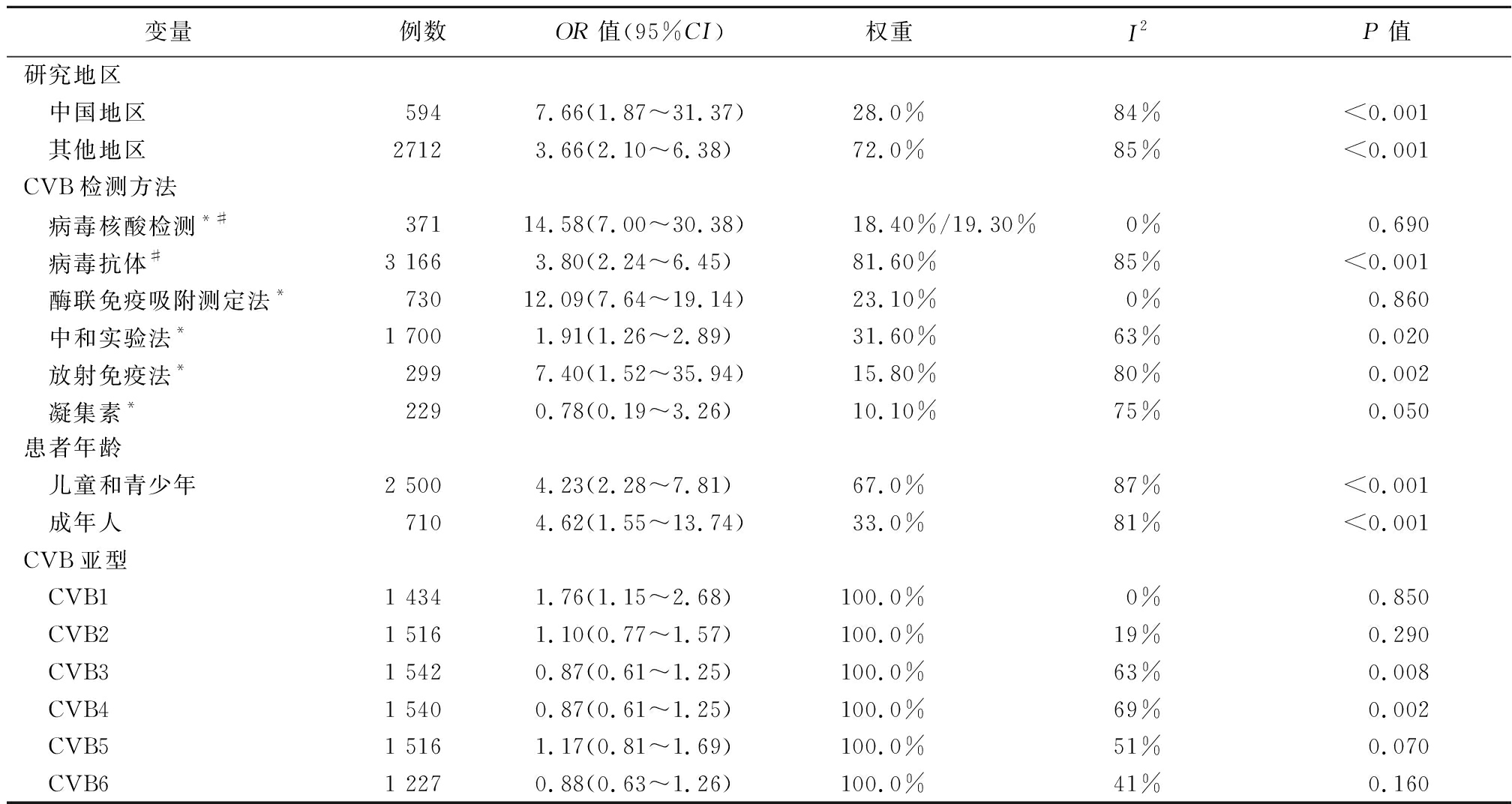
变量例数OR值(95%CI)权重I2P值研究地区 中国地区5947.66(1.87~31.37)28.0%84%<0.001 其他地区27123.66(2.10~6.38)72.0%85%<0.001CVB检测方法 病毒核酸检测*#37114.58(7.00~30.38)18.40%/19.30%0%0.690 病毒抗体#3 1663.80(2.24~6.45)81.60%85%<0.001 酶联免疫吸附测定法*73012.09(7.64~19.14)23.10%0%0.860 中和实验法*1 7001.91(1.26~2.89)31.60%63%0.020 放射免疫法*2997.40(1.52~35.94)15.80%80%0.002 凝集素*2290.78(0.19~3.26)10.10%75%0.050患者年龄 儿童和青少年2 5004.23(2.28~7.81)67.0%87%<0.001 成年人7104.62(1.55~13.74)33.0%81%<0.001CVB亚型 CVB11 4341.76(1.15~2.68)100.0%0%0.850 CVB21 5161.10(0.77~1.57)100.0%19%0.290 CVB31 5420.87(0.61~1.25)100.0%63%0.008 CVB41 5400.87(0.61~1.25)100.0%69%0.002 CVB51 5161.17(0.81~1.69)100.0%51%0.070 CVB61 2270.88(0.63~1.26)100.0%41%0.160
#第一次亚组分析只针对抗体和核酸两种检测方法进行分析;*第二次亚组分析针对抗体的不同检测方法进一步分析,权重改变数据未发生改变
2.6 发表偏倚 漏斗图显示无明显不对称,呈倒漏斗状,提示无发表偏倚(图3)。
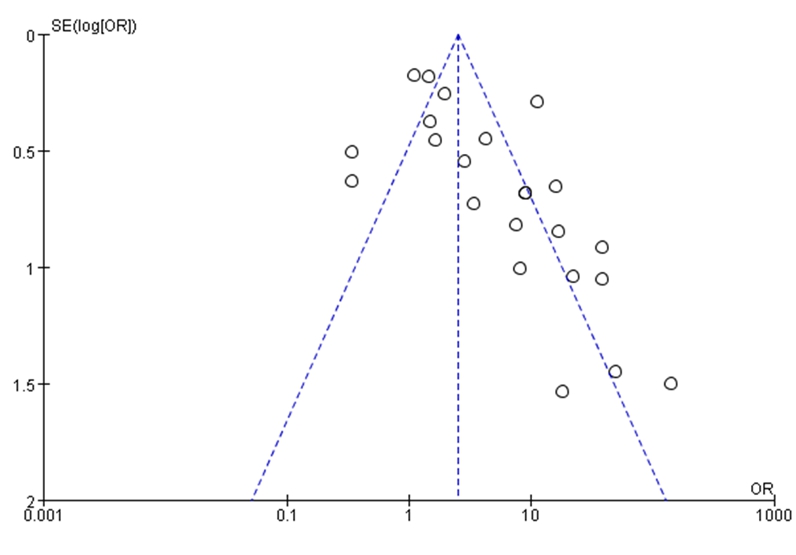
图3 23项研究发表偏倚图
Figure 3 Risk of bias of 23 included studies
3 讨 论
本Meta分析结果显示T1DM感染CVB风险比对照组高5倍,差异有统计学意义(P<0.05)。提示CVB感染与T1DM发生、发展有统计学相关性。T1DM病理变化为胰岛β细胞的破坏及功能障碍,引发体内胰岛素分泌不足,导致血糖升高及相关糖尿病并发症[36]。CVB引发糖尿病的具体机制主要有以下三方面:①CVB直接损伤胰岛β细胞,造成细胞损伤并降低其功能,不仅可引起β细胞溶解,而且能引起长期的胰腺β细胞的病理生理改变,使有功能的胰岛细胞逐渐丢失;②感染CVB后,胰岛周围腺体可呈现较强的免疫反应,病毒激发β细胞自身免疫,病毒感染后诱导主要组织相容复合物Ⅱ类抗原产生,β细胞能在免疫应答中提供自身抗原,自身抗原与增加的组织相容复合物Ⅱ类抗原激活自身反应性T细胞,释放白细胞介素及其它淋巴因子,产生一系列细胞免疫反应,导致胰岛细胞损伤;③因为CVB与胰岛β细胞有相同的表位,当CVB感染诱发机体免疫系统产生胰岛β细胞相关抗体后攻击胰腺组织,发生病理改变导致胰腺功能发生永久性损害[32,36]。
本Meta分析结果显示,T1DM感染CVB风险高于照组差异有统计学意义(P<0.05)。用漏斗图评价发表偏倚,结果显示漏斗图无明显不对称,提示无发表偏倚。为了探究高异质性来源,我们进行了亚组分析或敏感性分析。敏感性分析证明结果是稳固的。在基于CVB的检测方法进行的亚组分析中229例样本采用凝集素法检测CVB,分析结果显示T1DM感染CVB的风险增高,其余5种检测手段分析结果均显示CVB感染与T1DM发病存在相关性,只是相关强度各有不同。采用病毒核酸检测和酶联免疫吸附测定法检测CVB的研究之间不存在异质性。CVB亚型分析,2~6型CVB亚型感染存在导致T1DM的整体趋势,但不存在统计学意义(P>0.05)。CVB1可能促进T1DM的患病风险,差异有统计学意义(P<0.05)。
本研究的不足:① Meta分析结果存在较高异质性,进行亚组分析过后部分研究仍然存在异质性,仍需谨慎看待这项研究结果。分析异质性可能的来源,研究地区不同,确诊CVB感染的实验室方法不同,样本的年龄不同。②纳入研究全部参与者都是在医院进行的病例对照研究,而不是社区、卫生院等地方,可能存在入院率偏倚。③病例组样本可能存在患T1DM在CVB感染之前,而确诊T1DM在CVB感染之后,结果可能增加T1DM患者CVB感染的检出比例。④ 本Meta分析在进行CVB亚型分析时,存在异质性,由于每个亚型分析的总体样本量偏小,难以进行下一步亚型分析。⑤抗CVB抗体和CVB核酸检测导致的合成成果差异明显不同,相较于抗体检测,可能核酸检测病毒序列,影响因素较少。
虽然有学者将观察性研究认为是低质量的证据研究,但是全部观察性研究的方法学评估显示研究的整体质量良好,所以其合成的证据质量有仍然有一定程度的可靠性和真实性,为T1DM的防控策略提供了可信的循证医学证据。尚需大规模、多中心的队列随访研究来进一步证实。虽然目前T1DM的发病机制还未完全研究清楚,但是可以肯定的是T1DM的发生和发展是遗传易感体质在多种因素与自身免疫系统相互作用的结果,且T1DM在全球的发病率不断呈现上升趋势,据估计2040年全球糖尿病总数将达到6.42亿[37],中国的新发T1DM发病率也呈现明显上升的趋势[38]。本研究为及早开发针对CVB疫苗作为防控T1DM的策略提供了新思路和可靠的证据。
[1] Ilonen J,Lempainen J,Veijola R. The heterogeneous pathogenesis of type 1 diabetes mellitus[J]. Nat Rev Endocrinol,2019,15(11):635-650.
[2] 谭琼,张鸿,杨菊,等.柯萨奇B组病毒感染对1型糖尿病患儿胰岛功能的影响[J].临床误诊误治,2020,33(2):81-84.
[3] Knip M,Akerblom HK,Al TE,et al. Effect of hydrolyzed infant formula vs conventional formula on risk of type 1 diabetes:the TRIGR randomized clinical trial[J]. JAMA,2018,319(1):38-48.
[4] Perrett KP,Jachno K,Nolan TM,et al. Association of rotavirus vaccination with the incidence of type 1 diabetes in children[J]. JAMA Pediatr,2019,173(3):280-282.
[5] Ludvigsson F,Neovius M,Soderling J,et al. Maternal glycemic control in type 1 diabetes and the risk for preterm birth:a population-based cohort study[J]. Ann Intern Med,2019,170(10):691-701.
[6] Tapia G,Marild K,Dahl SR,et al. Maternal and newborn vitamin D-binding protein,vitamin D levels,vitamin D receptor genotype,and childhood type 1 diabetes[J]. Diabetes Care,2019,42(4):553-559.
[7] Sakurami T,Nabeya N,Nagaoka K,et al. Antibodies to coxsackie B viruses and HLA in japanese with juvenile-onset type 1(insulin-dependent) diabetes mellitus[J]. Diabetologia,1982,22(5):375-377.
[8] 孙国新,单忠艳,王宝辉,等.柯萨奇B病毒感染与Ⅰ型糖尿病的关系[J].中国医科大学学报,1994,23(2):130-133.
[9] 毛琳,李向群,王翔,等.柯萨奇B组病毒感染与儿童胰岛素依赖型糖尿病的相关性研究[J].基础医学与临床,2001,21(3):250-252.
[10] 黄红兰,李凡.柯萨奇B组病毒感染与胰岛素依赖型糖尿病关系的研究[J].微生物学杂志,2003,23(6):5-6.
[11] 吕玲.CVB病毒感染与1型糖尿病免疫失衡相关性研究[D].天津:天津医科大学病原生物学,2006.
[12] 李青,邢海燕,周颖,等.柯萨奇病毒感染及T淋巴细胞亚群的改变与1型糖尿病的关系研究[J].南方医科大学学报,2010,30(12):2699-2701.
[13] 温江涛,赵长新,李世宝,等.柯萨奇病毒和人巨细胞病毒感染与1、2型糖尿病的相关性研究[J/CD].中华临床医师杂志(电子版),2014,8(16):3044-3047.
[14] Schmidt WAK,Brade L,Müntefering H,et al. Course of coxsackie B antibodies during juvenile diabetes[J]. Med Microbiol Immunol,1978,164(4):291-298.
[15] Alberti AM,Amato C,Candela A,et al. Serum antibodies against Coxsackie B1-6 viruses in type 1 diabetics[J]. Acta Diabetol Lat,1985,22(1):33-38.
[16] Friman G,Fohlman J,Frisk G,et al. An Incidence Peak of Juvenile Diabetes. Relation to Coxsackie B Virus Immune Response[J]. Acta Paediatrica,1985,74(s320):14-19.
[17] Frisk G,Fohlman J,Kobbah M,et al. High frequency of coxsackie-B-virus-specific IgM in children developing type I diabetes during a period of high diabetes morbidity[J]. J Med Vir,1985,17(3):219-227.
[18] D′Alessio DJ. A case-control study of group b coxsackievirus immunoglobulin m antibody prevalence and HLA-DR antigens in newly diagnosed cases of insulin-dependent diabetes mellitus[J]. American J Epid,1992,135(12):1331-1338.
[19] Frisk G,Friman G,Tuvemo T,et al. Coxsackie B virus IgM in children at onset of type 1(insulin-dependent) diabetes mellitus: evidence for IgM induction by a recent or current infection[J]. Diabetologia,1992,35(3):249-253.
[20] Frisk G,Nilsson E,Tuvemo T,et al. The possible role of Coxsackie A and echo viruses in the pathogenesis of type I diabetes mellitus studied by IgM analysis[J]. J Infect,1992,24(1):13-22.
[21] Clements GB,Galbraith DN,Taylor KW. Coxsackie B virus infection and onset of childhood diabetes[J]. Lancet,1995,346(8969):221-223.
[22] Hyoty H,Hiltunen M,Knip M,et al. A prospective study of the role of coxsackie B and other enterovirus infections in the pathogenesis of IDDM[J]. Diabetes,1995,44(6):652-657.
[23] Andréoletti L,Hober D,Hober-Vandenberghe C,et al. Coxsackie B virus infection and beta cell autoantibodies in newly diagnosed IDDM adult patients[J]. Clin Diagn Virol,1998,9(2/3):125-133.
[24] Chehadeh W,Weill J,Vantyghem MC,et al. Increased level of interferon-α in blood of patients with insulin-dependent diabetes mellitus:relationship with coxsackievirus B infection[J]. J Infect Dis,2000,181(6):1929-1939.
[25] Laitinen OH,Honkanen H,Pakkanen O,et al. Coxsackievirus B1 is associated with induction of -cell autoimmunity that portends type 1 diabetes[J]. Diabetes,2014,63(2):446-455.
[26] Oikarinen S,Tauriainen S,Hober D,et al. Virus antibody survey in different European populations indicates risk association between coxsackievirus B1 and type 1 diabetes[J]. Diabetes,2014,63(2):655-662.
[27] Badia-Boungou F,Sane F,Alidjinou EK,et al. Marker of coxsackievirus-B4 infection in saliva of patients with type 1 diabetes[J]. Diabetes Metab Res Rev,2017,33(7):e2916.
[28] El-Senousy WM,Abdel-Moneim A,Abdel-Latif M,et al. Coxsackievirus B4 as a causative agent of diabetes mellitus type 1:is there a role of inefficiently treated drinking water and sewage in virus spreading?[J]. Food Environ Virol,2018,10(1):89-98.
[29] Nekoua MP,Yessoufou A,Alidjinou EK,et al. Salivary anti-coxsackievirus-B4 neutralizing activity and pattern of immune parameters in patients with type 1 diabetes: a pilot study[J]. Acta Diabetologica,2018,55(8):827-834.
[30] Heinimaki S,Hankaniemi MM,Sioofy-Khojine A B,et al. Combination of three virus-derived nanoparticles as a vaccine against enteric pathogens; enterovirus,norovirus and rotavirus[J]. Vaccine,2019,37(51):7509-7518.
[31] Jean-Baptiste V,Xia CQ,Clare-Salzler MJ,et al. Type 1 Diabetes and type 1 interferonopathies: localization of a type 1 common thread of virus infection in the pancreas[J]. EBio Medicine,2017,22:10-17.
[32] Christen U,von Herrath MG. Do viral infections protect from or enhance type 1 diabetes and how can we tell the difference?[J]. Cell Mol Immunol,2011,8(3):193-198.
[33] Liberati A,Altman DG,Tetzlaff J,et al. The PRISMA statement for reporting systematic reviews and meta-analyses of studies that evaluate health care interventions: explanation and elaboration[J]. PLoS Med,2009,6(7):1-27.
[34] Stroup DF,Berlin JA,Morton SC,et al. Meta-analysis of observational studies in epidemiology:a proposal for reporting.Meta-analysis of observational studies in epidemiology(MOOSE) group[J]. JAMA,2000,283(15):2008-2012.
[35] Wells G,Shea B,O′Connell D,et al. The newcastle-ottawa scale(NOS) for assessing the quality of nonrandomised studies in meta-analyses[EB/OL]. [2020/6/15]. http://www.ohri.ca/programs/clinical_epidemiology/oxford.asp.
[36] Wong FS,Tree TI. Historical and new insights into pathogenesis of type 1 diabetes[J]. Clin Exp Immunol,2019,198(3):292-293.
[37] Ogurtsova K,Da RFJ,Huang Y,et al. IDF diabetes atlas:global estimates for the prevalence of diabetes for 2015 and 2040[J]. Diabetes Res Clin Pract,2017,128:40-50.
[38] Weng J,Zhou Z,Guo L,et al. Incidence of type 1 diabetes in China,2010-13: population based study[J]. BMJ,2018,360:1-9.