复杂性尿路感染是泌尿系统在功能上如梗阻、结石等或解剖上或在肾外合并疾病如免疫力低下、糖尿病等,存在持续发作或反复发作的尿路感染[1]。复杂性尿路感染易复发,临床治愈率低,且容易反复发作,临床主要表现为尿急、尿频、尿痛等,若不及时治疗,可导致尿脓毒血症、全身炎症反应,严重时可引发感染性休克以及多器官功能衰竭,或出现肾萎缩,引发慢性肾功能衰竭[2]。因此,在治疗复杂性尿路感染时选择抗感染疗效好、安全性高的抗菌药物尤为重要。头孢他啶为第三代半合成头孢菌素,抗菌谱较广,对多数革兰阴性菌和革兰阳性菌有效,其对革兰阴性菌的作用较第一、二代头孢菌素强,且对大多数β-内酰胺酶耐受,在临床上常用于敏感菌所致呼吸道、泌尿道、耳鼻喉、胃肠等部位感染[3]。目前关于头孢他啶联合左氧氟沙星治疗尿路感染的研究较多,但关于头孢他啶不同给药频次对于治疗尿路感染的研究文献罕见报道。因此,本研究旨在观察头孢他啶不同给药频次对于复杂尿路感染的疗效比较,并采用药物经济学方法对成本-效果进行分析,以期为临床提供更加合理、有效、安全、经济用药方案。
1 资料与方法
1.1 一般资料 选择2019年1—12月于我院肾内科住院的复杂尿路感染患者153例,将所有患者随机分为A、B、C组,每组51例。A组男性25例,女性26例,年龄19~65岁,平均(42.11±6.13)岁;B组男性26例,女性25例,年龄18~63岁,平均(40.21±7.25)岁;C组男性24例,女性27例,年龄18~66岁,平均(43.51±7.01)岁。3组患者临床资料差异无统计学意义(P>0.05),具有可比性。
本研究经医院伦理委员会批准通过,所有患者均同意并签署知情同意书。
1.2 纳入标准和排除标准 纳入标准:①年龄大于18周岁者;②实验室检查和影像学检查符合复杂性尿路感染诊断标准者[4];③治疗前48 h内未接受抗生素治疗者;④头孢他啶皮试阴性者;排除标准:①对头孢他啶过敏者;②合并心脏、肝脏、肾脏功能严重损害者;③妊娠或哺乳期妇女;④合并全身严重感染者;⑤合并恶性肿瘤、自身免疫系统疾病者;⑥合并精神障碍等其他状态者。
1.3 治疗方法 所有患者均给予饮食和健康指导等常规治疗以及对症治疗。A组给予注射用头孢他啶1 g(韩美药品株式会社,1.0 g/支)静脉滴注,12 h/次;B组给予注射用头孢他啶1 g静脉滴注,8 h/次;C组给予注射用头孢他啶2 g静脉滴注,12 h/次。3组均以1周为1个治疗周期。
1.4 头孢他啶药代动力学/药效学(pharmaco kinetics/pharmaco dynamics,PK/PD)参数
1.4.1 HPLC法测定头孢他啶血浆药物浓度 样品处理:血浆样品200 μL,加入600 μL甲醇后采用涡旋振荡1 min,离心(14 500 r/min,10 min),取600 μL上清液并加入600 μL纯化水,涡旋振荡1 min,待进样。色谱条件:色谱柱为Spursil ODS C18柱(250 mm×4.6 mm,5 μm);流动相为0.01 mol/L磷酸二氢钠水溶液(pH 6.5)-乙腈(91∶9,v/v),检测波长为254 nm,流速为1.0 mL/min,进样量为30 μL,柱温为30 ℃。头孢他啶注射剂至少应用3个剂量后,所有患者于下次给药前5 min静脉采血2~3 mL,进行血样预处理以及HPLC测定头孢他啶浓度。
1.4.2 PK/PD参数计算 头孢他啶为时间依赖型抗菌药物,常以给药间隔内游离血药浓度超过致病菌最小抑菌浓度(minimum inhibitory concentration,MIC)的时间(T>MIC)作为PK/PD参数,本研究以100%T>MIC为PK/PD靶值,作为评价标准计算最终达标率。
1.5 观察指标
1.5.1 疗效判断 根据《抗菌药物临床研究指导原则》[5]对疗效进行判定,将疗效分为4级,包括痊愈、显效、进步、无效。痊愈:症状、体征、实验室及病原学检查均恢复至正常;显效:治疗后病情好转,症状、体征、实验室及病原学检查中3项恢复至正常;进步:症状、体征好转,实验室及病原学检查未恢复至正常;无效:症状、体征、实验室及病原学检查均无好转或进一步加重。总有效率=痊愈+显效。
1.5.2 临床症状 观察3组患者治疗前后的临床症状如尿急、尿频、尿痛等消退时间、尿检白细胞转阴时间以及退热时间。
1.5.3 实验室指标 分别在治疗前、治疗后对3组患者的降钙素原(procalcitonin,PCT)、血清超敏C反应蛋白(serum hypersensitive C-reactive protein,hs-CRP)、白细胞介素(interleukin,IL)-6、IL-8和病原学进行检查。病原学检查对治疗前后的患者的中段尿进行细菌培养,观察尿培养的转阴率。药品不良反应根据世界卫生组织不良反应分类原则对不良反应进行评价。
1.6 药物经济学评价[6]
1.6.1 治疗成本是指疾病治疗过程中消耗的资源,包括直接成本、间接成本和隐形成本。直接成本=治疗成本(包括检查费、住院费和药品费)。患者及家属产生的交通费、住宿费、医疗误工等间接成本和隐形成本个体之间差异较大,故本研究忽略不计。为便于成本-效果分析,本文的成本是指直接成本。
1.6.2 成本-效果分析 成本-效果比(cost/effectiveness,C/E)[7]表示不同治疗方案每达到一个单位效果所需花费的成本,比值越低,方案的治疗效果、经济型越好。增量成本-效果比(ΔC/ΔE)[8]是指增量成本与增量效果的比值,一般以成本最低的治疗方案为标准,其他方案的成本效果与之相比较,ΔC/ΔE的值越小,则说明每增加一个单位的额外效果,所需成本更少,说明治疗方案的实际意义更大,能够更加客观准确的判断方案的优势性。
1.6.3 敏感度分析 敏感度分析用于检测成本-效果分析的可靠性[9],是指对研究中某些变量的数值进行调整后,确定最终结果的变化范围,进而判断研究结果是否稳定。
1.7 统计学方法 应用SPSS 19.0统计软件处理数据。计量资料比较采用单因素方差分析、SNK-q检验和配对t检验,计数资料采用χ2检验,等级资料比较采用秩和检验。P<0.05 为差异有统计学意义。
2 结 果
2.1 临床疗效比较 对3组临床疗效总有效率比较,差异无统计学意义(P>0.05);秩和检验结果显示,3组临床疗效比较差异有统计学意义(P<0.05),见表1。
表1 3组临床疗效比较
Table 1 Comparison of clinical efficacy of three groups (n=51,例数)
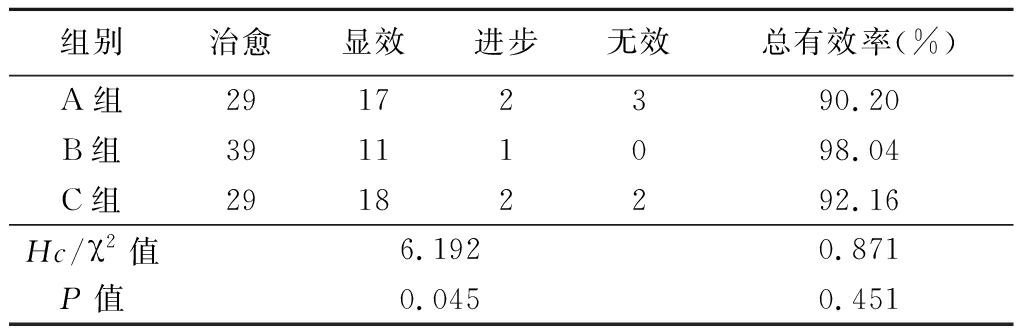
组别治愈显效进步无效总有效率(%)A组29172390.20B组39111098.04C组29182292.16Hc/χ2值6.1920.871P值0.0450.451
2.2 临床症状比较 治疗后,B组的临床症状消退时间、尿检白细胞转阴时间和退热时间显著低于A组和C组,且C组低于A组,差异有统计学意义(P<0.05)。见表2。
表2 3组相关症状转阴时间比较
Table 2 Comparison of negative conversion time of related
symptoms in three groups![]()
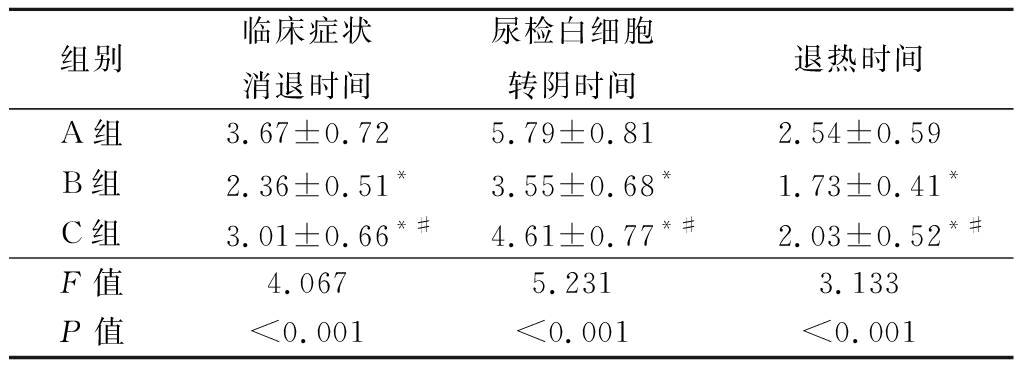
组别临床症状消退时间尿检白细胞转阴时间退热时间A组3.67±0.725.79±0.812.54±0.59B组2.36±0.51*3.55±0.68*1.73±0.41*C组3.01±0.66*#4.61±0.77*#2.03±0.52*#F值4.0675.2313.133P值<0.001<0.001<0.001
*P值<0.05与A组比较 #P值<0.05与B组比较(SNK-q检验)
2.3 实验室检查指标比较 治疗前,3组PCT、IL-6、hs-CRP和IL-8水平比较差异无统计学意义(P>0.05);治疗后,3组的PCT、IL-6、hs-CRP和IL-8水平明显降低,差异有统计学意义(P<0.05),其中B组的PCT、IL-6、hs-CRP和IL-8水平最低,C组次之,A组最高,见表3。
表3 3组临床指标比较
Table 3 Comparison of clinical indicators in three groups![]()
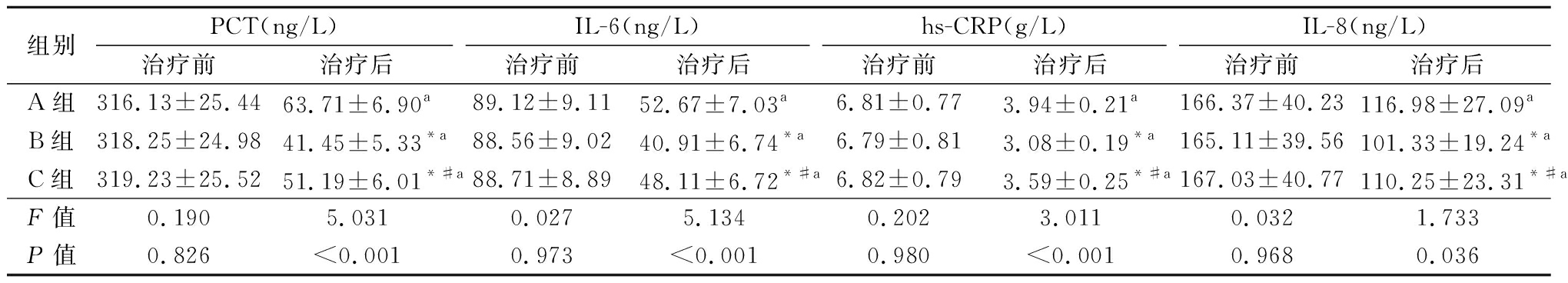
组别PCT(ng/L)治疗前治疗后IL-6(ng/L)治疗前治疗后hs-CRP(g/L)治疗前治疗后IL-8(ng/L)治疗前治疗后A组316.13±25.4463.71±6.90a89.12±9.1152.67±7.03a6.81±0.773.94±0.21a166.37±40.23116.98±27.09aB组318.25±24.9841.45±5.33*a88.56±9.0240.91±6.74*a6.79±0.813.08±0.19*a165.11±39.56101.33±19.24*aC组319.23±25.5251.19±6.01*#a88.71±8.8948.11±6.72*#a6.82±0.793.59±0.25*#a167.03±40.77110.25±23.31*#aF值0.1905.0310.0275.1340.2023.0110.0321.733P值0.826<0.0010.973<0.0010.980<0.0010.9680.036
*P值<0.05与A组比较 #P值<0.05与B组比较(SNK-q检验) aP值<0.05与治疗前组比较(配对t检验)
2.4 病原学检查结果 治疗后经病原学检查,A组的尿培养阳性6例,阴性45例,尿培养转阴率为88.24%;B组的尿培养阳性3例,阴性48例,尿培养转阴率为94.12%;C组的尿培养阳性5例,阴性46例,尿培养转阴率为90.20%,比较3组尿培养转阴率,差异无统计学意义(P>0.05),见表4。
表4 3组病原学检查结果
Table 4 Results of pathogenic examinations in three groups (n=51)
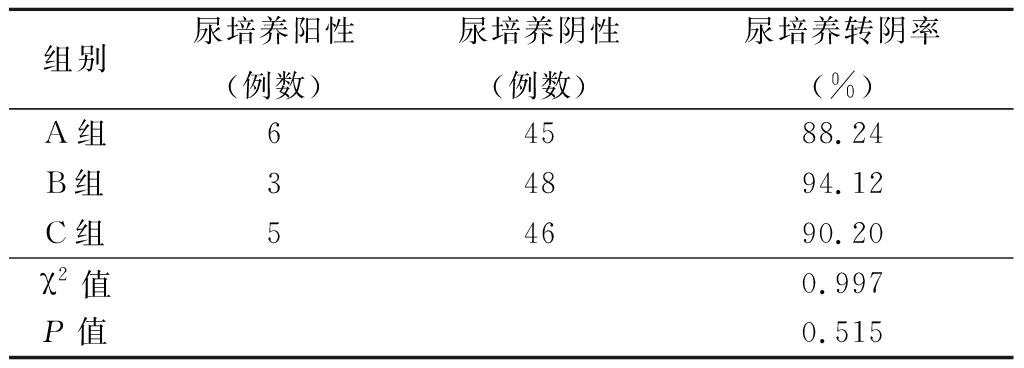
组别尿培养阳性(例数)尿培养阴性(例数)尿培养转阴率(%)A组64588.24B组34894.12C组54690.20χ2值0.997P值0.515
2.5 头孢他啶PK/PD达标率 治疗后,经HPLC测定头孢他啶血药浓度计算得100%T>MIC达标率,A组为35例,B组为43例,C组为37例,达标率分别为72.55%、84.31%、76.47%,比较3组头孢他啶PK/PD达标率,差异有统计学意义(χ2=6.100,P=0.047)。
2.6 药品不良反应评价 在治疗期间,A组患者存在2例胃肠道反应,皮疹1例,不良反应发生率为5.88%;B组患者存在胃肠道反应1例,不良反应发生率为1.96%;C组患者存在胃肠道反应1例,皮疹1例,不良反应发生率为3.92%,3组比较差异无统计学意义(χ2=0.718,P=0.366)。3组患者停药后不良反应消失,发生皮疹的患者给予对症处理后缓解。
2.7 成本确定 药品费用:A组为(9.8×2×7=137.2元);B组为(9.8×3×7=205.8元);C组为(9.8×2×2×7=274.4元)。患者均住3人间,床位费每天30元,护理费和诊查费为每人每天20元,住院费为(30+20+20)×7=490元。检查项目为尿常规、血常规、血生化及尿细菌培养,总额为每人305元。因此A组的总成本(C)=137.2+490+305=932.2元;B组总成本(C)=205.8+490+305=1 000.8元;C组总成本(C)=274.4++490+305=1 069.4元。
2.8 成本-效果分析 3组的(C/E)分别为A组10.33;B组10.21;C组11.60,B组最低。以最低成本方案为参考进行增量成本-效果分析,结果显示,A组和C组方案的ΔC/ΔE分别为9.77和-11.70。见表5。
表5 3组成本-效果分析
Table 5 Cost-effectiveness analysis in three groups
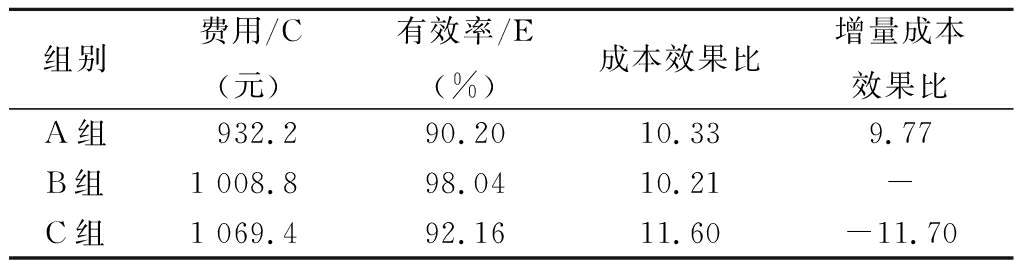
组别费用/C(元)有效率/E(%)成本效果比增量成本效果比A组932.290.2010.339.77B组1 008.898.0410.21-C组1 069.492.1611.60-11.70
2.9 敏感度分析 随着医改和“4+7”国家集中采购政策的实施[11],药品降价已成必然趋势,故假设其他费用不变,药品价格下降15%进行敏感度分析。结果无变化,B组仍优于A组和C组,见表6。
表6 3组方案敏感度分析
Table 6 Sensitivity analysis of three schemes
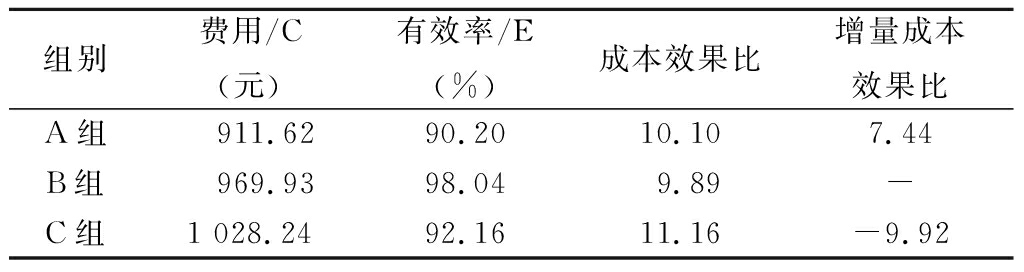
组别费用/C(元)有效率/E(%)成本效果比增量成本效果比A组 911.6290.2010.107.44B组 969.9398.049.89-C组1 028.2492.1611.16-9.92
3 讨 论
复杂性尿路感染为临床上常见的一种泌尿系统疾病,一般指发生尿路感染的同时发生获得性感染,或者在尿路感染治疗失败后引发输尿管、膀胱等结构和功能异常,由于其反复易发等特点,极易导致肾功能减退,因此需及时进行治疗[10-11]。头孢他啶为广谱的时间依赖性的抗菌药物,可通过结合细菌细胞膜上的青霉素结合蛋白,酰化转肽酶,使细菌细胞壁上的黏肽成分发生交叉连结受到影响,细菌细胞壁的合成被抑制,进而抑制细胞的生长和分裂,最终引起细菌的溶解和死亡[12-13]。头孢他啶在给药后可迅速分布于体内组织,血药浓度高,见效快,且不会在机体内代谢转化,作用后很快即可随尿液排出体内,安全性高[14]。时间依赖性抗菌药物的药动学/药效学参数为其MIC小于体内浓度的时间[15]。当机体的药物浓度大于MIC的时间为40%~50%时,其细菌清除率高达85%。因此,本研究采取不同剂量、不同给药频率的治疗方案,来观察其治疗效果。结果显示,头孢他啶1 g,12 h/次、1 g ,8 h/次和2 g,12 h/次3种方案均可有效治疗复杂性尿路感染,其总有效率来讲B组的临床疗效最佳。对临床症状消退时间、尿检白细胞转阴时间和退热时间进行比较,B组时间最短。进一步观察炎性因子指标,3组的PCT、IL-6、hs-CRP和IL-8水平明显降低,其中B组的PCT、IL-6、hs-CRP和IL-8水平最低,表明头孢他啶可明显降低机体的炎症反应,其中头孢他啶给药剂量为1 g、8 h/次给药频率的临床疗效最好,机体炎症反应显著减轻。
近年来,随着大量抗菌药物的使用以及滥用,引发多数致病菌出现耐药现象,增加了复杂性感染的治疗难度。因此,在治疗过程中,筛选合适的抗菌药物以及合理的给药方案具有重要意义[16]。在本研究中,中段尿细菌培养转阴率结果表明表明A、B、C 3种治疗方案均能有效杀灭病原菌,其中B组的给药方案尿培养转阴率最高,这可能与头孢他啶为时间依赖性药物有关,3组头孢他啶PK/PD达标率结果显示,B组治疗方案达标率最高,因此小剂量增加给药次数可增加临床疗效、增强抗菌作用。
随着泌尿生殖系统疾病患者的增多,其医疗费用也随之增长,对医疗需求的迅猛增长与有限医疗资源的平衡,已成为医疗相关部门的关注焦点。对临床治疗方案采用药物经济学分析,可有效地帮助医药经费的合理分配,有助于临床医生、药师在临床决策时选择最佳的治疗方案,以最小成本获取最大效益,下降医疗成本,减轻患者与社会的经济负担[17]。本研究对比三组的成本-效果分析,结果显示,B组的C/E最低,表明B组为最佳治疗方案。若药品价格下降15%后分析成本-效果,结果无变化,B组仍优于A组和C组。
综上所述,采用头孢他啶1 g、8 h/次给药频率的临床疗效最好,症状改善明显,机体炎症反应显著减轻,尿培养转阴率最高,更具成本-效果优势,为安全、有效、经济的治疗方案,可供临床参考。
[1] 覃新芳,李清初,邹迪莎,等.复杂性尿路感染的研究进展[J].内科,2018,13(3):363-366.
[2] Ana FM,Teri NH,David AH. Pathophysiology,treatment,and prevention of catheter-associated urinary tract infection[J]. Top Spinal Cord Inj Rehabil,2019,25(3):228-240.
[3] Alidjanov JF,Moritz F,Hoffman I,et al. Ceftazidime-avibactam:novel antimicrobial combination for the treatment of complicated urinary tract infections[J]. Future Microbiol,2017,12:655-670.
[4] 那彦群,叶章群.中国泌尿外科疾病诊断治疗指南[M].北京:人民卫生出版社,2014:426-428.
[5] 国家卫生计生委办公厅,国家中医药管理局办公室,解放军总后勤部卫生部药品器材局.抗菌药物临床应用指导原则(2015年版)[S].2015-07-24.
[6] Langley PC,Sullivan SD.Pharmacoeconomic evaluations:guidelines for drug purchasers[J].J Manag Care Spec Pharm,2020,26(6):689-695.
[7] Han JQ,Tian K,Yang JP,et al. Durvalumab vs placebo consolidation therapy after chemoradiotherapy in stage Ⅲ non-small-cell lung cancer:An updated PACIFIC trial-based cost-effectiveness analysis[J]. Lung Cancer,2020,146:42-49.
[8] Thathya VA,Zanfina A,Richard OA,et al. The cost-effectiveness of guideline-driven use of drug-eluting stents:propensity-score matched analysis of a seven-year multicentre experience[J]. Cur Med Res Opin,2020,36(3):419-426.
[9] 刘新义,谭重庆,曾小慧,等.分区生存模型在药物经济学评价中的应用简介及实例解析[J].中国现代应用药学,2019,36(24):3090-3093.
[10] 何虹,黄际薇,李艳芳,等.公立医院落实国家药品集中采购的实践与思考[J].中国医院管理,2020,40(7):88-89.
[11] 孙涛,贾洪涛,王秀新,等.复杂性尿路感染的病原菌分布及革兰阴性杆菌的耐药性分析[J].国际泌尿系统杂志,2018,38(2):237-240.
[12] Li JG,Lovern M,Green ML,et al. Ceftazidime-avibactam population pharmacokinetic modeling and pharmacodynamic target attainment across adult indications and patient subgroups[J]. Clin Transl Sci,2019,12(2):151-163.
[13] Kristoffersson AN,Bissantz C,Okujava R,et al. A novel mechanism-based pharmacokinetic-pharmacodynamic(PKPD) model describing ceftazidime/avibactam efficacy against β-lactamase-producing Gram-negative bacteria[J]. J Antimicrob Chemother,2020,75(2):400-408.
[14] Wang HH,Li XA,Sun SS,et al. Population pharmacokinetics and dosing simulations of ceftazidime in Chinese neonates[J].J Pharm Sci,2018,107(5):1416-1422.
[15] 肖永红.利用抗菌药物PK/PD优化感染治疗[J].中国抗生素杂志,2017,42(12):1033-1039.
[16] Brinkac L,Voorhies A,Gomez A,et al. The Threat of antimicrobial resistance on the human microbiome[J]. Microb Ecol,2017,74(4):1001-1008.
[17] 马爱霞,张籍元,钱焊森,等.医保支付价背景下药物经济学评价的应用探索[J].中国卫生经济,2018,37(2):74-76.