急性脑梗死是神经科常见的疾病类型之一,伴有高血压病、冠心病、糖尿病、高脂血症和吸烟、饮酒、肥胖者均为此病的高发人群[1]。研究指出,急性脑梗死在全球范围内的发病率呈逐步升高的趋势,是成年人致残和致死的一种常见原因,严重影响患者和家属的生活质量,加重患者家庭和社会负担[2]。目前,有关急性脑梗死的具体发病机制尚未完全明确,但已有研究显示,机体炎症因子、血脂代谢水平等方面均与急性脑梗死的发病密切相关[3-4]。另有研究指出,急性脑梗死的发病与机体凝血功能存在一定关系[5]。为此,本研究探讨联合检测超敏C反应蛋白(hypersensitive C-reactive protein,hs-CRP)、同型半胱氨酸(homocysteine,Hcy)及凝血功能对急性脑梗死病情严重程度的评估价值。
1 资料与方法
1.1 一般资料 选取安徽省蚌埠市第一人民医院2016年12月—2018年12月收治的106例急性脑梗死患者(病例组),根据患者发病96 h内有无神经功能症状进行性加重,分为进展组(50例)和未进展组(56例),并同期选择体检健康者45例作为对照组。病例组男性57例,女性49例;年龄35~78岁,平均(55.15±10.34)岁;大动脉粥样硬化50例,心源性阻塞20例,小动脉阻塞19例,不明原因17例。对照组男性28例,女性17例;年龄38~75岁,平均(54.45±9.08)岁。两组性别和年龄比较差异均无统计学意义(P>0.05)。纳入标准:①病例组均符合急性脑梗死的诊断标准[6];②病例组发病前1个月内未服用过抗血小板聚集、抗凝血或溶栓类药物;③对照组既往无严重急慢性疾病;④自愿签署知情同意书。排除标准:①合并严重肝肾功能损伤;②合并严重感染性疾病、恶性肿瘤;③处于哺乳期或妊娠期;④合并心血管疾病、自身免疫性疾病、血液系统疾病、肺部疾病、精神性疾病或其他出血性脑血管疾病等;⑤合并糖尿病;⑥合并深静脉血栓;⑦合并炎症状态。
本研究经医院医学伦理委员会审批通过。
1.2 检测方法 分别于对照组体检之日和病例组入院后次日,取其清晨空腹外周静脉血5 mL,置于抗凝管中,充分混匀,3 000 r/min离心10 min,分离血浆,通过全自动生化分析仪(美国贝克曼×库尔特公司,AU5811型)检测血脂四项指标,包括总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density liptein cholesterol,HDL-C);采用全自动血液分析仪(日本Sysmex公司,XT-2000i型)检测D-二聚体和Fib;通过循环酶法检测血清Hcy,试剂盒由广州健仑生物科技有限公司提供;通过放射免疫法检测血清hs-CRP,试剂盒由北京奥维亚生物技术有限公司提供,严格根据说明书指示进行操作,采血2 h内完成检测。
1.3 统计学方法 应用SPSS 23.0统计软件分析数据。计量资料比较采用t检验,计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组血脂代谢水平比较 各组血脂代谢指标比较差异存有统计学意义(P<0.05)。病例组TC、TG及LDL-C的水平较对照组明显增加(P<0.05),HDL-C的水平较对照组明显下降(P<0.05)。进展组TC、TG及LDL-C的水平较未进展组明显升高(P<0.05),HDL-C的水平较未进展组明显下降(P<0.05)。见表1~2。
表1 对照组与病例组血脂代谢水平比较
Table 1 Comparison of blood lipid metabolism level
between control group and case group![]()
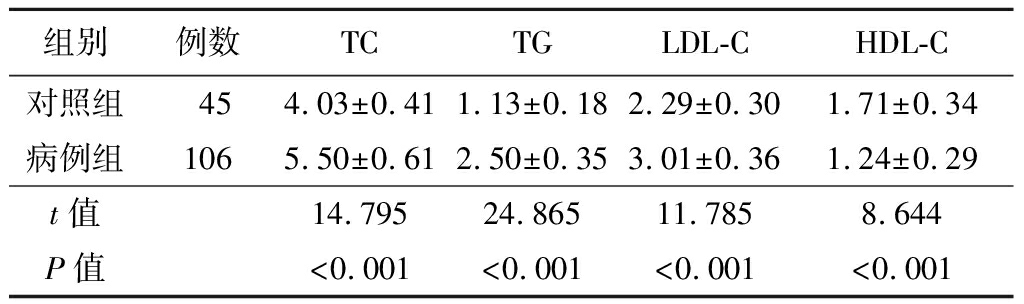
组别例数TCTGLDL-CHDL-C对照组454.03±0.411.13±0.182.29±0.301.71±0.34病例组1065.50±0.612.50±0.353.01±0.361.24±0.29t值14.79524.86511.7858.644P值<0.001<0.001<0.001<0.001
2.2 各组血清hs-CRP和Hcy水平比较 各组血清hs-CRP和Hcy水平比较差异均有统计学意义(P<0.05)。病例组血清hs-CRP和Hcy的水平较对照组明显增加(P<0.05)。进展组血清hs-CRP和Hcy的水平较未进展组明显升高(P<0.05)。见表3~4。
表2 未进展组与进展组血脂代谢水平比较
Table 2 Comparison of blood lipid metabolism levels between
the non-progressive group and the progressive group![]()
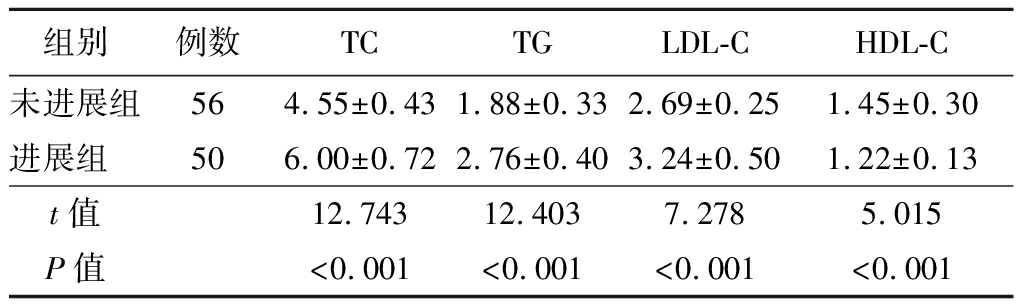
组别例数TCTGLDL-CHDL-C未进展组564.55±0.431.88±0.332.69±0.251.45±0.30进展组 506.00±0.722.76±0.403.24±0.501.22±0.13t值12.74312.4037.2785.015P值<0.001<0.001<0.001<0.001
表3 对照组与病例组血清hs-CRP和Hcy水平比较
Table 3 Comparison of serum hs-CRP and Hcy levels
between control group and case group![]()
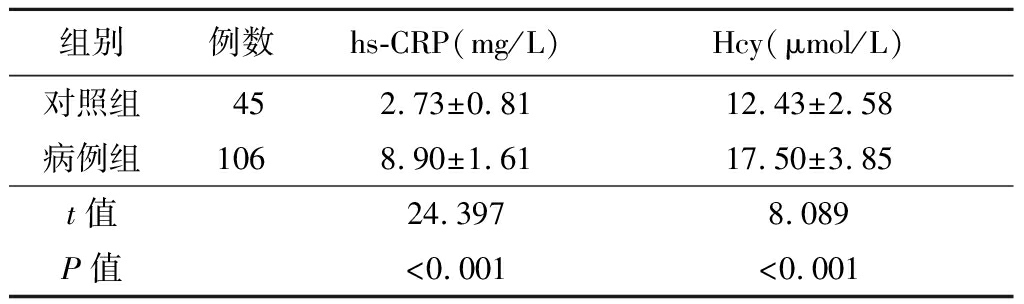
组别例数hs-CRP(mg/L)Hcy(μmol/L)对照组452.73±0.8112.43±2.58病例组1068.90±1.6117.50±3.85t值24.3978.089P值<0.001<0.001
表4 未进展组与进展组血清hs-CRP和Hcy水平比较
Table 4 Comparison of serum hs-CRP and Hcy levels
between the non-progressive group and the progressive group![]()
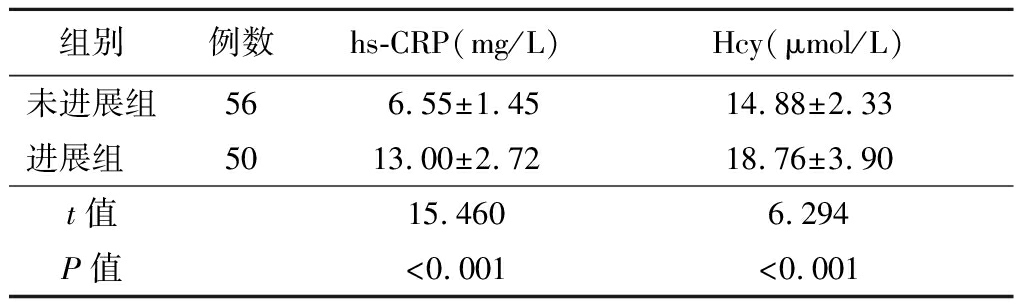
组别例数hs-CRP(mg/L)Hcy(μmol/L)未进展组566.55±1.4514.88±2.33进展组 5013.00±2.7218.76±3.90t值15.4606.294P值<0.001<0.001
2.3 各组血清Fib和D-二聚体水平比较 各组血清Fib和D-二聚体水平比较差异均有统计学意义(P<0.05)。病例组血清Fib和D-二聚体水平较对照组明显升高(P<0.05),进展组血清Fib和D-二聚体水平较未进展组明显升高(P<0.05),见表5~6。
表5 对照组与病例组血清Fib和D-二聚体水平的比较
Table 5 Comparison of serum Fib and D-dimer levels
between control group and case group![]()
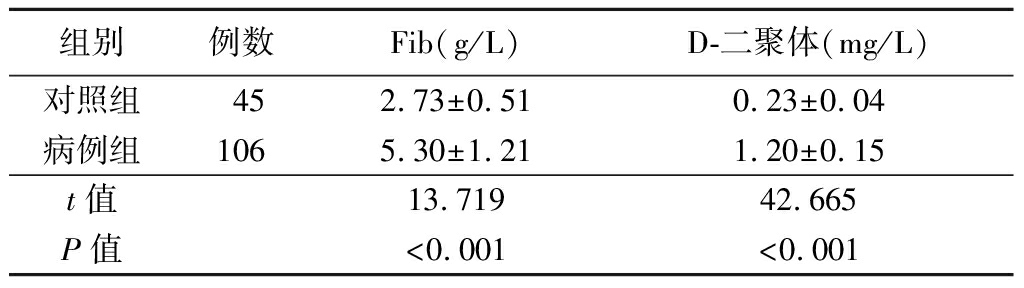
组别例数Fib(g/L)D-二聚体(mg/L)对照组452.73±0.510.23±0.04病例组1065.30±1.211.20±0.15t值13.71942.665P值<0.001<0.001
表6 未进展组与进展组血清Fib和D-二聚体水平的比较
Table 6 Comparison of serum Fib and D-dimer levels
between the non-progressive group and the progressive group![]()
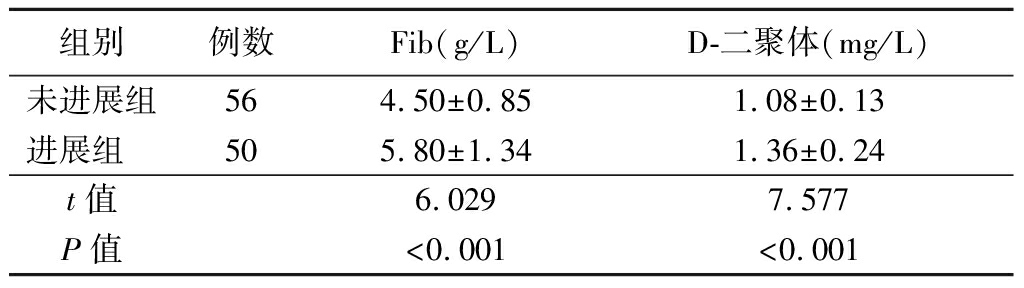
组别例数Fib(g/L)D-二聚体(mg/L)未进展组564.50±0.851.08±0.13进展组 505.80±1.341.36±0.24t值6.0297.577P值<0.001<0.001
3 讨 论
脑梗死是因脑局部血液供应不足而导致的缺氧、缺血性坏死,通过疾病的动态演变可引起不同程度的神经功能障碍,危害患者身心健康,使得患者生活质量下降,对预后状况造成极大的影响[7]。脑梗死以往多发于中老年人群,但在近年来该病呈现年轻化的趋势,其原因可能与年轻人群酗酒、吸烟、工作和生活压力加大等方面密切相关[8]。急性脑梗死是多因素综合作用而引起,如动脉管壁病变、血液成分改变、血流动力学改变等均是主要的致病原因[9]。研究指出,高脂血症是心脑血管疾病发病的主要影响因素,其与动脉粥样硬化密切相关,并且脂质大量聚集于血管内皮细胞而直接导致血管内皮细胞及其功能损伤,使得血液黏度提高,并进一步导致脑梗死[10-11]。本研究结果发现,各组血脂代谢指标比较差异均有统计学意义。病例组TC、TG及LDL-C水平较对照组明显增加,HDL-C水平较对照组明显下降。进展组TC、TG及LDL-C水平较未进展组明显升高,HDL-C水平较未进展组明显下降,与既往研究报道相符[12]。结果表明,急性脑梗死患者出现明显的血脂代谢紊乱,且各项血脂代谢指标的水平与患者病情进展程度存在密切关系,由此提示在急性脑梗死分和发展的病理过程中,血脂代谢紊乱发挥重要的促进作用。
作为临床常用的一种炎症标志物,hs-CRP是急性时相反应蛋白之一,其在机体出现创伤、感染时的含量快速增加,是心脑血管事件的敏感因子[13-14]。在血栓形成和动脉粥样硬化发生过程中,炎症反应发挥着重要的作用,且炎症反应亦是导致斑块不稳定、破裂的主要原因[15]。本研究结果显示,各组血清hs-CRP水平比较差异均有统计学意义;病例组血清hs-CRP水平较对照组明显增加;进展组血清hs-CRP水平较未进展组明显升高。急性脑梗死的发病不仅与炎症性反应密切相关,而且与机体凝血功能改变有关。Fib和D-二聚体均是临床常用于反映凝血功能的指标,其中Fib是一种重要的凝血因子,是炎性反应急性期蛋白之一,亦是急性脑梗死发病的主要高危因素,其作用主要在于通过趋化血管内皮细胞而引起血管内皮细胞损伤,进而导致凝血速度加快,亦可导致血浆增多使得全血黏度增加。Fib是血浆中的一种流动的蛋白质,可反映血液黏度,而血液黏度与血栓形成有关,同时Fib的降解产物——纤维蛋白可直接参与凝血过程。并且,Fib可通过介导血小板聚集而诱发血栓形成,亦可通过诱导血管平滑肌细胞增生,引起血管壁受损,进而在动脉粥样硬化的发生和发展过程中发挥着重要的作用[16-17]。D-二聚体是评估凝血和纤维蛋白溶解功能的一种重要分子标志物,在评估血液高凝状态和血栓性疾病的发生具有重要的预测价值[18]。本研究结果显示,病例组血清Fib和D-二聚体水平较对照组明显升高,进展组血清Fib和D-二聚体水平较未进展组明显升高。结果表明,炎症性反应和凝血功能障碍在急性脑梗死发病和病情进展过程中发挥重要作用。因此,检测炎症因子和凝血功能指标对评估急性脑梗死患者病情严重程度具有重要的判断价值。
Hcy是一种含硫氨基酸,也是一种常用于临床检测的炎症性细胞因子,是蛋氨酸循环的正常代谢产物。研究表明,Hcy不仅是脑梗死发病的一种独立影响因素,而且与动脉粥样硬化的发生密切相关[19-20]。目前,有关Hcy诱发急性脑梗死的具体发病机制仍未完全阐明,但随着对疾病认识的不断加深,已有研究显示Hcy在多种疾病的致病过程中起到重要的促进作用,从而可促进发病,如可提高凝血因子活性,促使血小板黏附和聚集[21];可通过调节机体氧化与抗氧化功能,进而直接诱导血管内皮细胞受损[22];促进血管平滑肌细胞合成,诱导平滑肌细胞增殖、分化、老化和纤维化的进展,促进动脉粥样硬化的形成等[23]。本研究结果显示,各组血清Hcy水平比较差异有统计学意义;病例组血清Hcy的水平较对照组明显增加;进展组血清Hcy的水平较未进展组明显升高。结果表明,Hcy在急性脑梗死患者血清中的水平较健康人群明显增高。由此提示,检测血清Hcy水平对急性脑梗死发病和病情进展程度评估具有重要的意义,随着疾病的进展和加重,血清Hcy的含量呈现明显增高的趋势,推测Hcy水平的变化与病情进展程度密切相关。
综上所述,急性脑梗死患者存在明显的凝血功能和血脂代谢障碍,并且处于进展期的患者血清Hcy、hs-CRP、TC、TG、LDL、D-二聚体、Fib的水平明显升高,这对判断急性脑梗死患者病情的严重程度具有一定的评估价值。
[1] 徐丽莎,汪锐,周乾晓,等.急性脑梗死后出血转化临床特征及影响预后的危险因素分析[J].河北医科大学学报,2020,41(8):892-895.
[2] Zheng M,Wang X,Yang J,et al. Changes of complement and oxidative stress parameters in patients with acute cerebral infarction or cerebral hemorrhage and the clinical significance[J]. Exp Ther Med,2020,19(1):703-709.
[3] Mo Z,Tang C,Li H,et al. Eicosapentaenoic acid prevents inflammation induced by acute cerebral infarction through inhibition of NLRP3 inflammasome activation[J]. Life Sci,2020,242(1):117133.
[4] Lv G,Wang GQ,Xia ZX,et al. Influences of blood lipids on the occurrence and prognosis of hemorrhagic transformation after acute cerebral infarction:a case-control study of 732 patients[J]. Mil Med Res,2019,6(1):2.
[5] 徐敏,许玉秋.急性脑梗死患者血液流变学及凝血功能的临床意义[J].中国实用神经疾病杂志,2017,20(18):35-38.
[6] 中华医学会神经病学分会,中华医学会神经病学分会脑血管病学组.中国急性缺血性脑卒中诊治指南2018[J].中华神经科杂志,2018,51(9):666-682.
[7] Kao CN,Liu YW. Acute cerebral infarction caused by atrial thrombus originating from left upper pulmonary vein stump after left upper lobe trisegmentectomy[J]. Gen Thorac Cardiovasc Surg,2020,68(2):206-207.
[8] Ni T,Fu Y,Zhou W,et al. Carotid plaques and neurological impairment in patients with acute cerebral infarction[J]. PLoS One,2020,15(1):e0226961.
[9] Ke Z,Zhao Y,Wang C,et al. The alliance with expanding blood volume and correcting anemia is an effective therapeutic measure for the adult anemia patients of acute cerebral infarction[J]. Int J Neurosci,2018,128(5):429-434.
[10] Beverly JK,Budoff MJ. Atherosclerosis:pathophysiology of insulin resistance,hyperglycemia,hyperlipidemia,and inflammation[J]. J Diabetes,2020,12(2):102-104.
[11] Miao J,Zang X,Cui X,et al. Autophagy,hyperlipidemia,and atherosclerosis[J]. Adv Exp Med Biol,2020,1207(1):237-264.
[12] Zhang Z,Qian M,Ge Z,et al. Effects of blood glucose and glycosylated hemoglobin levels on intravenous thrombolysis in patients with acute cerebral infarction and type 2 diabetes mellitus[J]. Pak J Med Sci,2019,35(3):862-867.
[13] 赵一品,汤建民,季莹莹,等.急性ST段抬高型心肌梗死患者入院血清白蛋白水平与梗死相关动脉自发再通的关系[J].郑州大学学报(医学版),2019,54(1):68-72.
[14] 陈君侠,张岳亭.不同剂量阿托伐他汀对不稳定型心绞痛行经皮冠脉介入术患者相关指标的影响[J].实用临床医药杂志,2019,23(1):96-99.
[15] Wu C,Li MN,Feng YW,et al. Continuous theta burst stimulation provides neuroprotection by accelerating local cerebral blood flow and inhibiting inflammation in a mouse model of acute ischemic stroke[J]. Brain Res,2020,1726(1):146488.
[16] Liang T,Wang SC,Zhang DT,et al. Evaluation of lipoprotein-associated phospholipase A2,serum amyloid A,and fibrinogen as diagnostic biomarkers for patients with acute cerebral infarction[J]. J Clin Lab Anal,2020,34(3):e23084.
[17] Tiscia GL,Margaglione M. Human fibrinogen:molecular and genetic aspects of congenital disorders[J]. Int J Mol Sci,2018,19(6):1597.
[18] Palit A. Title of thesis study of plasma d-dimer levels in acute ischemic stroke and its correlation with severity of stroke[J]. J Assoc Physicians India,2020,68(1):68.
[19] 赵帅,张玉婷,崔艳姬,等.脑梗死患者同型半胱氨酸、血小板参数、凝血功能指标的临床检测意义[J].心脑血管病防治,2017,17(6):483-485.
[20] Maksimova MY,Ivanov AV,Virus ED,et al. Disturbance of thiol/disulfide aminothiols homeostasis in patients with acute ischemic stroke stroke:preliminary findings[J]. Clin Neurol Neurosurg,2019,183(1):105393.
[21] Fan H,Yang S,Li Y,et al. Assessment of homocysteine as a diagnostic and early prognostic biomarker for patients with acute lacunar infarction[J]. Eur Neurol,2018,79(1/2):54-62.
[22] Lu SS,Xie J,Su CQ,et al. Plasma homocysteine levels and intracranial plaque characteristics:association and clinical relevance in ischemic stroke[J]. BMC Neurol,2018,18(1):200.
[23] Fokin AA,Kireev KA,Mikhaǐlov EV. Analysis of risk factors for lethal outcomes of ST-segment elevation acute myocardial infarction[J]. Angiol Sosud Khir,2019,25(2):18-23.