脑卒中后抑郁(post-stroke depression,PSD)是急性缺血性脑卒中患者最常见的精神疾病,超过50%的急性缺血性脑卒中患者合并PSD,其不仅影响患者康复治疗,且可引起认知功能障碍、性格改变,甚至有自杀倾向[1]。因此,及时预测PSD发病风险,进而提前预防及干预,可降低PSD发病率,改善脑卒中患者预后。有研究报道,炎症反应与PSD发生关系密切,PSD患者血清白细胞介素6(interleukin-6,IL-6)、IL-7、C-反应蛋白(C-reactive protein,CRP)等多种炎症因子水平升高,但炎症因子对PSD的预测作用研究的较少,且样本量较小[2]。近年来有学者证实,PSD患者血清非炎症指标如尿酸(uric acid,UA)也存在异常改变[3],但尚无其与PSD预后关系的报道。本研究探讨血清炎症指标及非炎症指标UA对老年缺血性脑卒中患者PSD的预测价值,报告如下。
1 资料与方法
1.1 一般资料 回顾性分析2017年5月—2020年6月我院诊治560例老年急性脑梗死患者的临床资料,其中男性335例,女性225例;年龄(68.23±8.76)岁。纳入标准:①急性缺血性脑卒中的诊断符合急性缺血性脑卒中急诊急救中国专家共识(2018)[4];②首次发病,且发病时间<72 h;③经颅部CT、MRI等影像学检查证实有脑梗死灶;④年龄≥60岁;⑤患者意识清楚或治疗后意识转清至少1周;⑥均签署知情同意书,可配合调查者。排除标准:①脑卒中前合并抑郁或近期服用抗抑郁药物治疗者;②有精神疾病者;③合并重度失语或严重听力障碍、智能障碍及其他原因无法进行言语交流者;④合并肿瘤、代谢性疾病等重大疾病者;⑤有其他可能导致抑郁的情况者;⑥临床资料不完整或随访期间失访者。
1.2 方法
1.2.1 临床资料收集 收集患者年龄、性别、婚姻状况、血脂[三酰甘油(triglyceride,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)];肝功能:[丙氨酸转氨酶(glutamic pyruvic transaminase,GPT)、天冬氨酸转氨酶(glutamic oxaloacetic transaminase,GOT)、总胆红素(total bilirubin,TBiL)];肾功能:[血肌酐(serum creatinine,SCr)];既往病史等一般资料及病变特征:如脑卒中病因学分型、病变部位、神经损伤程度、认知功能障碍。
1.2.2 血清炎症指标检测 采集患者入院次日空腹静脉血5 mL,置于抗凝管中;离心半径12 cm,3 500 r/min离心10 min分离血清,并分为2份。取其中1份血清,应用贝克曼AU5800全自动生化分析仪,采用ELISA法检测血清IL-1、IL-2、IL-6、IL-17、超敏C反应蛋白(hypersensitive C-reactive protein,hs-CRP)、肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α)、淀粉样蛋白A(serum amyloid A,SAA)水平,通过血常规检测计算中性粒细胞淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)血小板与淋巴细胞的比值(platelet to lymphocyte ratio,PLR)。试剂盒购自北京华耐特生物科技有限公司,严格按试剂盒说明书进行操作。
1.2.3 血清UA水平检测 取另一份血清,应用强生5600全自动生化分析仪,采用氧化酶法检测血清UA水平,试剂盒购自美国BD公司。
1.2.4 抑郁评定 采用汉密顿抑郁量表(hamilton depression scale,HAMD-17)[5], HAMD-17评分<7分无抑郁,7~17分轻度抑郁,17~23分中度,≥24分重度,得分越高表示抑郁程度越严重。每位患者进行两次问卷调查,并进行重测信度检测以保障问卷结果的真实性。
1.3 随访及分组 对所有患者随访6个月,依据是否合并抑郁,分为PSD组221例、非PSD组339例。
1.4 统计学方法 应用SPSS 22.0软件进行统计分析,计量资料比较采用独立样本t检验;计数资料比较采用χ2检验;多因素Logistic回归分析PSD发生的危险因素, ROC曲线法分析各血清指标预测PSD发生的价值。P<0.05为差异有统计学意义。
2 结 果
2.1 2组一般资料及临床特征比较 PSD在急性脑梗死6个月时发病率为39.46%。PSD组入院时美国国立卫生研究院卒中量表(national institute of health stroke scale,NIHSS)、简易精神状态评价量表(mini-mental state examination,MMSE)评分及婚姻状况为离异或丧偶比率均高于非PSD组(P<0.05),2组年龄、性别比例比较差异无统计学意义(P>0.05),见表1。
表1 2组一般资料及临床特征比较
Table 1 Comparison of general information and clinical characteristics of two groups
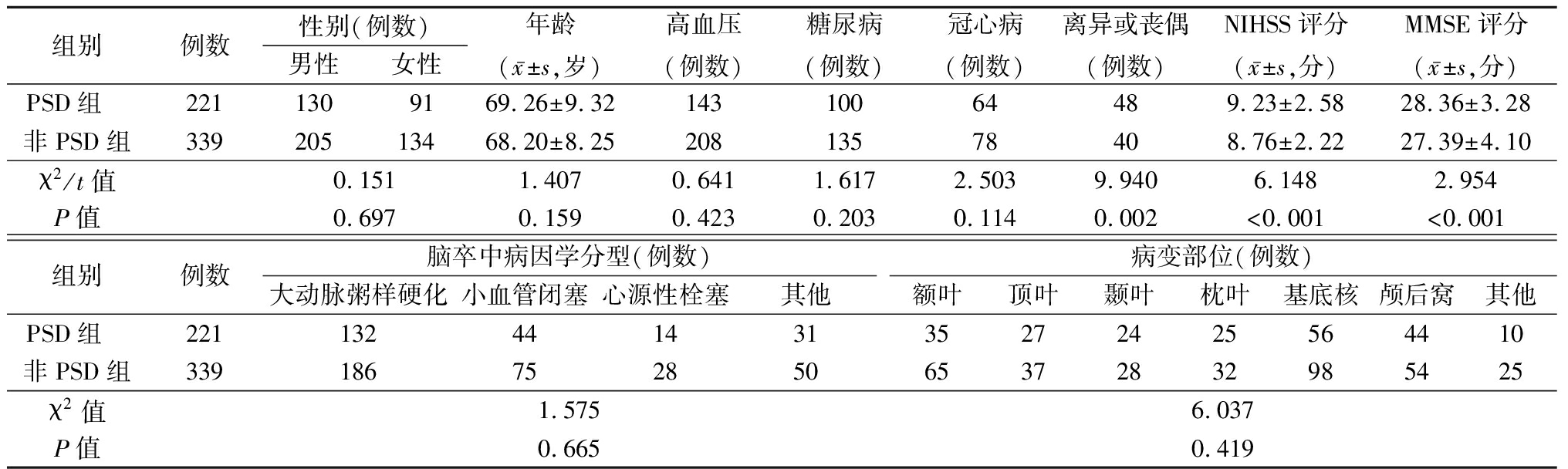
组别例数性别(例数)男性女性年龄(x-±s,岁)高血压(例数)糖尿病(例数)冠心病(例数)离异或丧偶(例数)NIHSS评分(x-±s,分)MMSE评分(x-±s,分)PSD组 2211309169.26±9.3214310064489.23±2.5828.36±3.28非PSD组33920513468.20±8.2520813578408.76±2.2227.39±4.10χ2/t值0.1511.4070.6411.6172.5039.9406.1482.954P值0.6970.1590.4230.2030.1140.002<0.001<0.001组别例数脑卒中病因学分型(例数)大动脉粥样硬化小血管闭塞心源性栓塞其他病变部位(例数)额叶顶叶颞叶枕叶基底核颅后窝其他PSD组 22113244143135272425564410非PSD组33918675285065372832985425χ2值1.5756.037P值0.6650.419
2.2 2组血清学指标比较 PSD组血清TC、SCr、UA、SAA、IL-1、IL-2、IL-6、IL-17、hs-CRP、TNF-α、NLR、PLR均高于非PSD组(P<0.05),LDL-C低于非PSD组(P<0.05),2组GPT、GOT比较差异无统计学意义(P>0.05),见表2。
表2 2组血清学指标比较
Table 2 Comparison of serological indicators in two groups![]()
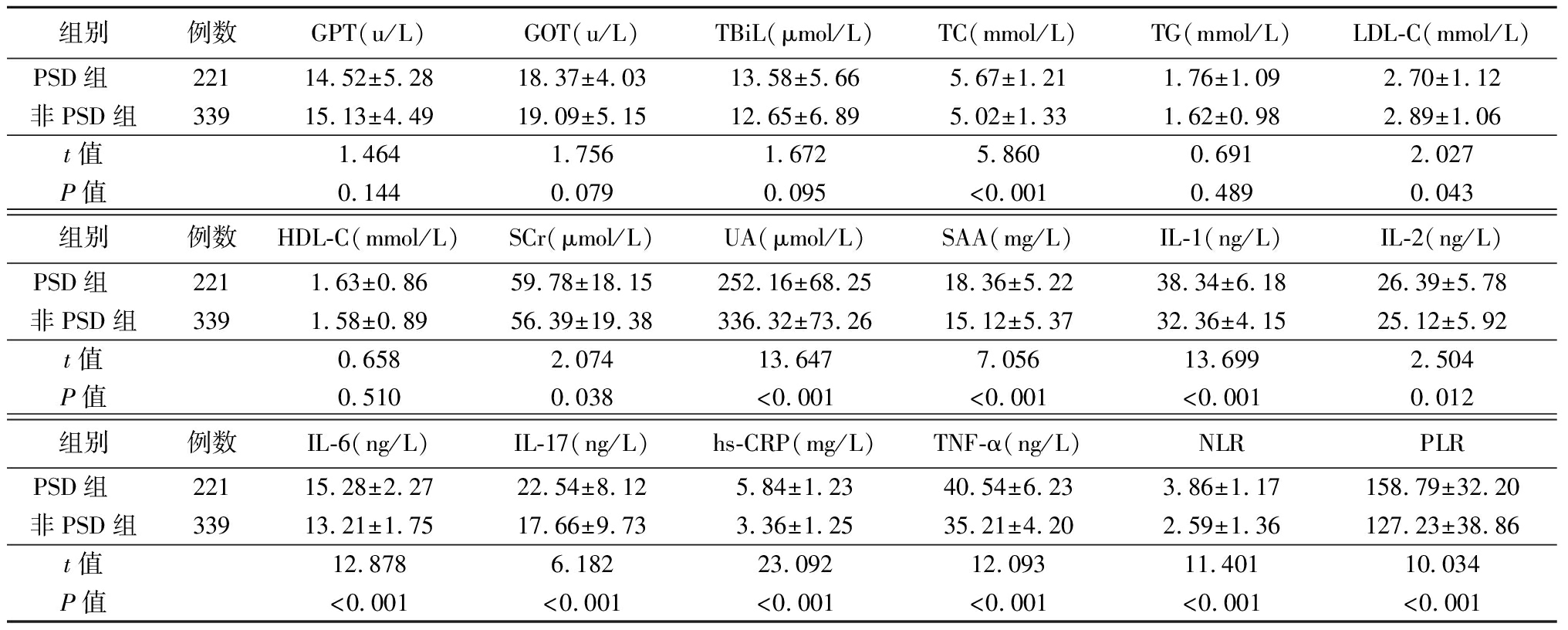
组别例数GPT(u/L)GOT(u/L)TBiL(μmol/L)TC(mmol/L)TG(mmol/L)LDL-C(mmol/L)PSD组 22114.52±5.2818.37±4.0313.58±5.665.67±1.211.76±1.092.70±1.12非PSD组33915.13±4.4919.09±5.1512.65±6.895.02±1.331.62±0.982.89±1.06t值1.4641.7561.6725.8600.6912.027P值0.1440.0790.095<0.0010.4890.043组别例数HDL-C(mmol/L)SCr(μmol/L)UA(μmol/L)SAA(mg/L)IL-1(ng/L)IL-2(ng/L)PSD组 2211.63±0.8659.78±18.15252.16±68.2518.36±5.2238.34±6.1826.39±5.78非PSD组3391.58±0.8956.39±19.38336.32±73.2615.12±5.3732.36±4.1525.12±5.92t值0.6582.07413.6477.05613.6992.504P值0.5100.038<0.001<0.001<0.0010.012组别例数IL-6(ng/L)IL-17(ng/L)hs-CRP(mg/L)TNF-α(ng/L)NLRPLRPSD组 22115.28±2.2722.54±8.125.84±1.2340.54±6.233.86±1.17158.79±32.20非PSD组33913.21±1.7517.66±9.733.36±1.2535.21±4.202.59±1.36127.23±38.86t值12.8786.18223.09212.09311.40110.034P值<0.001<0.001<0.001<0.001<0.001<0.001
2.3 PSD发生危险因素的多因素Logistic回归分析 以是否发生PSD为因变量(是=1,否=0),单因素分析差异有统计学意义的指标为自变量(连续型变量以实际测得数据纳入分析)进行多因素Logistic回归分析,结果显示离异或丧偶、IL-6、IL-17、NLR、SAA、UA是老年脑梗死患者发生PSD的影响因素。见表3。
表3 PSD发生危险因素的多因素Logistic回归分析结果
Table 3 Multivariate Logistic regression analysis results of risk factors for PSD
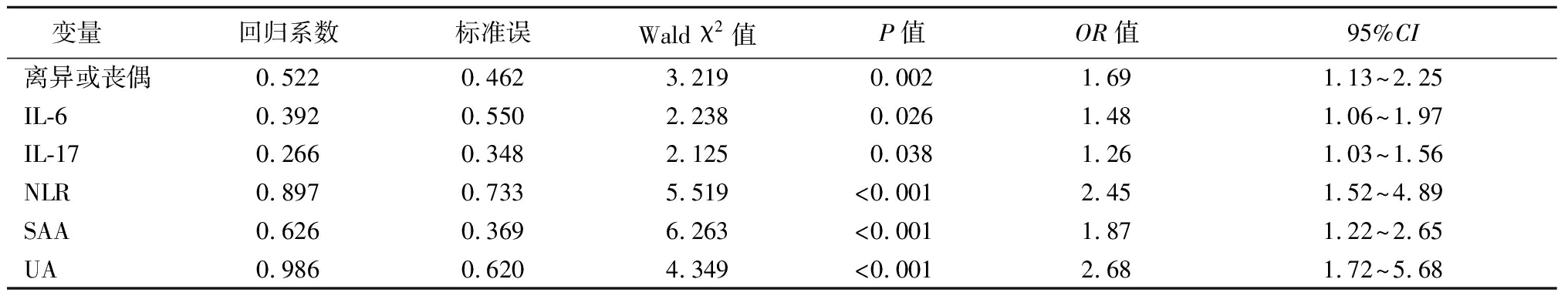
变量 回归系数标准误Wald χ2值P值OR值95%CI离异或丧偶0.5220.4623.2190.0021.691.13~2.25IL-60.3920.5502.2380.0261.481.06~1.97IL-170.2660.3482.1250.0381.261.03~1.56NLR0.8970.7335.519<0.0012.451.52~4.89SAA0.6260.3696.263<0.0011.871.22~2.65UA0.9860.6204.349<0.0012.681.72~5.68
2.4 IL-6、IL-17、NLR、SAA、UA对老年急性脑梗死患者发生PSD的预测作用 IL-6以13.50 ng/L为临界值,预测老年急性脑梗死患者6个月发生PSD的AUC为0.732(95%CI:0.686~0.769,P<0.001)。IL-17以20.50 ng/L为临界值,预测老年急性脑梗死患者6个月发生PSD的AUC为0.569(95%CI:0.523~0.617,P<0.001)。NLR以3.00为临界值,预测老年急性脑梗死患者6个月发生PSD的AUC为0.826(95%CI:0.773~0.882,P<0.001)。SAA以16.50 mg/L为临界值,预测老年急性脑梗死患者6个月发生PSD的AUC为0.759(95%CI:0.726~0.797,P<0.001)。UA以295.50 μmol/L为临界值,预测老年急性脑梗死患者6个月发生PSD的AUC为0.838(95%CI:0.792~0.870,P<0.001)。UA、NLR预测老年急性脑梗死患者6个月发生PSD的AUC高于IL-6、IL-17、SAA(P<0.05)。见图1。
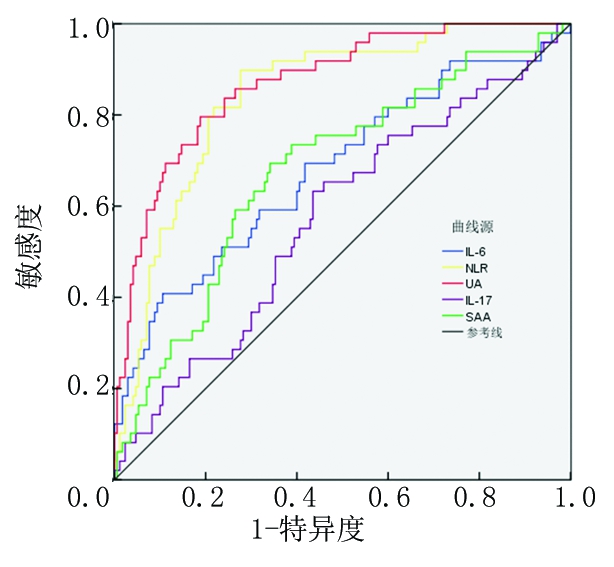
图1 IL-6、IL-17、NLR、SAA、UA预测老年急性脑梗死患者发生PSD的ROC曲线图
Figure 1 ROC curve of IL-6, IL-17, NLR, SAA, and UA for predicting the occurrence of PSD in elderly patients with acute cerebral infarction
3 讨 论
PSD是脑卒中患者常见的精神疾病并发症,临床表现为反应迟钝、兴趣减退,常伴有冷漠、焦虑等情绪障碍。研究表明,PSD不仅降低患者生活质量,妨碍患者回归正常的社会生活,且不利于肢体功能的恢复,更重要的是明显增加患者远期死亡率[6]。国外文献显示,18.5%~51.2%的脑卒中患者可并发PSD[7]。波动范围较大的原因可能与抑郁的判断标准或人群种族或患者年龄不同有关,此外PSD是一个渐进的过程,脑卒中后随访时间不同,PSD发生率也存在差异。本研究结果显示,560例老年急性脑梗死患者,脑卒中后6个月PSD发生率为39.46%,与冯维奎等[8]、胡佳等[9]、苑杰等[10]报道结果相符。
PSD发病机制尚未完全明确,炎症反应与PSD的关系逐渐受到关注。学者认为,炎症因子异常分泌可引起代谢紊乱,进一步导致内环境失衡,扰乱神经递质释放,进而导致PSD[11]。吴红霞等[12]研究显示,PSD患者血清多种炎症因子表达异常,可能与其发病有关。IL-6、IL-17是常见的炎症因子。研究显示,抑郁症患者血清IL-1、IL-2、IL-6等炎症因子表达水平明显高于非抑郁症患者[13]。张志强等[14]研究表明,PSD患者血清IL-17水平升高,且与抑郁炎症程度呈正相关。本研究结果显示,PSD组血清IL-1、IL-2、IL-6、IL-17高于非PSD组,多因素Logistic回归分析结果显示,IL-6、IL-17增高是PSD发生的危险因素,进一步ROC分析显示,IL-6、IL-17预测老年急性脑梗死患者6个月发生PSD的AUC分别为为0.732、0.569,提示监测血清IL-6、IL-17水平有助于预测PSD发生风险。可能原因:①IL-6、IL-17可影响5-羟色胺分泌,降低神经元突触中单胺类递质浓度,导致神经系统兴奋性降低[15];②影响边缘系统-下丘脑-垂体-肾上腺轴活性,进一步影响神经营养因子生成[16]。
NLR是中性粒细胞与淋巴细胞的比值,炎症反应时中性粒细胞多表达增多,淋巴细胞具有抗炎的作用。NLR是作为全身炎症反应的血清标志物,与PSD的发生关系密切。脑卒中可引起中性粒细胞穿过受损的血脑屏障,进入脑内梗死灶,进而分泌多种炎症因子,引起级联性炎症反应和过度氧化应激反应,后者可减少单胺类神经递质释放,降低神经兴奋性,促进PSD发生[17]。研究报道,NLR值可反映抑郁严重程度,对抑郁的发生有较好的预测作用[18]。冯维奎等[8]研究表明,NLR值随抑郁程度增加而升高,其预测PSD的AUC为0.836。本研究结果显示,NLR增加1个单位,PSD发生风险增加1.45倍,ROC分析曲线显示,NLR以3.00为临界值,预测老年急性脑梗死患者6个月发生PSD的AUC为0.826,提示NLR在预测PSD的发生中有较高的应用价值。
SAA是新型急性炎症反应标志物,其水平增高与感染、心脑血管疾病、肿瘤等疾病有关。动物试验结果显示,促进SAA表达可诱导大鼠抑郁状况[19]。研究显示,SAA可预测脑卒中患者预后,SAA与PSD患者HAMD17评分呈正相关[20-21]。程哲等[3]研究发现,SAA水平升高是PSD发生的危险因素,与本研究结果一致。可能原因是由于SAA可通过与Toll样受体-2结合,促进神经胶质细胞活化,进而影响5-羟色胺等单胺类神经递质分泌[21]。
UA是嘌呤类代谢终产物,可反映肾功能变化。UA与PSD发生的关系研究的较少。研究显示,UA同时具有促氧化及抗氧化的功能,当机体存在脂质过氧化物时,其抗氧化性减弱,发生促氧化作用,引起神经细胞结构改变和信号转导异常,使神经元发生退行性改变[10,22]。研究显示,血清UA增高与腺苷能传输降低有关,后者可减少兴奋性神经递质释放,降低神经元兴奋性,表现为焦虑、抑郁、冷漠等负面情绪增多[23]。Black等[24]研究发现,焦虑、抑郁患者血清UA降低。Chaudhari等[25]研究表明,血清UA与HAMD17评分呈正相关。本研究多因素Logistic回归分析结果显示,血清UA水平增高可增加PSD发生风险,ROC曲线显示UA预测老年急性脑梗死患者6个月发生PSD的AUC高于IL-6、IL-17、SAA,提示UA可预测PSD发生风险。
综上所述,血清IL-6、IL-17、SAA、NLR、UA水平增高是老年急性脑梗死患者发生PSD的危险因素,可预测PSD发生风险,且UA、NLR预测价值较高。本研究局限性:①未对血清学指标进行动态监测;②纳入的指标有限,可能存在其他影响因素没有入选;③随访时间较短。
[1] Robinson RG,Jorge RE. Poststroke depression:a review[J]. Can J Psychiatry,2016,173(3):221-231.
[2] 周琴.缺血性脑卒中后抑郁血清炎症因子检测及其临床意义[J].医药前沿,2016,6(26):239-241.
[3] 程哲,郭世龙,孟焱,等.缺血性脑卒中后抑郁患者血清淀粉样蛋白A水平检测及其意义研究[J].中华神经医学杂志,2018,17(11):1143-1146.
[4] 中国老年医学学会急诊医学分会,中华医学会急诊医学分会卒中学组,中国卒中学会急救医学分会,等.急性缺血性脑卒中急诊急救中国专家共识(2018)[J].临床急诊杂志,2018,19(6):351-359.
[5] 战丽萍,魏欢,李妍平,等.综合医院神经科焦虑、抑郁障碍的识别与治疗[J].中华全科医学,2011,9(3):411-412.
[6] Hornsten C,Lövheim H,Gustafson Y. The association between stroke,depression,and 5-year mortality among very old people[J]. Stroke,2013,44(9):2587-2589.
[7] Tang CZ,Zhang YL,Wang WS,et al. Serum levels of high-sensitivity C-reactive protein at admission are more strongly associated with poststroke depression in acute ischemic stroke than homocysteine levels[J]. Mol Neurobiol,2016,53(4):2152-2160.
[8] 冯维奎,陈峥.NLR联合hs-CRP在急性缺血性脑卒中后抑郁中的预测价值[J].临床医学研究与实践,2019,4(9):121-122,130.
[9] 胡佳,周伟,周志明,等.炎症指标对缺血性脑卒中卒中后抑郁的预测价值[J].南方医科大学学报,2019,39(6):665-671.
[10] 苑杰,路月英,郭鑫,等.血清尿酸水平对急性缺血性脑卒中后抑郁的预测价值研究[J].中国全科医学,2018,571(16):91-96.
[11] 李文涛,李志平,王胜,等.老年脑卒中患者血清炎症因子与焦虑抑郁程度相关性分析[J].国际精神病学杂志,2018,35(4):697-699,703.
[12] 吴红霞,韩天明,欧小凡,等.血清Th细胞因子在脑卒中后抑郁患者血清中的表达水平分析[J].临床和实验医学杂志,2019,18(17):1841-1844.
[13] 朱玉萍,赵晓晖,杨娟,等.脑卒中后不同时段抑郁障碍患者血清IL-1β、IL-6变化特点[J].卒中与神经疾病,2013,20(2):87-90.
[14] 张志强,张莉.脑卒中后抑郁患者血清皮质醇、白细胞介素-17、-18的表达[J].中国老年学杂志,2018,38(17):4125-4127.
[15] Ormonde do Carmo MB,Mendes-Ribeiro AC,Matsuura C,et al. Major depression induces oxidative stress and platelet hyperaggregability[J]. J Psychiatr Res,2015,61:19-24.
[16] Keller J,Gomez R,Williams G,et al. HPA axis in major depression:cortisol,clinical symptomatology and genetic variation predict cognition[J]. Mol Psychiatr,2017,22(4):527-536.
[17] Becker KJ. Inflammation and the silent sequelae of stroke[J]. Neurotherapeutics,2016,13(4):801-810.
[18] 张捷,欧阳任辉,陈道慧,等.中性粒细胞淋巴细胞比值在不同HAMD评分首发抑郁症患者中的价值研究[J].国际检验医学杂志,2018,39(5):626-629.
[19] Jang WY,Lee BR,Jeong J,et al. Overexpression of serum amyloid a 1 induces depressive-like behavior in mice[J]. Brain Res,2016,1654(Pt A):55-65.
[20] Getz GS,Krishack PA,Reardon CA. Serum amyloid A and atherosclerosis[J]. Curr Opin Lipidol,2016,27(5):531-535.
[21] Bryleva EY,Keaton SA,Grit J,et al. The acute-phase mediator serum amyloid A is associated with symptoms of depression and fatigue[J]. Acta Psychiatr Scandi,2017,135(5):409-418.
[22] Spiga R,Marini MA,Mancuso E,et al. Uric Acid Is associated with inflammatory biomarkers and induces inflammation via activating the NF-κB signaling pathway in HepG2 cells[J]. Arterioscler Thromb Vasc Biol,2017,37(6):1241-1249.
[23] Allen-Gipson DS,Blackburn MR,Schneider DJ,et al. Adenosine activation of A(2B) receptor(s) is essential for stimulated epithelial ciliary motility and clearance[J]. Am J Physiol Lung Cell Mol Physiol,2016,301(2):171-180.
[24] Black CN,Bot M,Scheffer PG,et al. Antioxidant uric acid is lower in current major depression and anxiety disorders[J]. Eur Psychiatry,2018,225:684-690.
[25] Chaudhari K,Khanzode S,Khanzode S,et al. Clinical correlation of alteration of endogenous antioxidant-uric acid level in major depressive disorder[J]. Indian J Clin Biochem,2010,25(1):77-81.