肝癌是严重威胁全球人类健康的恶性肿瘤,其在我国发病率有逐年升高趋势,且病死率较高,早期半数以上以肝区疼痛为主,多数患者在就诊时失去了手术根治机会,病灶完全切除率不足30%[1-2]。肝脏为机体凝血因子的重要组成部分,当肝脏功能受损时,可引起凝血因子消耗障碍,而凝血四项可反映凝血因子活性水平,常规凝血四项包括凝血酶原时间(prothrombin time,PT)、活化部分凝血活酶时间(activated partial thromboplastin time,APTT)、凝血酶时间(thrombin time,TT)、纤维蛋白原(fibrinogen,FIB),是目前监测患者凝血功能的常用方法[3],但单独诊断时对肝癌的鉴别效能低。血清肿瘤标志物有检测方便、微创、可反复操作等优点,能提高对高危人群的筛查能力,研究发现血清肿瘤标志物糖类抗原199(carbohydrate antigen199,CA199)、甲胎蛋白(α-fetoprotein,AFP)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、血管内皮生长因子(vascular endothelial growth factor,VEGF)等对原发性肝癌有较高诊断敏感度、特异度[4-5]。本研究主要分析凝血四项联合血清肿瘤标志物对乙型肝炎相关肝癌及良性病变的鉴别价值,结果报告如下。
1 资料与方法
1.1 一般资料 选取2017年2月—2020年6月我院收治的乙型肝炎相关肝癌患者20例(肝癌组)、肝硬化35例(肝硬化组)、乙型肝炎76例(乙型肝炎组)为研究对象。纳入标准:①良性病变者均符合《慢性乙型肝炎防治指南(2019年版)》[6]中相关诊断标准,肝癌患者均经临床病理学确诊为乙型肝炎相关肝癌[7];②肝癌患者均为首诊病例,入组时未接受任何治疗,肝硬化和乙型肝炎患者停药达3个月以上;③本研究经医院伦理委员会批准通过,所有患者均知情同意并自愿签署知情同意书。排除标准:①合并甲型肝炎、丙型肝炎、丁型肝炎、戊型肝炎病毒感染者;②药物性、自身免疫性、酒精性或其他原因所致的肝炎患者;③合并严重肾脏病变、心力衰竭者;④不愿参与本研究者。
1.2 方法 搜集所有患者的基线资料、乙型肝炎病毒感染相关指标、凝血四项(PT、APTT、TT、FIB)、肝功能[总胆红素(total bilirubin,TBIL)、丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)、碱性磷酸酶(alkaline phosphatase,ALP)、谷氨酰转肽酶(glutamyl transpeptidase,GGT)]及血清肿瘤标志物[AFP、CA199、α-L-岩藻糖苷酶(α-L-fucosidase,AFU)、TNF-α、VEGF]检测资料。HBV-DNA应用苏州华益美生物科技有限公司生产的基因HBV-DNA检测试剂盒(PCR-荧光探针法)进行测定,肝功能指标采用贝克曼AU5400进行测定,凝血四项应用法国生产的设备型号为STA-revolution仪器进行检测,肿瘤标志物采用Cobas8000电化学发光免疫分析仪(美国罗氏公司)进行检测。正常参考值:APTT 28~45 s,需与正常对照相比超过10 s以上异常;PT 11~15 s,需与正常对照超过3 s以上异常;TT 14~21 s,需与正常对照超过3 s以上异常;FIB 2~4 g/L;AFP 0~7.0 μg/L;CA199 0~27.0 kU/L;AFU 14.3~39.9 U/L。
1.3 观察指标 ①比较肝癌组、肝硬化组、乙型肝炎组基线资料、乙型肝炎病毒感染相关指标;②比较肝癌组、肝硬化组、乙型肝炎组凝血四项、肝功能、血清肿瘤标志物检测结果;③绘制受试者工作特征曲线(receiver operating characteristic curve,ROC),分析凝血四项、血清肿瘤标志物单独及联合对乙型肝炎相关肝癌的诊断效能,联合检测时以各项指标串联且均大于相应的临界值作为阳性标准。
1.4 统计学方法 应用SPSS23.0统计软件处理数据。计数资料比较采用χ2检验,计量资料比较采用单因素方差分析和SNK-q检验,绘制ROC曲线分析凝血四项、血清肿瘤标志物单独及联合对乙型肝炎相关肝癌的诊断效能。P<0.05为差异有统计学意义。
2 结 果
2.1 3组一般资料比较 肝癌患者临床分期Ⅰ期5例,Ⅱ期6例,Ⅲ期4例,Ⅳ期5例,病因:肝硬化13例,非肝硬化单纯乙型肝炎7例。肝硬化者中终末期肝病模型(model for end-stage liver disease,MELD)评分(13.57±1.48)分,肝硬化肝脏储备评分(child-turcotte-pugh,CTP)评分(9.45±0.98)分,其中5~6分为A级18例,7~9分为B级10例,10~15分为C级7例;肝硬化程度:代偿期20例,失代偿期15例。乙型肝炎组病情轻度27例,中度35例,重度14例。肝癌组HBeAg阳性率、HBV-DNA低于肝硬化组、乙型肝炎组,肝硬化组HBV-DNA低于乙型肝炎组,差异有统计学意义(P<0.05);肝硬化组、乙型肝炎组HBeAg阳性率差异无统计学意义(P>0.05)。3组性别、年龄、体重指数、肝功能Child-Pugh分级差异无统计学意义(P>0.05)。见表1。
表1 3组一般资料比较
Table 1 Comparison of general information among three groups![]()
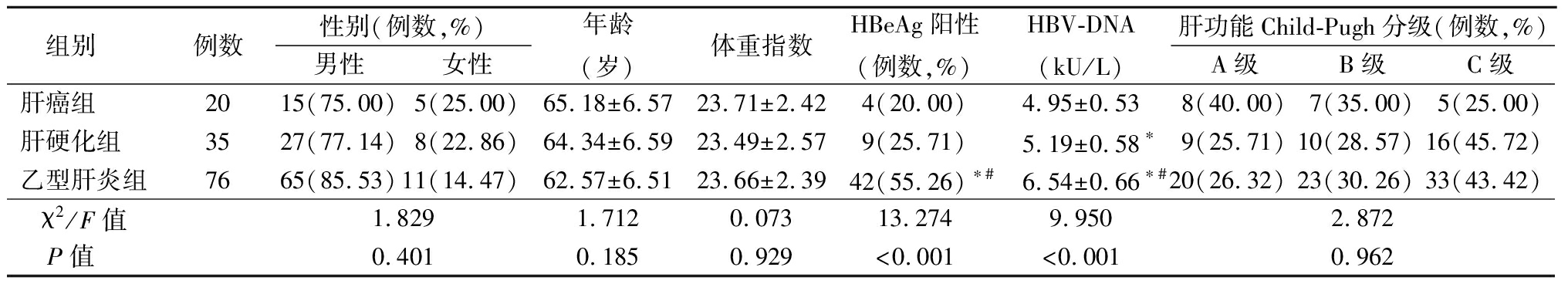
组别 例数性别(例数,%)男性女性年龄(岁)体重指数HBeAg阳性(例数,%)HBV-DNA(kU/L)肝功能Child-Pugh分级(例数,%)A级B级C级肝癌组 2015(75.00)5(25.00)65.18±6.5723.71±2.424(20.00)4.95±0.538(40.00)7(35.00)5(25.00)肝硬化组 3527(77.14)8(22.86)64.34±6.5923.49±2.579(25.71)5.19±0.58∗9(25.71)10(28.57)16(45.72)乙型肝炎组7665(85.53)11(14.47)62.57±6.5123.66±2.3942(55.26)∗#6.54±0.66∗#20(26.32)23(30.26)33(43.42)χ2/F值1.8291.7120.07313.2749.9502.872P值 0.4010.1850.929<0.001<0.0010.962
*P值<0.05与肝癌组比较 #P值<0.05与肝硬化组比较(SNK-q检验)
2.2 3组肝功能指标比较 肝癌组TBIL、ALT、ALP、GGT高于肝硬化组、乙型肝炎组,AST低于肝硬化组、乙型肝炎组,肝硬化组TBIL、ALT、ALP高于乙型肝炎组,AST低于乙型肝炎组,差异有统计学意义(P<0.05),肝硬化组和乙型肝炎组GGT比较差异无统计学意义(P>0.05)。见表2。
表2 3组肝功能指标比较
Table 2 Comparison of liver function indexes among three groups![]()
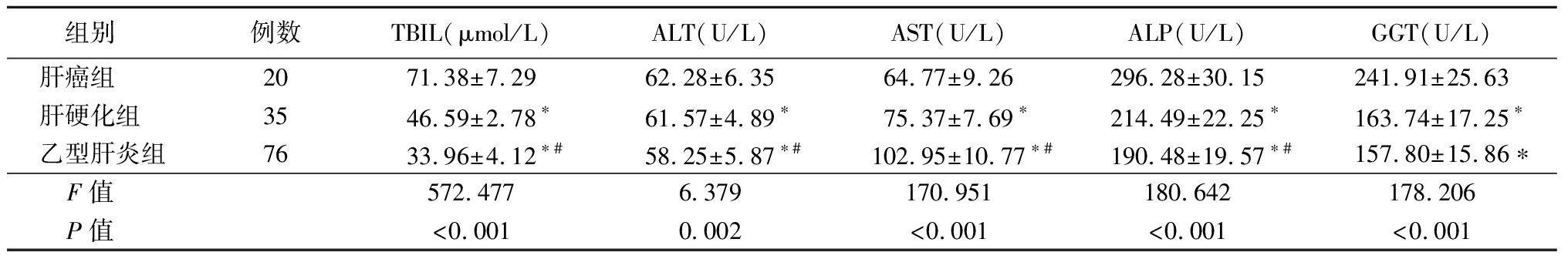
组别 例数TBIL(μmol/L)ALT(U/L)AST(U/L)ALP(U/L)GGT(U/L)肝癌组 2071.38±7.2962.28±6.3564.77±9.26296.28±30.15241.91±25.63肝硬化组 3546.59±2.78∗61.57±4.89∗75.37±7.69∗214.49±22.25∗163.74±17.25∗乙型肝炎组7633.96±4.12∗#58.25±5.87∗#102.95±10.77∗#190.48±19.57∗#157.80±15.86∗F值 572.4776.379170.951180.642178.206P值 <0.0010.002<0.001<0.001<0.001
*P值<0.05与肝癌组比较 #P值<0.05与肝硬化组比较(SNK-q检验)
2.3 3组凝血四项比较 肝癌组PT、APTT、TT短于肝硬化组,长于乙型肝炎组,FIB高于肝硬化组,低于乙型肝炎组,肝硬化组PT、APTT、TT长于乙型肝炎组,FIB低于乙型肝炎组,差异有统计学意义(P<0.05)。见表3。
表3 3组凝血四项比较
Table 3 Comparison of four coagulation indices among three groups![]()
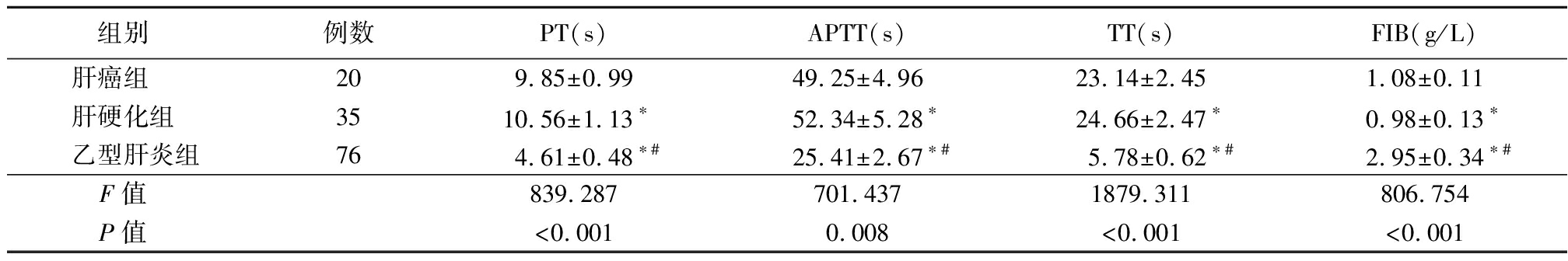
组别 例数PT(s)APTT(s)TT(s)FIB(g/L)肝癌组 209.85±0.9949.25±4.9623.14±2.451.08±0.11肝硬化组 3510.56±1.13∗52.34±5.28∗24.66±2.47∗0.98±0.13∗乙型肝炎组764.61±0.48∗#25.41±2.67∗#5.78±0.62∗#2.95±0.34∗#F值 839.287701.4371879.311806.754P值 <0.0010.008<0.001<0.001
*P值<0.05与肝癌组比较 #P值<0.05与肝硬化组比较(SNK-q检验)
2.4 3组肿瘤标志物比较 肝癌组血清AFP、CA199、AFU、TNF-α、VEGF水平均高于肝硬化组、乙型肝炎组,肝硬化组血清AFP高于乙型肝炎组,CA199、VEGF水平均低于乙型肝炎组,差异有统计学意义(P<0.05),肝硬化组和乙型肝炎组AFU、TNF-α比较差异无统计学意义(P>0.05)。见表4。
表4 3组肿瘤标志物比较
Table 4 Comparison of serum tumor markers among three groups![]()
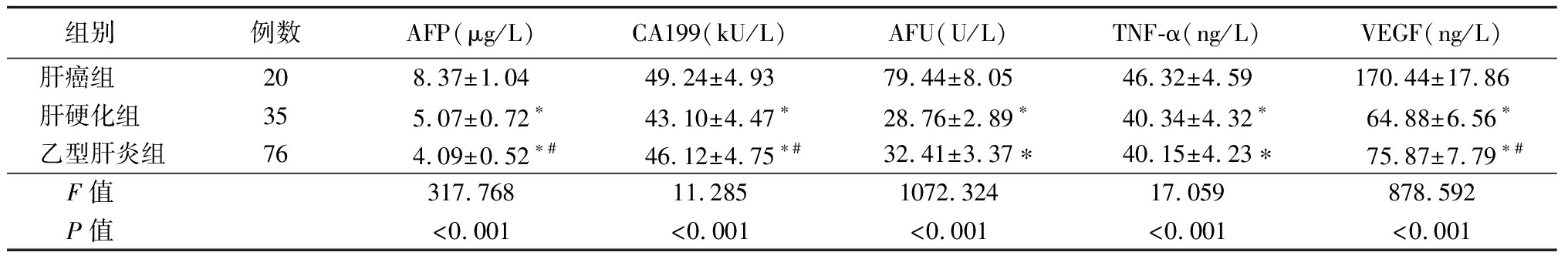
组别 例数AFP(μg/L)CA199(kU/L)AFU(U/L)TNF-α(ng/L)VEGF(ng/L)肝癌组 208.37±1.0449.24±4.9379.44±8.0546.32±4.59170.44±17.86肝硬化组 355.07±0.72∗43.10±4.47∗28.76±2.89∗40.34±4.32∗64.88±6.56∗乙型肝炎组764.09±0.52∗#46.12±4.75∗#32.41±3.37∗40.15±4.23∗75.87±7.79∗#F值 317.76811.2851072.32417.059878.592P值 <0.001<0.001<0.001<0.001<0.001
*P值<0.05与肝癌组比较 #P值<0.05与肝硬化组比较(SNK-q检验)
2.5 凝血四项、血清肿瘤标志物对乙型肝炎相关肝癌的诊断价值 绘制ROC曲线发现,单项检测中,凝血四项、各项血清肿瘤标志物对乙型肝炎相关肝癌均有预测价值[曲线下面积(AUC)>0.5)],联合检测以上各指标时敏感度、特异度、准确度最佳,分别为0.83、0.79、0.80,AUC为0.865。见表5,图1。
表5 凝血四项、血清肿瘤标志物对乙型肝炎相关肝癌的诊断价值
Table 5 The diagnostic value of four blood coagulation indices and serum tumor markers for hepatitis B-related liver cancer
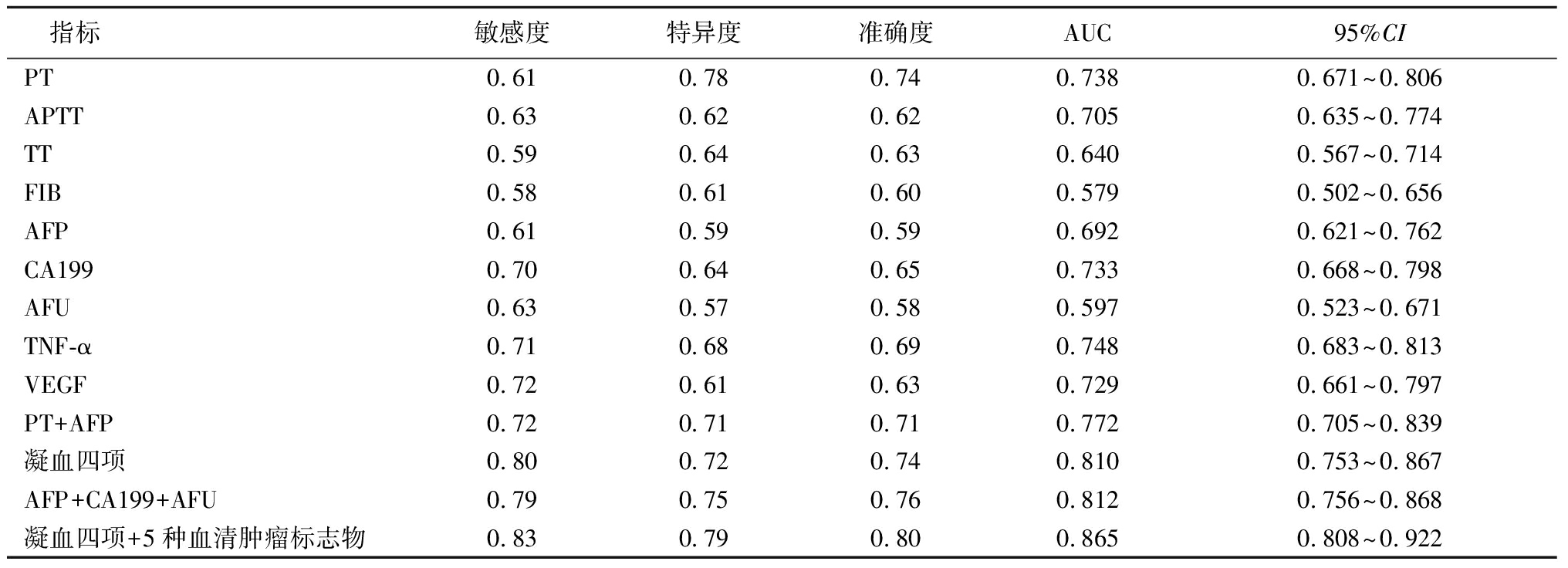
指标敏感度特异度准确度AUC95%CIPT0.610.780.740.7380.671~0.806APTT0.630.620.620.7050.635~0.774TT0.590.640.630.6400.567~0.714FIB0.580.610.600.5790.502~0.656AFP0.610.590.590.6920.621~0.762CA1990.700.640.650.7330.668~0.798AFU0.630.570.580.5970.523~0.671TNF-α0.710.680.690.7480.683~0.813VEGF0.720.610.630.7290.661~0.797PT+AFP0.720.710.710.7720.705~0.839凝血四项0.800.720.740.8100.753~0.867AFP+CA199+AFU0.790.750.760.8120.756~0.868凝血四项+5种血清肿瘤标志物0.830.790.800.8650.808~0.922
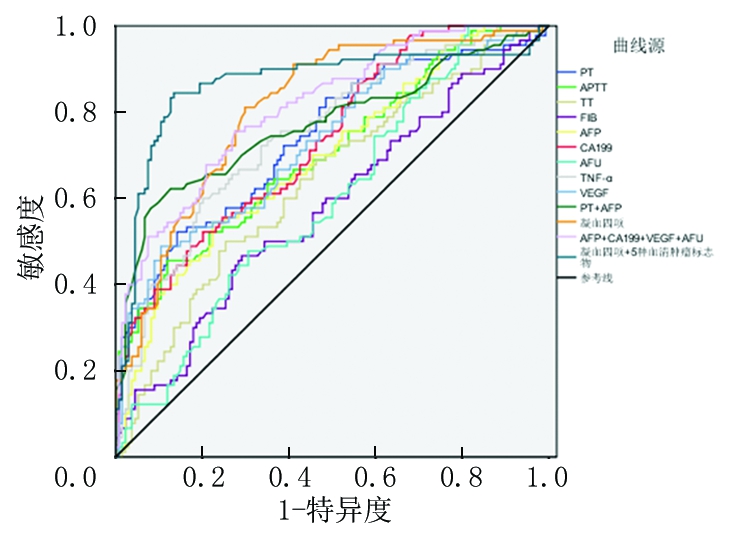
图1 ROC曲线
Figure 1 ROC curve
3 讨 论
全球每年超过70万人死于肝癌,而中国约占50%,病死率仅次于肺癌[8-9]。PT、APTT、TT、FIB是评估凝血功能常规检查方法,但检测样本为离心后血浆,是对某一时间点血液凝集状态的检测,且不能进行反映血小板与机体凝血功能间的相关性,因而检测结果可能有偏差[10]。AFP诊断肝癌在临床上应用多年,但由于多数直径<3 cm的肝癌AFP小于截断值,较多慢性肝病患者AFP仍呈阳性,因而并不适合单独对一般人群进行肝癌筛查,CA199为一种由腺癌细胞产生的非特异性肿瘤相关抗原,对肝癌有辅助诊断价值[11],TNF-α为多功能细胞因子,主要由单核细胞及巨噬细胞等产生,参与机体多种生理与免疫过程,而VEGF是相对分子质量为34 000~42 000的糖蛋白,由某些肿瘤细胞分泌,可和血管内皮细胞上受体结合,诱导血管生成并维持肿瘤继续生长,目前研究发现,TNF-α、VEGF在原发性肝癌中有一定表达,但目前关于凝血四项联合血清肿瘤标志物对乙型肝炎相关肝癌的筛查价值报道甚少[12]。
本研究结果显示,肝癌组、肝硬化组HBeAg阳性率、HBV-DNA低于乙型肝炎组,肝癌组TBIL、ALT、ALP、GGT高于肝硬化组、乙型肝炎组,AST低于肝硬化组、乙型肝炎组,肝硬化组TBIL、ALT、ALP高于乙型肝炎组,AST低于乙型肝炎组。表明慢性乙型肝炎发展到肝硬化、肝癌阶段,病毒的传染性、复制能力与肝功能持续损伤能力可能出现不同程度下降,这可能是因为机体感染HBV后,随病情进展,大量肝细胞坏死,导致依赖肝细胞的HBV复制减少,炎症反应减轻,因此在肝硬化、肝癌患者中HBeAg阳性率、HBV-DNA进一步下降。肝脏也是合成凝血因子的重要器官,肝功能受损后可引起机体凝血因子合成减少或凝血因子大量消耗,而凝血四项可反映外源性及共同途径中凝血因子活性水平[13]。本研究结果显示,肝癌组PT、APTT、TT短于肝硬化组,长于乙型肝炎组,FIB高于肝硬化组,低于乙型肝炎组,肝硬化组PT、APTT、TT长于乙型肝炎组,FIB低于乙型肝炎组,与周帘帘等[14]的报道相近,提示肝癌患者因病情进展及癌细胞增殖、浸润,免疫功能下降,抑制营养物质吸收,继而对机体凝血因子合成产生一定影响[15]。
本研究结果显示,肝癌组血清AFP、CA199、AFU、TNF-α、VEGF水平均高于肝硬化组、乙型肝炎组,肝硬化组血清AFP高于乙型肝炎组,CA199、VEGF水平均低于乙型肝炎组,这与党存曙等[16]的研究结论相符。表明血清肿瘤标志物AFP、CA199、AFU、TNF-α、VEGF与乙型肝炎相关肝癌及肝硬化、乙型肝炎病变发生发展有密切关系,随慢性乙型肝炎进展至肝硬化、肝癌,其AFP、CA199、AFU、TNF-α、VEGF表达水平可增加。早期刘军[17]研究发现,肝内胆管癌患者CA199升高较肝细胞癌患者更明显,罗一富[18]研究显示,原发性肝癌及转移性肝癌患者AFP、CA199水平高于健康对照组,且单独检测原发性肝癌与转移性肝癌的敏感度、特异度、阳性预测值、阴性预测值较联合检测低。本研究中AFP、CA199均在肝癌中高表达,且其表达水平高于肝硬化及乙型肝炎患者,这可能与肝癌患者的肝癌细胞分化更甚有关。作为溶酶体水解酶之一,AFU对肝癌的诊断价值在近年来也逐渐受到重视,其可在AFP呈阴性的乙型肝炎相关原发性肝癌患者中呈阳性表达。姜林等[19]研究表明,AFP、AFU、CA199对肝癌有较高诊断价值,尤其适用于HBsAg阳性的肝癌患者,且有助于区别原发性肝癌与转移性肝癌。本研究检测到TNF-α、VEGF在肝癌中高表达,因此血清肿瘤标志物对乙型肝炎相关肝癌与良性病变有鉴别价值,联合检测可能对其诊断有重要意义[20]。
本研究结果显示,ROC曲线显示,单项检测中凝血四项、各项血清肿瘤标志物均对乙型肝炎相关肝癌有预测价值(AUC>0.5),联合检测以上各个指标时敏感度、特异度、准确度最佳,分别为0.83、0.79、0.80,这与早期报道结果[21]相比诊断效能有所提高,表明凝血四项及血清肿瘤标志物(AFP、CA199、AFU、TNF-α、VEGF)联合检测对乙型肝炎相关肝癌有较高诊断价值。单独AFP对肝癌的早期临床诊断效能不足,既往廖楚舒等[22]报道,原发性肝癌患者血清VEGF水平随其进展逐渐增加,VEGF对原发性肝癌及早期原发性肝癌均有诊断价值,VEGF诊断原发性肝癌的AUC为0.712,均高于AFP(0.539),AFU主要参与分解代谢各种糖蛋白等生物大分子,一旦肝细胞发生癌变,AFU分泌量呈增加趋势,AFU、TNF-α、VEGF可弥补AFP的敏感度不足等缺点,从而提高肝癌检出率;CA199对AFP阴性患者有较高敏感度,可增加AFP诊断肝癌的准确度,但单独检测对疾病的早期诊断意义不大。本研究结果显示,凝血四项、5种血清肿瘤标志物诊断乙型肝炎相关肝癌的AUC分别为0.810、0.812,而将其联合检验后AUC达0.865,诊断效能进一步提高,因此考虑将凝血四项与血清肿瘤标志物联合用于乙型肝炎相关肝癌与良性病变者的鉴别诊断中,可发挥优势互补,提高诊断敏感度、特异度、准确度、阳性检出率等,有临床推广价值。早期也有学者报道,磁共振扩散加权成像联合血清肿瘤标志物对肝癌有较好诊断价值[23]。本研究因条件有限未作此方面的研究,后期值得进一步探讨。
综上所述,与乙型肝炎患者相比,乙型肝炎相关肝癌患者凝血四项、血清肿瘤标志物(AFP、CA199、AFU、TNF-α、VEGF)发生明显变化,将凝血四项与5种血清肿瘤标志物联合检测用于乙型肝炎相关肝癌及良性病变的鉴别诊断中有一定临床价值,可提高诊断效能,值得在临床推广实践。
[1] Li R,Yang D,Tang CL,et al. Combined hepatocellular carcinoma and cholangiocarcinoma(biphenotypic)tumors:clinical characteristics,imaging features of contrast-enhanced ultrasound and computed tomography[J]. BMC Cancer,2016,16(1):158.
[2] Chen QW,Li HJ,Chen YN,et al. Hepatic lesions detected after mastectomy,in breast cancer patients with hepatitis background may need to undergo liver biopsy to rule out second primary hepatocellular carcinoma[J]. PLoS One,2016,11(1):e0139782.
[3] 杨福洁.凝血四项指标及肿瘤标志物在乙型肝炎相关肝癌诊断中的应用价值[J/CD].临床检验杂志(电子版),2019,8(4):86.
[4] 闵旭立.肝细胞癌TACE治疗后血清TPS与VEGF的变化及意义[D].成都:川北医学院,2017.
[5] 王述莲,呼建民,何光伦,等.血清肿瘤标志物联合血常规指标检测在原发性肝癌诊断中的应用研究[J].标记免疫分析与临床,2017,24(1):4-7.
[6] 中华医学会感染病学分会,中华医学会肝病学分会.慢性乙型肝炎防治指南(2019年版)[J/CD].中华实验和临床感染病杂志(电子版),2019,13(6):441-466.
[7] 杨秉辉,任正刚.原发性肝癌诊断标准[J].中华肝脏病杂志,2000,8(3):135.
[8] Budny A,Kozlowski P,Kaminska M,et al. Epidemiology and risk factors of hepatocellular carcinoma[J]. Pol Merkur Lekarski,2017,43(255):133-139.
[9] Wang J,Liu W,Parikh K,et al. Alpha-fetoprotein-producing esophageal adenocarcinoma:a mimicker of hepatocellular carcinoma[J]. Clin J Gastroenterol,2017,10(1):7-12.
[10] 苏艳丽,冯军.血栓弹力图和常规凝血四项检测在评估肝癌患者围术期凝血功能中的应用研究[J].陕西医学杂志,2019,48(7):846-849.
[11] 卢冬彦.原发性肝癌伴门脉癌栓与血清肿瘤标志物表达相关[J].基础医学与临床,2019,39(9):1335-1336.
[12] 刘东梅,张剑,张兵兵.参芪扶正注射液联合索拉非尼对晚期原发性肝癌的疗效及对患者VEGF,TNF-α,IFN-γ水平的影响[J].现代生物医学进展,2019,19(22):4287-4290.
[13] Li H,Xu F,Li S,et al. The tumor microenvironment:An irreplaceable element of tumor budding and epithelial-mesenchymal transition-mediated cancer metastasis[J]. Cell Adh Migr,2016,10(4):434-446.
[14] 周帘帘,黄君.血清肿瘤标志物联合凝血四项诊断乙肝相关肝癌的价值[J].现代肿瘤医学,2019,27(1):95-98.
[15] Nojima H,Konishi T,Freeman CM,et al. Chemokine receptors,CX-CR1 and CXCR2,differentially regulate exosome release in hepatocytes[J]. PLoS One,2016,11(8):e0161443.
[16] 党存曙,刘大鹏,赵孟杰,等.不同TNM分期肝癌患者微血管密度与肿瘤标志物水平相关性研究[J].河北医药,2017,39(18):2725-2729.
[17] 刘军.四种肿瘤标志物测定对肝癌的诊断价值[J].中国肿瘤临床与康复,2017,24(1):30-32.
[18] 罗一富.多种血清肿瘤标志物联合诊断原发性与转移性肝癌的应用价值[J].实用医院临床杂志,2018,15(4):152-155.
[19] 姜林,张依娜,付君.多项肿瘤标志物联合应用对肝癌的诊断价值[J].癌症进展,2018,16(2):199-201,238.
[20] 张超.血浆VEGF、TPS、TuM2-PK水平在肺癌介入治疗前后的表达及意义[J].国际检验医学杂志,2017,38(7):916-918.
[21] 李正康,张鑫强,刘素玲,等.凝血四项指标和肿瘤标志物在乙型肝炎病毒感染相关肝硬化和原发性肝癌中的诊断价值[J].中国实验诊断学,2016,20(12):2061-2065.
[22] 廖楚舒,范莎莎,邓中华,等.血清TSP-1、VEGF水平与原发性肝癌的关系[J].检验医学,2017,32(2):104-107.
[23] 齐杰,高战强,刘树昌,等.磁共振扩散加权成像联合血清肿瘤标志物对诊断早期原发性肝癌价值分析[J].临床军医杂志,2018,46(9):1057-1058.