子宫内膜异位症(endometriosis,EMs)是一种常见的妇科良性疾病,该病影响着全球约1.5亿以上的妇女,是指具有活性的子宫内膜组织(腺体和间质)出现在子宫体以外的部位,并在该部位种植、生长。异位内膜组织可以侵犯全身任何部位,其中以卵巢和宫骶韧带最常见。EMs的主要症状包括痛经、不孕、性交不适等。EMs虽然是一种良性疾病,却有类似恶性肿瘤的生物学行为如:种植、侵袭和远处转移等。迄今为止,EMs的发病机制尚不明确。近年来的研究发现DNA启动子区的异常甲基化导致的相关基因的异常表达在EMs的发生和发展中起着重要的作用。本课题组应用Illumina Human Methylation 450K甲基化芯片首次比较分析了6例卵巢EMs患者异位内膜组织和6例对照妇女正常子宫内膜组织的DNA甲基化状态[1]。其中白细胞介素12B(interleukin-12B,IL-12B)基因启动子区CpG岛甲基化水平在异位内膜组织和对照组妇女正常内膜组织中存在显著差异。因此,在本研究中扩大样本量应用焦磷酸测序技术进一步分析验证卵巢EMs患者的异位内膜和对照妇女正常子宫内膜组织中IL-12B基因启动子区甲基化水平及mRNA表达水平的差异,以期进一步明确IL-12B基因表观遗传学改变在卵巢EMs发生发展中的作用。
1 资料与方法
1.1 一般资料 本研究共纳入50例卵巢EMs患者和44例因宫颈上皮内瘤变Ⅲ级(CINⅢ)行全子宫切除的患者(对照组)。所有研究对象均来自2014年10月—2016年5月在河北医科大学第四医院妇科行腹腔镜和开腹手术治疗的患者。所有卵巢EMs患者均经手术证实EMs Ⅲ期或Ⅳ期,且均经术后病理证实为卵巢EMs,年龄29~50岁,平均(39.76±6.47)岁。取其异位卵巢巧克力囊肿的囊壁组织为异位内膜组。对照组年龄29~50岁,平均(40.30±6.24)岁,取其子宫内膜组织为正常内膜组,所有内膜组织均经病理证实为正常内膜。两组手术时期均为月经周期的分泌期(依据末次月经时间及病理特征所见)。两组均为育龄期女性,术前6个月未服用激素类药物,均未合并子宫内膜病变、内分泌疾病、自身免疫性疾病及其他卵巢良恶性肿瘤等。标本取自患者术中的无菌离体组织,并迅速浸泡在盛有0.8 mL RNA later液的冻存管中,于4 ℃冰箱中过夜后置于-20 ℃冰箱里低温长期保存。
标本及病例资料收集均经患者及家属知情同意,并获医院伦理委员会批准。
1.2 组织RNA的提取和实时荧光定量PCR(quantitative real-time polymerase chain reaction,qRT-PCR) 异位内膜组和正常内膜组IL-12B RNA应用Trizol试剂盒提取。应用逆转录试剂盒(Thermo Scientific RevertAid First Strand cDNA Synthesis Kit)将总RNA逆转录成cDNA。应用QIAGEN生物技术公司的QuantiNova TMSYBR Green PCR试剂盒进行qRT-PCR反应技术检测组织中IL-12B基因mRNA的表达水平。IL-12B基因上下游引物分别为5′-CCCTGACATTCTGCG-TTCA-3′和5′-AGGTCTTGTCCGTGAAGACTC-TA-3′。内参磷酸甘油醛脱氢酶(reduced glyceraldehyde-phosphate dehydrogenase,GAPDH)上下游引物分别为5′-ACCACAGTC-CATGCCATCAC-3′和5′-TCCACCACCCTGTT-GCTGTA-3′。反应参数:95 ℃预变性5 min,95 ℃变性15 s,60 ℃退火10 s,72 ℃延伸25 s,共40个循环。所有溶解曲线均为单峰。 mRNA 表达量计算公式:2-△△CT,△CT=CT(目的基因)- CT(管家基因)。
1.3 组织DNA 提取及甲基化水平的检测 异位内膜组和对照内膜组IL-12B DNA采用美国Promega公司的Wizard Genomic DNA纯化试剂盒提取DNA。应用Nanodrop 2000检测所提取DNA的浓度及纯度。当标本A260 nm/A280 nm的比值在1.8~2.0时表示合格。采用焦磷酸测序技术(北京昂立信生物科技有限公司)检测所有组织DNA标本IL-12B基因启动子区的甲基化水平。引物由PyroMark Assay Design Software 2.0(Hua Da,Shen Zhen,China)设计见表1。应用Pyrodequencing检测仪(PyroMark Q96 ID,QIAGEN)进行甲基化特异性PCR,Pyro Q-CpG软件分析9个CpG位点(CpG1-9)的甲基化状态。CpG1位于转录起始位点(transcription start site,TSS)上游95 bp,CpG2-9位于TSS上游1 444 bp到1 499 bp。
表1 焦磷酸测序中的PCR扩增引物序列
Table 1 Primer sequences for pyrosequencing
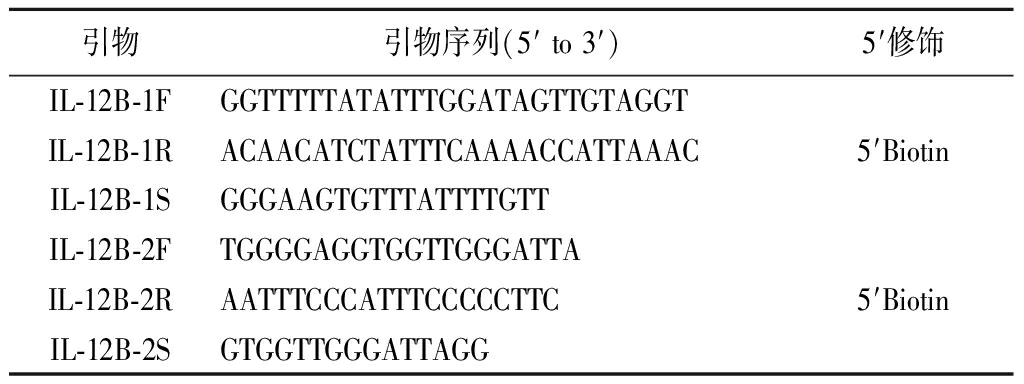
引物引物序列(5′ to 3′)5′修饰IL-12B-1FGGTTTTTATATTTGGATAGTTGTAGGTIL-12B-1RACAACATCTATTTCAAAACCATTAAAC5′BiotinIL-12B-1SGGGAAGTGTTTATTTTGTTIL-12B-2FTGGGGAGGTGGTTGGGATTAIL-12B-2RAATTTCCCATTTCCCCCTTC5′BiotinIL-12B-2SGTGGTTGGGATTAGG
1.4 统计学方法 应用SPSS 21.0软件包处理数据。 计量资料比较采用Wilcoxon秩和检验;计数资料比较采用χ2检验。采用Spearman相关系数分析IL-12B基因启动子区甲基化与其mRNA表达水平的关系。P<0.05为差异有统计学意义。
2 结 果
2.1 IL-12B基因启动子区在异位内膜组织和正常内膜组织中的甲基化状态 IL-12B基因启动子区的CpG1位点的甲基化水平在异位内膜组织和正常内膜组织中分别为52.060 (5.718)和62.640 (6.438),两者比较差异有统计学意义(Z=-7.547,P<0.001)。CpG2-9位点的甲基化水平在异位内膜组织和正常内膜组织中差异无统计学意义(P>0.05),见表2。
表2 异位内膜组织和正常内膜组织中IL-12B 基因启动子区CpG2-9位点的甲基化水平
Table 2 Methylation levels of CPG2-9 in the IL-12B gene promoter region in ectopic and normal endometrium tissues [M(QR)]
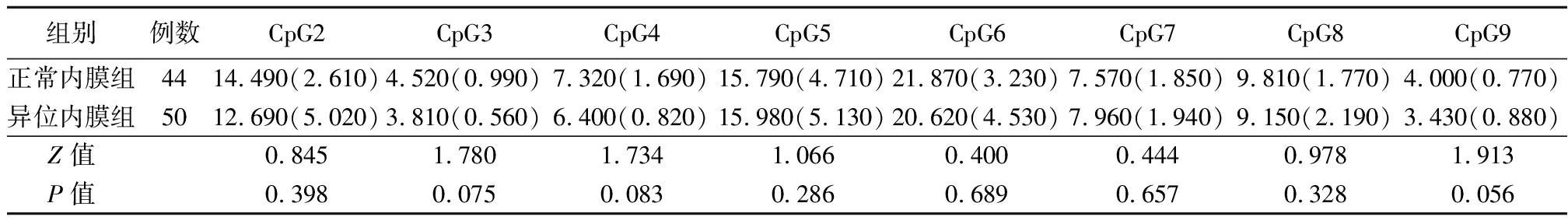
组别例数CpG2CpG3CpG4CpG5CpG6CpG7CpG8CpG9正常内膜组4414.490(2.610)4.520(0.990)7.320(1.690)15.790(4.710)21.870(3.230)7.570(1.850)9.810(1.770)4.000(0.770)异位内膜组5012.690(5.020)3.810(0.560)6.400(0.820)15.980(5.130)20.620(4.530)7.960(1.940)9.150(2.190)3.430(0.880)Z值0.8451.7801.7341.0660.4000.4440.9781.913P值0.3980.0750.0830.2860.6890.6570.3280.056
2.2 异位内膜组织和正常内膜组织中IL-12B基因mRNA的表达水平 异位内膜组织和正常内膜组织中IL-12B基因mRNA的表达水平分别为22.639 (392.693)和0.975 (2.992),两者比较差异有统计学意义(Z=6.054,P<0.001)。
2.3 相关性分析 采用Spearman相关系数分析,IL-12B基因启动子区的甲基化水平与其mRNA的表达水平在统计学上存在明显负相关性(r=-0.510,P<0.001)。
3 讨 论
DNA甲基化是真核生物调控基因表达的主要表观遗传学修饰方式,发生在启动子区的DNA甲基化可以直接阻止转录因子与DNA结合,也可以通过改变染色体的结构从而调控基因的表达[2]。DNA甲基化具有可遗传的、可逆的、动态的特点,不仅可以建立特定的细胞状态,还可以对微环境的变化作出反应,从而赋予细胞可塑性。这种变化可以在不同的生物液体中检测到,如血液、尿液和粪便样本[3]。在表观遗传修饰检测中,基于DNA甲基化检测是第一个被美国食品药品监督管理局批准的结肠直肠癌筛查试验[4],这表明甲基化分析可以作为一种无基因检测手段在临床实施,将其应用于不同疾病类型的临床筛查试验。既往的研究发现包括EMs在内的许多人类疾病与基因启动子区的异常甲基化状态有关。基质金属蛋白酶2(matrix metalloproteinase 2,MMP2)[5]、雌激素受体β(estrogen receptor β,ERβ)[6]、孕酮受体B(progesterone receptor B,PGR)[7]、Twist[8],谷胱苷肽S转移酶M1(Glutathione S-transferase M1,GSTM1)[9]等基因启动子区的异常甲基化状态均被证实在EMs的发生发展中发挥着重要的作用。本研究结果也显示,与正常内膜组织相比,卵巢EMs患者异位内膜组织中IL-12B基因启动子区呈现明显的低甲基化状态。而其mRNA的表达水平则明显高于正常内膜组织的表达水平,且IL-12B基因mRNA的表达水平与IL-12B基因启动子区的甲基化水平呈明显负相关性。
IL-12B基因编码IL-12p40亚基,IL-12p40亚基是IL-12和IL-23的组成部分。IL-12p40和IL-12p35亚基通过二硫键组成的具有异源二聚体结构的IL-12[10]。IL-12是连接先天性免疫和获得性免疫的重要的桥梁分子,是机体抵御病毒和病原微生物的关键细胞因子,促进原始T淋巴细胞向Th1细胞转化,增强细胞毒性T细胞(cytotoxic T cell,CTL)和自然杀伤细胞(natural killer,NK)的活性,被认为最强的NK细胞激活因子。在恶性黑色素瘤[11]、乳腺癌[12]、肺癌[13]和肝癌[14]中均被证实有明显抑制肿瘤细胞生长的作用。游离的IL-12p40亚基被认为是IL-12的一个天然拮抗剂,IL-12p40的同源二聚体能够与IL-12竞争结合IL-12R进而抑制IL-12的功能[15]。已有研究表明IL-12通过激活NK细胞的活性参与了EMs的初级防御,从而抑制子宫内膜异位症的发生。Somigliana等[16]将IL-12注入C57BL/6和BALB/c EMs小鼠模型的腹腔内,发现异位病灶的面积和重量会显著减少,说明IL-12在活体内能够抑制EMs的发展。而Itoh等[17]则进一步证实,IL-12可以通过激活NK细胞的活性进而抑制腹腔内异位病灶的发展。然而,目前关于EMs患者腹腔液中IL-12表达水平的研究结果不尽相同。研究显示,与正常对照者比较,EMs患者腹腔液中IL-12的含量明显降低[18-19]。而Singh等[20]和魏静波等[21]却得出了完全相反的研究结果。但是,Mazzeo等[22]研究认为腹腔液中IL-12的浓度在EMs组和对照组间差异无统计学意义,而EMs患者腹腔液中游离IL-12p40的浓度却明显高于对照组。而且EMs的严重程度与IL-12+游离IL-12p40/IL-12的比值呈正比。IL-12能够增强NK细胞对子宫内膜细胞的清除能力,而IL-12p40通过竞争结合NK细胞上的IL-12R抑制NK细胞的细胞毒作用,从而增加子宫内膜异位症的发病风险。梁华等[23]也认为腹腔液中IL-12p40水平的增高与子宫内膜异位症的发生有关。本研究结果显示,IL-12B基因启动子区甲基化水平及mRNA表达水平在异位内膜组织和正常内膜组织之间存在明显的差异。并且IL-12B基因启动子区甲基化水平和mRNA表达水平之间存在明显的负相关性,mRNA表达水平的差异可能进一步影响IL-12p40蛋白的表达水平,从而导致了子宫内膜异位症的发生。该结果与前期甲基化芯片筛查的结果一致。同时,应用Jaspar软件(http://jaspar.genereg.net/)分析发现IL-12B基因启动子区甲基化位点CpG1(cg18307303)处可能存在一个转录因子Sp1的结合位点。该位点的甲基化水平的改变可能会影响Sp1与启动子区的结合,进而影响IL-12B基因mRNA的表达水平。因此,认为IL-12B基因启动子区异常甲基化水平可能是通过影响其mRNA表达水平而在卵巢EMs的发生和发展过程中发挥着重要的作用。在今后的研究中,将进一步明确异位内膜组织和正常内膜组织及腹腔液中IL-12p40蛋白的表达水平。
本研究存在一定的局限性。课题选取因CINⅢ而行开腹或腹腔镜下行全子宫切除术的患者,虽然所有内膜组织均经病理证实为正常子宫内膜,但是CINⅢ是否对基因启动子区的甲基化水平有影响还未见报道。在以后的研究中尚需进一步来分析其影响。
综上所述,异位内膜组织中IL-12B基因启动子区的低甲基化水平可能通过上调其mRNA的表达水平,进而引起IL-12p40蛋白表达增加,从而增加了妇女患卵巢EMs的风险。本研究也进一步证明了EMs可能是一种表观遗传学疾病。寻找EMs甲基化差异基因有助于在分子水平上揭示其发病机制,为EMs的治疗提供新的靶点。
[1] Wang L,Zhao J,Li Y,et al. Genome-wide analysis of DNA methylation in endometriosis using illumina human methylation 450K bead chips[J]. Mol Reprod Dev,2019,86(5):491-501.
[2] Héberlé É,Bardet AF. Sensitivity of transcription factors to DNA methylation[J]. Essays Biochem,2019,63(6):727-741.
[3] Jakubowski JL,Labrie V. Epigenetic biomarkers for Parkinso′s disease:From diagnostics to therapeutics[J]. J Parkinsons Dis,2017,7:1-12.
[4] Song L,Jia J,Peng X,et al. The performance of the SEPT9 gene methylation assay and a comparison with other CRC screening tests:a meta-analysis[J]. Sci Rep,2017,7:3032.
[5] Tang L,Xiang Y,Zhou Y,et al. The DNA methylation status of genes encoding Matrix metalloproteinases and tissue inhibitors of matrix metalloproteinases in endometriosis[J]. Mol Reprod Dev,2018,85(1):17-25.
[6] Maekawa R,Mihara Y,Sato S,et al. Aberrant DNA methylation suppresses expression of estrogen receptor 1(ESR1) in ovarian endometrioma[J]. J Ovarian Res,2019,12(1):14.
[7] Rocha-Junior CV,Da Broi MG,Miranda-Furtado CL,et al. Progesterone receptor B(PGR-B) is partially methylated in eutopic endometrium from infertile women with endometriosis[J]. Reprod Sci,2019,26(12):1568-1574.
[8] Juanqing L,Hailan Y,Xiangwei F,et al. Relationship between the methylation levels of Twist gene and pathogenesis of endometriosis[J]. Cell Mol Biol(Noisy-le-grand),2019,65(3):94-100.
[9] Zhao J,Wang L,Li Y,et al. Hypomethylation of the GSTM1 promoter is associated with ovarian endometriosis[J]. Hum Reprod,2019,34(5):804-812.
[10] Cooper AM,Khader SA. IL-12p40:an inherently agonistic cytokine[J]. Trends Immunol,2007,28(1):33-38.
[11] 刘严友葓,徐虹铃,赖楠,等.过表达IL-12的恶性黑色素瘤细胞在肿瘤免疫微环境重建过程中抑制T细胞表面PD-1的表达[J].南方医科大学学报,2020,40(6):856-863.
[12] 刘莹,李宗海,蒋华.可诱导表达IL-12的GPC3靶向性CAR-T细胞在免疫健全小鼠中的抗乳腺癌作用[J].肿瘤,2018,38(7):631-642.
[13] Wang D,Cong J,Fu B,et al. Immunogenic chemotherapy effectively inhibits KRAS-Driven lung cancer[J]. Cancer Lett,2020,492:31-43.
[14] 穆永亮,赵华俊,张建,等.肝癌细胞异位过表达IL-12的抗肿瘤作用研究[J].中国免疫学杂志,2019,35(23):2864-2868.
[15] Ling P,Gately MK,Gubler U,et al. Human IL-12 p40 homodimer binds to the IL-12 receptor but does not mediate biologic activity[J]. J Immunol,1995,154(1):116-127.
[16] Somigliana E,Vigano P,Gaffuri B,et al. Modulation of NK cell lytic function by endometrial secretory factors:potential role in endometriosis [J]. Am J Reprod Immunol,1996,36(5):295-300.
[17] Itoh H,Sashihara T,Hosono A,et al. Interleukin-12 inhibits development of ectopic endometriotic tissues in peritoneal cavity via activation of NK cells in a murine endometriosis model[J]. Cytotechnology,2011,63(2):133-141.
[18] Lee YH,Cui L,Fang J,et al. Limited value of pro-inflammatory oxylipins and cytokines as circulating biomarkers in endometriosis - a targeted omics study[J]. Sci Rep,2016,6:26117.
[19] Bellelis P,Frediani Barbeiro D,Gueuvoghlanian-Silva BY,et al. Interleukin-15 and interleukin-7 are the major cytokines to maintain endometriosis[J]. Gynecol Obstet Invest,2019,84(5):435-444.
[20] Singh AK,Dutta M,Chattopadhyay R,et al. Intrafollicular interleukin-8,interleukin-12,and adrenomedullin are the promising prognostic markers of oocyte and embryo quality in women with endometriosis[J]. J Assist Reprod Genet,2016,33(10):1363-1372.
[21] 魏静波,刘辉,赵彬,等.IL-10、IL-12在子宫内膜异位症组织中的表达[J].现代妇产科进展,2016,25(3):221-223.
[22] Mazzeo D,Vigano P,Di Blasio AM,et al. Interleukin-12 and its free p40 subunit regulate immune recognition of endometrial cells:potential role in endometriosis[J]. J Clin Endocrinol Metab,1998,83(3):911-916.
[23] 梁华,洛若愚,刘元姣.IL-12p70、p40在子宫内膜异位症患者腹腔液中的表达及意义[J].中国优生与遗传杂志,2003,11(4):68-69.