胆道感染是外科常见、多发且难治性的一类感染性疾病,多由胆道梗阻或胆汁淤积时胆道系统的细菌感染引起,胆囊炎和胆管炎是胆道感染的主要类型[1]。胆道感染若诊断治疗不及时,可引起胆囊穿孔、肝脓肿、甚至感染性休克等严重并发症[1-2],且近年来,随着胆道内镜技术和广谱抗生素的广泛应用,胆道感染细菌耐药问题也日趋严重,给临床诊治增加了难度。为帮助临床了解本地胆道感染病原菌构成、合理选择并使用抗菌药物,本研究回顾性分析2017—2019年我院胆汁培养分离出的病原菌及耐药菌感染特征,现报告如下。
1 资料与方法
1.1 一般资料 收集2017—2019年南京医科大学第一附属医院胆汁培养标本3 253例,其中阳性菌株1 264株,剔除同一患者重复分离的菌株;分析胆汁培养CRE阳性患者的临床资料,包括性别、年龄、原发疾病、治疗、转归等。本研究经医院伦理委员会批准。
1.2 仪器与试剂 VITEK 2 Compact全自动细菌鉴定分析仪及其配套鉴定卡、药敏卡购自生物梅里埃公司;药敏纸片来自英国OXOID公司;血平板、沙保罗平板、MH琼脂平板来自中国安图公司和法国生物梅里埃公司;CO2培养箱(Thermo公司,美国);生物安全柜(山东博科公司)。
1.3 方法
1.3.1 菌株鉴定及药敏 按照《全国临床检验操作规程》(第4版)的要求将胆汁标本进行接种和培养,并将临床分离的菌株使用VITEK 2 Compact全自动微生物分析仪及配套鉴定卡和药敏卡进行鉴定及药敏试验;药敏结果按照美国临床和实验室标准化协会(CLSI)M100-S26规定进行判读。
1.3.2 质量控制 质控菌株为铜绿假单胞菌ATCC 27853,大肠埃希菌ATCC 25922,金黄色葡萄球菌ATCC25923,白色念珠菌ATCC90028。
1.4 统计学方法 使用WHONET 5.6、SPSS 22.0软件进行数据收集、录入及分析。对影响胆汁培养CRE阳性患者临床预后的单因素分析采用χ2检验,多因素分析采用Logistic回归分析。P<0.05为差异有统计学意义。
2 结 果
2.1 胆汁培养病原菌构成及科室分布 2017—2019年3 253例胆汁培养标本中,阳性标本1 043例,培养阳性率为32.1%,两种及以上细菌混合感染占20.3%(212/1 043),共检出非重复分离病原菌1 264株,其中革兰阴性菌780株(61.7%),革兰阳性菌417株(33.0%),真菌67株(5.3%),见表1。胆汁培养病原菌来源科室分布广泛,主要包括普外科(28.7%)、肝胆中心病区(19.5%)、胰胆中心病区(13.4%)等。各病区病原菌构成略有不同,其中普外科、胆胰中心病区以大肠埃希菌和肺炎克雷伯菌为主,肝胆中心以大肠埃希菌和屎肠球菌为主。
表1 2017—2019年胆汁病原菌分布及构成比
Table 1 Distribution and composition of pathogenic
bacteria in bile from 2017 to 2019

病原菌菌株数(%)革兰阴性菌780(61.7) 大肠埃希菌327(25.9) 肺炎克雷伯菌138(10.9) 阴沟克雷伯菌49(3.9) 铜绿假单胞菌47(3.7) 鲍曼不动杆菌39(3.1) 嗜水/豚鼠气单胞菌37(2.9) 嗜麦芽窄食单胞菌17(1.3) 弗氏柠檬酸杆菌16(1.3) 产酸克雷伯菌14(1.1) 其他96(7.6) 革兰阳性菌417(33.0) 屎肠球菌148(11.7) 粪肠球菌112(8.9) 铅黄肠球菌18(1.4) 鹑鸡肠球菌16(1.3) 金黄色葡萄球菌12(0.9) 溶血葡萄球菌12(0.9) 其他99(7.8) 真菌67(5.3) 白假丝酵母菌36(2.8) 热带假丝酵母菌16(1.3) 光滑假丝酵母菌6(0.5) 其他9(0.7) 合计1 264(100.0)
表2 2017—2019年胆汁分离主要革兰阴性菌药物敏感性分析
Table 2 DDrug sensitivity analysis of major gram-negative bacteria in bile from 2017 to 2019 (%)
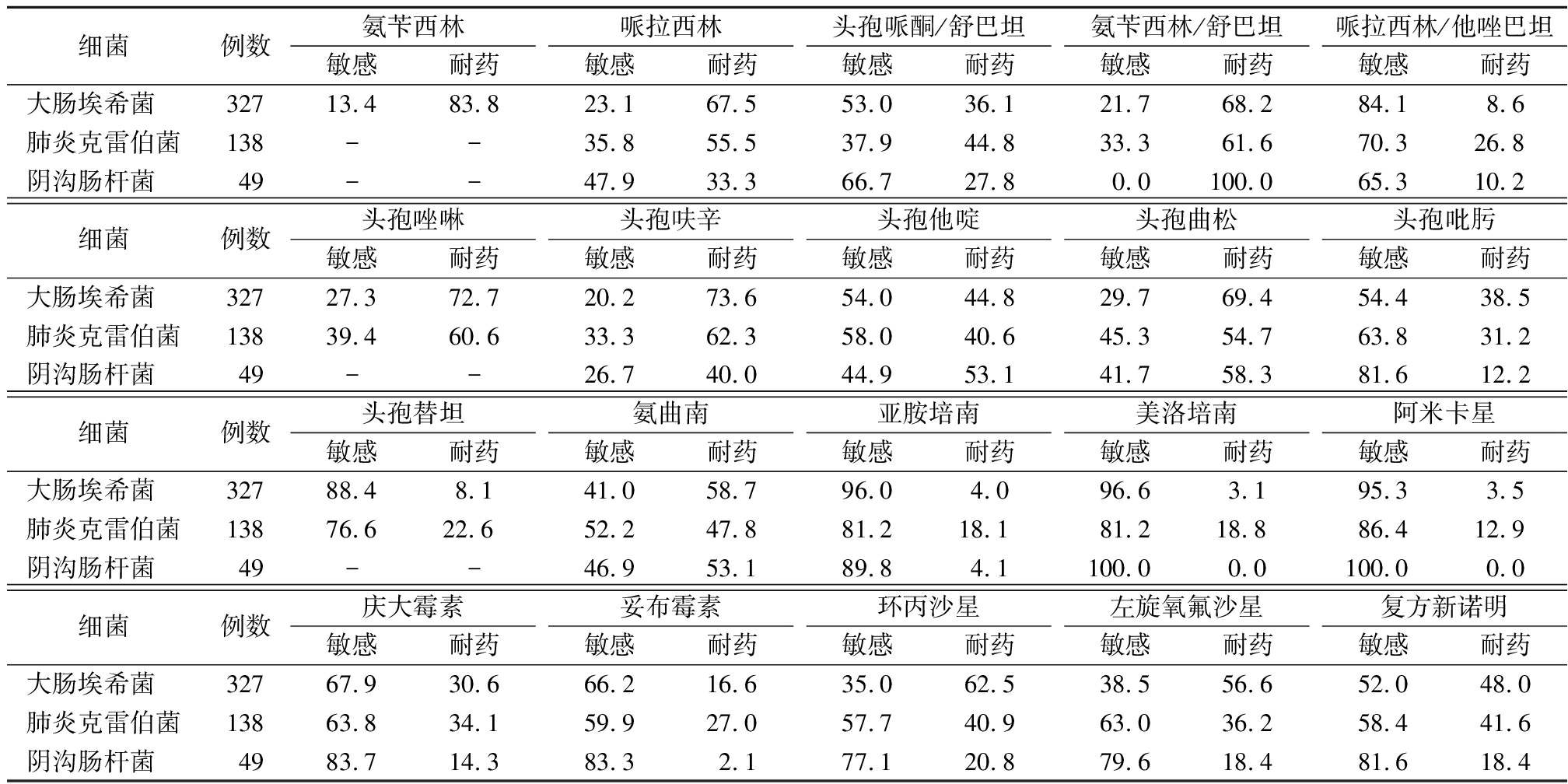
细菌例数氨苄西林敏感耐药哌拉西林敏感耐药头孢哌酮/舒巴坦敏感耐药氨苄西林/舒巴坦敏感耐药哌拉西林/他唑巴坦敏感耐药大肠埃希菌 32713.483.823.167.553.036.121.768.284.18.6肺炎克雷伯菌138--35.855.537.944.833.361.670.326.8阴沟肠杆菌 49--47.933.366.727.80.0100.065.310.2细菌例数头孢唑啉敏感耐药头孢呋辛敏感耐药头孢他啶敏感耐药头孢曲松敏感耐药头孢吡肟敏感耐药大肠埃希菌 32727.372.720.273.654.044.829.769.454.438.5肺炎克雷伯菌13839.460.633.362.358.040.645.354.763.831.2阴沟肠杆菌 49--26.740.044.953.141.758.381.612.2细菌例数头孢替坦敏感耐药氨曲南敏感耐药亚胺培南敏感耐药美洛培南敏感耐药阿米卡星敏感耐药大肠埃希菌 32788.48.141.058.796.04.096.63.195.33.5肺炎克雷伯菌13876.622.652.247.881.218.181.218.886.412.9阴沟肠杆菌 49--46.953.189.84.1100.00.0100.00.0细菌例数庆大霉素敏感耐药妥布霉素敏感耐药环丙沙星敏感耐药左旋氧氟沙星敏感耐药复方新诺明敏感耐药大肠埃希菌 32767.930.666.216.635.062.538.556.652.048.0肺炎克雷伯菌13863.834.159.927.057.740.963.036.258.441.6阴沟肠杆菌 4983.714.383.32.177.120.879.618.481.618.4
2.2 主要革兰阴性菌药物敏感性分析 2017—2019年胆汁分离病原菌中,三种主要肠杆菌科细菌大肠埃希菌、肺炎克雷伯菌、阴沟肠杆菌对碳青霉烯类、氨基糖苷类药物、哌拉西林/他唑巴坦敏感性均>63.8%,其中大肠埃希菌对美罗培南敏感性最高,为96.6%;肺炎克雷伯菌对阿米卡星敏感性最高,为86.4%;阴沟肠杆菌对美罗培南、阿米卡星敏感性均为100%,见表2。主要非发酵菌中铜绿假单胞菌对大多数抗菌药物敏感性较高,除外氨苄西林/舒巴坦、复方新诺明,其余药物敏感性均>52.6%,鲍曼不动杆菌耐药情况严重,对常用抗菌药物敏感性均小于47.4%。
—:未测定
2.3 主要革兰阳性菌药物敏感性分析 2017—2019年胆汁分离革兰阳性菌以肠球菌属为主,其中屎肠球菌、粪肠球菌对高浓度庆大霉素、高浓度链霉素、利奈唑胺、万古霉素敏感性较高(>63.3%);对红霉素、克林霉素敏感性较低(<11.6%)。屎肠球菌对青霉素类、喹诺酮类药物敏感性(<29.1%)显著低于粪肠球菌(>83.9%);除对万古霉素天然耐药的肠球菌,暂未发现对万古霉素耐药的肠球菌。
2.4 主要耐药菌统计及耐药菌临床特点分析 2017—2019年胆汁分离CRE共50株,占肠杆菌科细菌总数的8.4%。近两年CRE有上升趋势,分离率分别为6.5%(4/61)、9.4%(15/160)、8.4%(31/370)。50株CRE中肺炎克雷伯菌占62.0%(31/50),大肠埃希菌占26.0%(13/50),阴沟肠杆菌、产气克雷伯菌、弗氏柠檬酸杆菌近年来也有CRE检出,分别占比6.0%(3/50)、4.0%(2/50)、2.0%(1/50)。CR-KPN检出率最高22.5%(31/138),阴沟肠杆菌和大肠埃希菌次之,检出率分别为6.1%(3/49),4.0%(13/327)。
2.5 患者预后不良因素的Logistic回归分析 50例胆汁培养出CRE菌株的患者中男性占70%(35/50);大于50岁患者占78%(37/50);患者基础疾病包括胆道结石、恶性肿瘤、肝移植、腹部外伤,消化道出血等;患者多有胆囊切除和胆汁引流史;合并有血流感染者占30%(15/50);病情好转患者占70%(35/50),死亡及自动出院患者占30%(15/50)。Logistic回归分析以患者预后(好转=0,不良=1)作为因变量,以胆汁培养CR-KPN(否=0,是=1)、消化道出血(否=0,是=1)、性别(女=0,男=1)、年龄(<50岁=0,≥50岁=1)为自变量,结果显示胆汁培养出CR-KPN是患者预后不良的独立危险因素(P<0.05),见表3。
表3 胆汁培养CRE阳性患者预后不良因素的Logistic回归分析
Table 3 Logistic regression analysis of adverse prognostic factors in patients with positive CRE in bile culture
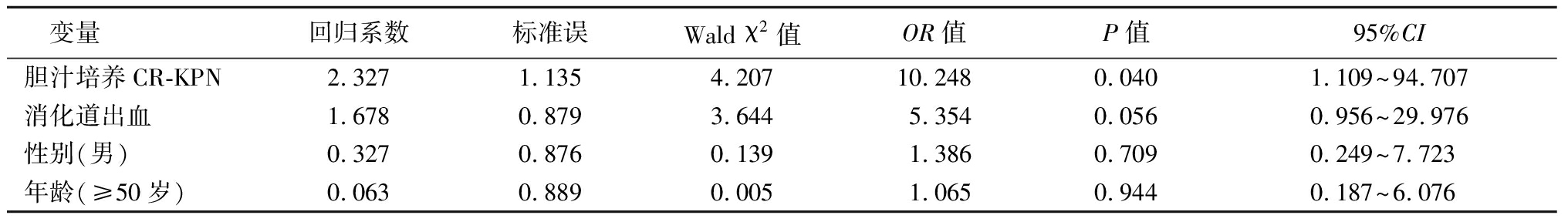
变量回归系数标准误Wald χ2值OR值P值95%CI胆汁培养CR-KPN2.327 1.1354.20710.2480.0401.109~94.707消化道出血1.678 0.8793.6445.3540.0560.956~29.976性别(男)0.327 0.8760.1391.3860.7090.249~7.723年龄(≥50岁)0.063 0.8890.0051.0650.9440.187~6.076
3 讨 论
胆汁培养可确定急性胆道感染的病原菌[3],血培养也可对胆道感染进行辅助诊断[4]。有文献显示胆道感染时胆汁培养阳性率一般在75%左右[5],本研究中胆汁培养阳性率为32.1%,可能和院感监测力度加强,临床增加胆汁标本送检量有关,地区和培养技术的差异也导致阳性率不同[1,6]。本研究分离的非重复1 264株病原菌中,革兰阴性菌占61.7%,革兰阳性菌占33.0%,病原菌种类大多与肠道细菌种类一致,间接证明胆道细菌来源于肠道细菌移位,其他研究也得出类似结论[7-9]。真菌占5.3%,较殷红莲等[1]、陈明慧等[6]报道的要多,此现象可能是由于本院外科手术、引流等侵入性操作的广泛应用导致。本研究无厌氧菌检出,有报道指出厌氧菌在胆汁培养中也有一定比例[10],临床医生应意识到胆道存在厌氧菌感染的可能性,规范留取胆汁厌氧菌培养标本,增加厌氧菌培养的送检量,以提高本院胆汁厌氧菌检出率。我院胆汁混合感染的标本数占20.3%,国内其他研究少有报道[7-9],临床医生应警惕胆道存在混合感染的相关问题。
胆汁病原菌来源科室以肝、胆、胰疾病相关科室为主,患者多有胆道结石、肝胆肿瘤、胰腺炎症或肿瘤等消化系统疾病,易导致胆道梗阻及胆汁淤积,临床多采用胆道引流及外科手术进行治疗,而术后胆道感染是较为常见且严重的并发症之一[6]。因此高危科室应根据各病区胆汁病原菌分布特点在围手术期合理使用抗菌药物,预防胆道感染发生。
本院胆汁分离革兰阴性杆菌中,三种主要肠杆菌科细菌大肠埃希菌、肺炎克雷伯菌、阴沟肠杆菌对青霉素类药物、氨苄西林/舒巴坦、氨曲南、一代、二代、三代头孢敏感性低,不推荐其作为经验用药;大肠埃希菌对喹诺酮类药物耐药严重,肺炎克雷伯菌和阴沟肠杆菌对其比较敏感,临床医师应根据药敏情况选择是否使用喹诺酮类药物。肠杆菌科细菌对碳青霉烯类药物、氨基糖苷类药物、哌拉西林/他唑巴坦敏感性较高,此类药物可作为肠杆菌科细菌胆道感染的有效抗菌药物[3],但氨基糖苷类药物有肾毒性和耳毒性,应谨慎使用[6]。非发酵菌中,铜绿假单胞菌对妥布霉素、阿米卡星敏感性最高,在考虑肾毒性及耳毒性情况后氨基糖苷类药物适合经验性治疗铜绿假单胞菌引起的胆道感染。鲍曼不动杆菌耐药情况严重,治疗此类细菌引起的胆道感染推荐使用替加环素、多黏菌素等[7,11]。
本院胆汁分离革兰阳性菌以肠球菌属为主,其中屎肠球菌对多种抗生素的耐药率明显高于粪肠球菌,这与其他学者的研究类似[7,11]。屎肠球菌、粪肠球菌对利奈唑胺、万古霉素的耐药率低,急性胆道感染东京指南推荐万古霉素作为经验性治疗屎肠球菌胆道感染的首选药物,对于粪肠球菌,氨苄西林表现出较高的敏感性(99.1%),指南指出氨苄西林可覆盖大多数粪肠球菌菌株,利奈唑胺或达托霉素可用于治疗万古霉素耐药的肠球菌属胆道感染[3]。本院胆汁分离真菌多为胆汁引流,以白假丝酵母菌为主,对常用抗真菌药物均敏感,故及时拔除或更换引流管并使用抗真菌药物可起到良好疗效。
近年来,随着胆道内镜技术、外科引流技术的广泛应用以及抗生素不合理使用,胆道感染细菌耐药问题日趋严重,其中CRE显著增多[6-7,9]。本院2017—2019年胆汁分离CRE菌株占肠杆菌科细菌总数的8.3%,明显高于汪倩钰等[11]报道的CRE检出率,且近两年有上升趋势,提示我院CRE感染情况严重,尤其是CR-KPN感染。本研究就50例胆汁培养CRE菌株的患者临床特点进行分析,从患者性别来看,男性明显多于女性,可能是由于男性饮食习惯差,容易造成胆道感染,CRE的比例也随之增加;从患者年龄及临床诊断来看,胆汁培养CRE阳性患者中大于50岁以上的人群占74%且多数患者病情复杂,提示CRE更易感染中老年免疫功能低下及危重症患者,张露方等[12-13]也得出类似结论;患者多有手术及胆汁引流等治疗史,手术引流可能是胆道感染的危险因素[14]。有研究表明胆道感染继发血流感染会明显增加其病死率[4],临床医生应警惕患者胆道感染CRE后继发血流感染的风险。胆道CRE感染患者预后较差,死亡及自动出院患者比例较高,因此临床早期进行有效的抗菌治疗至关重要。
本研究随后对影响胆汁培养CRE阳性患者的临床预后进行单因素分析显示,消化道出血、CR-KPN可能是胆汁培养CRE阳性患者预后不良的危险因素,进一步做多因素Logistic回归分析表明,CR-KPN是胆汁培养CRE阳性患者预后不良独立的危险因素,临床医生应警惕CR-KPN引起的胆道感染并及时进行干预。此外,由于胆道病原菌多为肠道来源,而肠道定植CRE是造成患者随后感染CRE重要的危险因素,会增加胆道CRE感染的概率,有研究表明经过主动筛查联合其他干预措施后,CRE感染会明显减少[15],因此建议在做胆道手术前或有胆道感染的高风险人群治疗前进行CRE主动筛查,并进行去定植治疗,以减少后期患者感染CRE的风险。目前,针对CRE的治疗没有特效抗菌药物,临床推荐使用黏菌素、氨基糖苷类、替加环素、磷霉素以及新药头孢他啶/阿维巴坦等进行治疗[12]。
综上所述,我院胆汁分离病原菌以肠杆菌科细菌为主,肠球菌属次之。肠杆菌科细菌对碳青霉烯耐药的情况严重,临床应加强院感防控,根据耐药菌类型判断预后并及时进行干预,主动筛查消化道的耐药菌定植,减少耐药菌异位感染的发生,降低胆道感染的病死率。
[1] 殷红莲,汤国宁,郭丽红.胆道感染病原菌分布及耐药性分析[J].实用医技杂志,2020,27(1):52-55.
[2] 董汉华,武齐齐,陈孝平.急性胆道感染东京指南(2018版)更新解读[J].临床外科杂志,2019,27(1):5-9.
[3] Gomi H,Solomkin JS,Schlossberg D,et al. Tokyo Guidelines 2018:antimicrobial therapy for acute cholangitis and cholecystitis[J]. J Hepatobiliary Pancreat Sci,2018,25(1):3-16.
[4] 刘娟,刘波,李惠芬,等.胆道感染病原学分析[J].中华医院感染学杂志,2018,28(20):3111-3114.
[5] 黄锦荣,肖吓鹏,郑赟,等.200例胆石症合并胆道感染患者的病原菌分布、耐药性及危险因素分析[J].中国病原生物学杂志,2020,15(3):332-334.
[6] 陈明慧,陈莎燕,杰房,等.2016-2018年临床常见胆道感染病原菌分布及耐药性变迁[J].中国实验诊断学,2019,23(12):2081-2085.
[7] 屠艳烨,李情操,吴巧萍,等.肝胆外科胆汁标本病原学分布及耐药性分析[J].中国卫生检验杂志,2019,29(20):2481-2484.
[8] 邬丽娜,宋毓飞,周云,等.宁波地区3410例胆道感染患者胆汁培养病原菌分布及耐药性调查分析[J].现代实用医学,2019,31(5):649-650.
[9] 刘青华,王成英,宋宇,等.735株胆汁培养细菌菌株构成及耐药性分析[J].国外医药(抗生素分册),2019,40(4):355-358.
[10] 陈鑫,牛淼.急性胆源性胰腺炎患者胆汁中主要致病菌与敏感抗菌药物及相关因素分析[J].国际检验医学杂志,2019,40(3):321-324.
[11] 汪倩钰,李从荣,郭静,等.胆道疾病患者胆汁病原菌谱与耐药监测[J].肝胆胰外科杂志,2019,31(7):417-421.
[12] 张露方,耿荣华,曲芬.耐碳青霉烯肠杆菌科细菌的流行病学特点以及抗生素应用策略[J].中国抗生素杂志,2019,44(9):1008-1014.
[13] 李纾,郭辅政,赵秀娟,等.重症监护病房患者耐碳青霉烯类肠杆菌定植情况及对感染的危险因素分析[J].实用医学杂志,2020,36(2):254-257.
[14] 刘润平.胆道结石术后感染病原菌分布及其影响因素分析[J].中国药物与临床,2020,20(5):714-716.
[15] 王福斌,王广芬,廖丹,等.耐碳青霉烯类肠杆菌科细菌主动筛查研究进展[J].中华医院感染学杂志,2018,28(3):477-480.