宫颈癌是最为常见的妇科恶性肿瘤,也是发展中国家女性第三大死亡原因。宫颈癌的发病率和病死率正在趋于年轻化,发病率呈增长趋势[1]。宫颈病变是育龄妇女最常见的疾病,主要包括炎症、损伤、畸形、癌前病变以及肿瘤等,其中宫颈癌的危害最大,已成为仅次于乳腺癌的恶性肿瘤。宫颈癌通常是由人乳头瘤病毒(human papillomavirus,HPV)感染引起的, HPV是一种球形DNA病毒,能够引发人体皮肤黏膜鳞状上皮增殖,进一步繁殖可能会导致各种宫颈疾病。HPV成为引发宫颈上皮瘤变(cervical intraepithelial neoplasia, CIN)及宫颈癌的必要条件[2],其在宫颈病变甚至宫颈癌的发展过程中,有着至关重要的作用。研究发现可将其作为宫颈癌筛查的手段,便于识别高危人群对其进行早期诊断及预防。现如今宫颈脱落细胞DNA定量分析已成为宫颈病变的一种常规筛查方法,但关于HPV的负荷量与宫颈病变的关系存在很多争议[3]。本研究选取我院门诊就诊均行宫颈液基薄层细胞学筛查(thinprep cytologic test, TCT)、HPV的体检者1 169例,以组织病理结果为诊断标准,对宫颈病变阳性率进行回顾性分析,分析HPV DNA负荷载量与宫颈病变的关系,比较TCT、HPV筛查方法在诊断宫颈病变的应用价值,为今后开展宫颈疾病防治和健康教育工作提供理论依据。结果分析报告如下。
1 资料与方法
1.1 一般资料 选取2018年6月1日—12月31日在联勤保障部队第九八〇医院妇科门诊就诊者1 169例,均行TCT、HPV检查,纳入标准:①有性生活史;② 3 d内未有阴道用药史,24 h内无性生活史。排除标准:妊娠期、月经期、宫颈手术史、子宫切除术史、宫颈上皮内病变史、盆腔放射治疗史患者。
1.2 研究方法 行TCT和HPV检查前体检者需要禁止性生活1 d,同时禁止对阴道进行上药或者清洗。TCT检查需使用专用的宫颈刷,采用的为新柏式液基薄层细胞检测技术,操作规范,先将宫颈刷置于宫颈管中,旋转3~5 圈,然后将获取分泌物的宫颈刷放置于试管中,获取样本。将刷头进行洗涮,收集宫颈表面和颈管的脱落细胞,盖好瓶盖做好登记,送检。TCT诊断标准依据2001年修订国际癌症协会TBS诊断系统[4]:分别为正常范围、炎症反应性改变、非典型鳞状细胞(atypical squamous cell,ASC) [包括意义不明的非典型鳞状上皮细胞(atypical squamous cells of undetermined significance,ASC-US)和不能排除高级别鳞状上皮内病变(high grade squamous intraepithelial lesions,HSIL)的非典型鳞状上皮细胞(atypical squamous cells that cannot exclude HSIL,ASC-H)]、低级别鳞状上皮内病变(low grade squamous intraepithelial lesions,LSIL)、高级别鳞状上皮内病变(high grade squamous intraepithelial lesions,HSIL)、鳞癌和腺癌。TCT≥ASC检查结果为阳性。
HPV 采样将采样刷置于宫颈管,逆时针旋转3~5 圈,将采样刷置于标本存储瓶里,置于4 ℃环境中保存待检。HPV DNA 采用HC2技术,严格按照基因试剂盒说明书进行检测,利用对抗体捕获信号放大和化学发光信号的检测,可同时检测13种HPV并可检测 HPV DNA 载量。判断标准为: HPV DNA负荷量≥1.0 ng/L为阳性,HPV DNA负荷量1.0 ng/L以下则为阴性[5]。
对于HPV DNA阳性并且 TCT≥ASC或HPV DNA 阴性但 TCT≥LSIL者,建议经阴道镜下宫颈活组织病理检查。采用电子阴道镜,组织切片结果由2名以上病理科医师阅片。组织病理诊断包括:①正常或者炎症;②CINⅠ级;③CINⅡ级;④CINⅢ级(包括原位癌);⑤浸润癌或者腺癌。
1.3 统计学方法 应用SPSS 21.0统计软件分析数据。计数资料比较采用χ2检验。 P<0.05为差异有统计学意义。
2 结 果
2.1 研究人群的人口学特征 资料完整样本共1 169例,年龄20~75岁,平均(42.10±11.69)岁,年龄<35岁333例(28.49%),35~44岁383例(32.76%),45~54岁281例(24.04%),55~64岁118例(10.09%),65~75例(4.62%)。
2.2 宫颈活组织病理检查检出情况 对于HPV DNA阳性并且 TCT≥ASC或HPV DNA 阴性但 TCT≥LSIL者,建议经阴道镜下宫颈活组织病理检查。1 169例中有205例(17.54%)妇女行宫颈活组织病理检查,其中病理结果阴性 89 例(43.41%),阳性116例(56.59%)[包括CINⅠ 66例(56.90%),CINⅡ 26 例(22.41%),CINⅢ 17例(14.66%),子宫颈癌 7例(0.06%)]。
2.3 TCT与组织病理检出情况 1 169例中共有258例(22.07%)TCT检查结果为阳性。对于HPV DNA阳性并且 TCT≥ASC或HPV DNA 阴性但 TCT≥LSIL者,行经阴道镜下宫颈活组织病理检查,行宫颈活组织病理检查共有205例妇女,其中TCT检查结果为ASC、LSIL、HSIL阳性率分别为49.47%(47/95)、57.69%(45/78)和75.00%(24/32)。与ASC与HSIL病理结果阳性率比较差异均有统计学意义(P<0.05),见表1。
表1 TCT与组织病理检出情况
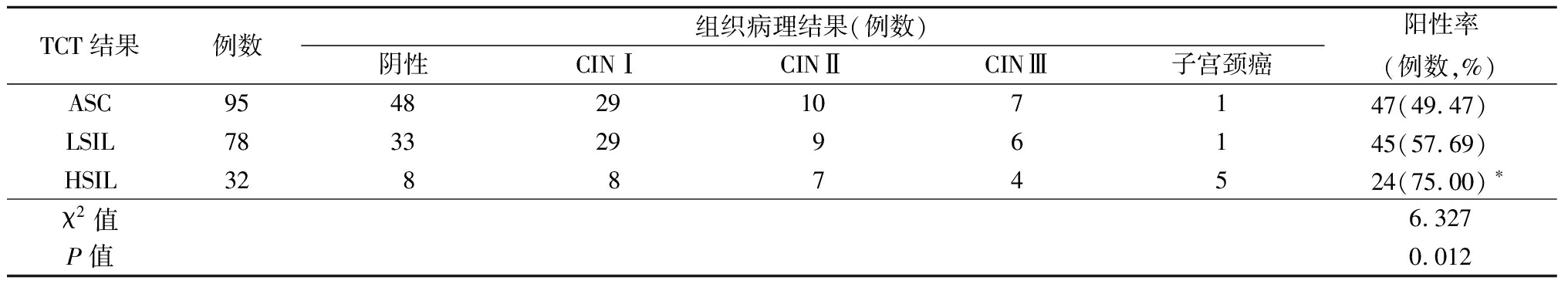
TCT结果例数组织病理结果(例数)阴性CINⅠCINⅡCINⅢ子宫颈癌阳性率(例数,%)ASC954829107147(49.47) LSIL78332996145(57.69) HSIL328874524(75.00)∗χ2值6.327P值0.012
*P值<0.05 与ASC比较(χ2检验)
2.4 HPV DNA负荷量与组织病理检出情况 1 169例中共有296例(25.32%)HPV结果为阳性。对于HPV DNA阳性并且 TCT≥ASC或HPV DNA 阴性但 TCT≥LSIL者,行经阴道镜下宫颈活组织病理检查,行宫颈活组织病理检查共有205例妇女,将HPV DNA负荷量按照<1、1~<10、10~<100、100~<500、500~<1 000、>1 000进行分组,各组病理结果阳性率分别为11.76%(4/34)、60.94%(39/64)、68.57%(24/35)、60.61%(20/33)、78.26%(18/23)和68.75%(11/16)。HPV DNA负荷量1~<10、10~<100、100~<500、500~<1 000、>1 000组与<1组比较差异均有统计学意义(P<0.05),见表2。
表2 HPV DNA负荷量与组织病理检出情况
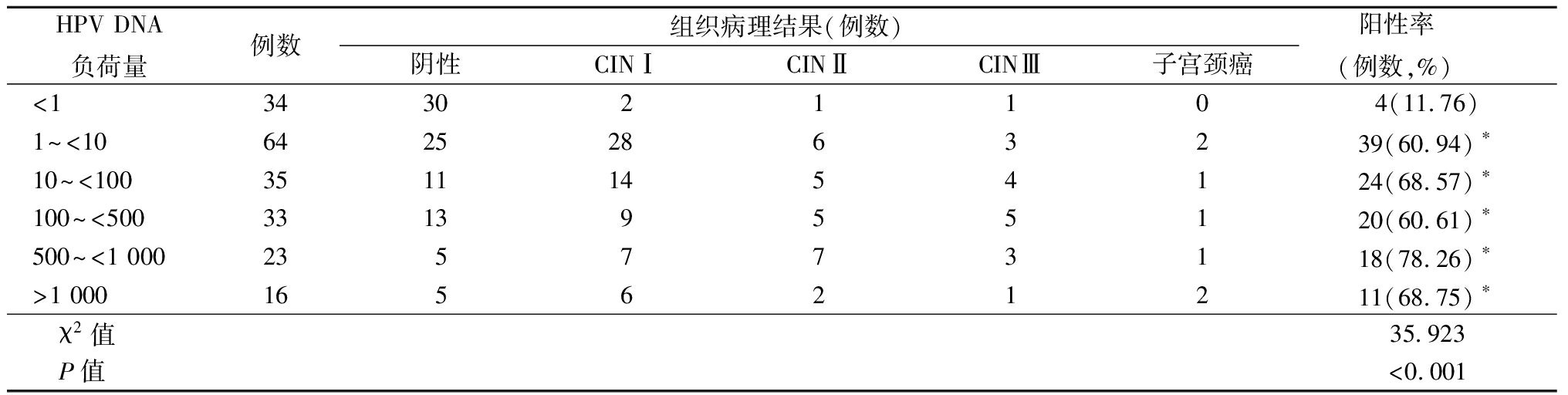
HPV DNA负荷量例数组织病理结果(例数)阴性CINⅠCINⅡCINⅢ子宫颈癌阳性率(例数,%)<1343021104(11.76)1~<1064252863239(60.94)∗10~<10035111454124(68.57)∗100~<5003313955120(60.61)∗500~<1 000235773118(78.26)∗>1 000165621211(68.75)∗ χ2值35.923 P值<0.001
*P值<0.05与<1比较(χ2检检)
2.5 TCT和HPV检测结果 以TCT结果为ASC及以上作为活组织病理检查的标准,则TCT在宫颈病变的敏感度为87.93%,特异度为28.09%。若以HPV阳性作为活检的标准,则HPV在宫颈病变的敏感度为96.55%,特异度为33.71%。TCT和HPV检测敏感度比较差异有统计学意义(χ2=6.023,P<0.05),特异度比较差异无统计学意义(P>0.05)。HPV在宫颈病变中的敏感度和特异度均高于TCT,见表3。
表3 TCT与HPV检测情况比较
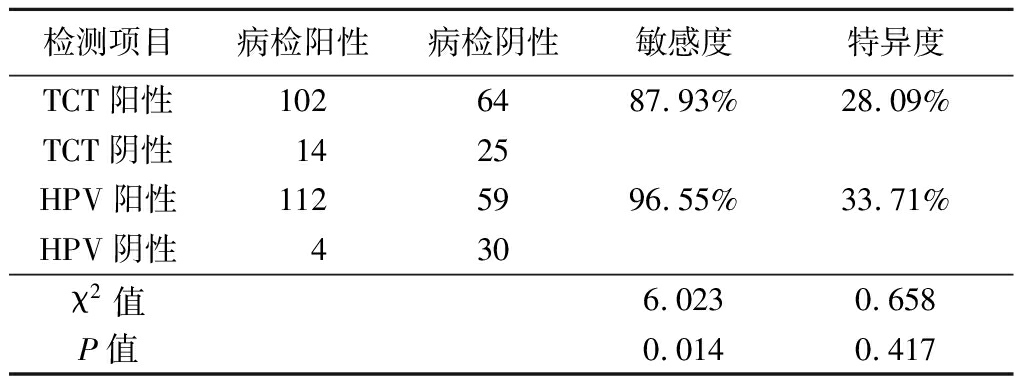
检测项目病检阳性病检阴性敏感度特异度TCT阳性1026487.93%28.09%TCT阴性1425HPV阳性1125996.55%33.71%HPV阴性 430χ2值6.0230.658P值0.0140.417
3 讨 论
宫颈癌发病居妇科恶性肿瘤首位,是造成女性死亡的恶性肿瘤之一,病死率高达10%~15%[6]。全世界子宫颈癌新发病例约53万,死亡病例约26.6万,世界范围内2018年新增病例56.9万例,新增死亡31.3万人次, 95%以上宫颈癌归因于HPV感染。我国作为发展中国家之一,宫颈癌发生屡见不鲜。报道显示,2015年我国子宫颈癌新发病例为9.89万,如果不加以预防和控制,预计到2050年,子宫颈癌新发病例数将增加到18.7万[7]。同时随着社会的发展,相关调查数据提示宫颈癌发病率呈现年轻化的趋势,同时年轻人缺乏对于子宫颈癌认识[8]。宫颈癌演变过程比较漫长,早发现、早诊断、早治疗是其预防的重要手段。目前对于宫颈病变的筛查方式有很多种 ,其中HPV、TCT、阴道镜下活检都是几种常用的检查手段。宫颈病变的检出率随着宫颈癌筛查项目的发展和TCT的应用不断提升。HPV也被广泛应用于宫颈癌前病变的筛查,已成为主要的筛查方法[9]。科学技术的发展使得宫颈癌的致病因素浮出水面,特别是HPV 病毒感染,90% 以上宫颈癌伴有HPV 感染。本研究HPV的感染率为25.32%,与国内各省市比较处于中等水平[10-12] 。分析HPV DNA负荷载量与宫颈病变的关系,比较TCT与HPV在诊断宫颈病变的应用价值,对于今后开展宫颈疾病防治和健康教育工作有重要意义。
本研究宫颈活组织病理检查阳性率为56.59%,HPV的感染在CIN各级病变转归中起着极其重要的作用。Arrossi等[13]回顾性分析了2010-2011年接受细胞学筛查的29 631例妇女中,236例检测到CINⅡ+。在2012-2014年检测的49 565例女性HPV中,693例在第1轮筛查后发现存在CINⅡ+。与细胞学筛查相比,在控制年龄后,HPV经临床医生采集试验诊断CINⅡ+病变的优势比为2.34。Arbyn等[14]研究相比较HPV的检出率提高了1倍,但同样指出HPV检测对于CINⅡ+或CINⅢ+的准确性与临床医生采集的宫颈样本相似。Kelly等[15]也发现HPV DNA在CINⅡ以上级别的检出率上有较高的敏感度和特异度,均高于TCT检查。本研究TCT检查结果阳性率为22.07%,HPV感染检查结果阳性率为25.32%,处于较高水平。对于HPV DNA阳性并且 TCT≥ASC或HPV DNA 阴性但 TCT≥LSIL者,建议经阴道镜下宫颈活组织病理检查,各TCT检查结果以及各组HPV DNA负荷量病理检查结果阳性率比较差异均有统计学意义,与国内许多研究结果一致[3]。
有研究学者发现,HPV高病毒载量的会增加患者5年内宫颈癌复发和死亡的风险[16]。使用HPV DNA检测的随机临床试验发现,HPV筛查可对宫颈癌提前起到保护作用,推荐对年龄≥30岁的妇女进行HPV的筛查[17]。许多国内外学者对宫颈病变的严重程度与高危型HPV的负荷量的关系做了深度分析探讨,但仍存在一些争议:部分学者认为HPV的高负荷量与病毒不断复制和持续感染有关,HPV感染检查结果阳性率和病毒载量中位数与宫颈病变的病理程度相关,HPV的持续感染在宫颈病变的发展中起着重要的作用[18-19];也有部分学者认为,HPV DNA负荷量与宫颈病变的程度无关[6]。HPV DNA负荷量与宫颈病变的关系尚需进一步研究。本研究HPV DNA负荷量由低到高各组病理结果阳性率分别为11.76%(4/34)、60.94%(39/64)、68.57%(24/35)、60.61%(20/33)、78.26%(18/23)和68.75%(11/16),说明高病毒载量和宫颈病变的程度密切相关。
本研究使用TCT在宫颈病变的敏感度为87.79%,特异度为28.09%,HPV在宫颈病变的敏感度为96.55%,特异度为33.71%。HPV在宫颈病变中的敏感度和特异度均高于TCT。结果与一些学者的检查结果一致[3],但不符合宫颈细胞学敏感度不足(60%~80%),而特异度高(90%以上)的特点[4],可能与样本选取有关。TCT实际检测中敏感度不高,会产生较高的漏诊率,主要与其容易受到液基细胞学试剂、技术人员等因素的影响有关。HPV的敏感度为96.55%,有一小部分宫颈癌对HPV呈阴性,可能与HPV检测对反映宫颈病变过于敏感,在引起宫颈病变之前,HPV可以被免疫系统清除[10],或有研究报道指出低百分比的宫颈癌是通过不依赖HPV途径发生的。HPV阴性肿瘤在晚期被诊断,淋巴结转移率较高[20]。假阴性是干扰癌前病变或宫颈癌诊断的重要原因之一,研究假阴性的检出率可以有效获得精准的临床数据,作为今后研究参考。本研究也存在不足之处,并未对TCT联合HPV结果进行对比,并未考虑HPV分型,研究结果仍需更大规模的前瞻性调查,在宫颈癌筛查的专家共识解读中指出,对于HPV16/18阳性者均应转诊阴道镜检查,即对于TCT阴性,但HPV16/18阳性者也应该做了阴道镜或宫颈活组织病理检查,能够提高检出率。同时应当重点关注假阴性检出率。
综上所述,HPV在宫颈病变中的敏感度和特异度优于TCT,HPV筛查和早期诊断有利于降低宫颈癌的发病率。宫颈病变程度与HPV DNA负荷载量等级呈正相关,负荷载量对初步诊断宫颈疾病类型具有重要的意义,可以帮助医生有效管理或筛查,需要密切关注高病毒载量患者。
[1] Chen X,Xu H,Xu W,et al. Prevalence and genotype distribution of human papillomavirus in 961,029 screening tests in southeastern China(Zhejiang Province) between 2011 and 2015[J]. Scientific Rep,2017,7(1):14813.
[2] 李彦,乔森,刘研,等.健康体检者与妇科门诊患者及宫颈癌患者人乳头瘤病毒基因型分布特点分析[J].中华医院感染学杂志,2017,27(10):2344-2347.
[3] 胡家昌,单莺.TCT和HC2检测在宫颈病变筛查中的临床意义[J].检验医学与临床,2019,16(17):2450-2452.
[4] 赵昀,魏丽惠.CSCCP关于中国宫颈癌筛查及异常管理相关问题专家共识解读[J].实用妇产科杂志,2018,34(2):101-104.
[5] Bottari F,Sideri M,Gulmini C,et al. Comparison of onclarity human papillomavirus(HPV) assay with hybrid capture Ⅱ HPV DNA assay for detection of cervical intraepithelial neoplasia grade 2 and 3 lesions[J]. J Clin Microbio,2015,53(7):2109-2114.
[6] Ojesina AI,Lichtenstein L,Freeman SS,et al. Landscape of genomic alterations in cervical carcinomas[J]. Nature,2014,506(7488):371.
[7] Chen W,Zheng R,Baade PD,et al. Cancer statistics in China,2015[J]. CA Cancer J Clin,2016,66(2):115-132.
[8] Farazi PA,Siahpush M,Michaud T L,et al. Awareness of HPV and cervical cancer prevention among university health sciences students in cyprus[J]. J Cancer Edu,2019,34(4):685-690.
[9] Ma L,Lei J,Ma L,et al. Characteristics of women infected with human papillomavirus in a tertiary hospital in Beijing China,2014-2018[J]. BMC infect Dis,2019,19(1):670.
[10] 张晓红,陈良凤,李东红,等.陕西省女性宫颈HPV感染流行病学现状调查[J].中国妇幼健康研究,2017,28(12):1589-1592.
[11] 裴蕴锋,经先振,周娟,等.医院就诊人群HPV感染的流行病学特征及其与宫颈癌/癌前病变的关系[J].华中科技大学学报(医学版),2018,47(3):349-353.
[12] 孙聪聪,梁爽,蒋鹏,等.重庆市女性HPV感染情况的流行病学调查[J].重庆医学,2016,45(36):5136-5138.
[13] Arrossi S,Paolino M,Laudi R,et al. Programmatic human papillomavirus testing in cervical cancer prevention in the jujuy demonstration project in argentina:a population-based,before-and-after retrospective cohort study[J]. Lancet Glob Health,2019,7(6):e772-e783.
[14] Arbyn M,de Sanjose S,Weiderpass E. HPV-based cervical cancer screening,including self-sampling,versus screening with cytology in argentina[J]. Lancet Glob Health,2019,7(6):e688-e689.
[15] Kelly H,Mayaud P,Segondy M,et al. A systematic review and meta-analysis of studies evaluating the performance of point-of-care tests for human papillomavirus screening[J]. Sex Transmitted Infect,2017,93(S4):S36-S45.
[16] Cheung TH,Yim SF,Yu MY,et al. Liquid biopsy of HPV DNA in cervical cancer[J]. J Clin Virol,2019,114:32-36.
[17] Forslund O,Miriam Elfström K,Lamin H,et al. HPV-mRNA and HPV-DNA detection in samples taken up to seven years before severe dysplasia of cervix uteri[J]. Int J Cancer,2019,144(5):1073-1081.
[18] Li TY,Wu ZN,Jiang MY,et al. Association between high risk human papillomavirus DNA load and cervical lesions in different infection status[J]. Zhong Hua Zhong Liu Za Zhi,2018,40(6):475-480.
[19] 张燕珠.HPV在宫颈炎、宫颈癌前病变、宫颈癌中的检测及临床意义[J].临床医学工程,2018,25(10):1355-1356.
[20] Nicol s I,Marimon L,Barnadas E,et al. HPV-negative tumors of the uterine cervix[J]. Mod Pathol,2019,32(8):1189-1196.
s I,Marimon L,Barnadas E,et al. HPV-negative tumors of the uterine cervix[J]. Mod Pathol,2019,32(8):1189-1196.