缺血预处理(ischemic preconditioning)是器官的短期缺血适应,可以在永久性缺血坏死之前起到保护作用,但完整的分子机制仍不明确[1]。据报道,氧化应激反应、线粒体损伤和细胞凋亡激活在缺血预处理后均被抑制。近年来有研究提出,自噬也许参与了缺血预处理的重要环节来减轻神经损伤[2]。本研究通过制作大鼠缺血再灌注模型,并对部分大鼠事先进行缺血预处理,探索自噬在大鼠脑缺再灌注损伤中的具体作用及可能的分子机制。进一步为脑缺血的防治提供可能策略。报告如下。
1 材料与方法
1.1 动物实验的设计 选择中国解放军军事医学科学院卫生学环境医学研究所的Sprague-Dawley雄性大鼠(8~9周龄,0.23~0.27 kg)。实验前大鼠处于12/12 h明/暗周期,并维持40%~60%相对湿度、(23±2)℃温度,保证实验动物获得标准啮齿动物饲料和自来水。依照《实验动物护理和使用指南》进行所有动物实验。将100只大鼠随机分为假手术组(A组)、缺血再灌注组(B组),缺血预处理组(C组),缺血再灌注+自噬抑制剂3-甲基腺嘌呤(3-Methyladenine,3-MA)组(D组),缺血预处理+3-MA组(E组),每组20只。2%戊巴比妥钠(50 mg/kg)麻醉实验动物,并为保持其体温在37 ℃,将其置于加热垫上。
1.2 试剂 TTC染色液(上海信帆生物科技有限公司),3-MA(Sigma,美国),全蛋白提取试剂盒(南京凯基生物),磷酸盐缓冲液(PBS,赛默飞公司,美国),兔抗鼠 Beclin-1、兔抗鼠LC3-Ⅱ(Cell Signaling,美国),GAPDH(Kangchen,美国),Western blot 发光试剂盒(Millipore,美国);浓缩型DAB试剂盒(北京中杉金桥生物技术有限公司)。
1.3 方法
1.3.1 缺血再灌注及缺血预处理模型的建立 脑缺血再灌注模型:使用Longa线栓法[3]以尼龙线栓(型号:2634-A4,北京西浓科技有限公司,中国)阻断大鼠右侧大脑中动脉血流供应,2 h后拉出恢复正常血流供应。缺血预处理模型:按照上述方法,用线栓阻断右侧大脑中动脉10 min后拔出,恢复血流20 min,并重复3次,24 h后继续制作缺血再灌注模型。假手术组只接受相同的麻醉和颈动脉剥离过程,不阻断大脑血流供应。大鼠脑缺血再灌注模型建立成功后,将0.5 mg 3-MA加入500 mL生理盐水中,制备1 mg/L浓度3-MA溶液,向D、E组大鼠侧脑室注射7.5 μg 3-MA溶液,A、B、C组注射等量生理盐水。
1.3.2 神经功能障碍评分 所有大鼠脑缺血再灌注后24 h评估神经功能障碍评分:0分,无神经功能障碍;1分,不能完全伸展左前肢;2分,爬行时左侧转圈;3分,爬行时向左侧倾倒;4分,无自主活动能力及意识障碍。
其中B组死亡2只, D组死亡1只(蛛网膜下腔出血),死亡与应用3-MA无关。上述死亡实验动物均不纳入实验数据,并随机补足实验动物,保证每组20只。
1.3.3 脑梗死体积的检测 大鼠采用4%水合氯醛(100 mg/kg)麻醉,迅速取出脑,去掉嗅球及后脑,从额极开始切取4张冠状脑片,厚约1.5 mm,立刻置于2% TTC溶液(pH值7.4,0.01 mol/L磷酸缓冲液配制)中,37 ℃避光孵育30 min。然后用10%多聚甲醛溶液浸泡固定。梗死区呈现白色,非梗死区呈现红色。应用使用光学显微镜(BX-51/DP-72)高清晰度彩色病理图文报告分析系统测出各区脑梗塞面积,根据公式V=t(A1+……+An)-(A1+An)t/2,算出梗死体积。其中t为切片厚度,A为梗死面积。
1.3.4 免疫组织化学法检测自噬标志物 LC3-Ⅱ及Beclin-1水平 取右侧海马组织,制备脑组织切片(2 mm),经二甲苯脱蜡,再由乙醇水化至水。用10%正常马血清阻断PBS后,应用兔抗大鼠LC3-Ⅱ和Beclin-1的多克隆抗体,并在恒温4 ℃下过夜。然后调整温度为37 ℃,用山羊抗兔抗体孵育15 min,滴入辣根过氧化物酶标记,应用浓缩型DAB试剂盒染色,充分显色后封片。
每只大鼠随机选取4张切片,使用光学显微镜(BX-51/DP-72,Olympus)查看神经细胞的形态学变化,每张切片随机观察5个视野,计数LC3-Ⅱ及Beclin-1阳性细胞(阳性细胞会被染色成灰色),取平均值。
1.3.5 细胞凋亡检测 取右侧海马组织切片(2 mm)遵按照制造商(德国曼海姆罗氏诊断公司)的方案,采用末端脱氧核苷酸转移酶脱氧尿苷三磷酸切口末端标记(terminal deoxynucleotidyl transferase dUTP nick end labeling,TUNEL)法标记凋亡的神经细胞。在光学显微镜400倍放大的条件下,连续选择10个区域,每个区域至少包含500个细胞。计算TUNEL染色阳性细胞占比(%)=TUNEL染色阳性细胞数/总细胞核数量×100%。
1.4 统计学方法 应用SPSS 17.0统计软件分析数据。计量资料比较采用单因素方差分析和SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组脑梗死体积和神经功能障碍评分测定结果比较 A组脑梗死体积和神经功能障碍评分均为0;C组脑梗死体积和神经功能障碍评分小于B组;D组脑梗死体积和神经功能障碍评分大于B组,小于C组;E组脑梗死体积和神经功能障碍评分大于C组,小于D组,差异有统计学意义(P>0.05)。见表1。
表1 各组大鼠脑梗死体积和神经功能障碍评分比较
Table 1 Comparison of cerebral infarct volume and
neurological dysfunction scores of rats in each group ![]()
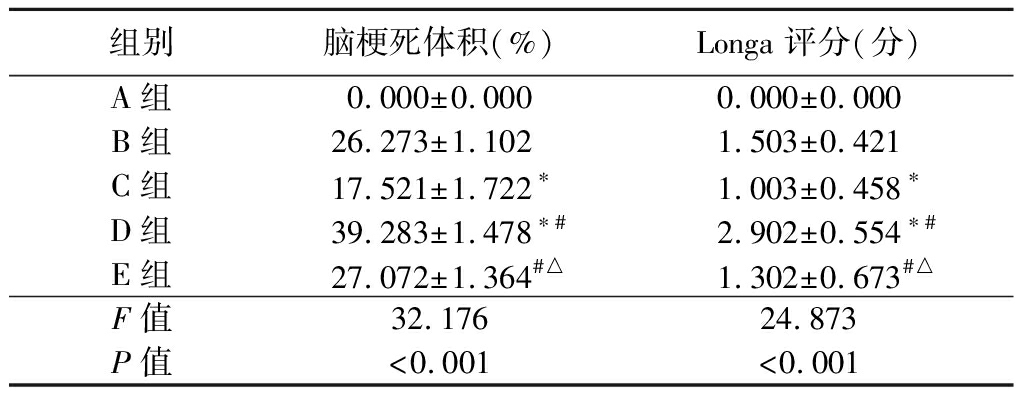
组别脑梗死体积(%)Longa 评分(分)A组 0.000±0.0000.000±0.000B组 26.273±1.1021.503±0.421C组 17.521±1.722∗1.003±0.458∗D组 39.283±1.478∗#2.902±0.554∗#E组 27.072±1.364#△1.302±0.673#△F值32.17624.873P值<0.001<0.001
*P值<0.05与B组比较 #P值<0.05与C组比较 △P值<0.05与D组比较(SNK-q检验)
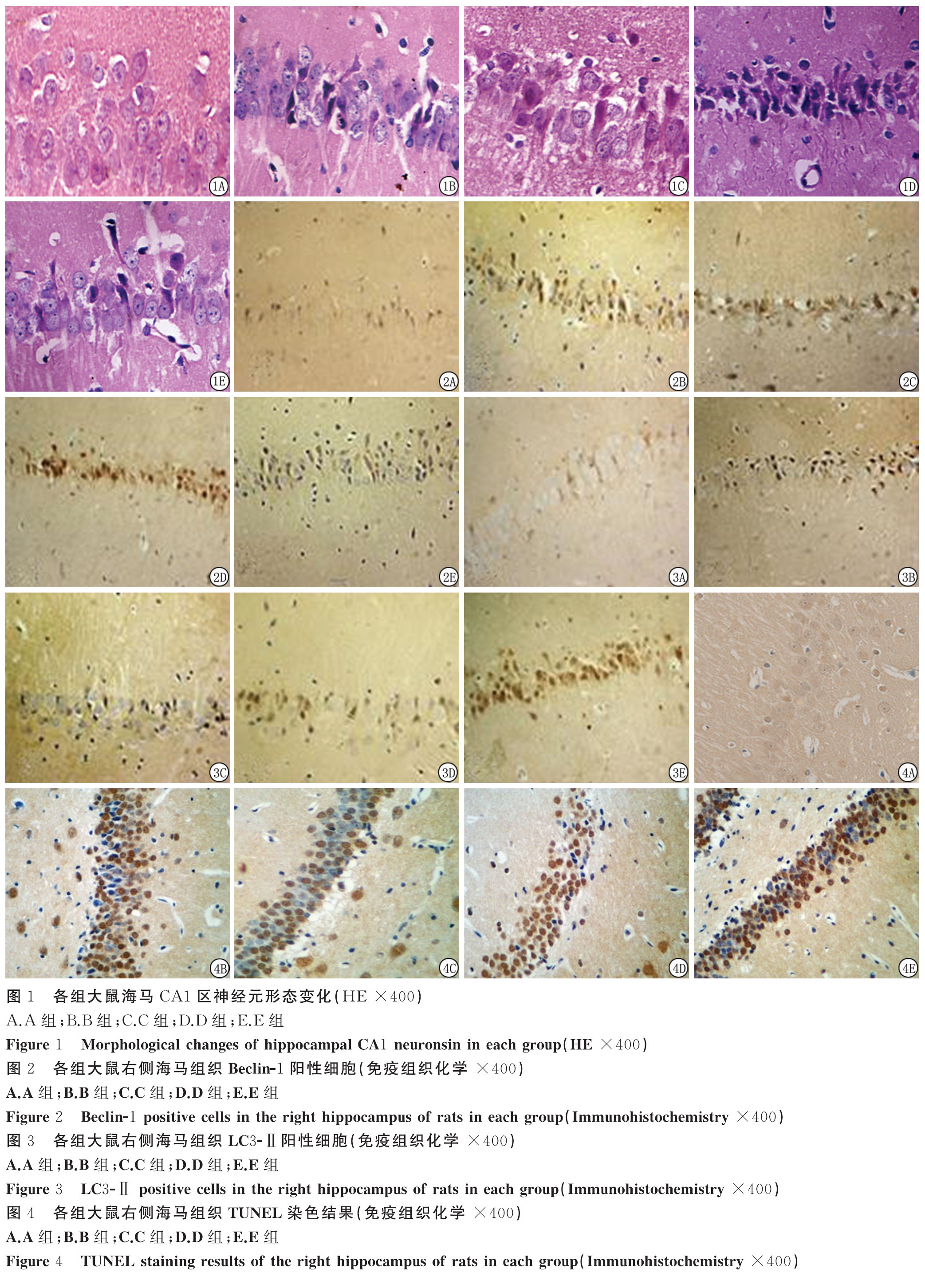
2.2 各组脑组织病理形态变化 在光学显微镜下观察神经元:A组数量多,形态完整;其余4组数量少,形态破坏,细胞核破裂、固缩,其中最为严重的是B组和C组,D组和E组神经元数量较B组和C组增多,细胞水肿及细胞核损伤减轻(图1)。
2.3 各组右侧海马组织Beclin-1、LC3-Ⅱ及TUNEL染色阳性细胞数比较 A组Beclin-1、LC3-Ⅱ及TUNEL染色阳性细胞表达少见;4组Beclin-1、LC3-Ⅱ及TUNEL染色阳性细胞表达多。C组Beclin-1、LC3-Ⅱ阳性细胞数大于B组,TUNEL染色阳性细胞数小于B组;D组Beclin-1、LC3-Ⅱ阳性细胞数及TUNEL染色阳性细胞数小于B组和C组,TUNEL染色阳性细胞数大于B组和C组;E组Beclin-1、LC3-Ⅱ阳性细胞数小于C组,TUNEL染色阳性细胞数小于D组,差异有统计学意义(P<0.05)。见图2~4,表2。
表2 各组右侧海马组织Beclin-1、LC3-Ⅱ及
TUNEL染色阳性细胞数比较
Table 2 Comparison of Beclin-1,LC3-Ⅱ and TUNEL
staining-positive cells in the right hippocampus of each group ![]()
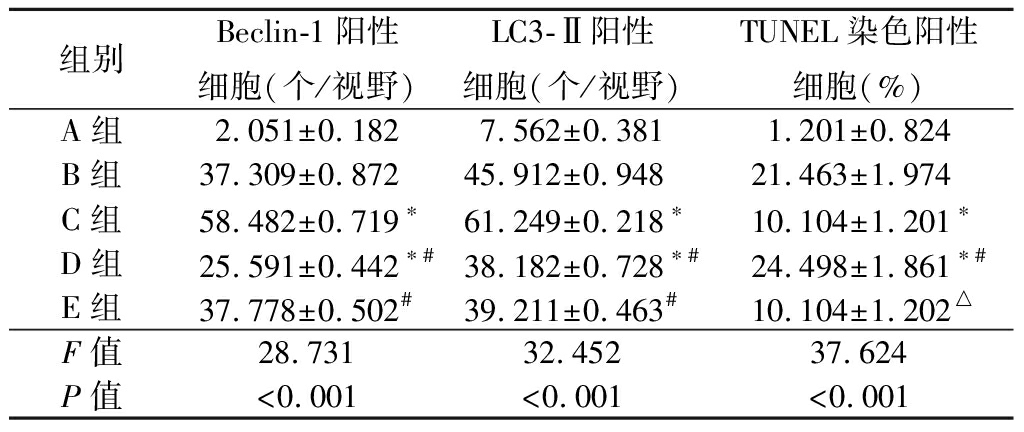
组别Beclin-1阳性细胞(个/视野)LC3-Ⅱ阳性细胞(个/视野)TUNEL染色阳性细胞(%)A组 2.051±0.1827.562±0.3811.201±0.824B组 37.309±0.87245.912±0.94821.463±1.974C组 58.482±0.719∗61.249±0.218∗10.104±1.201∗D组 25.591±0.442∗#38.182±0.728∗#24.498±1.861∗#E组 37.778±0.502#39.211±0.463#10.104±1.202△F值28.73132.45237.624P值<0.001<0.001<0.001
*P值<0.05与B组比较 #P值<0.05与C组比较 △P值<0.05与D组比较(SNK-q检验)
3 讨 论
目前已有许多研究指出脑缺血预处理可以一定程度上减轻后续的脑梗死损伤,但其机制仍需进一步研究[4-5]。缺血预处理是在随后长期的或致命性的缺血损伤之前,事先对靶器官进行一次或多次短暂性缺血适应,从而达到保护器官损伤的一种方法,包括大脑、心脏、肾脏等器官都可从中受益[6]。但缺血预处理保护靶器官的分子机制尚不完全清楚。有研究报道,缺血预处理可以抑制氧化应激反应、线粒体失序和细胞凋亡[7]。同时,近年来有多种证据证实适度的自噬可能是缺血预处理发挥作用的重要调节剂[8-9]。LC3-Ⅱ水平一定程度上反映了细胞自噬的程度和自噬体的含量[10],缺血预处理的促进自噬作用主要是通过LC3-Ⅱ表达增强来实现的[11]。更有研究提出,缺血预处理在再灌注期间可被自噬抑制剂3-MA明显削弱其神经保护作用[12]。
值得注意的是,能量传感器腺苷酸活化蛋白激酶(AMP activated protein kinase,AMPK)可能是缺血预处理对自噬调节的重要协调器[13-15]。有研究证实,缺血预处理可以激活AMPK磷酸化,启动细胞自噬,抑制神经细胞凋亡,缩小脑梗死体积,起到神经保护作用;而当使用AMPK抑制剂时,几乎完全使缺血预处理的神经保护作用丧失[16]。但也有报道提示自噬的诱导剂雷帕霉素也可减轻脑损伤[17]。这一系列实验表明,自噬的确是缺血预处理发挥神经保护作用的一种重要途径,并且为脑梗死的治疗提供潜在的策略。
但是,有学者提出相反的观点,认为在复杂的自噬信号级联反应中,Beclin-1具有调节自噬表达的作用,是诱发脑梗死自噬或细胞凋亡的关键点,若降低脑梗死自噬水平,可减少神经元凋亡;敲除小鼠Beclin-1基因后,可显著减少同侧丘脑组织中双膜自噬体的形成,并伴有TUNEL阳性凋亡神经元的明显减少[18]。表明通过抑制自噬水平可保护神经元在缺血缺氧条件下免受损伤。
自噬与多种细胞内生物学过程相互作用,包括氧自由基积累、线粒体功能障碍、内质网应激等,影响细胞活性[19]。研究自噬途径在缺血性脑卒中的作用和调节机制越来越引起人们的兴趣,部分原因是自噬可以在应激条件下减少细胞损伤;学术界尚未就自噬在缺血性脑卒中的确切作用达成共识。目前普遍认为,脑梗死激活的自噬对神经元的存活有利有弊。但是,由于实验设计内容繁杂,且具有异质性,包括研究对象、年龄、细胞/动物模型、脑组织缺血持续时间的差异等,都会导致实验结果的差异。目前认为,适度的自噬可通过克服各种应激刺激,增加细胞的生存能力。但是长时间缺血导致的过度自噬对神经元是致命性的打击[20]。因此可以推测,适度的自噬反应可以通过脑血管短暂的缺血预处理激活,从而在缺血性脑卒中发生时,神经元的损伤明显减轻。
综上所述,脑缺血预处理可以起到神经保护作用,以适度激活自噬系统的方式来抑制神经元凋亡。而脑缺血预处理的时间及强度可能是影响缺血性脑卒中神经元自噬的重要因素,还需要进一步研究。
[1] Yunoki M,Kanda T,Suzuki K,et al. Ischemic tolerance of the brain and spinal cord:a review[J]. Neurol Med Chir,2017,57(11):590-600.
[2] 汪文英,崔德荣,江伟.自噬在大脑缺血再灌注损伤中作用的研究进展[J].上海交通大学学报(医学版),2014,34(2):248-253.
[3] 王德龙,石秋艳,孙原,等.M型钾离子通道开放剂对脑梗死再灌注损伤的保护作用[J].西安交通大学学报(医学版),2016,37(5):636-640.
[4] 王小琴,邹玉安,郭春燕.脑缺血预处理和脑缺血耐受机制的研究进展[J].神经药理学报,2015,5(2):30-37.
[5] Badawi Y, Pal R, Hui D, et al. Ischemic tolerance in an in vivo model of glutamate preconditioning[J]. J Neurosci Res,2015,93(4):623-632.
[6] Luo CL,Li QQ,Gao Y,et al. Poloxamer 188 attenuates cerebral hypoxia/ischemia injury in parallel with preventing mitochondrial membrane permeabilization and autophagic activation[J]. J Mol Neurosci,2015,56(4):988-998.
[7] Lv B,Li F,Han J,et al. Hif-1α overexpression improves transplanted bone mesenchymal stem cells survival in rat MCAO stroke model[J]. Front Mol Neurosci,2017,10:80.
[8] Wang P,Shao BZ,Deng ZQ,et al. Autophagy in ischemic stroke[J]. Prog Neurobiol,2018,163/164:98-117.
[9] 周天恩,曾朝涛,方家俊,等.自噬调节剂对不同时间氧糖剥夺所致大鼠海马神经元损伤的影响[J].中华危重病急救医学,2017,29(8):738-743.
[10] 黄小平,李静娴,杨筱倩,等.PC12细胞氧糖剥夺模型细胞自噬与损伤的关系及黄芪甲苷的保护作用研究[J].世界中医药,2016,11(4):597-603.
[11] 王德秀,蔡欣,金成文,等.神经元自噬在脑缺血再灌注损伤中的作用机制研究进展[J].生理科学进展,2018,49(6):471-474.
[12] McWilliams TG,Ganley IG. Life in lights:tracking mitochondrial delivery to lysosomes in vivo[J]. Autophagy,2016,12(12): 2506-2507.
[13] 何鹤,曾庆,黄国志.自噬——脑缺血中潜在的神经保护策略?[J].中国康复医学杂志,2018,33(11):1360-1365.
[14] 厉永强,付苏,王来,等.自噬与缺氧缺血性脑损伤[J].生理学报,2017,69(3):316-324.
[15] Sheng R,Qin ZH. The divergent roles of autophagy in ischemia and preconditioning[J]. Acta Pharm Sinica,2015,36(4):411-420.
[16] Jiang T,Yu JT,Zhu XC,et al. Ischemic preconditioning provides neuroprotection by induction of AMP-activated protein kinase-dependent autophagy in a rat model of ischemic stroke[J]. Mol Neurobiol,2015,51(1):220-229.
[17] 李荣虎,于论,缪珀,等.缺氧缺血海马组织中自噬相关蛋白Beclin-1和LC3的表达变化以及雷帕霉素对其表达的影响[J].中国当代儿科杂志,2015,17(4):400-404.
[18] Li H,Gao A,Feng D,et al. Evaluation of the protective potential of brain microvascular endothelial cell autophagy on blood-brain barrier integrity during experimental cerebral ischemia-reperfusion injury[J]. Transl Stroke Res,2014,5(5):618-626.
[19] Li L,Tan J,Miao Y,et al. ROS and autophagy: interactions and molecular regulatory mechanisms[J]. Cell Mol Neurobiol,2015,35(5):615-621.
[20] Maj ST, Lisa JR,Torben M. The vascular basement membrane in the healthy and pathological brain[J]. J Cerebr Blood F Met,2017,37(10):3300-3317.