随着城市化和经济的快速增长,近年来我国面临着空气污染的重大挑战。研究显示,接触细颗粒物会导致精子数量和质量下降[1],与其产生的大量活性氧有关,活性氧会引起生殖系统氧化应激,触发一系列的病理过程,包括炎症、凋亡和增殖[2]。N-乙酰半胱氨酸(N-acetylcysteine,NAC)作为一种重要的羟基自由基的重要清除剂,参与调节精液质量和睾丸形态过程中的细胞内氧化还原效应,但是证明NAC干预减弱大气细颗粒物(particulate matter,PM)2.5对生殖系统的负作用的研究较少。因此,本研究侧重于抗氧化剂NAC对PM2.5致生殖系统毒性的改善作用,以及是否防止睾丸细胞凋亡。
1 材料与方法
1.1 实验动物 30只雄性SPF级Wistar大鼠(120~150 g)由河北省实验动物中心提供,动物安置在恒温、恒湿的房间中,并保持一个标准化的12 h光/暗循环,适应周期为1周,动物实验方案是按照实验动物管理和保护有关规定进行。
1.2 PM2.5悬液配制 细颗粒物PM2.5是由石家庄环境监测中心提供的纤维滤膜,其利用24 h高流量采样器(ThermoScientific TEOM1405,美国)收集,采样器位于石家庄主干道,周边没有大的工厂,但交通繁忙,具有城市环境特色,将PM2.5过滤膜切割成1 cm×2 cm矩形条状,浸入去离子水中,然后用超声波清洗机(KQ-400KDB型,中国)进行5×30 min的震荡,然后利用八层无菌纱布过滤溶液,细颗粒悬浮液进行真空冷冻干燥,然后于-20 ℃冷冻保存。PM2.5颗粒的直径测量以及多分散系数(polymer dispersity index,PDI)、Zeta电位由河北医科大学提供技术支持,使用ZetasizerNanoZS90(Malvern仪器,英国)测量。其中PDI参数是衡量纳米粒子分散均匀性的重要指标,PDI数值越接近0.10,说明粒径分布集中,PDI数值越接近1,说明总体粒子直径分布不均匀,存在过大及过小颗粒。Zeta电位是反映纳米颗粒在贮存条件下物理化学稳定性的重要参数,所有纳米粒子的Zeta电位均记录为负值,Zeta电位绝对值越高,说明纳米颗粒体系越稳定。同时采用电感耦合等离子体质谱仪(ICP-MS)(ELANDRCII,PE,美国)对PM2.5样品中重金属进行定量分析。
1.3 PM2.5染毒大鼠模型建立 30只大鼠随机分为3组,分为生理盐水对照组、PM2.5暴露组、PM2.5+NAC组。PM2.5染毒方式通过气管滴注法,每周染毒1次,共2个月;NAC组在PM2.5染毒的基础上,通过灌胃方式连续给予150 mg·kg-1·d-1 NAC;生理盐水对照组给予相同容量生理盐水。
1.4 睾酮测定 造模后,大鼠腹腔注射戊巴比妥钠,采用腹主动脉进行取血,离心取上清备用,采用酶联免疫吸附测定法测定血清中睾酮含量。
1.5 睾丸炎性及氧化指标检测 采血后,迅速剥离一侧睾丸,置入提前预冷的生理盐水中,手工匀浆,4 ℃下,3 000 r/min离心15 min,取上清液,根据试剂盒说明书,测定超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽(glutathione,GSH)和丙二醛(malondialdehyde,MDA)指标情况,应用酶联免疫吸附测定法测定白细胞介素10(interleukin-10,IL-10)指标水平。
1.6 大鼠睾丸组织病理切片染色 睾丸固定在4%多聚甲醛中,脱水,石蜡包埋,每个组织块切成4 μm厚,用苏木精和伊红染色,并进行组织学评价。在100倍放大镜下,对每只大鼠的睾丸组织切片进行观察,以观察生精小管中可能发生的任何组织学改变,如生殖细胞的脱落、生精小管结构破坏、多核巨细胞的存在或生殖细胞的丢失。
1.7 大鼠肺组织细胞凋亡检测 在4 μm厚的石蜡包埋切片上进行TUNEL染色,利用原位细胞凋亡检测试剂盒(Roche,Mannheim,德国)说明书检测细胞凋亡。在放大倍数为200的显微镜视野下观察凋亡细胞,并对每个切片的10个区域进行计数。 最后所有图像均采用倒置显微镜(奥林巴斯,日本)放大100倍进行采图。
1.8 统计学方法 应用SPSS 21.0统计软件分析数据。计量资料比较采用单因素方差分析和SNK-q检验,计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 PM2.5理化性质 马尔文Zeta纳米分析仪显示,从石家庄市非工业区收集到的冬季PM2.5,PM2.5直径122~178 μm,PM2.5悬浮液的PDI<0.47,则表明样品均匀分散。PM2.5的zeta电位为-29.65 mV,表明PM2.5悬浮液具有良好的稳定性,综上,收集的PM2.5样品具有粒径小、均匀一致,且稳定性好特点。 PM2.5毒性主要取决于其化学成分,PM2.5样品中七种重金属的浓度,包括致癌物质As、Cd、Cr、Ni和非致癌物质Pb、Hg、Mn,见表1。
表1 PM2.5混悬液重金属含量测定
Table 1 Measurement of heavy metal content
in the PM2.5 suspension (μg/g)
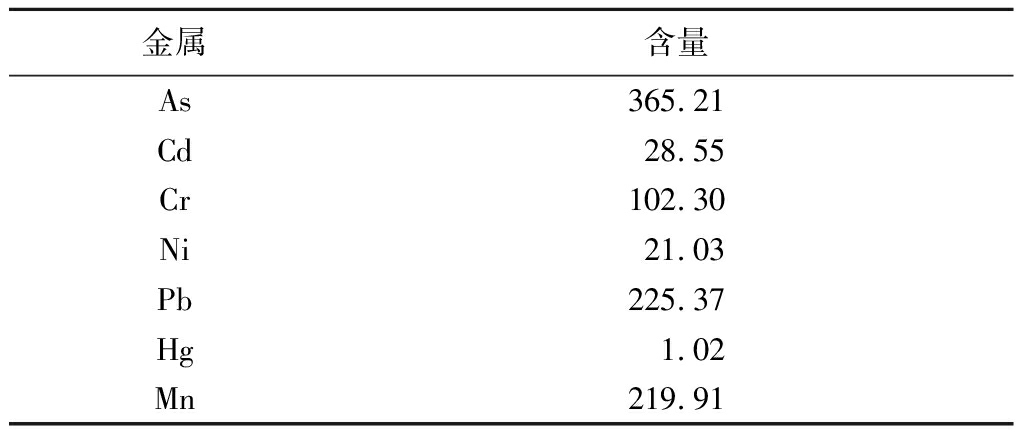
金属含量As365.21Cd28.55Cr102.30Ni21.03Pb225.37Hg1.02Mn219.91
2.2 大鼠血清睾酮及睾丸MDA、GSH、SOD、IL-10含量 PM2.5暴露组和PM2.5+NAC组大鼠血清睾酮水平及睾丸组织GSH、SOD、IL-10水平均低于盐水对照组,睾丸组织MDA水平升高,PM2.5+NAC组睾酮水平及睾丸组织GSH、SOD、IL-10水平高于PM2.5组,睾丸组织MDA水平下降,差异有统计学意义(P<0.05),见表2。
表2 各组大鼠血清睾酮及睾丸MDA、GSH、SOD、IL-10含量
Table 2 Content of serum testosterone,MDA,GSH,SOD,and IL-10 in testicular tissue of rats in each group ![]()
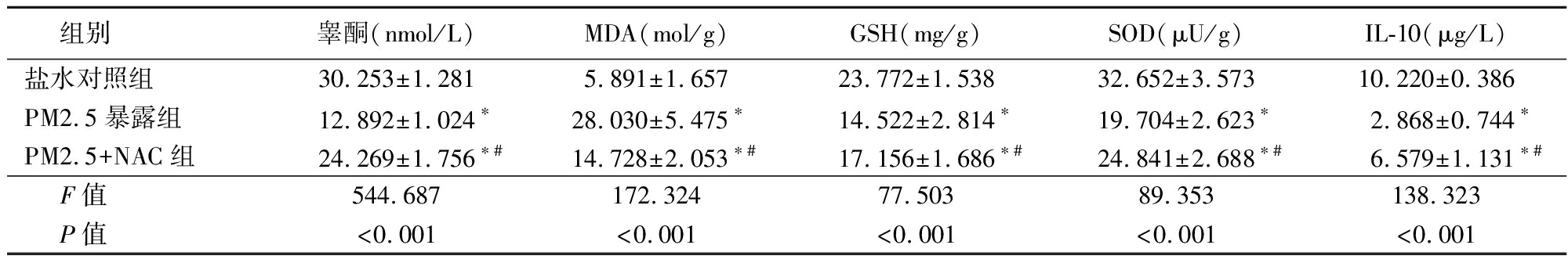
组别睾酮(nmol/L)MDA(mol/g)GSH(mg/g)SOD(μU/g)IL-10(μg/L)盐水对照组30.253±1.2815.891±1.65723.772±1.53832.652±3.57310.220±0.386PM2.5暴露组12.892±1.024∗28.030±5.475∗14.522±2.814∗19.704±2.623∗2.868±0.744∗PM2.5+NAC组24.269±1.756∗#14.728±2.053∗#17.156±1.686∗#24.841±2.688∗#6.579±1.131∗# F值544.687172.32477.50389.353138.323 P值<0.001<0.001<0.001<0.001<0.001
*P值<0.05与盐水对照组比较 #P值<0.05与PM2.5暴露组比较(SNK-q检验)
2.3 大鼠睾丸组织HE染色 盐水对照组睾丸组织形态无异常改变,曲细精管排列规则,结构正常,官腔内有大量精子细胞;PM2.5暴露组细胞类型无法识别,细胞核染色度过高,小管直径减小,生精细胞急剧减少,生精细胞向管腔脱离和脱落;NAC减轻了PM2.5诱导的睾丸组织病理学损伤。见图 1。
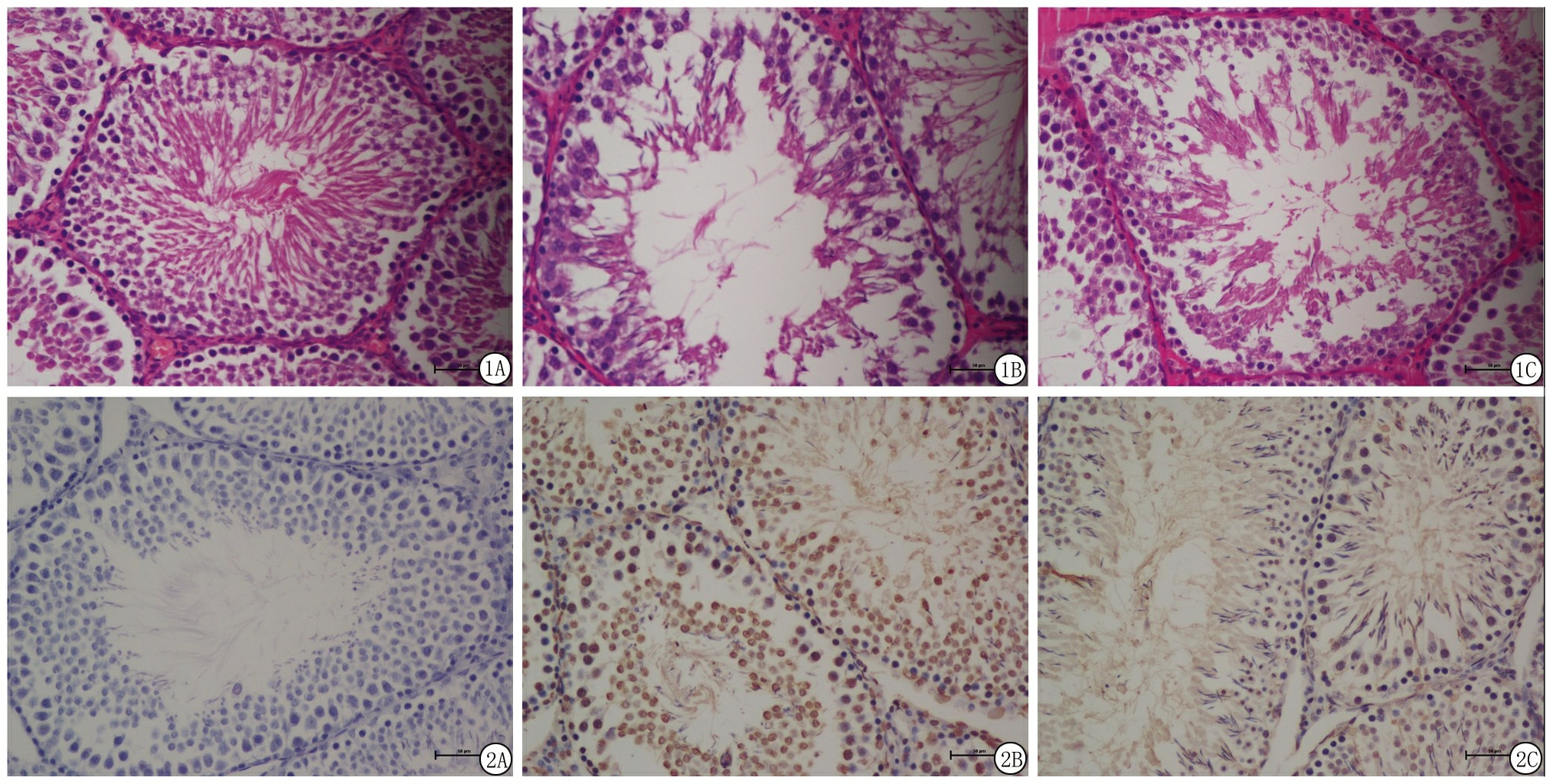
图1 睾丸组织病理表现(HE ×200)
A.盐水对照组;B.PM2.5暴露组;C.PM2.5+NAC组
Figure 1 The pathological observation of the testicular tissues(HE ×200)
图2 睾丸细胞凋亡情况(TUNEL ×200)
A.盐水对照组;B.PM2.5暴露组;C.PM2.5+NAC组
Figure 2 Assessment of apoptosis rate in testicular tissue by TUNEL method(TUNEL ×200)
2.4 睾丸细胞凋亡情况 在PM2.5暴露组中,曲精小管中多个细胞核表现出明显的深棕色染色,TUNEL阳性细胞的计数明显高于盐水对照组和PM2.5+NAC组,差异有统计学意义(P<0.05);而PM2.5+NAC组凋亡细胞数明显低于PM2.5组,但高于盐水对照组,差异有统计学意义(P<0.05)。PM2.5暴露组和PM2.5+NAC组睾丸细胞凋亡指数高于盐水对照组,PM2.5+NAC组低于PM2.5暴露组,差异有统计学意义(P<0.05)。见图2,表3。
表3 各组大鼠睾丸细胞凋亡指数分析
Table 3 Apoptosis index analysis of
rat testicle cells in each group ![]()
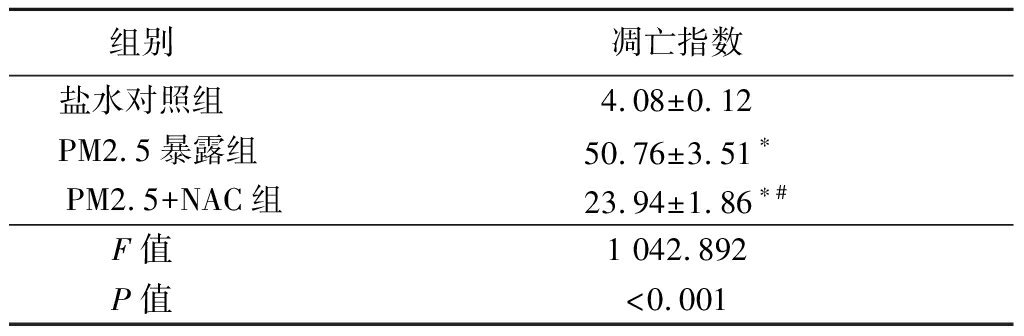
组别 凋亡指数盐水对照组 4.08±0.12PM2.5暴露组 50.76±3.51∗PM2.5+NAC组23.94±1.86∗#F值 1 042.892P值 <0.001
*P值<0.05与盐水对照组比较 #P值<0.05与PM2.5暴露组比较(SNK-q检验)
3 讨 论
众所周知,大气污染是一个复杂的过程,涉及大气中不同的污染物。国际癌症研究机构于2013年10月17日宣布,室外空气污染被归类为一种致癌物质,PM是室外空气污染的主要成分,也被归类为致癌物。根据空气动力学直径和通过呼吸道吸入能力,PM分为三类,PM2.5被认为是最具代表性的空气污染物[3]。PM2.5是一种复杂的混合物,通过强的积累效应,成为各种有害物质的载体,如多环芳烃、硫酸盐、硝酸盐、铵、部分离子水、无机离子和有机元素碳[4]。研究亦证实硝酸萃取的PM2.5重金属成分,是通过相对较弱的静电形式吸附于细颗粒物表面,而且重金属显示出比细颗粒物表面其他有毒成分更高的生物利用度,换言之,其更容易被外界环境中更多的食物或者物体所吸收,沉积于物质表面,通过离子交换进入物质深部,一旦人体摄入,进一步诱导机体产生一系列的恶性疾病。通过对PM2.5的分析,科学家已确定PM2.5可以诱发氧化应激[5],导致脂质过氧化,从而使细胞功能失调,促进细胞凋亡。同样,本研究结果证实了PM2.5暴露诱导的生殖毒理学作用。
不孕症已成为全球公共卫生的威胁,据估计影响到全世界8%~12%的育龄夫妇, 男性因素被认为超过50%。中国不孕症流行病学研究表明,河北省约17.2%的育龄夫妇患有不孕症[6],多项研究证明可能与空气重污染水平有关[7]。开展PM2.5不同暴露水平的研究对于居住在PM2.5污染严重地区的人口是有意义的。本研究结果显示PM2.5可以导致睾丸生精细胞数量减少,生精微环境稳定性受到破坏,降低血浆中睾酮水平,诱发氧化应激和凋亡,而NAC可以减轻PM2.5对睾丸的损伤程度,可以改善大鼠抗氧化、抗炎能力,减少睾酮指标下降。
睾丸是最重要的雄性生殖腺之一,它产生配子并分泌激素,主要是睾酮。男性95%以上睾酮含是由位于睾丸中的睾丸间质细胞产生的。精子发生主要由睾酮调节[8],研究证实PM2.5致精子数量的减少,与睾丸生殖细胞的减少是平行的,睾酮减少可能是睾丸间质细胞损害的指标[9]。研究显示睾酮激素水平的下降,可能与睾丸睾酮合成酶,包括P450scc、17βHSD、StAR的表达降低有关[10]。本研究结果显示,气管内灌注PM2.5扰乱精子发生的各个阶段,破坏基底膜和固有膜,减少生殖细胞数量,而且PM2.5染毒大鼠循环睾酮下降。本研究结果与先前的动物研究结果是一致的[11]。
睾丸细胞和精子容易受到自由基的氧化损伤,因为其质膜中含有丰富的多不饱和脂肪酸,而细胞膜脂质过氧化可能最终导致细胞功能障碍和结构损伤。本研究结果显示睾丸结构异常,包括生殖细胞和睾丸间质细胞,PM2.5染毒大鼠中MDA指标明显升高,可能与PM2.5致睾丸质膜中多不饱和脂肪酸的过氧化作用有关。
氧化应激是由于活性氧生成与清除之间的不平衡导致,进而导致细胞成分的氧化损伤,改变许多细胞功能,包括各种酶活性的丧失。抗氧化酶是对抗活性氧的重要组成部分,SOD能够催化超氧阴离子自由基歧化生成氧和过氧化氢,谷胱甘肽在保护细胞免受活性氧(如H2O2)和抗氧化活性的影响方面非常重要,谷胱甘肽还可以减少脂质过氧化。本研究结果显示,SOD和GSH活性下降,可能是由于PM2.5导致的氧化应激损伤睾丸细胞,进而使酶合成减少或者活性氧直接导致酶活性下降。NAC作为有效的抗氧化剂[12],PM2.5+NAC组中SOD、GSH活性较PM2.5组明显升高,表明NAC可以减少睾丸细胞损伤,提高抗氧化酶活性。另外在氧化应激过程中,谷胱甘肽浓度降低,NAC迅速影响水解和合成谷胱甘肽的γ-谷氨酰半胱氨酸和GSH合成酶,增加谷胱甘肽水平。
正常的生理情况下,细胞凋亡是机体为了维持内环境的稳定,PM2.5导致睾丸氧化应激,引发细胞毒效应,从而诱导睾丸细胞凋亡,这可能涉及FAS、FASL和Bax[13]。但是PM2.5介导的睾丸细胞凋亡具体机制尚不清楚。有研究显示,NAC抑制凋亡前基因的表达,此外,NAC还能抑制前炎症和抗凋亡基因活性,如c-Jun N端激酶、MAP激酶p38、SAPK/INK、c-fos通路和核因子κB[14]。研究表明,NAC能够抑制壬基酚引起的睾丸氧化应激、睾丸组织凋亡、萎缩和退化的影响[15]。
综上所述,NAC作为一种有效的抗氧化剂,通过加强抗氧化防御系统和防止氧化应激,对PM2.5引起的睾丸损伤具有潜在的保护作用,建议利用NAC治疗和预防雄性生殖系统PM2.5中毒。
[1] Zhang J,Liu J,Ren L,et al. PM2.5 induces male reproductive toxicity via mitochondrial dysfunction,DNA damage and RIPK1 mediated apoptotic signaling pathway[J]. Sci Total Environ,2018,634(9):1435-1444.
[2] Bui AD,Sharma R,Henkel R,et al. Reactive oxygen species impact on sperm DNA and its role in male infertility[J]. Andrologia,2018,50(8):e13012.
[3] Ritz B,Hoffmann B,Peters A. The effects of fine dust,ozone,and nitrogen dioxide on health[J]. Dtsch Arztebl Int,2019,51/52(51/52):881-886.
[4] Yang L,Li C,Tang X. The impact of PM2.5 on the host defense of respiratory system[J]. Front Cell Dev Biol,2020,8(3):91.
[5] Wei Y,Cao XN,Tang XL,et al. Urban fine particulate matter(PM2.5) exposure destroys blood-testis barrier(BTB) integrity through excessive ROS-mediated autophagy published correction appears in toxicol mech methods[J]. Toxicol Mech Methods,2018,28(4):302-319.
[6] Zhou Z,Zheng D,Wu H,et al. Epidemiology of infertility in China:a population-based study[J]. BJOG, 2018,125(4):432-441.
[7] 刘畅翔,孙发. PM2.5引起机体生殖毒性的探讨[J]. 名医,2019,10(1):14-15.
[8] Plant TM,Marshall GR. The functional significance of FSH in spermatogenesis and the control of its secretion in male primates[J]. Endocr Rev,2001,22(6):764-86.
[9] Yang Y,Yang T,Liu S,et al. Concentrated ambient PM2.5 exposure affects mice sperm quality and testosterone biosynthesis[J]. Peer J,2019,7(1):e8109.
[10] Qiu L,Chen M,Wang X,et al. Exposure to concentrated ambient pm2.5 compromises spermatogenesis in a mouse model: role of suppression of hypothalamus-pituitary-gonads axis[J]. Toxicol Sci,2018,162(1):318-326.
[11] Liu B,Wu SD,Shen LJ,et al. Spermatogenesis dysfunction induced by PM2.5 from automobile exhaust via the ROS-mediated MAPK signaling pathway[J]. Ecotoxicol Environ Saf,2019,167(1):161-168.
[12] Jannatifar R,Parivar K,Roodbari NH,et al. Effects of N-acetyl-cysteine supplementation on sperm quality,chromatin integrity and level of oxidative stress in infertile men[J]. Reprod Biol Endocrinol, 2019,17(1):24.
[13] Wang M,Su P. The role of the Fas/FasL signaling pathway in environmental toxicant-induced testicular cell apoptosis: An update[J]. Syst Biol Reprod Med, 2018,64(2):93-102.
[14] 张明洋,尹涵,李新如,等.N-乙酰半胱氨酸抗氧化作用在慢性阻塞性肺疾病治疗中的研究进展[J].河北医科大学学报,2019,40(8):980-984.
[15] Malmir M,Soleimani Mehranjani M,Naderi Noreini S,et al. Protective antioxidant effects of N-acetylcysteine against impairment of spermatogenesis caused by paranonylphenol[J]. Andrologia, 2018,50(10):e13114.