龋病是由多因素引起的牙体硬组织受破坏的感染性疾病,是影响人类健康的常见口腔疾病之一。第四次全国口腔健康流行病学调查结果显示,近十年来,我国儿童乳牙龋及年轻恒牙龋患病水平呈现上升趋势。变异链球菌(Streptococcus mutans,S.mutans)是目前公认的最主要的致龋菌[1-2],因其具有很强的产酸性和耐酸性[3-4],并能够黏附于牙齿表面形成复杂的生物膜结构[5-6],通过代谢碳水化合物持续产酸,引起牙齿脱矿,导致龋病发生[7]。产酸性能与黏附性能是S.mutans致龋的主要毒力因子[8],其中产酸性能是造成龋病的最直接因素[9-10],而黏附形成的细菌生物膜则是其持续作用、避免被口腔内环境清除的重要手段。实验证明,抑制或减少S.mutans产酸和对牙面的黏附可以有效降低龋病发生率[11-13]。芦荟苷是从芦荟中提取出的一种蒽醌类化合物,绿原酸是金银花的提取物,水溶性较好,具有抗菌消炎等药用价值,且对变异链球菌均存在一定的抑制作用[14-16]。探讨两种或多种药物联合应用,以达到降低单组分药物的使用剂量和不良反应的研究方法也是药物学研究的一个新方向[17],将芦荟苷与绿原酸联合应用是否能够加强其对变异链球菌的抑制作用目前尚无人研究。本研究采用芦荟苷和绿原酸配伍应用,测定不同浓度混合液对变异链球菌产酸、黏附及生物膜形成的影响,以探讨其对变异链球菌的生物学作用,并为其开发应用于临床龋病预防提供一定的研究基础。
1 材料与方法
1.1 主要试剂 芦荟苷、绿原酸(纯度98%);洗必泰购自深圳南粤药业有限公司;牛脑心浸出液培养基(brain heart infusion,BHI)购自杭州微生物试剂有限公司;BHI固体培养基购自青岛高科技工业园海博生物技术有限公司;国际标准菌株变异链球菌ATCC25175购自广东省微生物研究所。
1.2 药液制备
1.2.1 实验菌株及菌液制备 将冻存菌株复苏,传代,鉴定,然后挑取2~3个菌落接种于BHI液体培养基,37 ℃恒温培养24 h,离心,涂片,用生理盐水调节菌浓度为1.5×108 CFU/mL。
1.2.2 实验药液的制备 ①芦荟苷与绿原酸母液:将芦荟苷与绿原酸分别溶解于无菌BHI液体培养基中,配置浓度为5 g/L芦荟苷母液与20 g/L绿原酸母液,密封于4 ℃冰箱避光保存。②噻唑蓝[3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetraz-olium bromide,MTT]溶液:避光条件下称取0.15 g MTT溶于30 mL PBS缓冲液中,配制成浓度为5 g/L储备液,现配现用。③吖啶橙(acridine orange, AO)、溴化乙锭( ethidium bromide, EB)荧光染液:避光条件下称取AO、EB各1 mg,分别溶于10 mL pH为7.0的PBS缓冲液中,无菌针头过滤器滤过除菌,4 ℃冰箱避光保存备用。染色前将AO、EB储备液等比例混合后1∶20稀释成工作液。
1.3 不同浓度芦荟苷-绿原酸联用对变异链球菌生长的影响
1.3.1 确定芦荟苷、绿原酸的最低抑菌浓度(minimum inhibitory concentration,MIC)值 二倍稀释法将芦荟苷母液稀释成5、2.5、1.25、0.63、0.31、0.16 g/L,向96孔板中每孔加入各浓度梯度芦荟苷药液190 μL和1.2.1中制备好的菌液10 μL,此时菌浓度为7.5×106 CFU/mL,37 ℃恒温箱培养24 h后取出,在暗色背景下肉眼观察,最低浓度的孔中无菌生长者为其MIC值。并设置阳性对照(190 μL双氯苯双胍已烷+BHI液体培养基+10 μL菌液)、阴性对照(190 μL BHI液体培养基+10 μL菌液)、空白对照(200 μL BHI液体培养基),实验重复3次。同法确定芦荟苷的MIC值。
1.3.2 确定混合液的MIC值 在96孔板上横排分别加入浓度为1.25、0.63、0.31、0.16、0.08、0.04 mg芦荟苷溶液95 μL,纵排分别加入等体积浓度为10、5、2.5、1.25、0.63、0.31 g/L绿原酸溶液,两溶液充分混匀后,每孔分别加入菌液10 μL,于37 ℃恒温箱中培养24 h,观察结果,并设置阳性对照、阴性对照、空白对照,实验重复3次。
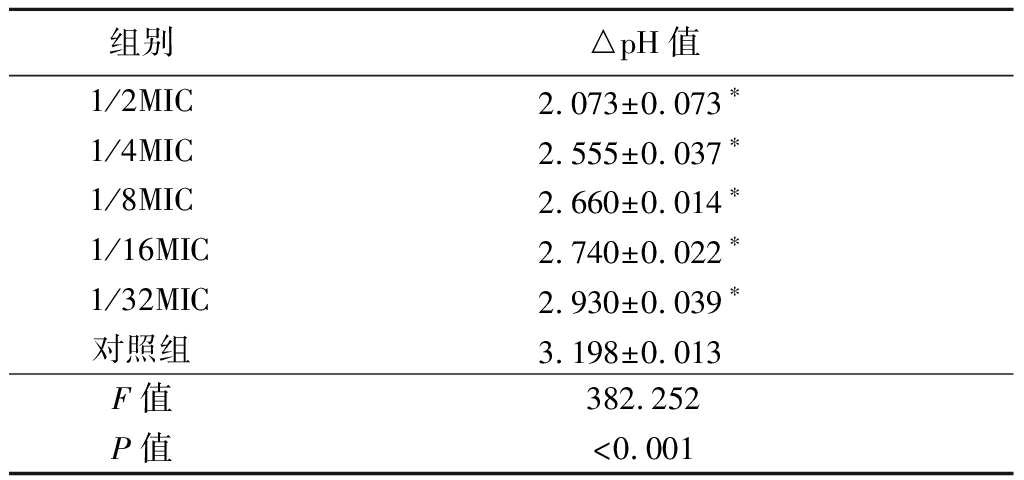
1.3.3 联合用药效果评价 通过计算分级抑制浓度(fractional inhibitory concentration,FIC)指数来测定两者的抑菌关系。FIC=A药联用时MIC/A药单测时MIC+B药联用时MIC/B药单测时MIC。FIC≤0.5时,两药为协同作用;0.5 1.4 芦荟苷-绿原酸对变异链球菌产酸能力的影响 选取联合用药实验中MIC以内5个浓度梯度(1/2、1/4、1/8、1/16、1/32 MIC),用含1%蔗糖的BHI培养基二倍稀释法配置以上5个浓度混合药液,pH计调定初始pH=7.4,按菌液与药液1∶20(体积分数)比例接种变异链球菌,于37 ℃恒温箱中培养24 h后,离心,pH计测量上清液pH值,计算培养前后的△pH,并设置阴性对照,实验重复4次。 1.5 芦荟苷-绿原酸对变异链球菌24 h生物膜黏附作用的影响 将变异链球菌悬液接种于96孔板中,37 ℃恒温培养24 h,吸去孔板内BHI培养基,分别加入上述5个浓度(1/2、1/4、1/8、1/16、1/32 MIC)的混合药液,恒温培养24 h后吸去孔板内溶液,PBS漂洗2次,黏附于孔板底部的细菌用MTT法定量测定,全自动酶标仪波长490 nm 检测吸光度(optical delnsity,OD)值,计算细菌抑制率,并设置阴性对照,实验重复4次。 抑制率=(阴性对照组OD值-实验组OD值)/阴性对照组OD值×100%。 1.6 激光共聚焦扫描显微镜(confocal laser scanning microscope,CLSM)观察混合液对变异链球菌24 h生物膜作用的影响 在激光共聚焦小皿中加入变异链球菌菌液,37 ℃恒温培养24 h,吸去液体培养基,分别加入前述5个浓度(1/2、1/4、1/8、1/16、1/32 MIC)混合药液,于37 ℃恒温箱中培养24 h后,吸去混合药液,PBS漂洗2次,于避光暗室中滴加AO、EB混合荧光染液200 μL,孵育15 min后,PBS漂洗去除多余染料。用放大倍数40×10(物镜×目镜)CLSM(波长488/543 nm)观察细菌生物膜。设置阳性对照、阴性对照,实验重复3次。 1.7 统计学方法 应用SPSS 21.0统计软件分析数据。计量资料比较采用单因素方差分析和SNK-q检验。P<0.05为差异有统计学意义。 2.1 芦荟苷和绿原酸的MIC值 二倍稀释法抑菌试验结果显示,芦荟苷、绿原酸的MIC值分别为0.63 g/L和5 g/L(图1)。 图1 芦荟苷和绿原酸的MIC 1.5 g/L芦荟苷;2.2.5 g/L芦荟苷;3.1.25 g/L芦荟苷;4.0.63 g/L芦荟苷;5.0.31 g/L芦荟苷;6.0.16 g/L芦荟苷; A.20 g/L绿原酸;B.10 g/L绿原酸;C.5 g/L绿原酸;D.2.5 g/L绿原酸;E.1.25 g/L绿原酸;F.0.63 g/L绿原酸;X.阴性对照组; Y.阳性对照组; Z.空白对照组 Figure 1 MIC of aloin and chlorogenic acid 2.2 芦荟苷-绿原酸混合液对变异链球菌生长的影响 芦荟苷和绿原酸联用时的MIC值为0.31 g/L芦荟苷+2.5 g/L绿原酸。根据1.3.4的公式计算得到二者联用时的FIC=1,存在相加作用,见表1。 表1 不同浓度芦荟苷和绿原酸联用对变异链球菌生长的影响 绿原酸浓度(g/L)芦荟苷浓度(g/L)0.630.310.160.080.040.025.00---+++2.50--++++1.25-+++++0.63-+++++0.31-+++++0.16-+++++ 2.3 芦荟苷-绿原酸混合液对变异链球菌产酸能力的影响 在1/2、1/4、1/8、1/16、1/32 MIC 5个浓度的混合液,随着药物浓度的增加△pH值逐渐降低,各实验组与对照组比较差异有统计学意义(P<0.05)。见表2。 表2 芦荟苷-绿原酸混合液对变异链球菌产酸 组别△pH值1/2MIC2.073±0.073∗1/4MIC2.555±0.037∗1/8MIC2.660±0.014∗1/16MIC2.740±0.022∗1/32MIC2.930±0.039∗对照组3.198±0.013 F值382.252P值<0.001 *P值<0.05与对照组比较(SNK-q检验) 2.4 芦荟苷-绿原酸混合液对变异链球菌24 h生物膜黏附作用的影响 选取1/2、1/4、1/8、1/16、1/32 MIC 5个浓度的混合液,检测其对变异链球菌黏附于96孔聚苯乙烯培养板上生物膜菌量的影响(厌氧孵育24 h)。随着药物浓度的增加生物膜的量(OD值)逐渐减少,抑制率增加。实验组与对照组比较差异均有统计学意义(P<0.05)。见表3。 表3 芦荟苷-绿原酸混合液对变异链球菌 组别黏附效果(x-±s)抑制率(%)1/2MIC0.421±0.004∗67.851/4MIC0.527±0.077∗59.751/8MIC0.562±0.078∗57.051/16MIC0.654±0.071∗50.041/32MIC0.708±0.123∗45.89对照组1.308±0.025 -F值72.659P值<0.001 *P值<0.05与对照组比较(SNK-q检验) 2.5 CLSM观察芦荟苷-绿原酸混合液对变异链球菌24 h生物膜作用的影响 CLSM观察显示,1/32 MIC混合液的图像由于活菌数量大于死菌,绿色荧光强度高于红色荧光强度,同一视野叠加后呈绿色,细菌多呈块状或网状聚集,但是密集程度不及阴性对照组。随着药液浓度的增加绿色荧光面积逐渐减少,红色荧光面积逐渐增加,同一视野叠加开始呈现黄绿色/黄色,细菌分布稀疏;浓度为1/2 MIC时,活菌量显著减少,而阳性对照组则显示极为分散的少量细菌。见图2。 图2 芦荟苷-绿原酸混合液对变异链球菌24 h生物膜作用的结果(CLSM,绿色为活菌,红色为死菌,×400)A.阴性对照组;B.阳性对照组;C.1/2 MIC组;D.1/4 MIC组;E.1/8 MIC组;F.1/16 MIC组;G.1/32 MIC组 Figure 2 The effect of aloin-chlorogenic acid mixture on the 24 h biofilm of Streptococcus mutans(CLSM,green staining indicates live bacteria,and red staining indicates dead bacteria, ×400) 天然植物内含有诸多具有治疗特性的物质,可以用于筛选合成潜在药物的前体成分。对于天然植物有效成分的基础与应用研究已有大量报道,天然提取物在全球范围内的使用率也在日益提高[18]。芦荟苷和绿原酸分别为植物芦荟与金银花中的提取物,其水溶液在常温下均可呈现比较稳定的状态,并且可长时间保持其生物活性。芦荟苷为蒽醌类化合物,可以通过破坏细菌细胞壁的聚糖骨架结构、抑制细菌遗传物质和蛋白质的合成途径,从而起到对微生物的杀灭作用[19-20]。而绿原酸不仅可以通过降低细菌细胞壁的硬度,减慢细菌的迁移,影响细菌细胞膜的稳定性和诱导活性氧的产生来发挥抑菌作用[21],而且还可以降低变异链球菌的黏附作用[22]。研究表明,单独应用芦荟苷或绿原酸均可对变异链球菌产生一定的抑制作用[16,23],而将二者联合应用是否可增强其抑菌效果,降低二者的不良反应目前尚无人报道。本研究分析了芦荟苷与绿原酸单独应用对变异链球菌的抑菌作用,并且将二者配伍应用,采用棋盘稀释法研究不同浓度的混合溶液对变异链球菌的体外抑制作用。结果显示,单独抑菌时0.63 g/L芦荟苷和5 g/L绿原酸均可以抑制变异链球菌的生长;而将二者配伍应用时,0.31 g/L芦荟苷与2.5 g/L绿原酸即可达到其联用时的MIC,且二者联合应用时对其抑菌性能具有相加作用。其原因可能是二者分子式中都含有酚羟基结构,均可对细菌的细胞壁造成破坏,从而使联合应用时存在相加的抑菌效应。 本研究观察了1/2、1/4、1/8、1/16、1/32 MIC共5个浓度梯度混合溶液对变异链球菌产酸、黏附以及生物膜形成的影响,发现二者配伍后随着浓度的降低,培养基中变异链球菌的△pH值及OD值变化增加,表明二者配伍应用对变异链球菌产酸及黏附能力的抑制作用具有浓度相关性。有研究表明,变异链球菌在生物膜状态下比在浮游状态下有更强的生存能力,清除生物膜中的变异链球菌需要更高的药物浓度和更合理的用药方式[24],因此,理想的防龋抗菌剂不仅要抑制变异链球菌的生长而且还可以有效减少生物膜的形成,从而达到减少变异链球菌聚集生长产酸的目的,取得较好的防龋效果。本研究利用CLSM观察了芦荟苷和绿原酸联用后变异链球菌生物膜的变化,结果发现,芦荟苷与绿原酸配伍应用可以影响变异链球菌24 h生物膜的形成,芦荟苷-绿原酸混合液的浓度越高其抑制生物膜的中细菌活性的能力越强。 综上所述,芦荟苷和绿原酸联合应用对变异链球菌的生长具有显著的体外抑制作用,并且降低了单组份应用的抑菌浓度,增强了抑菌效果。但是实验仅提供了体外抑菌作用的研究结果,并未涉及体内实验及分子生物学机制方面的研究,因此芦荟苷和绿原酸混合液在口内的使用效果、其安全性如何以及相关作用机制等尚需进一步的研究探讨,为开发与制备安全有效的防龋产品并应用于临床提供实验依据。 [1] Elgamily HM,Gamal AA,Saleh SAA,et al. Microbiological and environmental assessment of human oral dental plaque isolates[J]. Microb Pathog,2019,135:10362. [2] Nagasawa R,Yamamoto T,Utada AS,et al. Competence-stimulating peptide-dependent localized cell death and extracellular DNA production in Streptococcus mutans biofilms[J]. Appl Environ Microbiol,2020,86(23):e02080-20. [3] Wang S,Wang Y,Wang Y,et al. Theaflavin-3,3′-digallate suppresses biofilm formation,acid production,and acid tolerance in streptococcus mutans by targeting virulence factors[J]. Front Microbiol,2019,10:1705. [4] Guo L,Hu W,He X,et al. Investigating acid production by Streptococcus mutans with a surface-displayed pH-sensitive green fluorescent protein[J]. PLoS One,2013,8(2):e57182. [5] Song YM,Zhou HY,Wu Y,et al. In vitro evaluation of the antibacterial properties of tea tree oil on planktonic and biofilm-forming streptococcus mutans[J]. AAPS Pharm Sci Tech,2020,21(6):227. [6] 郭洁,赵满琳.老年人根面龋的发病特点及茶多酚对龋病的预防[J].河北医科大学学报,2010,31(10):1278-1280. [7] Balasubramanian AR,Vasudevan S,Shanmugam K,et al. Combinatorial effects of trans-cinnamaldehyde with fluoride and chlorhexidine on streptococcus mutans[J]. J Appl Microbiol,2020,130(2):382-393. [8] Bedoya-Correa CM,Rincón Rodríguez RJ,Parada-Sanchez MT. Genomic and phenotypic diversity of Streptococcus mutans[J]. J Oral Biosci,2019,61(1):22-31. [9] 谢周杰,张昭,刘力伟,等.变形链球菌中的次级代谢产物及其在口腔生物被膜中的生态功能[J].生物工程学报,2017,33(9):1547-1554. [10] 张辉伟,张风华,张峥,等.木糖醇对唾液和菌斑中变形链球菌的影响[J].河北医科大学学报,2010,31(8):932-934. [11] 李京洋,姚毅章,赵国廷.姜黄素对变异链球菌产酸、耐酸能力的影响[J].口腔医学,2020,40(8):707-710. [12] Nijampatnam B,Zhang H,Cai X,et al. Inhibition of streptococcus mutans biofilms by the natural stilbene piceatannol through the inhibition of glucosyltransferases[J]. ACS Omega,2018,3(7):8378-8385. [13] 全旭,许彤彤,张慧彦,等.D-组氨酸抑制变异链球菌生物膜作用的研究[J].口腔医学研究,2019,35(2):176-179. [14] 林家成,赵玮,卢佳璇.绿原酸防龋的实验研究[J].广东药学院学报,2012,28(5):549-551. [15] Kamath NP,Tandon S,Nayak R,et al. The effect of aloe vera and tea tree oil mouthwashes on the oral health of school children[J]. Eur Arch Paediatr Dent,2020,21(1):61-66. [16] 李鸣宇,朱彩莲,刘正.天然植物提取物对变链菌胞外多糖的抑制[J].现代口腔医学杂志,2004,18(6):481-482. [17] 黄晓晶,卢国英,刘建党,等.茶多酚与葡萄柚提取物联合应用对变异链球菌生长、产酸的影响[J].第三军医大学学报,2011,33(1):58-60. [18] Dua K,Sheshala R,Al-Waeli HA,et al. Antimicrobial efficacy of extemporaneously prepared herbal mouthwashes[J]. Recent Pat Drug Deliv Formul,2015,9(3):257-261. [19] 谢宇婷,陈昭斌.芦荟的生物学活性成分及其抗微生物作用的研究现状[J].中国消毒学杂志,2018,35(8):608-611. [20] 田兵,华跃进,马小琼,等.芦荟抗菌作用与蒽醌化合物的关系[J].中国中药杂志,2003,28(11):41-44. [21] 王庆华,杜婷婷,张智慧,等.绿原酸的药理作用及机制研究进展[J]. 药学学报,2020,55(10):2273-2280. [22] Palíková I,Heinrich J,Bedn [23] 陈昱敏,许斯华,张泽,等.绿原酸对变形链球菌抑制作用的体外实验研究[J]. 赣南医学院学报,2019,39(4):341-342,346. [24] 娄兵新,许颖,魏莉.丹皮酚对变形链球菌生物膜影响的体外研究[J].中国微生态学杂志,2017,29(2):159-161.2 结 果

Table 1 Effects of combined application of aloin and chlorogenic acid at different concentrations on the growth of
Streptococcus mutans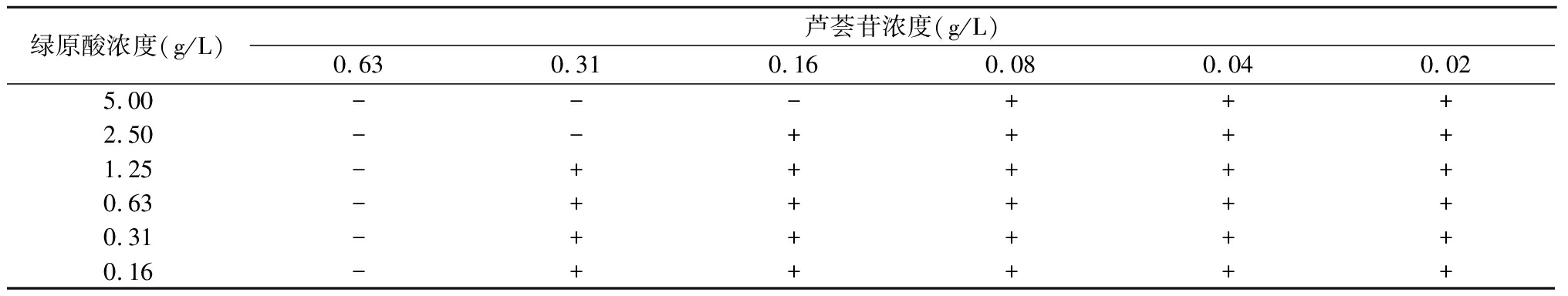
能力的影响
Table 2 The effect of aloin-chlorogenic acid mixture on the
acid production ability of Streptococcus mutans ![]()
24 h生物膜的黏附效果和抑制率比较
Table 3 The adhesive effects and inhibition rates of 24 h
biofilms of Streptococcus mutans by
aloin-chlorogenic acid mixtures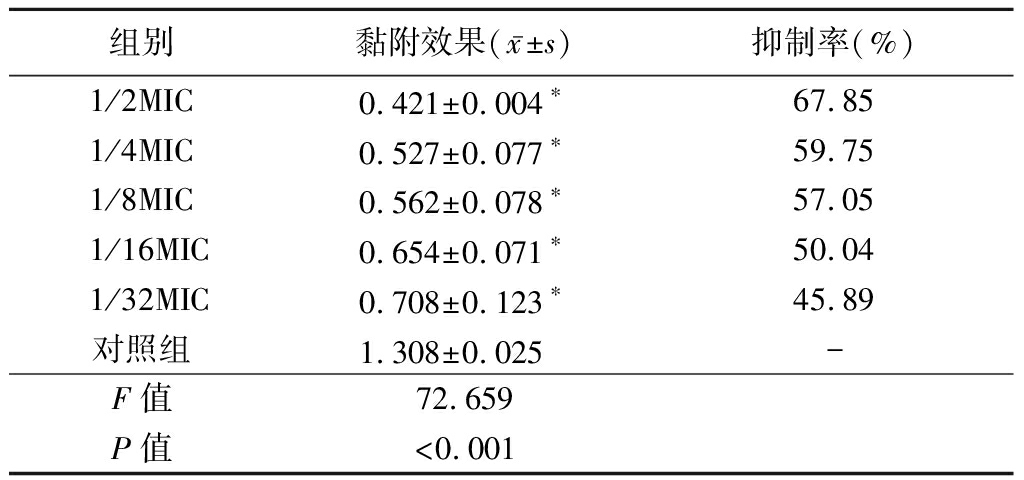
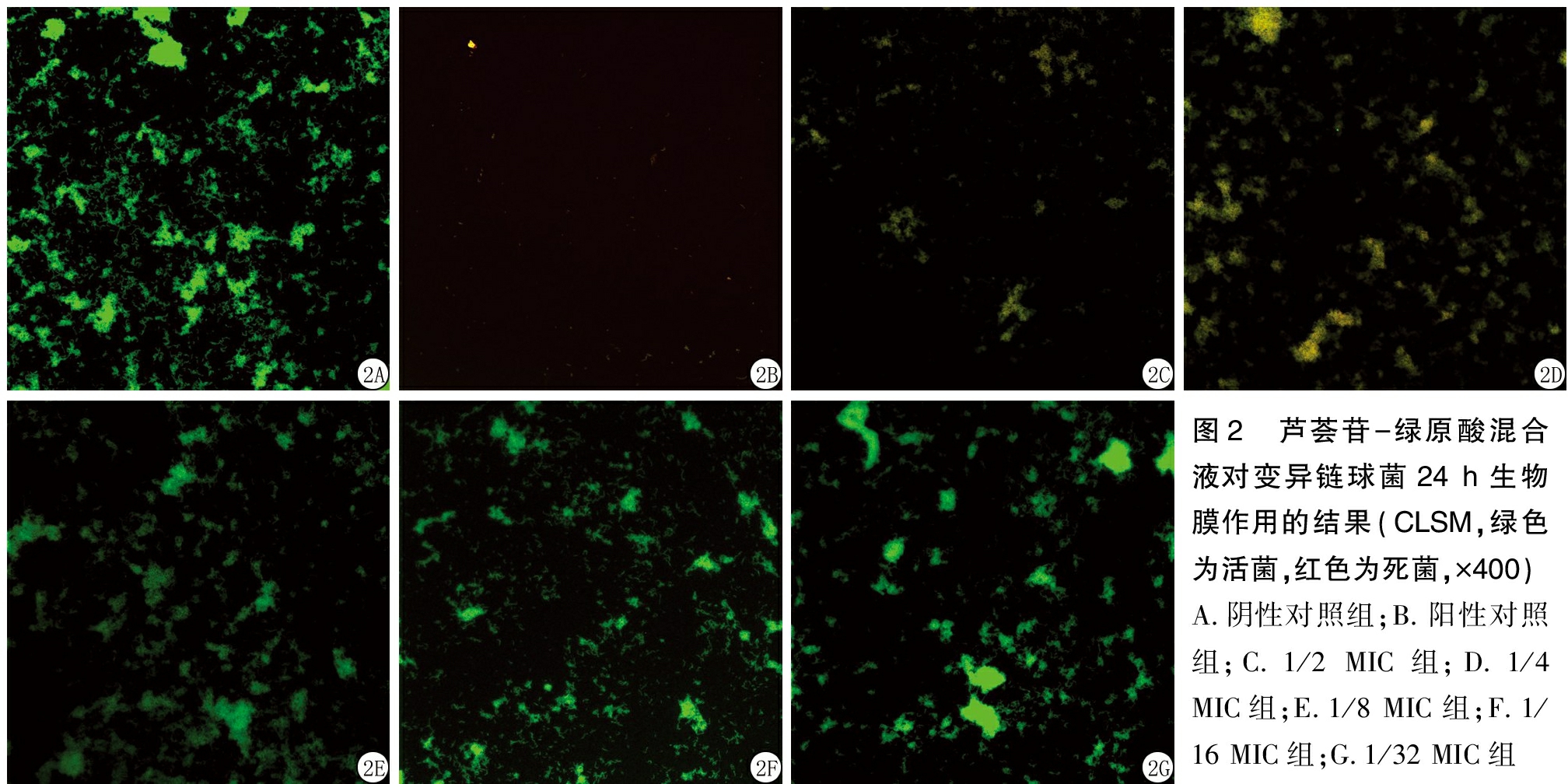
3 讨 论
 r P,et al. Constituents and antimicrobial properties of blue honeysuckle:a novel source for phenolic antioxidants[J]. J Agric Food Chem,2008,56(24):11883-11889.
r P,et al. Constituents and antimicrobial properties of blue honeysuckle:a novel source for phenolic antioxidants[J]. J Agric Food Chem,2008,56(24):11883-11889.