输血依赖的非重型再生障碍性贫血(transfusion dependent non-severe aplastic anemia,TD-NSAA)是指在未发展成为重型再生障碍性贫血(aplastic anemia,AA),血常规有一项符合重型AA,需依赖输注血制品的非重型再生障碍性贫血(non-severe aplastic anemia,NSAA)。每月需要≥2 U的红细胞(red blood cell,RBC)输血或≥2个治疗量的血小板作为开始治疗的起始点[1]。目前推荐使用抗人胸腺细胞免疫球蛋白(anti-human thymocyte immunoglobulin,ATG)联合环孢素A(cyclosporin A,CsA)为主的免疫抑制治疗(immunosuppressive therapy,IST)作为TD-NSAA的起始治疗[2-3]。虽然IST在AA的治疗中已取得有意义的效果,但Kobayashi等[4]和Ades等[5]研究支持,对于有同胞相合供者的患者可直接进行移植而不使用IST,因为异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation,allo-HSCT)前行IST与未行IST患者5年总生存(overal survival,OS)率分别为(60.2±6.7)%、(84.5±4.3)%[6]。随着移植技术完善,allo-HSCT治疗AA或成为更好的选择。传统移植采用异基因全相合造血干细胞,仅在有同胞相合供者或具备人类白细胞抗原(human leukocyte antigen,HLA)8/10以上相合非亲缘供者的基础上进行。从同胞兄弟姐妹配型,一般只有1/4的机会接受移植,非血缘关系人群中,HLA相合的非亲缘供者配型成功概率更是小于1/10万。目前亲缘单倍相合(haploidentical donor,HID)造血干细胞移植在世界范围内广泛认可,在恶性血液病及AA中均有应用。而且有血缘亲属的患者都能迅速找到单倍体相合的亲缘供者,HID-HSCT配型时间仅需2周,缩短移植等待期。本研究对亲缘单倍体移植组(HID组)和全相合亲缘或无关供者移植组(matched donor realated or unrelated donor,MR/UD组)的植入率、植入时间、围移植期死亡、移植相关并发症、OS率等进行比较,以评价2种方法的效果。报告如下。
1 资料与方法
1.1 一般资料 回顾性分析2016年9月—2019年6月于河北医科大学第二医院行allo-HSCT治疗的TD-NSAA患者14例,男性7例,女性7例。纳入标准:①首诊拟行造血干细胞移植患者;②预处理方案使用前无心悸、胸闷、呼吸困难、心前区不适等症状;③未治疗时心电图正常、窦性心率;④血清学标志物(如B型钠尿肽、肌钙蛋白Ⅰ和T、天冬氨酸转氨酶、肌红蛋白、乳酸脱氢酶、肌酸激酶同工酶,可溶性生长刺激表达基因2蛋白)正常;⑤均知情同意并签署知情同意书。排除标准:①非移植或无法接受移植治疗患者;②年龄>70岁;③既往有器质性心脏病病史伴心功能不全Ⅱ级;④有精神病史;⑤并发重要脏器功能不全失代偿;⑥未取得知情同意书;⑦预期生存不足1年。诊断标准参照张之南《血液病诊断及疗效标准》(第3版),且伴有输血依赖,需每月输注红细胞悬液≥2 U。纳入14例TD-NSAA患者,根据供者来源分为HID组8例和MR/UD组6例。随访至2020年1月,评价植入率、植入时间、围移植期死亡、移植相关并发症、总体生存率等。
本研究经医院医学伦理委员会批准通过。
1.2 预处理方案 HID组以北京方案为基础方案,改良白消安(Busulfan,BU)/环磷酰胺(cyclophosphamide,Cy)+氟达拉滨(fludarabine,Flu) +兔抗人胸腺细胞球蛋白(rabbit anti-human thymocyte globulin,ATG)方案8例,-8 d~-6 d BU 每6 h 0.8 mg/m2,-8 d~-5 d Flu 每天30 mg/m2,-4 d~-3 d Cy 每天50 mg/kg;-5 d~-2 d ATG 每天2.5 mg/kg。MR/UD组,改良Bu/Cy+Flu+ATG方案2例,-8 d~-6 d BU 每6 h 0.8 mg/m2,-8 d~-5 d Flu 每天30 mg/m2,-4 d~-3 d Cy 每天30 mg/kg;-5 d~-2 d ATG 每天2.5 mg/kg;Flu+Cy+ATG方案1例;改良Bu/Cy+Flu+ATG方案3例。
1.3 干细胞动员及采集 体检合格的供者皮下注射5~6 d重组人粒细胞集落刺激因子(recombinant human granulocyte colony-stimulating factor,rhG-CSF)每天5~10 μg/kg动员造血干细胞采集并计数,回输细胞达标是指单个核细胞>5.0×108/kg,CD34+细胞>2.0×106/kg。并应用脐带血辅助外周血干细胞回输。
1.4 移植物抗宿主病预防 依据英国血液与骨髓移植学会指南对急性移植物抗宿主病(acute graft-versus-host-disease,aGVHD)的诊断、分级和治疗。-9 d开始给予CsA+吗替麦考酚酯及甲氨蝶呤方案。
1.5 造血重建标准 移植后隔天检测血常规,中性粒细胞连续3 d>0.5×109/L为中性粒细胞植活,血小板≥20×109/L且连续7 d不输注血小板为血小板植活。
1.6 嵌合状态检测 移植后30 d骨髓通过短串重复序列聚合酶链反应(short tandem repeat-polymerase chain reaction,STR-PCR)判断植入情况。
1.7 统计学方法 应用SPSS 21.0统计软件分析数据。非正态分布的计量资料比较采用秩和检验;计数资料比较采用Fisher确切概率法。采用Kaplan-Meier法进行生存分析,Log-rank检验用于生存数据的组间比较。P<0.05为差异有统计学意义。
2 结 果
2.1 各组移植前临床特征比较 HID组和MR/UD组性别、年龄、供受血型情况、预处理方案情况、输血依赖至移植时间、干细胞来源、干细胞计数差异均无统计学意义(P>0.05)。见表1。
表1 HID组及MR/UD组病例资料分析
Table 1 Analysis of case data in HID group and MR/UD group
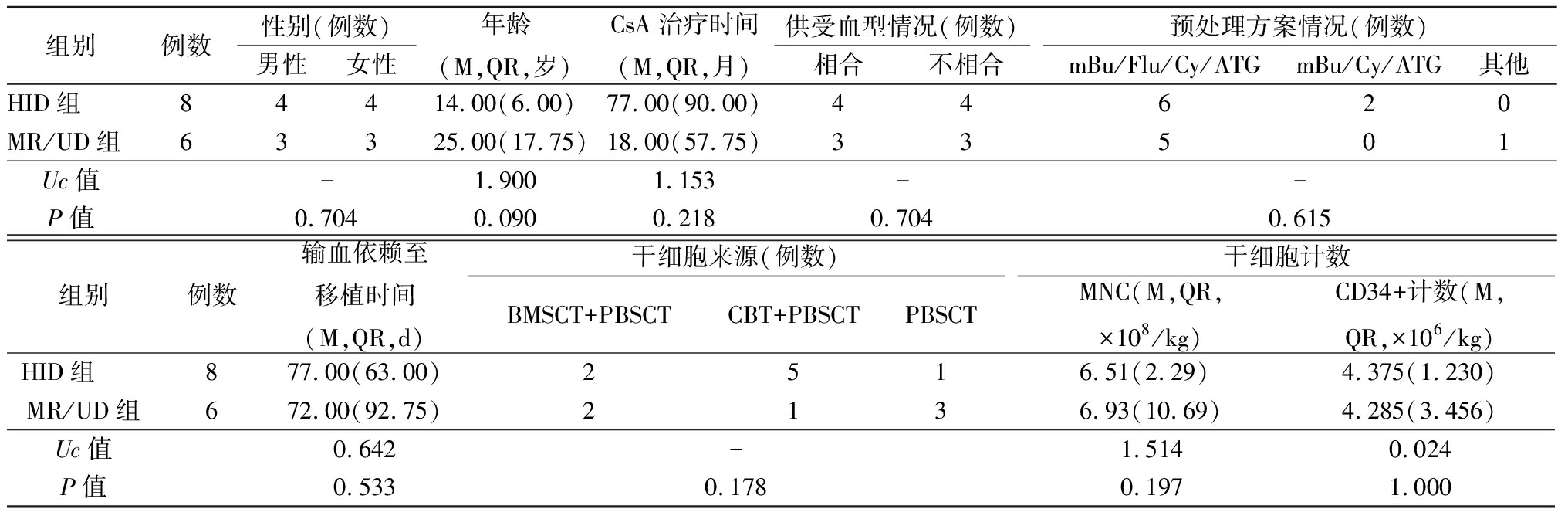
组别例数性别(例数)男性女性年龄(M,QR,岁)CsA治疗时间(M,QR,月)供受血型情况(例数)相合不相合预处理方案情况(例数)mBu/Flu/Cy/ATGmBu/Cy/ATG其他HID组84 4 14.00(6.00)77.00(90.00)44620MR/UD组633 25.00(17.75)18.00(57.75)33501Uc值-1.9001.153--P值0.7040.0900.2180.7040.615组别例数输血依赖至移植时间(M,QR,d)干细胞来源(例数)BMSCT+PBSCTCBT+PBSCTPBSCT干细胞计数MNC(M,QR,×108/kg)CD34+计数(M,QR,×106/kg)HID组 877.00(63.00)2516.51(2.29) 4.375(1.230)MR/UD组672.00(92.75)2136.93(10.69)4.285(3.456)Uc值0.642-1.5140.024P值0.5330.1780.1971.000
-为Fisher确切概率法
2.2 造血重建情况比较 HID组和MR/UD组粒细胞植活时间、血小板植活时间差异无统计学意义(P>0.05)。见表2。
表2 2组造血重建情况比较
Table 2 Comparison of hematopoietic reconstruction (M,QR,d)
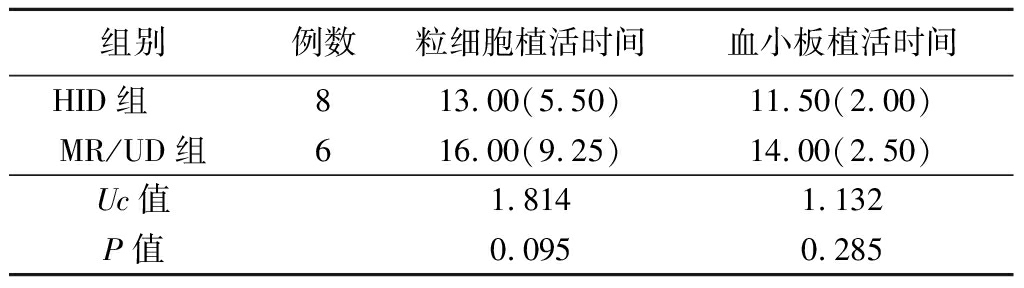
组别例数粒细胞植活时间血小板植活时间HID组 813.00(5.50)11.50(2.00)MR/UD组616.00(9.25)14.00(2.50)Uc值1.8141.132P值0.0950.285
2.3 嵌合状态比较 移植后30 d骨髓送检STR-PCR检测嵌合率。HID组所有患者达到完全嵌合,7例(87.5%)在后期随访中达到稳定嵌合;1例在3个月查T细胞嵌合率下降至33.48%,B细胞嵌合率下降至83.32%,经2次补充外周血干细胞无明显改善,+84 d时死于脑出血。动态监测嵌合体显示MR/UD组6例在早期及后期随访均达到稳定嵌合。2组间达到稳定嵌合差异无统计学意义(P=0.571)。
2.4 移植物抗宿主病比较 HID组发生aGVHD 7例,其中Ⅰ~Ⅱ度6例(75%),Ⅲ度1例,主要累及皮肤5例,肠道2例,肝脏1例;发生肝脏慢性移植物抗宿主病(chronic graft-versus-host disease,cGVHD)1例,肝功能损伤、胆汁淤积。MR/UD组无符合诊断标准的aGVHD及cGVHD。HID组aGVHD发生率高于MR/UD组,差异有统计学意义(P=0.002)。
2.5 移植相关并发症比较 HID组发生肺部感染3例,EB病毒(epstein-barr virus,EBV)血症3例,BK病毒(BK virus, BKV)感染4例,巨细胞病毒(cytomegalovirus,CMV)感染6例,出血性膀胱炎4例(其中1例达Ⅳ度),咯血1例,蛛网膜下腔出血1例。MR/UD组发生肺部感染2例,BKV感染1例,CMV感染3例,出血性膀胱炎1例,玻璃体出血1例。2组均无肝静脉闭塞综合征、间质性肺炎发生。2组移植后肺部感染、病毒感染和出血性膀胱炎发生率差异无统计学意义(P>0.05)。
2.6 移植相关死亡和OS情况比较 随访至2020年1月,中位随访时间15(19)个月。HID组+84 d时死亡1例,MR/UD组无围移植期死亡病例(P=0.571)。HID组血小板植入不良1例,需间断输注单采血小板,其余患者目前PS评分0~1分。HID组预计3年OS率和DFS率分别为87.5%和75.0%,MR/UD组随访无移植相关死亡及疾病进展(P>0.05),见图1~2。
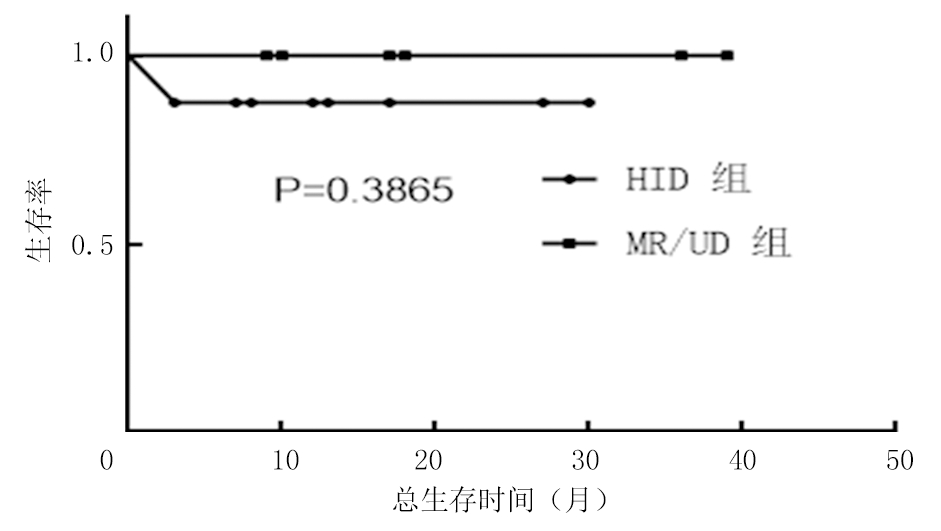
图1 HID组和MR/UD组OS率比较
Figure 1 Comparison of overall survival time between the HID and MR/UD groups
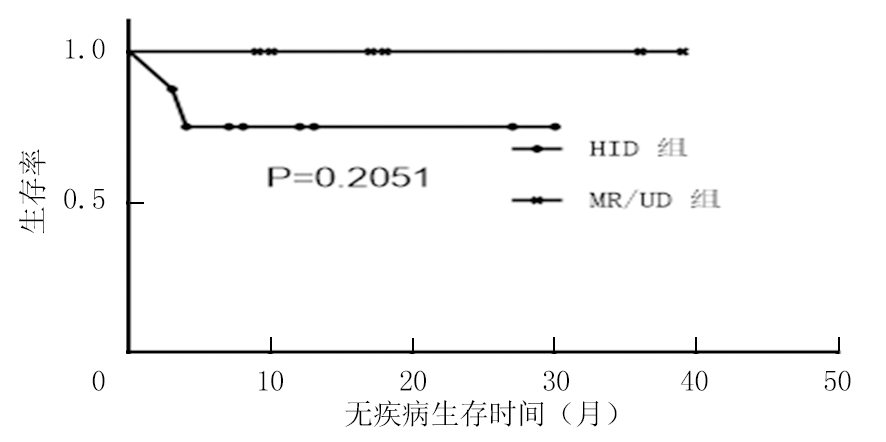
图2 HID组和MR/UD组DFS率比较
Figure 2 Comparison of disease-free survival time between HID group and MR/UD group
3 讨 论
已有研究表明,TD-NSAA有向重型再生障碍性贫血(severe aplastic anemia,SAA)的高进展率[7],检索国内无介入治疗时机普遍共识,所以此项研究中以日本定义输血依赖治疗起始点[1]作为参考。2009发布AA诊断管理指南及中国2017版AA指南[2],ATG+CsA为主[8]的IST治疗4~6个月未缓解的患者中,<50岁或50~60岁一般状况良好的患者可考虑行allo-HSCT[9]。回顾本研究数据,12例(85.7%)患者在移植前有CsA治疗史,12~114个月不等。在临床工作中约有60%患者可长时间从中获益[10],但患者可出现不耐受、个人意愿等问题使得IST治疗患者受益时间长短不一,若接受第2次IST治疗反应率约降至一半,并且IST治疗并未降低TD-NSAA进展发生率[11]。虽然采用allo-HSCT治疗TD-NSAA的方法未被指南推荐,但鉴于TD-NSAA患者易向SAA转化使得疗效变差, 因此allo-HSCT作为治愈手段而被提出[12-13]。
干细胞的成熟度从外周血、骨髓、脐带血依次变弱[14-15]。成熟细胞较高帮助快速的造血重建,但GVHD的发生率较高[16-17]。随着移植水平的改进和免疫抑制药物的规范使用,外周血干细胞移植被普遍使用[18-19]。为比较两者移植数据,对入组患者基本信息、病例特征进行统计学分析,以求最大化消除误差。2组移植模式差异无统计学意义,所以在保证干细胞优质动员的基础上比较单个核细胞数和CD34+细胞计数差异无统计学意义。考虑Kobayashi等[4]、Ades等[5]研究支持移植前接受IST组与未接受IST组的排异发生率及生存率无差异。本研究对患者使用IST相关药物史及用药时间进行统计学分析,结果显示差异无统计学意义,以消除IST在分组间的作用。
本研究结果显示,HID组与MR/UD组移植物抗宿主病发生率差异有统计学意义(P<0.05)。HID组aGVHD发生率高于MR/UD组。2组干细胞植活、嵌合率、肺部感染、相关病毒感染、出血性膀胱炎、3年OS等方面差异无统计学意义(P>0.05)。
Xu等[20]研究显示,HID组aGVHD发生率高于MR/UD组。DeZern等[21]研究显示,单倍体移植患者CMV感染发生率为73.7%,单倍体造血干细胞移植后CMV感染发生率较高。单因素分析结果显示,CMV感染与aGVHD有明显相关性,与已有文献[22]报道一致。基于本研究HID组发生CMV血症6例(75%)和MR/UD组CMV血症发生率3例(50%),呈高发生率,检索接受Haplo-HSCT的患者初发CMV、复发和累积发生率分别为63.9%、34.9%和50.1%,与其余移植方式相当[23]。但Haplo-HSCT患者观察CMV持续时间延长,峰值负荷显着更高。
在重型AA,HID和MR/UD的allo-HSCT在cGVHD发生率和3年OS、DFS差异无统计学意义(P>0.05)[20]。报道HID异基因移植治疗成人重型AA的效果与全相合供者相当,经过检索目前在TD-NSAA阶段采用Haplo-HSCT治疗的患者例数较少。本研究进行回顾性分析,也只是对8例患者进行了初步的探索,样本量不够大且部分病例随访时间有限,但通过对已经完成的 Haplo-HSCT 治疗TD-NSAA患者疗效相关数据的随访的初步结果表明:通过HID和MR/UD的allo-HSCT治疗TD-NSAA疗效比较,在无HLA全相合的供者,亲缘Haplo-HSCT作为替代治疗的选择是安全、有效的。
[1] Yamazaki H. Treatment strategy for acquired aplastic anemia[J]. Rinsho Ketsueki,2018,59(10):1969-1978.
[2] 付蓉.再生障碍性贫血诊断与治疗中国专家共识(2017年版)[J]. 中华血液学杂志,2017,38(1):1-5.
[3] Marsh JC,Ball SE,Cavenagh J,et al. Guidelines for the diagnosis and management of aplastic anaemia[J].Br J Haematol,2009,147(1):43-70.
[4] Kobayashi R,Yabe H,Hara J,et al. Preceding immunosuppressive therapy with antithymocyte globulin and ciclosporin increases the incidence of graft rejection in children with aplastic anaemia who underwent allogeneic bone marrow transplantation from HLA-identical siblings[J].Br J Haematol,2006,135(5):693-696.
[5] Ades L,Mary JY,Robin M,et al. Long-term outcome after bone marrow transplantation for severe aplastic anemia[J]. Blood,2004,103(7):2490-2497.
[6] 宋媛,宋宁霞,刘希民,等.异基因造血干细胞移植治疗重型再生障碍性贫血71例临床分析[J].中华血液学杂志,2016,37(2):151-153.
[7] Nishio N,Yagasaki H,Takahashi Y,et al. Natural history of transfusion-independent non-severe aplastic anemia in children[J].Int J Hematol,2009,89(4):409-413.
[8] Zhu XF,He HL,Wang SQ,et al. Current treatment patterns of aplastic anemia in China:a prospective cohort registry study[J].Acta Haematol,2019,142(3):162-170.
[9] Pierri F,Dufour C. Management of aplastic anemia after failure of frontline immunosuppression[J]. Expert Rev Hematol,2019,12(10):809-819.
[10] Nishikawa E,Yagasaki H,Hama A,et al. Long-term outcomes of 95 children with moderate aplastic anemia treated with horse antithymocyte globulin and cyclosporine[J]. Pediatr Blood Cancer,2017,64(5):26305.
[11] Matsuda K,Koya J,Arai S,et al. Cyclosporine therapy in patients with transfusion-independent non-severe aplastic anemia:a retrospective analysis[J]. Intern Med,2019,58(3):355-360.
[12] Frank P,Carmen B,Ulrich G,et al. First-line allogeneic hematopoietic stem cell transplantation of HLA-matched sibling donors compared with first-line ciclosporin and/or antithymocyte or antilymphocyte globulin for acquired severe aplastic anemia[J]. Cochrane Database Syst Rev,2013,2013(7):CD006407.
[13] Enkhtsetseg P,Xin T,Georg A,et al. Allogeneic transplantation using CD34+ selected peripheral blood progenitor cells combined with non-mobilized donor T cells for refractory severe aplastic anaemia[J]. Br J Haematol,2017,176(6):950-960.
[14] Gãman A,Gãman G,Bold A. Acquired aplastic anemia:correlation between etiology,pathophysiology,bone marrow histology and prognosis factors[J]. Rom J Morphol Embryol,2009,50(4):669-674.
[15] El-Mahgoub ER,Ahmed E,Afifi RA,et al. Mesenchymal stem cells from pediatric patients with aplastic anemia:isolation,characterization,adipogenic,and osteogenic differentiation[J]. Fetal Pediatr Pathol,2014,33(1):9-15.
[16] Sanz J,Montoro J,Solano C,et al. Prospective randomized study comparing myeloablative unrelated umbilical cord blood transplantation versus HLA-haploidentical related stem cell transplantation for adults with hematologic malignancies[J]. Biol Blood Marrow Transplant,2020,26(2):358-366.
[17] Georges GE,Doney K,Storb R. Severe aplastic anemia:allogeneic bone marrow transplantation as first-line treatment[J]. Blood Adv,2018,2(15):2020-2028.
[18] DeZern AE,Zahurak ML,Symons HJ,et al. Haploidentical BMT for severe aplastic anemia with intensive GVHD prophylaxis including posttransplant cyclophosphamide[J]. Blood Adv,2020,4(8):1770-1779.
[19] Nao Y,Ryoji K,Hiromasa Y,et al. First-line treatment for severe aplastic anemia in children:bone marrow transplantation from a matched family donor versus immunosuppressive therapy[J]. Haematologica,2014,99(12):1784-1791.
[20] Xu LP,Jin S,Wang SQ,et al. Upfront haploidentical transplant for acquired severe aplastic anemia:registry-based comparison with matched related transplant[J]. J Hematol Oncol,2017,10(1):25.
[21] DeZern AE,Brodsky RA. Haploidentical donor bone marrow transplantation for severe aplastic anemia[J]. Hematol Oncol Clin North Am,2018,32(4):629-642.
[22] 薛慧,韩雪,刘志彬,等.单倍体造血干细胞移植患者巨细胞病毒感染的临床特点分析[J]. 解放军医学院学报,2019,40(7):648-650.
[23] Huntley D,Gimenez E,Pascual MJ,et al. Incidence,features,and outcomes of cytomegalovirus DNAemia in unmanipulated haploidentical allogeneic hematopoietic stem cell transplantation with post-transplantation cyclophosphamide[J]. Transpl Infect Dis,2019,22(1):e13206.