糖尿病足溃疡(diabetic foot ulcers,DFU)是糖尿病患者常见的一种慢性并发症,如情况严重将可能截肢。临床发现,糖尿病足的预后较差且影响因素较多,其中以年龄、病程、合并疾病等因素较为重要[1-2]。也有观点认为,目前糖尿病足缺乏具有特征的临床症状,导致该病无法在早期检出,进而影响治疗及预后[3]。目前,国内外已经就糖尿病足形成了一套快速、完善的评定体系,可以在短时间内判断出糖尿病足的危险程度,为治疗医师提供有效的干预方案提供有效依据以改善预后。当前大多数学者对于糖尿病足的关注仍在于患病后创面的处理与治疗,鲜少对患肢的细菌感染程度特征与下肢血管病变及预后的关系进行研究。通过研究糖尿病足的发病机制可发现,血管病变的程度是其溃疡形成、程度及预后效果的重要影响因素[4]。为了解不同严重程度糖尿病足细菌感染特征与血管病变程度及病情结局之间的关系,为临床提升糖尿病足治疗及预后提供参考,故进行此项研究。现总结报告如下。
1 资料与方法
1.1 一般资料 选取2018年3月—2020年3月我院收治的糖尿病伴有足部感染患者113例,按照大西洋学会联盟(Trans Atlantic Inter Society Consensus,TASC)分级标准(A级:仅有单处发生病变,单发狭窄低于10 cm且闭塞低于5 cm,膝下目标血管存在闭塞或存在相似甚至更严重狭窄/闭塞;B级:出现多处病变且每处低于5 cm,或单处病变低于15 cm且不累及膝下腘动脉,或单发/多发病变伴有胫动脉闭塞,膝下目标血管存在闭塞或存在相似甚至更严重狭窄/闭塞;C级:多处出现狭窄或闭塞且累及长度低于15 cm,或患者经过两次腔内治疗后复发下狭窄或闭塞情况,膝下目标血管多发狭窄病变,和/或存在单一闭塞,总程度>10 cm;D级:慢性股总动脉或股浅动脉闭塞且闭塞长度高于20 cm并累及腘动脉,或为慢性腘动脉且三分叉近端完全闭塞,膝下目标血管存在多阶段闭塞,总长度>10 cm,或血管壁严重钙化,无可见侧支循环)[5]足部严重由轻到重分为A组25例,B组18例,C组41例,D组29例。纳入标准:①确诊为糖尿病或有糖尿病史者;②之前未接受过任何抗生素治疗或对细菌感染部分进行清创或清洗者;③接受下肢踝肱指数(ankle brachial index,ABI)、趾肱指数(toe brachial index,TBI)和双下肢动脉计算机断层造影(computed tomography angiography,CTA)。排除标准:①糖尿病伴有足溃疡,但局部分泌物无细菌生长者;②接受下肢动脉CTA未检查出下肢有明显狭窄或闭塞者;③自身免疫性皮肤病变及因静脉曲张引起溃疡者;④合并其他感染者;⑤资料不全、中途退出或失联者。
本研究经医院医学伦理委员会批准通过,患者及家属均知情同意并签署知情同意书。
1.2 方法 所有患者入院后进行首次溃疡创口清洗和清创,医护人员在此时采用无菌棉拭子采集足部溃疡处深部分泌物并进行培养,并且为避免其他细菌的污染,每个患者均行3次细菌培养:①使用无菌器械切除患处深部感染组织并放置在灭菌加盖的容器内并在1 h内送检;②严格按照《全国临床检验操作规程》[6]进行病原学培养,采用划线分离法将标本中的细菌直接接种在血琼脂平板上,温度设定37 ℃,行24~48 h孵育,随后用微量生化稀释法鉴定细菌类型并做好相关记录。
所有患者在入院后3 d内完成ABI和TBI检测,由同一位具有丰富经验的专业技师进行测量,取患肢的数值即可。ABI=踝部动脉收缩压/肱部动脉收缩压,TBI=足趾部收缩压/肱部动脉收缩压。对于局部感染患者而言,在测量TBI时需避开感染区域,必要时可用纱布包扎。每3个月对患者进行电话随访,为期1年。
1.3 感染程度分级[7] ①轻度感染:出现化脓、红肿、疼痛、触痛、局部发热、硬结等情况中的2个或以上情况;或出现蜂窝组织直径/溃疡边缘红肿<2 cm,且未出现局部或全身并发症;②中度感染:未出现糖代谢不稳定症状,但出现蜂窝组织发炎面积>2 cm,或出现淋巴管炎、筋膜下感染并扩散,深部组织出现脓肿或坏疽,并累及肌肉、肌腱、关节等;③重度感染:出现全身毒血症状且代谢不稳定。
1.4 病情结局[8] ①愈合:溃疡创面皮肤完全恢复正常或已经形成痂皮;②复发:溃疡愈合后再次出现溃疡;③小截肢:经跗跖关节或跗跖关节以下进行截肢;④大截肢:跗跖关节以上进行截肢;⑤心脏事件:如急性心力衰竭、心源性猝死、急性冠状动脉综合征等;⑥脑血管事件:致命或非致命性脑卒中。
1.5 统计学方法 应用SPSS 22.0统计软件分析数据。计量资料比较采用单因素方差分析和SNK-q检验;计数资料比较采用χ2检验,相关性分析采用Spearman相关分析。P<0.05为差异有统计学意义。
2 结 果
2.1 4组临床资料比较 4组年龄、糖尿病病程、ABI、TBI、中性粒细胞差异有统计学意义(P<0.05),随下肢病变程度加重,年龄、糖尿病病程、中性粒细胞水平升高,ABI、TBI水平降低。见表1。相关性分析显示,下肢病变程度与年龄、糖尿病病程、中性粒细胞呈正相关,与ABI、TBI呈负相关。见表2。
表1 4组临床资料比较
Table 1 Comparison of clinical data of patients in four groups ![]()
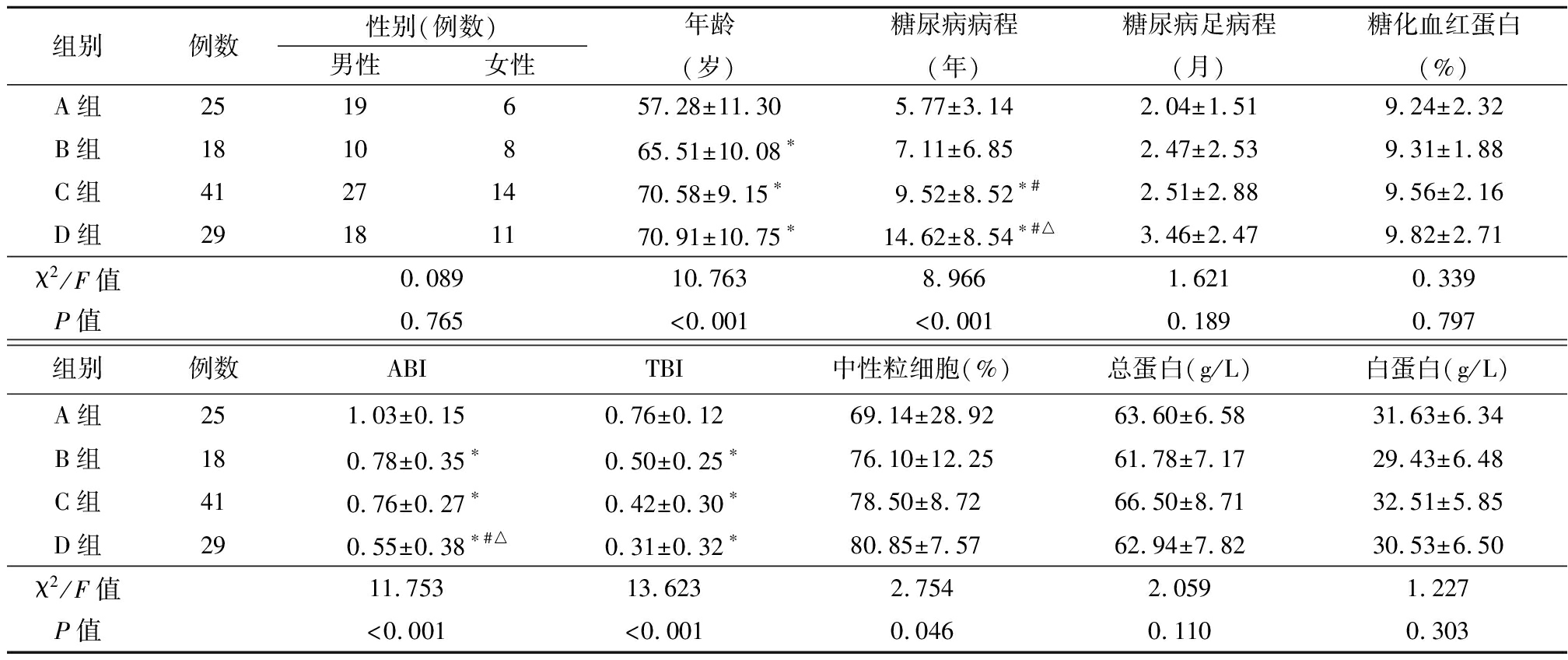
组别例数性别(例数)男性女性年龄(岁)糖尿病病程(年)糖尿病足病程(月)糖化血红蛋白(%)A组2519 657.28±11.305.77±3.142.04±1.519.24±2.32B组1810865.51±10.08∗7.11±6.852.47±2.539.31±1.88C组41271470.58±9.15∗9.52±8.52∗#2.51±2.889.56±2.16D组29181170.91±10.75∗14.62±8.54∗#△3.46±2.479.82±2.71χ2/F值0.08910.7638.9661.6210.339P值0.765<0.001<0.0010.1890.797组别例数ABITBI中性粒细胞(%)总蛋白(g/L)白蛋白(g/L)A组251.03±0.150.76±0.1269.14±28.9263.60±6.5831.63±6.34B组180.78±0.35∗0.50±0.25∗76.10±12.2561.78±7.1729.43±6.48C组410.76±0.27∗0.42±0.30∗78.50±8.7266.50±8.7132.51±5.85D组290.55±0.38∗#△0.31±0.32∗80.85±7.5762.94±7.8230.53±6.50χ2/F值11.75313.6232.7542.0591.227P值<0.001<0.0010.0460.1100.303
*P值<0.05与A组比较#P值<0.05与B组比较△P值<0.05与C组比较(SNK-q检验)
表2 下肢病变程度的相关性分析
Table 2 Correlation analysis of the degree of
lower extremity lesions
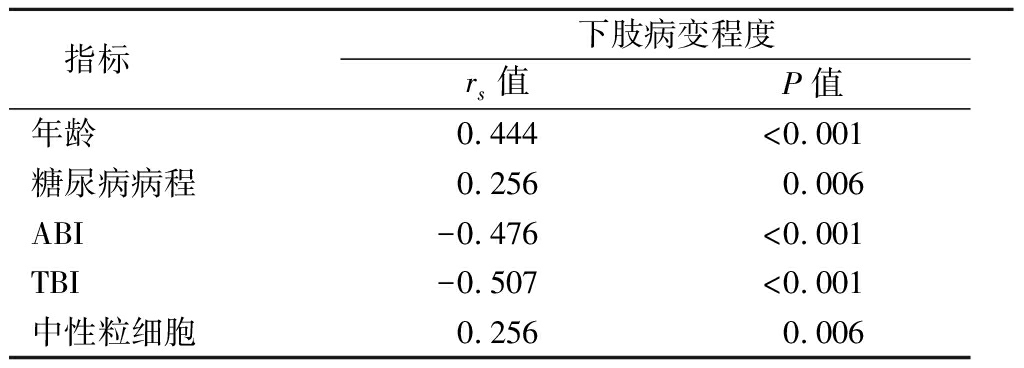
指标下肢病变程度rs值P值年龄0.444<0.001糖尿病病程0.2560.006ABI-0.476<0.001TBI-0.507<0.001中性粒细胞0.2560.006
2.2 4组患者细菌感染特征比较 4组患者的革兰阴性菌感染情况比较,差异有统计学意义(P<0.05)。C组和D组的革兰阴性菌感染情况明显多于A组和B组,A组感染主要以非革兰阴性菌为主,B组感染仍以非革兰阴性菌较多,C组和D组感染的革兰阴性菌和非革兰阴性菌基本差异无统计学意义,说明随着病情的加重,感染革兰阴性菌情况加重。见表3。
表3 4组患者细菌感染特征比较
Table 3 Comparison of the characteristics of bacterial infection in four groups (株数)
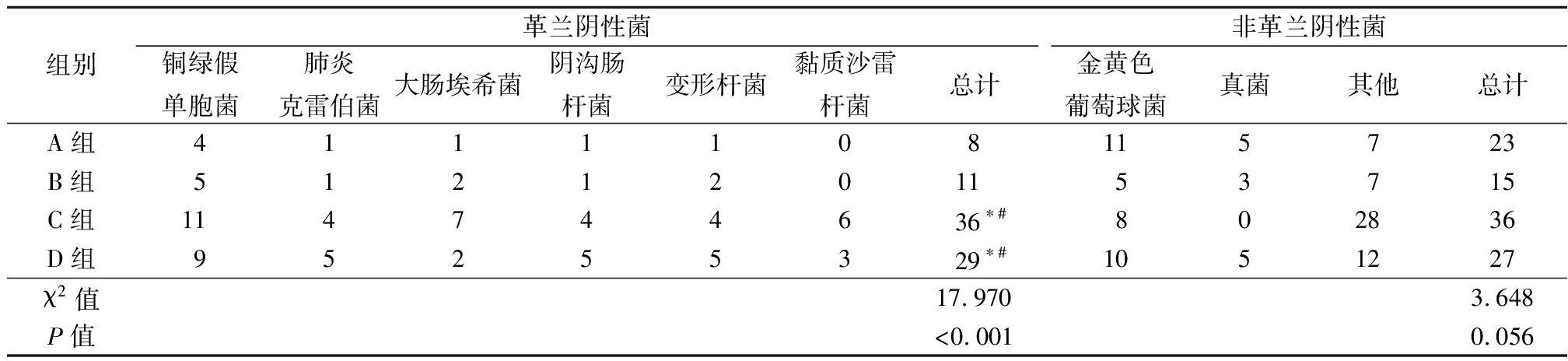
组别革兰阴性菌铜绿假单胞菌肺炎克雷伯菌大肠埃希菌阴沟肠杆菌变形杆菌黏质沙雷杆菌总计非革兰阴性菌金黄色葡萄球菌真菌其他总计A组4111108115723B组5121201153715C组114744636∗#802836D组95255329∗#1051227χ2值17.9703.648P值<0.0010.056
*P值<0.05与A组比较 #P值<0.05与B组比较(χ2检验)
2.3 4组患者细菌感染程度比较 4组患者细菌感染程度中轻度感染率和重度感染率差异有统计学意义(P<0.05)。A组轻度感染率明显高于B组、C组和D组,B组和D组重度感染率明显多于A组。见表4。
表4 4组患者细菌感染程度比较
Table 4 Comparison of the degree of bacterial
infection in four groups (例数,%)
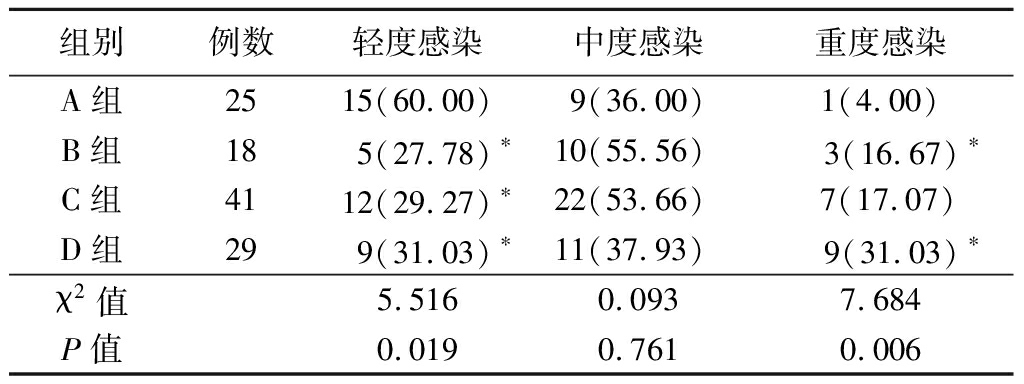
组别例数轻度感染中度感染重度感染A组2515(60.00)9(36.00)1(4.00)B组185(27.78)∗10(55.56) 3(16.67)∗C组4112(29.27)∗22(53.66)7(17.07)D组299(31.03)∗11(37.93) 9(31.03)∗χ2值5.5160.0937.684P值0.0190.7610.006
*P值<0.05与A组比较(χ2检验)
2.4 4组患者细菌感染情况比较 4组患者混合感染情况差异有统计学意义(P<0.05)。A组的混合感染率明显低于C组和D组,B组混合感染率明显低于D组。见表5。
表5 4组患者细菌感染情况比较
Table 5 Comparison of bacterial infection in four groups (例数,%)

组别组例混合感染单一感染A组254(16)21(84)B组184(22.22)14(77.78)C组4116(39.2)∗25(60.98)D组2917(58.62)∗#12(41.38)χ2值14.471P值<0.001
*P值<0.05与A组比较 #P值<0.05与B组比较(χ2检验)
2.5 4组患者病情结局情况比较 4组患者愈合、小截肢、大截肢和死亡结局差异有统计学意义(P<0.05)。A组患者愈合例数明显高于B组、C组和D组,A组小截肢例数明显低于C组和D组。见表6。
表6 4组患者的病情结局情况比较
Table 6 Comparison of disease outcome in four groups (例数,%)
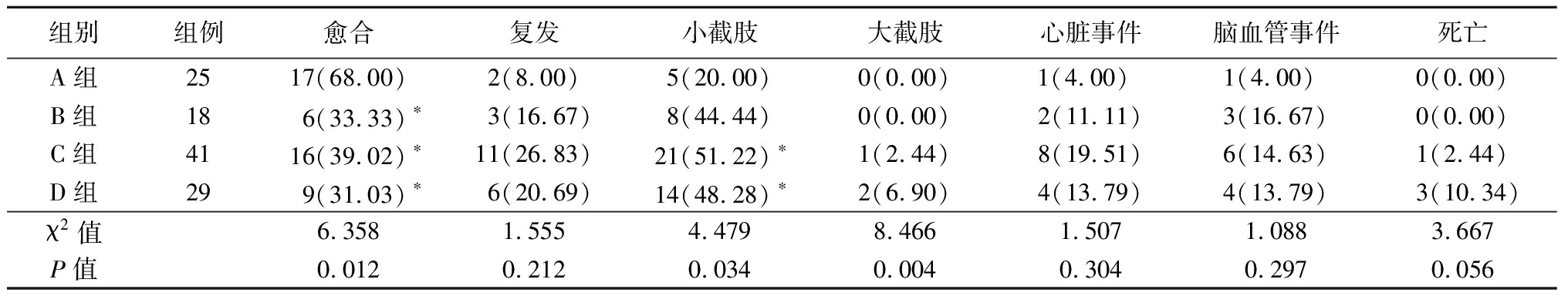
组别组例愈合复发小截肢大截肢心脏事件脑血管事件死亡A组2517(68.00)2(8.00)5(20.00)0(0.00)1(4.00) 1(4.00) 0(0.00)B组186(33.33)∗3(16.67)8(44.44)0(0.00)2(11.11)3(16.67)0(0.00)C组4116(39.02)∗11(26.83)21(51.22)∗1(2.44)8(19.51)6(14.63)1(2.44)D组299(31.03)∗6(20.69)14(48.28)∗2(6.90)4(13.79)4(13.79)3(10.34)χ2值6.3581.5554.4798.4661.5071.0883.667P值0.0120.2120.0340.0040.3040.2970.056
*P值<0.05与A组比较(χ2检验)
3 讨 论
DFU的形成主要是由于糖尿病患者的血管或神经病变导致关节变形、肌肉性能改变,其发展程度则主要受到糖尿病患者运动有限性的影响[9]。临床上发现,影响DFU发展的因素较多,主要与血糖、血脂等表现水平有关。研究证明,与正常人相比,糖尿病患者存在免疫系统紊乱的情况,而这被认为是导致其容易感染的重要原因。而随着患者的年龄加大,其出现全身心血管粥样硬化的危险性也会增加,加上机体免疫力的下降,将进一步加剧血管内皮受损和再生修复能力降低,加重机体内炎症反应和血管病变。本研究结果显示,患者下肢病变程度与年龄、糖尿病病程、中性粒细胞呈正相关,与ABI、TBI呈负相关。说明,当患者的下肢血管病变程度加深,下肢运动能力也将进一步削弱,如此形成恶性循环。而且患者年龄和病程增加,机体的自身免疫能力和抗感染能力也会随之下降,感染情况将进一步加重,继而引发中性粒细胞百分比升高。
国内既往研究发现,在糖尿病足患者中,以革兰阳性球菌的患者占大多数,并随着瓦格纳分级的升高而增加,且革兰阳性菌会慢慢发展转化成为革兰阴性菌,如为混合感染,该情况出现的概率会明显增加[10]。国外有研究发现,糖尿病足患者的感染程度加深,其对于青霉素和头孢类抗生素的耐药性将提升,混合感染的情况会进一步加剧,进而影响到干预效果及预后[11-12]。本研究结果显示,随糖尿病足患者下肢病变程度加重,革兰阴性菌感染增加,此现象在轻度感染和重度感染中更为显著。而且,混合感染时该情况会进一步加剧。可见,随着糖尿病足患者的下肢血管病变程度不断加深,革兰阴性菌和混合感染率提升,患者的治疗效果将大大降低。国内相关研究发现,糖尿病足的瓦格纳分级越轻,患者的预后结局就越理想[13]。国外也有学者研究证实,糖尿病足瓦格纳分级越高,其愈合情况就越不理想[14]。本研究结果显示,随着患者的下肢病变程度加深,其愈合率降低,且复发、小截肢、大截肢和死亡概率升高。但也有学者发现,糖尿病足患者下肢病变程度加深,其出现心脑血管事件发生率越高[15]。可能是有由于本研究随访时间仅为1年,无法就患者下肢病变程度与其病情结局进行更深入的研究。
综上所述,随着糖尿病足患者下肢血管病变程度增加,足部细菌感染革兰阴性菌情况和混合感染情况加重,愈合率降低,而小截肢、大截肢和死亡概率增加。影响糖尿病足病情结局的因素众多且复杂,由于本研究样本有限且随访时间较短,无法就糖尿病足下肢病变与病情结局之间的关系进行更深入、全面的研究分析。
[1] 鲁铭,马湘玉.黄连紫草油纱条治疗糖尿病足早期溃疡的效果观察[J].实用临床医药杂志,2020,24(5):98-100.
[2] 张朝光,戴黎明,杨夏.糖尿病足患者下肢血管病变与细菌感染的关系研究[J].中华医院感染学杂志,2018,28(1):51-54,61.
[3] 杨立娜,张翠兰,侯书鹏,等.426例糖尿病足住院患者临床特征分析[J].河北医科大学学报,2019,40(3):347-350.
[4] 王雪欣,余鹏,张明谏,等.糖尿病足患者下肢动脉病变和伤口细菌学分析[J].中华烧伤杂志,2018,34(6):386-388.
[5] 刘文导,冯柳迁,孟凡喆,等.下肢动脉硬化闭塞症介入治疗效果及影响术后复发因素分析[J].介入放射学杂志,2017,26(6):514-517.
[6] 胡敬梅,银玲,邓蓉,等.糖尿病足溃疡感染患者病原菌特点及其与下肢血管病变程度的关系[J].实用医院临床杂志,2018,15(4):77-79.
[7] 杨雪梅,林珊珊,郭丽敏.150例糖尿病足感染患者细菌分布及药敏反应特点[J].山东医药,2019,59(25):76-78.
[8] 张晶,马强,陈荣.葛根芩连汤对2型糖尿病合并下肢血管病变的临床效果及作用机制[J].陕西中医,2018,39(1):86-88.
[9] 李红敏,钱伟军,刘江平,等.糖尿病足并发骨髓炎临床特点及MR征象分析[J].医学影像学杂志,2020,30(1):163-167.
[10] 詹桂桂,杨少玲,宋潇萌,等.糖尿病足混合细菌感染特征及影响因素分析[J].临床误诊误治,2018,31(3):92-95.
[11] Brocco E,Ninkovic S,Marin M,et al. Diabetic foot management:multidisciplinary approach for advanced lesion rescue[J]. J Cardiovasc Surg(Torino),2018,59(5):670-684.
[12] Tae KK,Armstrong DG. Microbiology and antimicrobial therapy for diabetic foot infections[J]. Infect Chemother,2018,50(1):11-20.
[13] 谢树永,牛敏,申金付,等.糖尿病足复发感染不同严重程度分级中病原菌分布特点研究[J].中国全科医学,2020,23(8):919-922.
[14] Uckay I,Jornayvaz FR,Lebowitz D,et al. An overview on diabetic foot infections,including issues related to associated pain,hyperglycemia and limb ischemia[J]. Curr Pharm Des,2018,24(12):1243-1254.
[15] 罗伟,刘高熊,池卫东,等.不同致病菌感染对糖尿病足溃疡患者病情与预后影响分析[J].中华医院感染学杂志,2018,28(10):79-82.