葡萄胎(hydatidiform mole,HM)是妊娠滋养细胞疾病中最常见的一种病变,分为完全性葡萄胎(complete hydatidiform mole,CHM)和部分性葡萄胎(partial hydatidiform mole,PHM)。葡萄胎的病因研究已取得一些进展,但确切病因不明,发病及恶变机制尚不明确,有待进一步研究。目前临床预测恶变主要依据高危因素,包括妊娠年龄>40岁、血清绒毛膜促性腺激素(human chorionic gonadotrophin,HCG)值过高(≥105 U/L)、子宫体积大于停经月份、重复性葡萄胎等,据此采取预防性化疗及预防性子宫切除术,以预防恶变,但预防性干预目前仍存在争议。生长抑制因子4(inhibitor of growth family member 4,ING4)基因是近年来新发现的一种活性较强的候选抑癌基因,与多种肿瘤的发生、发展密切相关。微血管密度(microvessel density,MVD)是评价肿瘤内微血管增殖状况的金指标,CD34是形成血管再生上皮细胞的一个标志物。本研究通过检测葡萄胎组织中ING4蛋白表达及与MVD的关系,探讨其临床意义。
1 资料与方法
1.1 一般资料 选取2015年11月—2017年11月河北生殖妇产医院妇科门诊人工流产所得正常早孕绒毛标本20例为正常早孕绒毛组,年龄21~48岁,平均(32.45±11.02)岁,患者均<12孕周,且无异常妊娠疾病史。选取河北医科大学第三医院2010年11月—2017年11月病理资料完整的葡萄胎患者清宫标本30例为葡萄胎组,年龄21~53岁,平均(32.77±10.20)岁,所有标本均经病理学检查确诊为葡萄胎)。其中CHM 14例,PHM 16例,恶变为侵蚀性葡萄胎者3例。无高危因素5例,有高危因素25例。年龄≤40岁23例,>40岁7例;血清HCG≤105 U/L 9例,>105 U/L 21例;子宫大小≤孕周16例,>孕周14例;有重复性葡萄胎病史2例。所有患者均未行清宫术前化疗。两组一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 试剂与方法 鼠抗人原始造血细胞CD34单克隆抗体,PV6002山羊抗小鼠二步法免疫组织化学检测试剂,PV6001兔二步法免疫组织化学检测试剂均购自北京中杉金桥生物技术公司。兔抗人ING4多克隆抗体购自美国Proteintech Group有限公司。
免疫组织化学PV法检测组织中ING4蛋白的表达:收集的标本经多聚甲醛固定保存,进行脱水、透明、浸蜡、石蜡包埋,蜡块连续切片,厚约4 μm。采用免疫组织化学PV6001法染色,按PV法说明书进行操作。4%中性甲醛固定,石蜡包埋,3 μm切片,常规苏木精-伊红染色和免疫组织化学染色。结果判断:以磷酸盐缓冲液(phosphate buffered saline,PBS)代替一抗作为阴性对照。ING4蛋白阳性表达以细胞核和(或)胞浆内出现染色颗粒为标准,采用半定量积分法判定结果。先按染色强度评分:未见染色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;再按染色细胞所占百分比评分,随机选取高倍镜(×200)下观察4个视野,每个视野计数100个细胞,无染色细胞为0分,染色细胞≤25%为1分,染色细胞26%~50%为2分,染色细胞>50%为3分。将两者评分之和所得总分进行结果判定:总分>2分定义为阳性表达,总分≤2分定义为阴性表达。切片均有2名病理医生采用双盲法分别对同一切片强度评定。
免疫组织化学PV法检测组织中的MVD:收集的标本经中性福尔马林液固定保存,进行脱水、透明、浸蜡、石蜡包埋,蜡块连续切片,厚约4 μm。采用免疫组织化学PV6002法染色,按PV法说明书进行操作。结果判断:CD34阳性表达定位于血管内皮细胞的胞质或胞膜,用于标记并计数MVD。MVD计数:滋养细胞间质内血管内皮细胞或细胞族代表1条单独的微血管;如果主要结构不相连,分支结构也作为一个血管计算,凡管腔>8个红细胞直径或肌层较厚者不列入计数;先在低倍(×40、×100)显微镜视野内观察整张切片的血管分布情况,找到病变组织内微血管密度最高的区域(热点区),然后在高倍(×200)显微镜视野内计数4个区域微血管的数目,求其平均值作为该张组织切片的MVD值。分辨不清或染色模糊的细胞不计入计数结果。
1.3 统计学方法 应用SPSS 13.0统计软件分析数据。计量资料比较采用t检验、单因素方差分析和SNK-q检验,计数资料比较采用χ2检验,两组变量间的相关分析采用Spearman等级相关分析。P<0.05为差异有统计学意义。
2 结 果
2.1 不同组织中ING4蛋白表达 早孕绒毛中ING4蛋白主要表达于滋养细胞的细胞核,少许表达于细胞质,多呈强阳性表达;葡萄胎组织中ING4蛋白大部分表达于滋养细胞的细胞质,小部分表达于细胞核,滋养细胞间质未见ING4蛋白表达。正常早孕绒毛中ING4蛋白表达阳性率100%(30/30),葡萄胎组织中ING4蛋白表达阳性率50%(15/30),葡萄胎组ING4蛋白表达低于正常早孕绒毛组,差异有统计学意义(χ2=14.286,P<0.05)。见图1,2。
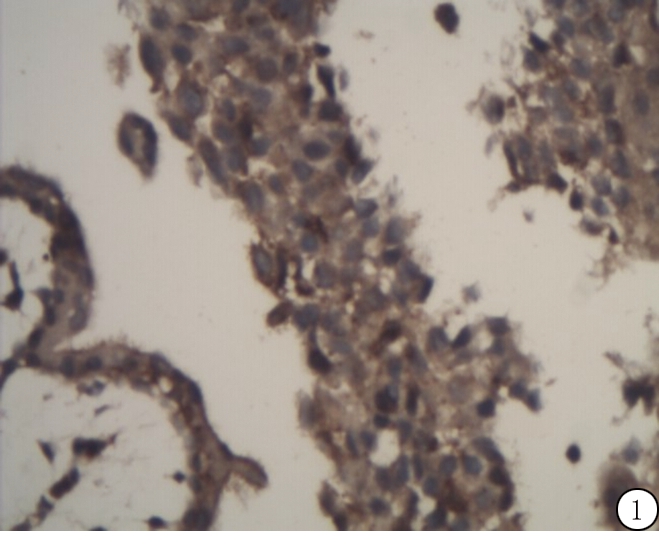
图1 ING4蛋白在正常早孕绒毛中的表达(免疫组织化学 ×200)
Figure 1 Immunohistochemical detection of ING4 in the chorion of early gestation tissues(PV ×200)
2.2 不同临床高危因素及病理类型中ING4蛋白表达 CHM组和PHM组中ING4蛋白表达均低于正常早孕绒毛组,差异有统计学意义(P<0.05)。CHM组和PHM组的ING4蛋白表达差异无统计学意义(P>0.05)。无高危因素组与有高危因素组ING4蛋白表达均低于正常早孕绒毛组,差异有统计学意义(P<0.05)。无高危因素与有高危因素组ING4蛋白表达差异无统计学意义(P>0.05)。单因素分析结果表明,葡萄胎组织中ING4蛋白表达与临床高危因素无关(P>0.05)。见表1~3。
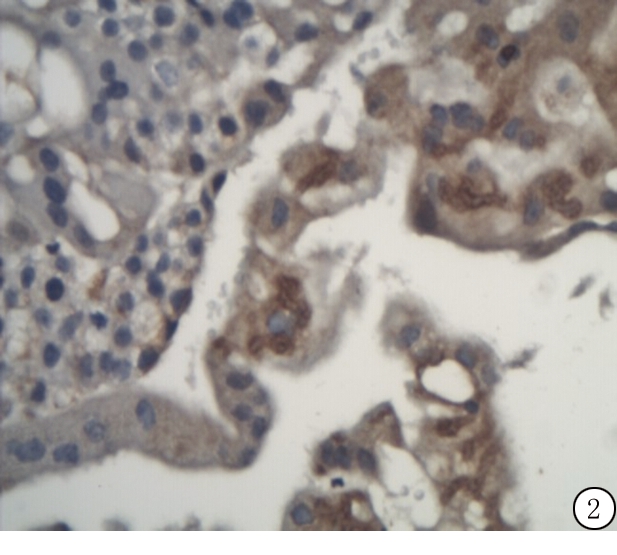
图2 ING4蛋白在葡萄胎中的表达(免疫组织化学 ×200)
Figure 2 Immunohistochemical detection of ING4 in the chorion of early gestation tissues(PV×200)
表1 不同葡萄胎病理类型及
正常早孕绒毛中ING4蛋白表达
Table 1 Expression of ING4 protein in patients with
different pathological types of hydatidiform mole and
in chorionic villi of normal early pregnancy (例数)
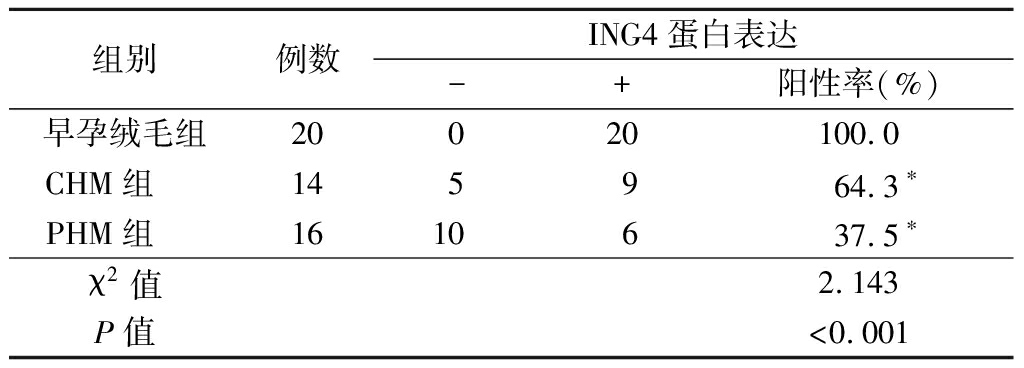
组别例数ING4蛋白表达-+阳性率(%)早孕绒毛组20020100.0CHM组 145964.3∗PHM组 1610637.5∗χ2值2.143P值<0.001
*P值<0.05与早孕绒毛组比较
表2 有无高危因素葡萄胎组织中ING4蛋白表达
Table 2 Expression of ING4 protein in hydatidiform mole
tissue with or without high-risk factors (例数)
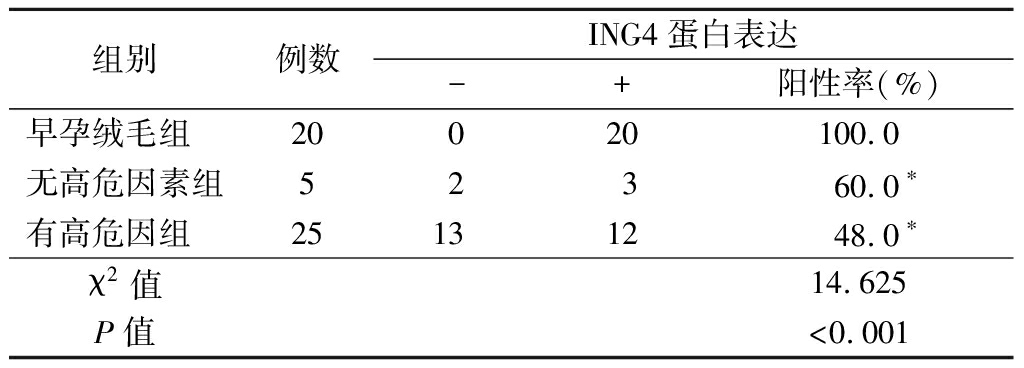
组别例数ING4蛋白表达-+阳性率(%)早孕绒毛组 20020100.0无高危因素组52360.0∗有高危因组 25131248.0∗χ2值14.625P值<0.001
*P值<0.05与正常早孕绒毛组比较
2.3 正常早孕绒毛及葡萄胎组织中MVD测定 在正常早孕绒毛间质中见较多CD34标记的微血管,见图3。葡萄胎组织标本中CD34标记的微血管明显减少。完全性葡萄胎绒毛间质分隔为大小不等的水池,在水池内偶见微血管,见图4。部分性葡萄胎中水肿绒毛与正常绒毛并存,水肿绒毛间质中CD34表达减少,正常绒毛部分间质CD34表达与正常早孕绒毛相似,见图5。正常早孕绒毛组MVD值高于葡萄胎组MVD值,差异有统计学意义(t=9.535,P<0.05)。
表3 不同临床高危因素葡萄胎组织中ING4蛋白表达
Table 3 Expression of ING4 protein in hydatidiform mole
tissues with different clinical high-risk factors (例数)
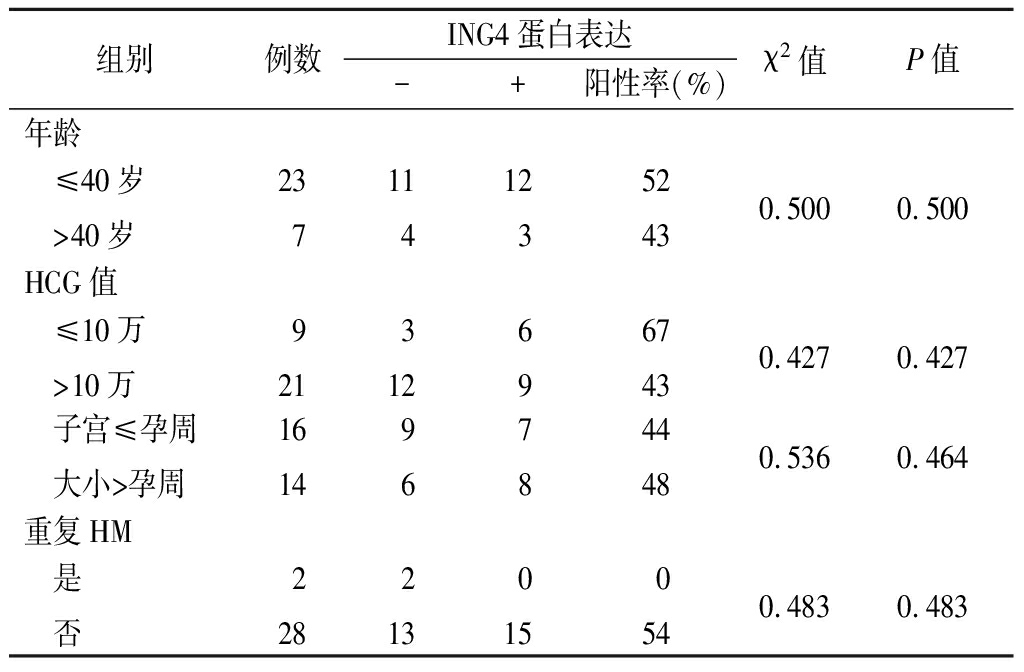
组别例数ING4蛋白表达-+阳性率(%)χ2值P值年龄 ≤40岁 >40岁23711412352430.5000.500HCG值 ≤10万 >10万9213126967430.4270.427 子宫≤孕周 大小>孕周1614967844480.5360.464重复HM 是 否2282130150540.4830.483
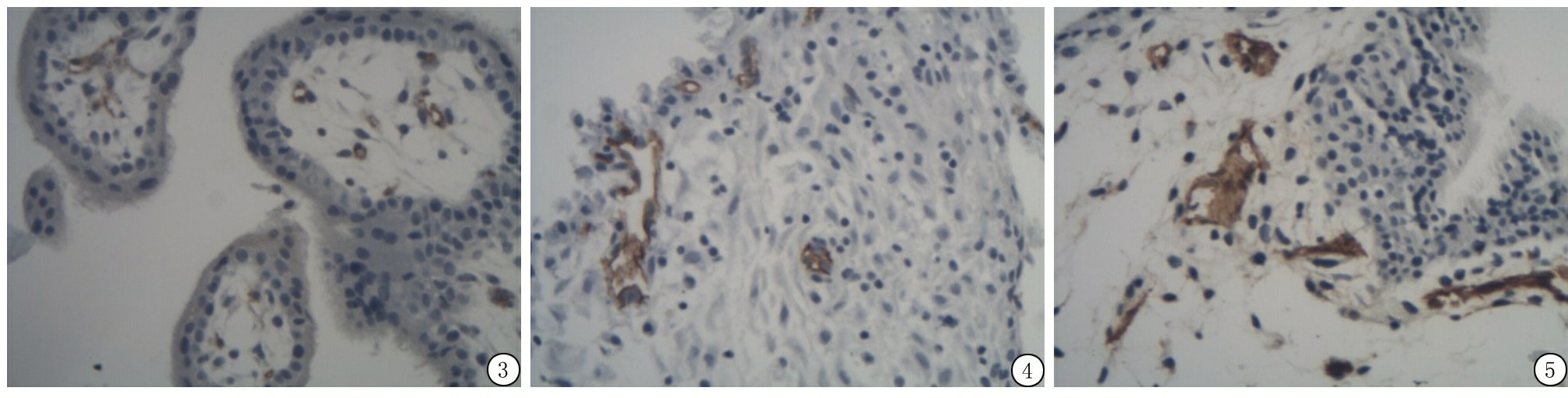
图3 正常早孕绒毛中CD34 标记的MVD(免疫组织化学 ×200)
Figure 3 Immunohistochemical determination of MVD using anti-CD34 antibody in the chorion of early gestation tissues (PV ×200)
图4 CHM中CD34 标记的MVD(免疫组织化学 ×200)
Figure 4 Immunohistochemical determination of MVD using anti-CD34 antibody in the complete hydatidiform mole tissues (PV ×200)
图5 PHM中CD34 标记的MVD(免疫组织化学 ×200)
Figure 5 Immunohistochemical determination of MVD using anti-CD34 antibody in the partial hydatidiform mole tissues (PV ×200)
2.4 不同高危因素及病理类型中MVD测定 PHM组和CHM组MVD值均小于正常绒毛组,PHM组高于CHM组,差异有统计学意义(P<0.05)。无高危因素组和有高危因素组MVD值均小于正常绒毛组,有高危因素组高于无高危因素组,差异有统计学意义(P<0.05)。单因素分析结果表明,葡萄胎组织中MVD值与临床高危因素无关(P>0.05)。见表4~6。
表4 不同葡萄胎病理类型及正常早孕绒毛中MVD比较
Table 4 Comparison of MVD in patients with different
pathological types of hydatidiform mole and in chorionic
villi of normal early pregnancy ![]()
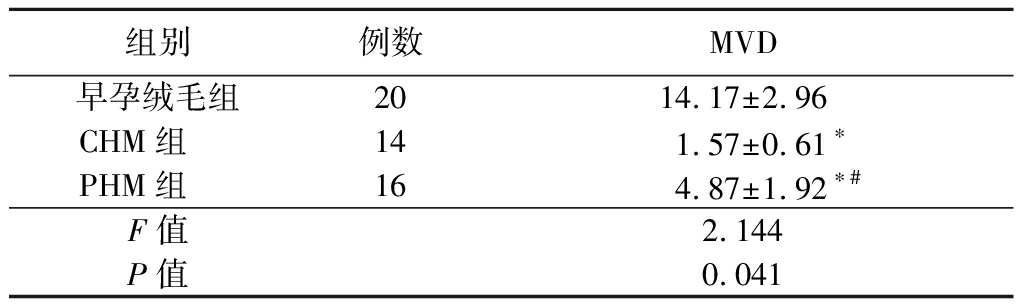
组别例数MVD早孕绒毛组2014.17±2.96CHM组 141.57±0.61∗PHM组 164.87±1.92∗#F值2.144P值0.041
*P值<0.05与早孕绒毛组比较 #P值<0.05与CHM组比较(SNK-q检验)
2.5 葡萄胎组织中ING4蛋白表达与MVD的关系 葡萄胎组织中ING4蛋白表达与MVD无相关性(rs=0.137,P=0.470)。
2.6 恶变的葡萄胎组织中ING4蛋白表达及MVD 恶变组ING4 蛋白表达低于未恶变组,MVD蛋白表达高于未恶变组,差异有统计学意义(P<0.05)。见表7。
表5 有无高危因素葡萄胎组织中MVD比较
Table 5 Comparison of MVD in hydatidiform mole with
or without high-risk factors ![]()

组别例数MVD早孕绒毛组 2014.17±2.96无高危因素组51.40±0.31∗有高危因素组253.72±1.27∗F值8.594P值<0.001
*P值<0.05与早孕绒毛组比较 #P值<0.05无高危因素组比较(SNK-q检验)
表6 不同临床高危因素葡萄胎组织中MVD比较
Table 6 Comparison of MVD in hydatidiform mole
tissues with different clinical high-risk factors ![]()
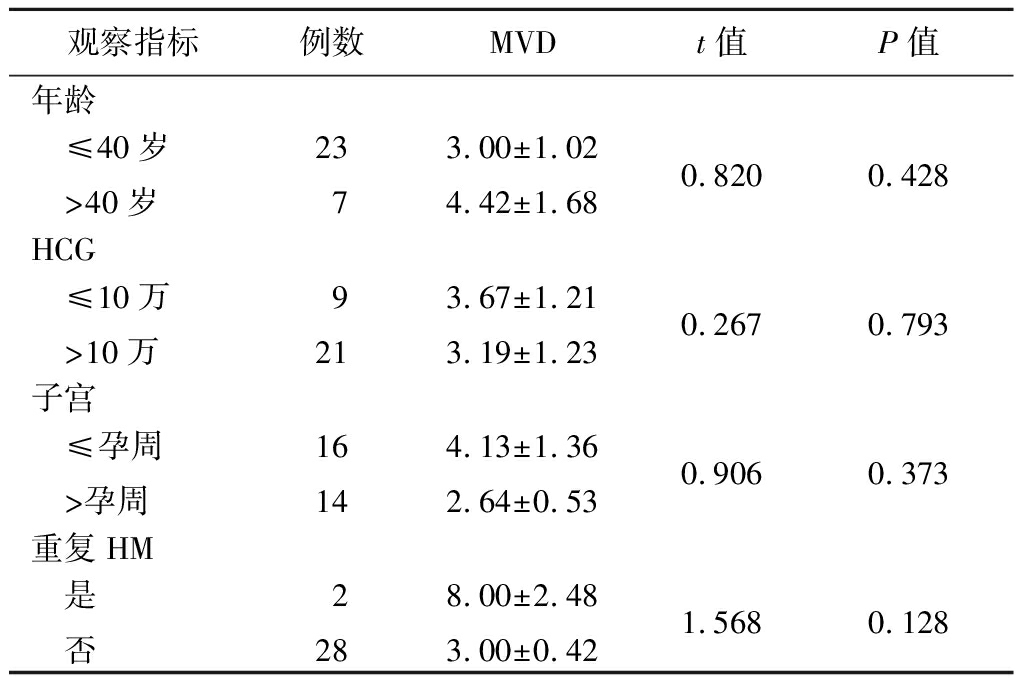
观察指标例数MVDt值P值年龄 ≤40岁 >40岁2373.00±1.024.42±1.680.8200.428HCG ≤10万 >10万9213.67±1.213.19±1.230.2670.793子宫 ≤孕周 >孕周16144.13±1.362.64±0.530.9060.373重复HM 是 否2288.00±2.483.00±0.421.5680.128
表7 是否恶变葡萄胎组织中ING4蛋白表达
Table 7 Expression of ING4 protein in patients with or
without malignant hydatidiform mole tissue
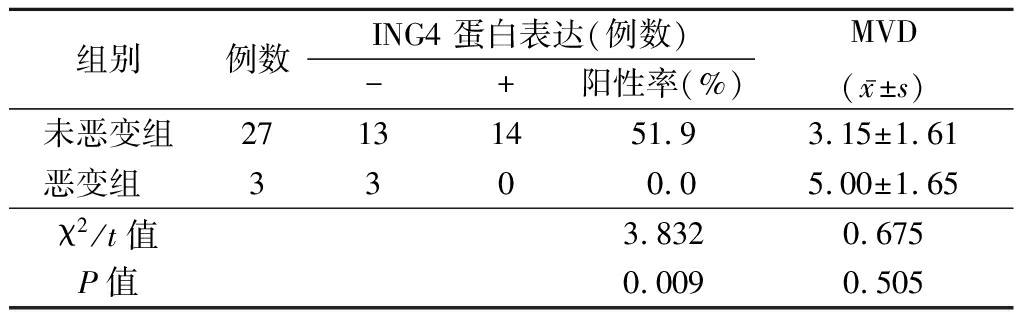
组别 例数ING4 蛋白表达(例数)-+阳性率(%) MVD(x-±s)未恶变组27131451.93.15±1.61恶变组 3300.05.00±1.65χ2/t值3.8320.675P值0.0090.505
3 讨 论
葡萄胎虽属良性病变,但具有潜在恶变的危险,且有5.0%~15.0%可能发展成妊娠滋养细胞肿瘤[1]。葡萄胎的发病及恶变机制尚不明确,尚无很好的方法预测恶变,传统病理学分类也很难作为葡萄胎性质及预后的判断,而且一旦恶变很早就可通过血运转移,因此早期预测恶变是葡萄胎处理需要解决的重要任务。
正常妊娠滋养细胞本身具有一定浸润性,但侵入过程受到母体严格精细调控,即侵入具有节制性,成为葡萄胎后的滋养细胞侵袭能力明显增强。研究表明从葡萄胎、侵蚀性葡萄胎到发展成绒毛膜癌,很可能是一个疾病发展的不同阶段。ING4作为一种活性较强的候选抑癌基因,在正常组织中表达丰富,而在肿瘤组织中表达异常或发生突变。研究表明ING4在许多与癌症相关的细胞进程中发挥重要作用,广泛参与肿瘤发生发展的多个过程。ING4能够增强P53的活性、诱导细胞凋亡和促进p21表达、抑制接触抑制的丧失、调节细胞周期、参与染色质重塑,此外,ING4还抑制缺氧诱导因子1(hypoxia-inducible factor-1,HIF-1)的稳定性和活性,并抑制核因子κB(nuclear factor κB,NF- κB)的p65亚基与p65亚基相互作用调节肿瘤的生长和血管的生成[2]。
ING4蛋白是一种细胞核因子,主要定位于细胞核,目前研究显示在ING4蛋白的中部有二联的核定位信号区域(nuclear localization signal,NLS),其介导ING4蛋白的核定位以及ING4与P53在细胞核内的复合定位外,并且在ING4和p53的相互结合中起关键作用,ING4基因缺乏核定位信号后将失去其负调节细胞增殖,细胞扩散和细胞迁移能力。ING4与p53的相互作用也将被废除,并且下调p53所诱导的p21表达上调[3]。本研究显示与正常绒毛相比葡萄胎组织中出现了较多ING4蛋白的异位表达,这种异位表达可能将导致其功能改变,干扰ING4与p53的相互作用,与张蕾等[4]的Meta分析结论一致,p53高表达可能在亚洲人的HM形成及发展过程中起重要作用,吴齐斌等[5]研究结果提示p53基因突变在滋养细胞肿瘤发病及恶性进展中起重要作用。目前一系列研究表明ING4基因在多种肿瘤中易发生缺失突变和(或)表达下调,包括胶质瘤、肺癌、乳腺癌[6],头颈部癌、黑色素瘤、肝癌、胃癌、结直肠癌[7]、卵巢癌[8]、子宫内膜癌[9]等,并与肿瘤发生及肿瘤恶性程度密切相关[10]。本研究结果说明在葡萄胎的发病过程中ING4蛋白的表达明显被抑制,虽然葡萄胎是良性病变,但有恶变倾向,符合ING4基因抑癌功能的相关结论。ING4蛋白的异位表达及降低促进了葡萄胎的发病。本研究结果显示,CHM组与PHM组中ING4蛋白表达差异无统计学意义(P>0.05),也说明传统的病理学分类很难作为葡萄胎性质及预后的判断标准,且均有发展成为妊娠滋养细胞肿瘤的可能。无高危因素与有高危因素组ING4蛋白表达均低于早孕绒毛组,差异有统计学意义(P<0.05)。无高危因素与有高危因素组ING4蛋白表达差异无统计学意义(P>0.05)。单因素分析结果表明,葡萄胎组织中ING4蛋白表达与患者年龄、血清HCG水平、子宫大小及是否重复性葡萄胎无关。孙旭凌等[11]研究ING4在结直肠癌中的表达显示,ING4阳性表达与患者年龄、性别、肿瘤部位、肿瘤大小、浸润深度无关,但与分化程度、有无淋巴结转移、TNM分期有关,并且证实ING4是结直肠癌预后的独立危险因素之一。本研究结果提示ING4蛋白的表达水平与葡萄胎临床高危因素并不一致,说明临床高危因素预测恶变,具有一定的参考价值但准确性不高。研究中有3例葡萄胎恶变为侵蚀性葡萄胎,恶变率10%,3例恶变者ING4蛋白表达均为阴性,未恶变组ING4蛋白表达阳性率52%,恶变组与未恶变组ING4蛋白表达相比呈现下降趋势,但差异无统计学意义(P>0.05),提示ING4目前还不能作为葡萄胎恶变的分子标志物之一,可能与病例数较少有关,且有部分高危患者行预防性子宫切除术及选择性化疗降低了恶变率。需扩大样本量以进一步研究。
微血管增生是很多肿瘤的特征,MVD是目前检测肿瘤血管形成活性的重要指标。研究表明ING4基因在多种肿瘤中能够抑制肿瘤血管形成进而抑制肿瘤生长及转移,ING4基因是血管形成重要的调节因素。其作用机制可能和白细胞介素8及低氧诱导因子1等有关[12]。本研究结果与郭虹等[13]及李富亮等[14]研究结论一致,葡萄胎中CD34表达显著低于正常妊娠组织。葡萄胎与正常妊娠组织不同病理改变在于绒毛间质血管明显减少。目前研究认为葡萄胎存在受精缺陷,葡萄胎血管发育障碍导致胚胎死亡,由于血管减少及缺失致内循环停止,无法输出,以至发生液体储留,形成葡萄胎。本研究表明不同临床高危因素中MVD测定:无高危因素与有高危因素组分别与早孕绒毛组相比MVD值均低于早孕绒毛组(P<0.05)。无高危因素与有高危因素组MVD值差异无统计学意义(P>0.05)。单因素分析结果表明,葡萄胎组织中MVD值与患者年龄、血清HCG、子宫大小及是否重复性葡萄胎无关。葡萄胎组织中ING4蛋白表达与MVD值二者呈正相关,但相关性不大,差异无统计学意义(P>0.05)。此结果与ING4在多种肿瘤中表现出的抑制肿瘤血管形成,与肿瘤血管形成呈负相关不一致,推测在葡萄胎中可能存在拟血管形成,因滋养细胞与血管内皮细胞同性,且滋养细胞可以取代血管内皮细胞组成血管壁内层[15],这种血管生成方式与经典的血管生成方式完全不同,不依赖内皮细胞,传统的内皮细胞标志物染色通常为阴性,非内皮细胞衬覆的微循环管腔在正常成熟组织中并不存在,但可见于正常胚胎组织,滋养细胞在参与人胎盘及原始微循环形成过程中可获得血管内皮细胞表型,该现象称之为拟血管形成。3例恶变组中ING4蛋白表达与MVD呈负相关,与ING4在其他肿瘤中表现出的抑制肿瘤血管形成,与肿瘤血管形成呈负相关结论一致。葡萄胎与正常早孕绒毛相比滋养细胞有程度不等的增生,是否在葡萄胎中存在拟血管形成这种血管形成方式及ING4蛋白表达抑制是否促进葡萄胎的恶变均有待扩大样本量进一步研究。
[1] 王璐璐,孔为民.447例葡萄胎的临床病理特点分析[J].中国妇幼保健,2015,30(26):4455-4457.
[2] Li XH,Kikuchi K,Zheng Y,et al .Down regulation and translocation of nuclear ING4 is correlated with tumorigenesis and progression of head and neck squamous cell carcinoma[J]. Oral Oncol,2011,47(3):217-223.
[3] Alberto M,Alicia P,Jose LO,et al. Functional impact of cancer associated mutations in the tumor suppressor protein ING4[J]. Advance Access Pub,2010,31(11):1932-1938.
[4] 张蕾,赵丹丹,李家平,等.P53蛋白在葡萄胎中表达的Meta分析[J].临床与病理杂志,2018,38(1):147-155.
[5] 吴齐斌,郑秀,吴荔香,等.maspin和p53在妊娠滋养细胞疾病中的表达及临床意义[J].国际妇产科学杂志,2015,42(6):630-633,721.
[6] Mao ZL,He SB,Sheng WH,et al. Adenovirus-mediated ING4 expression reduces multidrug resistance of human gastric carcinoma cells in vitro and in vivo[J]. Oncol Rep,2013,30(5):2187-2194.
[7] 张福杰,张文俊,于登峰,等.术前短程辅助化疗联合根治性手术治疗结肠癌的临床效果及对患者CDX2、ING4表达的影响[J].河北医科大学学报,2018,39(1):54-57.
[8] 牛娜,程丽,刘乾,等.ING4在卵巢肿瘤中的表达及其临床意义[J].现代肿瘤医学,2014,22(7):1658-1662.
[9] 赵倩,朱长青,海盼盼,等.ING4在正常子宫内膜及子宫内膜癌的表达及临床意义[J].实用妇产科杂志,2018,34(1):61-66.
[10] Byron SA,Min E,Thal TS,et al. Negative regulation of NF-kB by the ing4 tumor suppressor in breast cancer[J].PLoS One,2012,7(10):e46823.
[11] 孙旭凌,申婧,黄桂林,等.结直肠癌细胞增殖核抗原及生长抑制因子4表达的关系及预后因素[J].安徽医科大学学报,2018,53(1):132-136.
[12] Ozer A,Wu LC,Bruick RK,et al. The candidate tumor suppressor ING4 represses activation of the hypoxia inducible factor(HIF) [J]. Proc Natl Acad Sci USA,2005,102(21):7481-7486.
[13] 郭虹,赵春华.造血和血管共同的祖细胞——血液血管干细胞[J].医学研究通讯,2003,32(4):47-50.
[14] 李富亮,刘春英,王云.p57、CD34和Ki-67在胎盘绒毛水肿性病变中的表达及意义[J].新乡医学院学报,2018,35(1):35-38.
[15] 宋鸿钊,杨秀玉,向阳.滋养细胞肿瘤的诊断和治疗[M].北京:人民卫生出版社,2004:2.