卵巢癌(ovarian cancer)是病死率居女性生殖道系统首位的恶性肿瘤[1],尽管近些年来对其诊断、手术方式、化学治疗及分子靶向治疗等手段取得了很大进步,但晚期患者5年的总生存率仍徘徊在40%左右[2]。卵巢癌高致死率的主要原因是发病隐匿且进展迅速,约70%患者就诊时已发生盆腹腔病灶转移。血管内皮生长因子(vascular endothelial growth factor,VEGFA)作为重要诱导血管生成的因子,在肿瘤生长、侵袭及远处转移过程中起重要作用[3-4]。先前多个研究报道了VEGFA在卵巢癌组织中表达上调[5-6],但调控其表达上调的作用机制尚不明确。微小RNAs(miRNAs)在调控基因表达方面起重要作用,通过生物信息学预测得知,miR-107可以靶向调控VEGFA表达,且已被多个研究证实[7-8]。由于miRNAs对靶基因调控作用具有组织特异性,卵巢癌组织中VEGFA异常表达是否由miR-107的表达异常所致,目前尚未见报道。本研究检测卵巢癌组织和正常卵巢组织中miR-107与VEGFA的表达情况,探讨其在卵巢癌发生中的作用并分析二者表达的相关性。
1 资料与方法
1.1 一般资料 选择2016年6月—2020年3月在河北省石家庄市人民院行手术治疗的56例卵巢癌患者为病例组,术前均未接受新辅助化疗,术后经病理检查确诊为上皮性卵巢癌。卵巢癌患者年龄29~74岁,平均(53.8±6.7)岁;FIGO手术病理分期:Ⅰ期10例、Ⅱ期5例、Ⅲ期35例、Ⅳ期6例;肿瘤分化程度:高、中分化31例、低分化25例;组织学类型:浆液性腺癌37例、黏液性囊腺癌7例、子宫内膜样癌12例;淋巴结转移:阳性18例,淋巴结转移阴性38例。选取同期因盆腔脏器脱垂、子宫肌瘤或宫颈癌行全子宫双附件切除患者的正常卵巢组织60例为对照组,其中子宫脱垂患者21例、子宫肌瘤患者28例,宫颈癌患者11例。对照组患者年龄40~73岁,平均(54.5±7.9岁)。2组患者年龄差异无统计学意义(P>0.05),具有可比性。
所有组织标本均在离体30 min内收集,迅速放入-80 ℃冰箱里低温保存备用。标本和资料收集均由患者知情同意,并获得石家庄市人民医院伦理委员会批准通过。
1.2 试剂与仪器 TRIzol试剂盒(美国Invitrogen公司);RNA反转录试剂盒(美国Promega公司);Go Taq Green Master Mix试剂盒、miRNA 提取试剂盒、miRNA逆转录试剂盒、miScript SYBR Green PCR Kit试剂盒(均购于德国QIAGEN公司);PCR 引物由上海生工合成;7500型荧光定量PCR仪(美国ABI公司)。
1.3 检测方法
1.3.1 RNA提取及逆转录 应用TRIzol试剂抽提卵巢癌组织及正常卵巢组织总RNA,检测其纯度、浓度及完整性后,将其逆转录成cDNA;应用miRNA提取试剂盒抽提卵巢癌组织及正常卵巢组织的miRNA,应用miRNA逆转录试剂盒将其逆转录成cDNA,-20 ℃保存备用。
1.3.2 RT-qPCR检测VEGFA及miR-107的表达 目的基因VEGFA mRNA的检测应用QuantiNova TMSYBR Green PCR Kit试剂盒进行PCR扩增,反应体系为:Green Master Mix 10.0 μL、Rox 0.1 μL、上游引物各 1.4 μL、cDNA 模板1.0 μL、最后加去离子水至20 μL;反应条件设定:95 ℃预变性5 min;然后40个循环95 ℃变性15 s、60 ℃退火30 s、72 ℃延伸25 s;最后95 ℃变性15 s、60 ℃退火60 s、95 ℃延伸30 s。反应引物:目的基因VEGFA上游引物序列5′-ACCATGAACTTT-CTGCTGTCTTGGGTGCAT-3′,下游引物序列5′-TCACCGCCTCGGCTTGTCACATCTGCAAGT-3′;内参GAPDH上游引物序列5′-ACCACAGTCCATGCCATCAC-3′,下游引物序列5′-TCCACCACCCTGTTGCTGTA-3′。目的基因miR-107应用miScript SYBR Green PCR Kit进行PCR扩增,反应体系为:Ultra SYBR Mix 5.0 μL、上游引物各1.0 μL、cDNA 模板1.0 μL、最后加去离子水至10 μL;反应条件设定:95 ℃预变性15 min;然后40个循环95 ℃变性15 s、60 ℃退火30 s、72 ℃延伸30 s。目的基因miR-107的上游引物5′-GCCGAATTCAAAGCGAGATTCCATCAGCA-3′,下游引物5′-GCCGGATCCTGTCAACCC-AGAACTCAAAGG-3′;以U6基因为内参,其上游引物序列5′-CTCGCTTCGGCAGCACA-3′,下游引物序列5′-AACGCTTCACGAATTTGCGT-3′。根据系统生成的Ct值,采用2-△△CT法进行计算,获得miR-107和VEGFA在各组织样本中的相对表达量。
1.4 统计学方法 应用SPSS 24.0统计软件分析数据。计量资料采用t检验、单因素方差分析,计数资料比较采用χ2检验。应用Pearson相关性分析对卵巢癌组织中miR-107和VEGFA表达量进行相关性分析。采用ROC曲线分析卵巢癌组织中miR-107表达对卵巢癌的诊断意义。P<0.05为差异有统计学意义。
2 结 果
2.1 VEGFA及miR-107的表达情况 VEGFA基因mRNA在卵巢癌组织中的相对表达量为2.04±0.65,在正常卵巢组织中的相对表达量为0.99±0.40,卵巢癌组织中VEGFA基因mRNA的表达量显著高于正常卵巢组织,差异有统计学意义(t=10.427,P<0.001)。卵巢癌组织中miR-107的相对表达量为0.90±0.42,其在正常卵巢组织中的相对表达量为2.06±0.65,2组比较差异有统计学意义(t=11.319,P<0.001)。
2.2 卵巢癌组织中VEGFA及miR-107表达水平的相关性分析 卵巢癌组织中VEGFA基因mRNA表达与miR-107表达水平呈显著负相关(P<0.001),见表1。
表1 卵巢癌组织中miR-107与VEGFA
mRNA表达的相关性
Table 1 Correlation between the expression of miR-107 and
VEGFA mRNA in the ovarian cancer tissues ![]()

组别表达量VEGFA组2.04±0.65miR-107组0.90±0.42r值-0.498P值<0.001
2.3 不同FIGO分期患者卵巢癌组织中miR-107及VEGFA基因mRNA表达情况比较 卵巢癌组织中miR-107及VEGFA基因mRNA在不同FIGO分期的表达比较,差异有统计学意义(P<0.05),见表2。
表2 不同FIGO分期卵巢癌组织中miR-107及
VEGFA mRNA表达比较
Table 2 Comparison of miR-107 and VEGFA mRNA
expression in ovarian cancer tissues in different FIGO stages ![]()
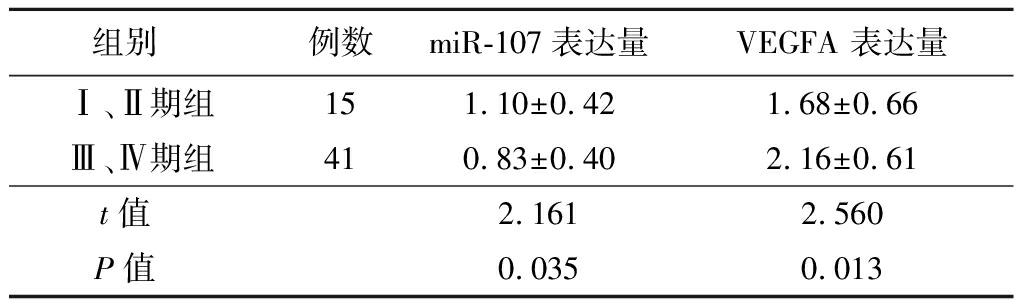
组别 例数miR-107表达量VEGFA 表达量Ⅰ、Ⅱ期组151.10±0.421.68±0.66Ⅲ、Ⅳ期组410.83±0.402.16±0.61t值 2.1612.560P值 0.0350.013
2.4 不同组织学分级患者卵巢癌组织中miR-107及VEGFA mRNA表达情况比较 卵巢癌组织中miR-107及VEGFA基因mRNA在不同组织学分级的表达比较,差异无统计学意义(P>0.05),见表3。
表3 不同组织学分级卵巢癌组织中miR-107及
VEGFA mRNA表达比较
Table 3 Comparison of miR-107 and VEGFA mRNA
expression in ovarian cancer tissues of different
histological grades ![]()
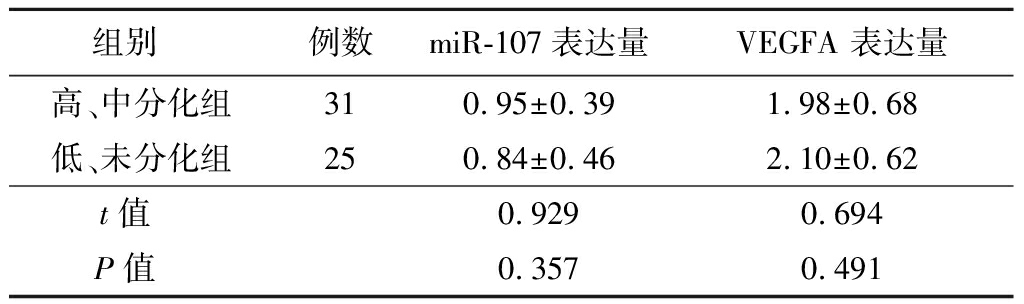
组别 例数miR-107表达量VEGFA 表达量高、中分化组310.95±0.391.98±0.68低、未分化组250.84±0.462.10±0.62t值 0.9290.694P值 0.3570.491
2.5 不同病理类型卵巢癌组织中miR-107及VEGFA mRNA表达情况比较 卵巢癌组织中miR-107及VEGFA基因mRNA在不同病理类型的表达比较,差异无统计学意义(P>0.05),见表4。
表4 不同病理类型卵巢癌组织中miR-107及
VEGFA mRNA表达比较
Table 4 Comparison of miR-107 and VEGFA mRNA
expression in ovarian cancer tissues of
different histological grades ![]()
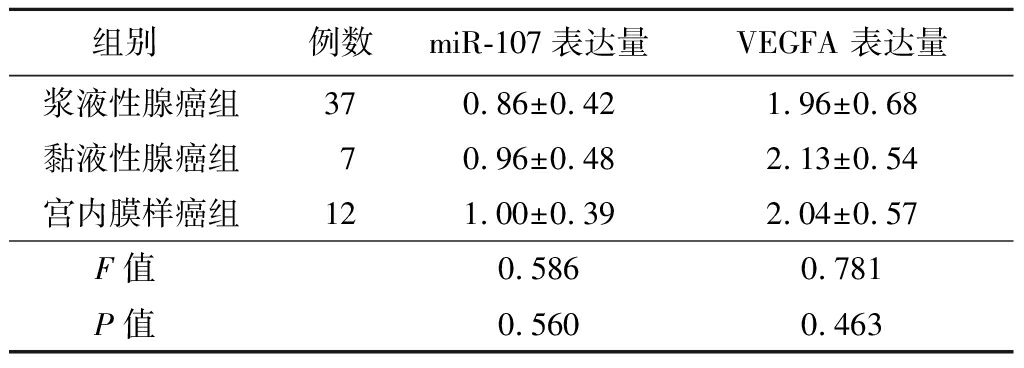
组别 例数miR-107表达量VEGFA 表达量浆液性腺癌组370.86±0.421.96±0.68黏液性腺癌组70.96±0.482.13±0.54宫内膜样癌组121.00±0.392.04±0.57F值 0.5860.781P值 0.5600.463
2.6 不同手术残余病灶卵巢癌组织中miR-107及VEGFA mRNA表达情况比较 卵巢癌组织中miR-107及VEGFA基因mRNA在不同手术残余病灶的表达比较,差异无统计学意义(P>0.05),见表5。
表5 不同手术残余病灶卵巢癌组织中miR-107及
VEGFA mRNA表达比较
Table 5 Comparison of miR-107 and VEGFA mRNA
expression in ovarian cancer tissues from
different surgical residual lesions ![]()
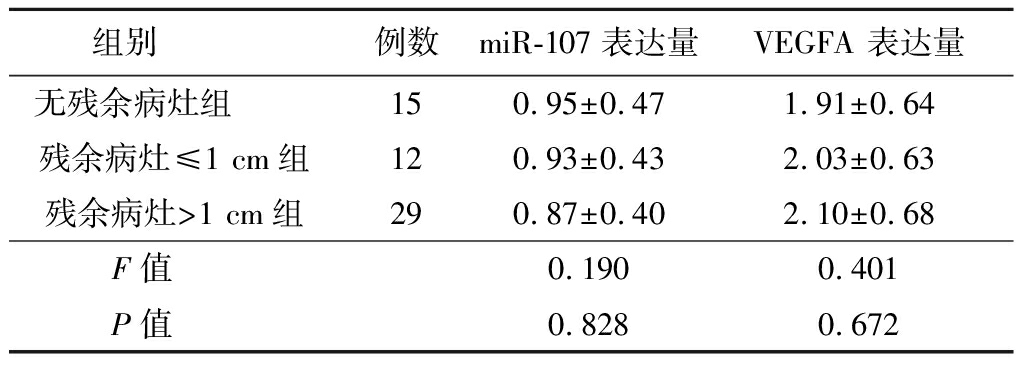
组别 例数miR-107表达量VEGFA 表达量无残余病灶组 150.95±0.471.91±0.64残余病灶≤1 cm组120.93±0.432.03±0.63残余病灶>1 cm组290.87±0.402.10±0.68F值 0.1900.401P值 0.8280.672
2.7 淋巴是否转移患者卵巢癌组织中miR-107及VEGFA mRNA表达情况比较 卵巢癌组织中miR-107及VEGFA基因mRNA在是否发生淋巴转移的表达比较,差异有统计学意义(P<0.05),见表6。
表6 淋巴结是否转移患者卵巢癌组织中miR-107及
VEGFA mRNA表达比较
Table 6 Comparison of miR-107 and VEGFA mRNA
expression in ovarian cancer tissues of patients
with or without lymph node metastasis ![]()
组别 例数miR-107表达量VEGFA 表达量淋巴转移阳性组180.71±0.332.32±0.70淋巴转移阴性组380.99±0.431.90±0.60t值 2.4322.305P值 0.0180.025
2.8 卵巢癌组织中miR-107表达量对卵巢癌的诊断意义 miR-107诊断卵巢癌的ROC曲线下面积(AUC值)为0.936,95%可信区间为0.895~0.976,与AUC=0.5比较,差异有统计学意义(P<0.001),见图1。说明卵巢癌组织中miR-107表达对卵巢癌的诊断具有较高的准确性。最优截断点(cut-off值)为1.639,在最优截断点敏感度和特异度分别为94.6%和76.7%。
图1 卵巢癌组织中miR-107表达水平判断卵巢癌的ROC曲线
Figure 1 ROC curves for miR-107 expression level in ovarian cancer tissues in the diagnosis of ovarian cancer
3 讨 论
卵巢癌是女性常见的恶性肿瘤,大多数在确诊时已为晚期,发生了肿瘤浸润、盆腹腔内种植播散,具有极差的预后。因此研究卵巢癌侵袭、转移机制,同时寻找有效抑制卵巢癌侵袭、转移的方法,是妇科肿瘤临床医师研究的热点。VEGFA在肿瘤生长、侵袭及远处转移过程中起重要作用。本研究通过分析比较了VEGFA及可能调控其表达的miR-107在卵巢癌组织与正常卵巢组织中的表达情况,并探讨了它们与卵巢癌病理特征的关系,为后续研究卵巢癌发生、发展及转移的作用机制提供前期基础,同时为卵巢癌的诊断和治疗寻找新的生物学标志物及药物治疗靶点。
20世纪70年代学者们提出了肿瘤血管生成理论,该理论指出如果没有新生血管形成,肿瘤不会发生远处转移且只能生长到1~2 mm3,只有在新生血管形成后,肿瘤的生长会加倍增长,发生转移的机率也随之上升。形成新生血管是肿瘤生长和发生转移的前提,这同样适合于卵巢恶性肿瘤。VEGFA作为一种高效、特异的血管内皮细胞有丝分裂原,具有促进血管生成和维持血管内皮细胞通透性的功能,在肿瘤生长和侵袭转移过程中发挥重要作用。先前的研究报道了VEGFA在卵巢癌组织中的表达显著高于其在良性或低度恶性卵巢肿瘤中的表达,且VEGFA的表达水平与卵巢癌患者的化疗敏感性及预后相关,其表达水平越高患者的预后则越差[9-11]。因此,VEGFA的高表达可能与卵巢癌的发生发展及患者预后密切相关。本研究应用RT-qPCR检测了VEGFA基因mRNA在卵巢癌组织与正常卵巢组织中的表达情况,结果与先前的报道一致,VEGFA基因mRNA在卵巢癌组织中的表达水平显著高于正常卵巢组织,表明VEGFA表达上调可能在卵巢癌变过程中起作用。淋巴结转移阳性患者的卵巢癌组织中VEGFA表达水平显著高于其在淋巴结转移阴性患者中的表达,说明VEGFA表达可能与卵巢癌细胞的侵袭、转移相关。FIGO分期是判断卵巢癌患者预后重要的指标, 本研究结果发现Ⅲ、Ⅳ期患者的卵巢癌组织中VEGFA基因mRNA的表达水平显著高于其在Ⅰ、Ⅱ期患者中的表达,,说明VEGFA表达水平有可能作为判断卵巢癌患者预后的重要指标。
VEGFA表达升高在卵巢癌发生、发展过程中起重要作用,然而其在卵巢癌组织中表达上调的调控机制目前仍不明确。miRNAs作为一类重要的基因调控分子,在调控组织特异性基因表达方面起重要作用。近年来,研究发现卵巢癌组织中存在许多异常表达的miRNAs,miRNA通过与靶基因mRNA的3′UTR区结合,促进靶基因mRNA降解或者抑制其翻译,从而来调控基因表达[12]。本研究首先通过生物信息学在线软件(targetscan、 PicTar、miRanda)进行预测表明miR-107与VEGFA存在靶向关系,且先前许多文献报道了异常表达的miR-107通过靶向调控VEGFA表达,在人类多种疾病的发生、发展中起重要作用[13-16]。本研究通过RT-qPCR检测了miR-107在卵巢癌组织和正常卵巢组织中的表达情况,发现卵巢癌组织中miR-107的表达显著低于正常卵巢组织,临床病理参数分析显示miR-107的表达水平与卵巢癌患者临床分期及淋巴结转移相关,且相关性分析显示其表达量与VEGFA基因mRNA表达水平呈显著负相关性,这与上面报道的结果相似。我们的结果表明miR-107表达减少可能通过上调VEGFA的表达来增加卵巢癌细胞的侵袭及迁移能力,从而促进卵巢癌的发生和发展。
本研究还采用ROC曲线分析了miR-107表达对卵巢癌的诊断价值,结果表明miR-107对卵巢癌的诊断准确性较高,可作为一个卵巢癌的诊断预测指标。经过分析cut-off值为1.639,其敏感度为94.6%,特异度为76.7%,考虑组织标本的不易获得性,在今后的研究中,将进一步检测卵巢癌患者外周血中miR-107的表达情况,进一步明确外周血中miR-107的表达水平的诊断价值。此外,我们还将在卵巢癌细胞系中进一步验证miR-107与VEGFA的靶向关系。
综上所述,卵巢癌组织中miR-107表达降低可能通过靶向上调VEGFA基因的表达来促进卵巢癌细胞的浸润和转移能力,从而在卵巢癌发生、发展中起作用。因此,进一步探索其在卵巢癌发生、发展中的分子机制,可为卵巢癌的早期诊断、预防及治疗提供新思路。
[1] Chen W,Sun K,Zheng R,et al. Cancer incidence and mortality in China,2014[J]. Chin J Cancer Res,2018,30:1-12.
[2] Jiang X,Tang H,Chen T. Epidemiology of gynecologic cancers in China[J]. J Gynecol Oncol,2018,29(1):e7.
[3] Jang K,Kim M,Gilbert CA,et al. VEGFA activates an epigenetic pathway upregulating ovarian cancer-initiating cells[J]. EMBO Mol Med,2017,9(3):304-318.
[4] Zhao J,Du P,Cui P,et al. LncRNA PVT1 promotes angiogenesis via activating the STAT3/VEGFA axis in gastric cancer[J]. Oncogene,2018,37(30):4094-4109.
[5] Zhao L,Ji G,Le X,et al. An integrated analysis identifies STAT4 as a key regulator of ovarian cancer metastasis[J]. Oncogene,2017,36(24):3384-3396.
[6] Zhao Z,Yang S,Cheng Y,et al. MicroRNA 655 inhibits cell proliferation and invasion in epithelial ovarian cancer by directly targeting vascular endothelial growth factor[J]. Mol Med Rep,2018,18(2):1878-1884.
[7] Donzelli S,Milano E,Pruszko M,et al. Expression of ID4 protein in breast cancer cells induces reprogramming of tumour-associated macrophages[J]. Breast Cancer Res,2018,20(1):59.
[8] Tian QX,Xia SH,Wu YH,et al. Comprehensive analysis of the differential expression profile of microRNAs in missed abortion[J]. Kaohsiung J Med Sci,2020,36(2):114-121.
[9] Zhang L,Chen Y,Li F,et al. Atezolizumab and bevacizumab attenuate cisplatin resistant ovarian cancer cells progression synergistically via suppressing epithelial-mesenchymal transition[J]. Front Immunol,2019,10:867.
[10] Komatsu H,Oishi T,Itamochi H,et al. Serum vascular endothelial growth factor-a as a prognostic biomarker for epithelial ovarian cancer[J]. Int J Gynecol Cancer,2017,27(7):1325-1332.
[11] Maleki P,Sheida SV,Mowla SJ,et al. LINK-A long non-coding RNA and VEGF RNA expression in epithelial ovarian cancer patients[J]. Hum Antibodies,2020,28(3):227-232.
[12] Deb B,Uddin A,Chakraborty S. miRNAs and ovarian cancer:an overview[J]. J Cell Physiol,2018,233(5):3846-3854.
[13] Zhang Z,Wu S,Muhammad S,et al. miR-103/107 promote ER stress-mediated apoptosis via targeting the Wnt3a/β-catenin/ATF6 pathway in preadipocytes[J]. J Lipid Res,2018,59(5):843-853.
[14] Xiao D,Gao HX. Mechanism of miR-107-targeting of regulator of G-protein signaling 4 in hepatocellular carcinoma[J]. Oncol Lett,2019,18(5):5145-5154.
[15] Bao W,Zhang Y,Li S,et al. miR 107 5p promotes tumor proliferation and invasion by targeting estrogen receptor α in endometrial carcinoma[J]. Oncol Rep,2019,41(3):1575-1585.
[16] Ahonen MA,Haridas PAN,Mysore R,et al. miR-107 inhibits CDK6 expression,differentiation,and lipid storage in human adipocytes[J]. Mol Cell Endocrinol,2019,479:110-116.