多囊卵巢综合征(polycystic ovary syndrome,PCOS)是一种临床常见的内分泌妇科疾病,发病率高达10%[1]。PCOS的临床表现主要包括肥胖、胰岛素抵抗和高雄激素血症等主要病理生理学特征[2]。PCOS是临床一种高度异质、病因复杂的疾病,发病机制目前仍然不清楚。随着Kelly等[3]首次报道PCOS患者可能有慢性低度炎症,“炎症学说”在PCOS发病机制中的作用逐渐引起人们的关注,“炎症学说”逐渐成为PCOS研究热点[4-5]。一些专家认为肥胖伴胰岛素抵抗、血脂异常及慢性低度炎症状态是PCOS发生的危险因素。慢性低度炎症,也称为代谢性炎症,是由营养代谢引发的炎症反应,是低于感染性和自身免疫性炎症水平的炎症,无红肿热痛等局部和全身症状,主要表现为急性相反应产物,如C反应蛋白(C-reactive protein,CRP)、白细胞介素6(interleukin-6,IL-6)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)等的增加[6-8]。而代谢调节和生殖的关系亦非常密切,因此炎症反应在作为生殖内分泌代谢异常疾病PCOS中受到广泛关注。Gonzalez等[9]认为炎症可能直接导致PCOS患者发生高雄激素血症。高雄激素血症与慢性低度炎症之间存在密切关系[5,10],表明慢性低度炎症可能在PCOS的发病机制中起重要作用。本研究初步探索超重或者肥胖与PCOS患者临床低度慢性炎症之间的关系,旨在为后续进一步临床实验提供思路和方向。
1 资料与方法
1.1 一般资料 选择2016年10月—2018年5月就诊于黑龙江中医药大学附属第一医院门诊的PCOS患者126例,按体重指数(body mass index,BMI)将患者分为正常组(BMI<23,n=69)和超重组(BMI≥23,n=57)。
本研究经医院伦理委员会批准通过,患者及家属知情同意并签署知情同意书。
1.2 诊断标准、纳入标准及排除标准 PCOS的诊断标准:根据2003年鹿特丹会议制定的标准。纳入标准:符合上述诊断标准;年龄15~35岁。排除标准:患有其他雄激素过多相关的内分泌疾病。
1.3 研究方法 临床采集患者资料,包括身高、年龄、体重、臀围(hip circumference,HC)、腰围(waist circumference,WC)、腰臀比(WHR)=WC(cm)/HC(cm)及BMI=体重(kg)/身高(m2)。于月经周期或者药物撤退出血第3天到第5天上午空腹抽血采集血清及全血,检测指标包括CRP、白细胞计数(white blood cell,WBC)、淋巴细胞数(lymphocyte,LYMPH)、单核细胞数(monocyte,MONO)、中性粒细胞数(neutrophil,NEUT)、嗜碱粒细胞数(basophil,BASO)、嗜酸粒细胞数(eosinophil,EO)、三酰甘油(triglyceride,TG)、总胆固醇(cholesterol total,TC)、低密度脂蛋白胆固醇(low density lipoprotein,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein,HDL-C)、载脂蛋白A(apolipoprotein A,ApoA)、载脂蛋白B(apolipoprotein A,ApoB)、空腹血糖(fasting plasma glucose,FPG)、空腹胰岛素(fasting insulin,FINS)、胰岛素敏感指数(HOMA-IR)=FPG(mmol/L)×FINS(μU /mL)/22.5,睾酮(testosterone,T)、雄烯二酮(androstenedione,AND)、性激素结合雄蛋白(sex hormone binding globulin,SHBG)、雌二醇(estrogen,E2)、黄体生成激素(luteinizing hormone,LH)及卵泡生成素(follicle stimulating hormone,FSH)水平。
1.4 统计学方法 应用SPSS 21.0统计软件分析数据。计量资料比较采用独立样本t检验,计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 两组临床指标比较 超重组重、WC、HC、WHR高于正常组,差异有统计学意义(P<0.05),见表1。
表1 两组临床指标比较
Table 1 Comparison of clinical characteristics
between two groups ![]()
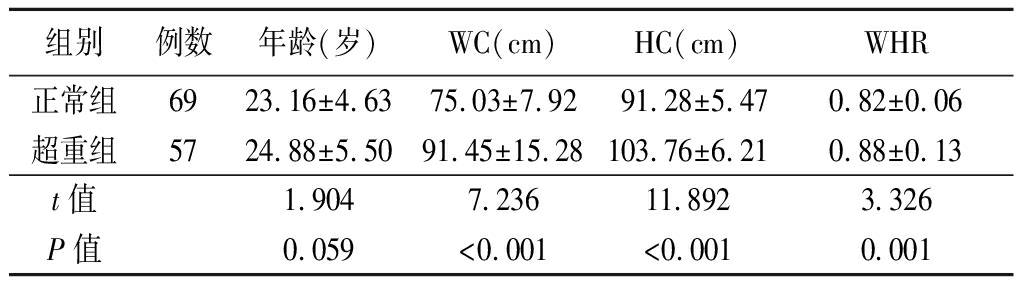
组别例数年龄(岁)WC(cm)HC(cm)WHR正常组6923.16±4.6375.03±7.9291.28±5.470.82±0.06超重组5724.88±5.5091.45±15.28103.76±6.210.88±0.13t值1.9047.23611.8923.326P值0.059<0.001<0.0010.001
2.2 两组性激素和糖脂代谢指标的比较 超重组与正常组比较LH、FSH、LH/FSH、SHBG、HDL-C及Apo-A水平降低,差异有统计学意义(P<0.05),而FPG、FINS、HOMA-IR、TG、TC及LDL-C水平升高,差异有统计学意义(P<0.05),见表2~3。
表2 两组性激素水平比较
Table 2 Comparison of the levels of sex hormone between two groups ![]()
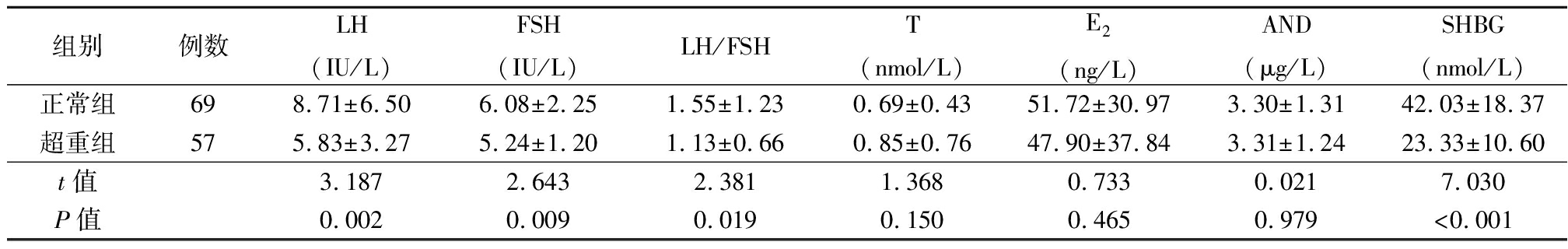
组别例数LH(IU/L)FSH(IU/L)LH/FSHT(nmol/L)E2(ng/L)AND(μg/L)SHBG(nmol/L)正常组698.71±6.506.08±2.251.55±1.230.69±0.4351.72±30.973.30±1.3142.03±18.37超重组575.83±3.275.24±1.201.13±0.660.85±0.7647.90±37.843.31±1.2423.33±10.60t值3.1872.6432.3811.3680.7330.0217.030P值0.0020.0090.0190.1500.4650.979<0.001
表3 两组糖脂代谢指标比较
Table 3 Comparison of the levels of glucose and lipid metabolism between two groups ![]()
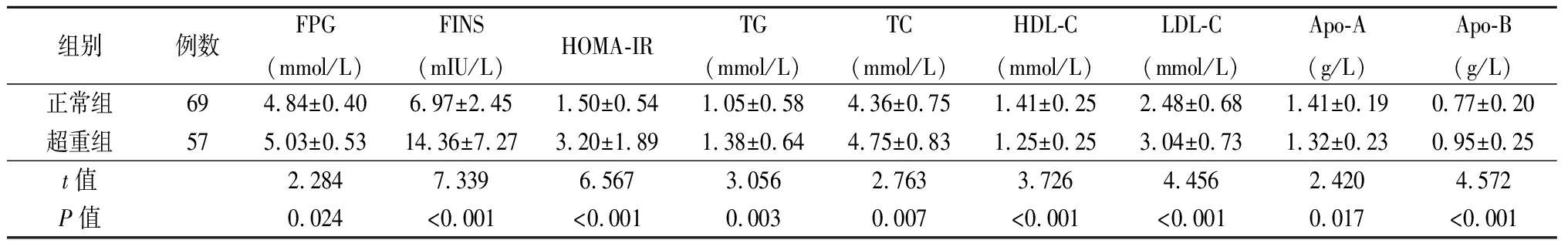
组别例数FPG(mmol/L)FINS(mIU/L)HOMA-IRTG(mmol/L)TC(mmol/L)HDL-C(mmol/L)LDL-C(mmol/L)Apo-A(g/L)Apo-B(g/L)正常组694.84±0.406.97±2.451.50±0.541.05±0.584.36±0.751.41±0.252.48±0.681.41±0.190.77±0.20超重组575.03±0.5314.36±7.273.20±1.891.38±0.644.75±0.831.25±0.253.04±0.731.32±0.230.95±0.25t值2.2847.3396.5673.0562.7633.7264.4562.4204.572P值0.024<0.001<0.0010.0030.007<0.001<0.0010.017<0.001
2.3 两组CRP、白细胞计数等指标比较 超重组与正常组比较WBC、LYMPH、MONO、NEUT水平升高,差异有统计学意义(P<0.05),见表4。
表4 两组CRP、HSCRP、白细胞计数等指标比较
Table 4 Comparison of The levels of CRP,HSCRP,white blood cell count and other indicators between two groups ![]()
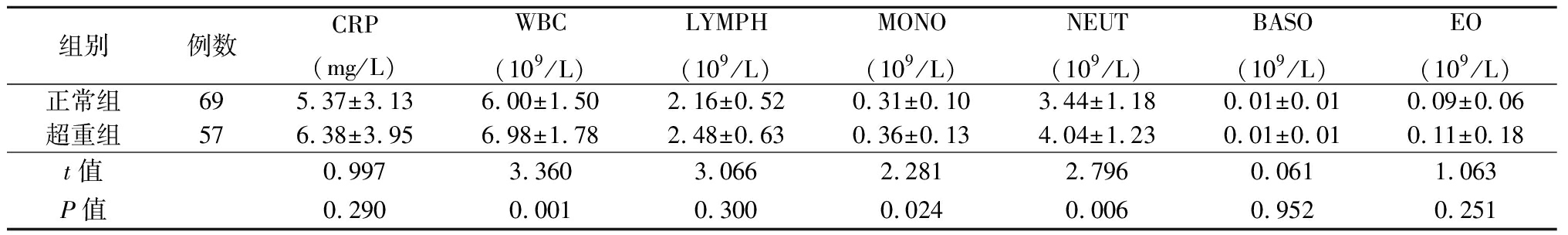
组别例数CRP(mg/L)WBC(109/L)LYMPH(109/L)MONO(109/L)NEUT(109/L)BASO(109/L)EO(109/L)正常组695.37±3.136.00±1.502.16±0.520.31±0.103.44±1.180.01±0.010.09±0.06超重组576.38±3.956.98±1.782.48±0.630.36±0.134.04±1.230.01±0.010.11±0.18t值0.9973.3603.0662.2812.7960.0611.063P值0.2900.0010.3000.0240.0060.9520.251
3 讨 论
根据PCOS的临床表现和发病机制,可分为下丘脑-垂体-卵巢轴紊乱,胰岛素抵抗两种类型,前者以LH水平升高为主要表现,后者以肥胖为主要表现,两种类型在分布上因地域,种族存在明显差异[11-12]。针对中国地区PCOS患者研究显示其主要临床表现为肥胖型[13]。而肥胖与低度慢性炎症之间存在密切关系[14]。作为评价炎症的主要指标-CRP,研究显示肥胖PCOS患者血清CRP水平显著升高,与BMI、WHR等呈正相关[15]。另一项研究表明,PCOS超重患者的WBC、LYMPH、NEUT、MONO以及EO高于体重正常PCOS患者(P<0.05)[16]。本研究结果显示,超重组WBC、LYMPH、MONO、NEUT水平较正常组高,提示超重或者肥胖PCOS患者与机体炎症状态存在关联。
研究认为单核细胞侵入组织,形成淋巴细胞、巨噬细胞,作用于脂肪内,促进脂肪分泌炎症因子,从而诱导胰岛素抵抗发生[16]。另外,超重PCOS患者体重、腰围、臀围、BMI、WHR值较大,表现为明显的中心性肥胖,以及黑棘皮评分增加明显,黑棘皮是高胰岛素血症和胰岛素抵抗的可靠皮肤标志[17]。超重PCOS组患者的空腹血糖,胰岛素以及胰岛素敏感指数,血清SHBG水平均升高,这些改变符合中心性肥胖的临床特征[18],同时超重PCOS组患者TG、TC、LDL-C水平升高,HDL-C、Apo-A水平降低,这些指标的改变,往往预示超重PCOS组患者慢性低度炎症状态,肥胖和胰岛素抵抗会增加远期心血管疾病,2型糖尿病的发生风险增加。有研究报道血脂异常与慢性低度炎症之间也存在密切关系,慢性炎症状态下,可导致集体的动脉粥样硬化,增加了心脑血管疾病的风险[19-21]。本研究结果显示,超重PCOS患者的糖脂代谢水平与炎症因子的水平密切相关。
而超重组的LH/FSH值与体重正常组比较,比值降低,曾有研究表明,与非肥胖型PCOS患者相比,肥胖PCOS患者LH、LH/FSH、E2、SHBG水平降低[22],提示肥胖对于PCOS月经紊乱的影响可能不是独立的影响因素。超重或者肥胖导致PCOS患者糖脂代谢异常甚至慢性低度炎症。
综上所述,PCOS的发病机制难以明确,但是PCOS患者存在低度慢性炎症,这一发病机制的证据正在被逐步证实。PCOS慢性低度炎症的严重程度与超重或者肥胖密切相关。
[1] Bakeer E,Radwan R,El Mandoury A,et al. Anti-Müllerian Hormone as a Diagnostic Marker in Egyptian Infertile Polycystic Ovary Syndrome Females:Correlations with Vitamin D,Total Testosterone,Dyslipidemia and Anthropometric Parameters[J]. J Med Biochem,2018,37(4):448-455.
[2] Shaaban Z,Khoradmehr A,Amiri-Yekta A,et al. Pathophysiologic mechanisms of obesity- and chronic inflammation-related genes in etiology of polycystic ovary syndrome[J]. Iran J Basic Med Sci,2019,22(12):1378-1386.
[3] Kelly CC,Lyall H,Petrie JR,et al. Low grade chronic inflammation in women with polycystic ovarian syndrome[J]. J Clin Endocrinol Metab,2001,86(6):2453-2455.
[4] Popovic M,Sartorius G,Christ-Crain M. Chronic low-grade inflammation in polycystic ovary syndrome:is there a(patho)-physiological role for interleukin-1?[J]. Semin Immunopathol,2019,41(4):447-459.
[5] Shorakae S,Ranasinha S,Abell S,et al. Inter-related effects of insulin resistance,hyperandrogenism,sympathetic dysfunction and chronic inflammation in PCOS[J]. Clin Endocrinol(Oxf),2018,89(5):628-633.
[6] 陈莉,孙梦娇.多囊卵巢综合征胰岛素抵抗与慢性炎症的相关性研究进展[J].中国计划生育学杂志,2018,26(8):750-753.
[7] Won KJ,Eun HJ,Shin KY,et al. High sensitivity C-reactive protein and its relationship with impaired glucose regulation in lean patients with polycystic ovary syndrome[J]. Gynecol Endocrinol,2012,28(4):259-263.
[8] Yilmaz MA,Duran C,Basaran M. The mean platelet volume and neutrophil to lymphocyte ratio in obese and lean patients with polycystic ovary syndrome[J]. J Endocrinol Invest,2015,39(1):45-53.
[9] Gonzalez F. Inflammation in polycystic ovary syndrome:underpinning of insulin resistance and ovarian dysfunction[J]. Steroids,2012,77(4):300-305.
[10] Wang Y,Huang R,Li X,et al. High concentration of chemerin caused by ovarian hyperandrogenism may lead to poor IVF outcome in polycystic ovary syndrome:a pilot study[J]. Gynecol Endocrinol,2019,35(12):1072-1077.
[11] 王莉,尹利荣,徐燕颖,等.肥胖与非肥胖型多囊卵巢综合征患者血清胃促生长素分泌特点与发病机制探讨[J].天津医药,2013,41(5):416-418.
[12] 李轶,李瑞岐,欧颂邦,等.高雄激素和非高雄激素型多囊卵巢综合征患者血清抗苗勒管激素分泌特点及诊断效能比较[J].实用妇产科杂志,2014,30(2):111-115.
[13] 陈子江,石玉华,郭萌,等.大样本中国人PCOS临床特点分析[J].山东医药,2008,48(11):4-6.
[14] 木良善,赵越,乔杰.肥胖与多囊卵巢综合征的关联性及潜在机制[J].中华生殖与避孕杂志,2018,38(4):343.
[15] Durmus U,Duran C,Ecirli S. Visceral adiposity index levels in overweight and/or obese,and non-obese patients with polycystic ovary syndrome and its relationship with metabolic and inflammatory parameters[J]. J Endocrinological Invest,2017,40(5):487-497.
[16] 王文娟,吴海波,杨琴,等.PCOS患者外周血白细胞计数变化的临床意义[J].现代生物医学进展,2016,16(31):6118-6120.
[17] 尚晨,龚凤英,王林杰.肥胖相关黑棘皮病的发病机制[J].国际内分泌代谢杂志,2016,36(6):416-419.
[18] 蒋婷婷,潘景,苏莹,等脂肪因子Vaspin、Apelin及瘦素与多囊卵巢综合征的相关性[J].昆明医科大学学报,2016,37(10):41-46.
[19] 张小平,赵家宁,余海珍,等.POCS合并亚临床甲状腺功能减退症患者激素和糖脂水平的变化[J].山西医科大学学报,2015,46(9):920-923.
[20] 薛艳军,谢华,孙美灵,等.PCOS合并胰岛素抵抗的血脂代谢异常特点分析[J].中国现代医学杂志,2014,24(25):94-98.
[21] Talbott EO,Zborowski JV,Sutton-Tyrrell K,et al. Cardiovascular risk in women with polycystic ovary syndrome[J]. Obstet Gynecol Clin North Am,2001,28(1):111-133.
[22] 李昕,林金芳.肥胖型多囊卵巢综合征患者临床及内分泌代谢特征的研究[J].中华医学杂志,2005,85(46):3266-3271.