肛瘘是我国肛门直肠疾病中最常见的疾病之一,而复杂型肛瘘占所有肛瘘的12%~15%,外科手术是其主要治疗方法,但因肛周盆腔解剖结构复杂,且瘘管走行复杂,导致复杂型肛瘘影像学诊断易遗漏隐匿性脓肿、分支瘘管等,致使术后复发率高达10%[1-4]。目前术前准确定位内口位置,明确瘘管数目、走行及与肛门括约肌的关系,已成为了临床正确规划手术治疗方式、改善预后的关键。以往临床肛瘘诊断多采用瘘管造影,但其对部分复杂型肛瘘某些细小内瘘口的显影效果欠佳,且存在一定电离辐射,故检测方式有待进一步优化。近年来,磁共振成像(magnetic resonance imaging,MRI)已成为了肛瘘术前评估及术后复发监测的金标准,但常规MRI主要依赖病灶形态学和信号特点来评估病变活动性,判断结果受制于各个操作者的临床经验及诊断水平,客观统一的量化标准缺乏,精确度及特异度欠佳[5-6]。而动态增强磁共振成像(dynamic contrast-enhanced magnetic resonance imaging,DCE-MRI)可有效弥补常规MRI的不足,通过清晰显示微结构信息,全面反映病变解剖形态学改变和功能活动性,已被证实在直肠肛管疾病诊断中具有重要作用,但目前鲜有报道分析其联合MRI钆剂瘘管造影诊断高位复杂型肛瘘患者细小内瘘口、分支瘘管与手术结果的一致性[7]。为此,本研究通过分析90例高位复杂型肛瘘患者DCE-MRI及MRI钆剂瘘管造影+DCE-MRI诊断的影像学资料并与手术诊断结果进行比较,从而判断二者诊断高位复杂型肛瘘患者主瘘管、分支瘘管、主内瘘口、细小内瘘口与手术结果的一致性,现报告如下。
1 资料与方法
1.1 一般资料 选取2017年10月—2020年10月安徽省宁国市人民医院收治的高位复杂型肛瘘患者90例,男性46例,女性44例,年龄18~65岁,平均(38.45±5.92)岁。纳入标准:①MRI平扫及直肠指检确诊为高位复杂型肛瘘(MRI分型为Ⅵ级,经肛提肌或肛提肌上瘘,伴脓肿或继发瘘管),细小内瘘口及细小分支瘘管显示不清;②年龄≥18岁,术前均顺利完成常规MRI及DCE-MRI、MRI钆剂瘘管造影+DCE-MRI检查;③临床病历资料完整。排除标准:①低位肛瘘或单纯性肛周脓肿;②恶性肿瘤;③MRI检查禁忌证,如患有幽闭恐惧症、体内有金属植入物、安装有心脏起搏器等;④对比剂钆喷酸葡胺过敏;⑤因运动伪影或其他因素致使MRI图像不清晰。 本研究经医院医学伦理委员会审批通过。
1.2 方法
1.2.1 MRI钆剂瘘管造影+DCE-MRI扫描方法 ①仪器及扫描方法:使用EZZENZA 1.5T MRI,采用8通道相控阵盆腔线圈,患者选择仰卧位、头先进的扫描方式,以耻骨联合处为磁场中心,先行矢状位扫描,根据矢状位T2加权图像(T2 weighted images,T2WI)判断肛管走向,后行平行和垂直于肛管长轴的冠状位、横轴位扫描。高位复杂型肛瘘先行MRI平扫,再采用高压注射器(美国MEDRAD公司)经上肢静脉注射氯化钠溶液20 mL+钆喷酸葡胺注射液(北京北陆药业股份有限公司,国药准字H10960045,剂量0.2 mmol/kg,注射流率2 mL/s)行MRI扫描。30 min后向肛瘘瘘管注入氯化钠溶液16 mL+钆喷酸葡胺注射液0.2 mmol/kg,同时行DCE-MRI扫描。②扫描序列:平扫序列包括T1加权图像(T1 weighted images,T1WI)横断位、T2WI冠状位抑脂、T2WI横断抑脂和T2WI矢状位;DCE-MRI扫描序列包括T1WI-Vibe序列横断位[横轴位动态增强扫描10期,每期扫描时间30 s,共300 s,扫描视野(field of view,FOV)38 cm×30 cm,层厚1.2 mm],结束动态扫描后再行横轴位、冠状位抑脂增强;MRI钆剂瘘管造影+DCE-MRI序列包括T1WI轴位、T1WI抑脂、冠状位Vibe序列、矢状位抑脂。③图像分析:由2名经验丰富的影像科副主任医师以双盲法阅片,分别描述主瘘管和分支瘘管走行方向并测量瘘管直径,根据截石位时钟定位法判断内瘘口和细小内瘘口位置,分析DCE-MRI、MRI钆剂瘘管造影+DCE-MRI对高位复杂型肛瘘患者主瘘管、>5 mm分支瘘管、<5 mm分支瘘管、主内瘘口和细小内瘘口的显示情况。
1.2.2 手术病理诊断 90例患者在MRI钆剂瘘管造影+DCE-MRI检查7 d内接受手术治疗,手术时医师根据MRI钆剂瘘管造影+DCE-MRI图像结果,综合探针检查及亚甲蓝染色等方法探查瘘管、瘘口等情况,并以此为最终病理诊断结果。
1.3 统计学方法 应用SPSS 22.0统计软件分析数据。在术后病理结果为金标准,采用四格表的诊断性试验分析法计算敏感度、特异度、准确度、阳性预测值、阴性预测值,一致性分析采用Kappa检验,Kappa指数>0.74为一致性好,0.4~0.75为一致性较好,<0.4为一致性差。P<0.05为差异有统计学意义。
2 结 果
2.1 高位复杂型肛瘘DCE-MRI、MRI钆剂瘘管造影+DCE-MRI诊断结果与手术病理诊断结果比较 手术病理诊断结果显示,高位复杂型肛瘘患者主瘘管95个,>5 mm分支瘘管162个,<5 mm分支瘘管229个,主内瘘口99个,细小内瘘口181个。DCE-MRI诊断结果显示,高位复杂型肛瘘患者主瘘管91个,>5 mm分支瘘管135个,<5 mm分支瘘管121个,主内瘘口81个,细小内瘘口27个。MRI钆剂瘘管造影+DCE-MRI诊断结果显示,高位复杂型肛瘘患者主瘘管92个,>5 mm分支瘘管137个,<5 mm分支瘘管154个,主内瘘口87个,细小内瘘口103个。
2.2 诊断结果的一致性分析 DCE-MRI诊断高位复杂型肛瘘患者主瘘管、>5 mm分支瘘管、<5 mm分支瘘管和主内瘘口的准确率分别为97.89%、88.27%、71.62%、85.86%,与手术病理诊断一致性检验的Kappa值分别为0.657、0.436、0.422、0.454(P<0.05);DCE-MRI诊断高位复杂型肛瘘患者细小内瘘口的准确率为29.83%,与手术病理诊断一致性检验的Kappa值为0.040(P>0.05),见表1。联合诊断高位复杂型肛瘘患者主瘘管、>5 mm分支瘘管、<5 mm分支瘘管、主内瘘口和细小内瘘口的准确率分别为98.95%、89.51%、75.55%、89.90%、71.82%,与手术病理诊断一致性检验的Kappa值分别为0.795、0.467、0.433、0.446、0.380(P<0.05),见表2。
表1 高位复杂型肛瘘DCE-MRI诊断结果与手术病理诊断结果的一致性分析
Table 1 Consistency analysis of DCE-MRI diagnosis results and surgical pathological diagnosis
results of high complex anal fistula
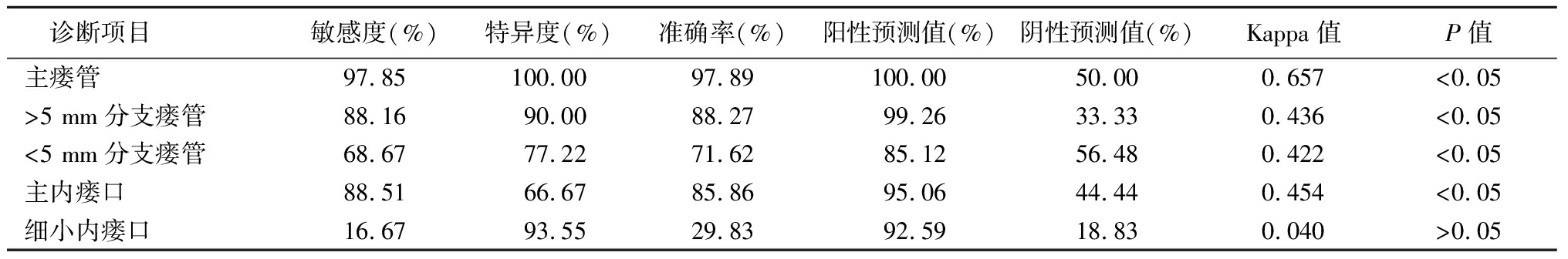
诊断项目敏感度(%)特异度(%)准确率(%)阳性预测值(%)阴性预测值(%)Kappa值P值主瘘管97.85100.0097.89100.0050.000.657<0.05>5 mm分支瘘管88.1690.0088.2799.2633.330.436<0.05<5 mm分支瘘管68.6777.2271.6285.1256.480.422<0.05主内瘘口88.5166.6785.8695.0644.440.454<0.05细小内瘘口16.6793.5529.8392.5918.830.040>0.05
表2 MRI钆剂瘘管造影+DCE-MRI诊断结果与手术病理诊断结果的一致性分析
Table 2 Consistency analysis of MRI gadolinium fistulography+DCE-MRI diagnosis results and surgical results
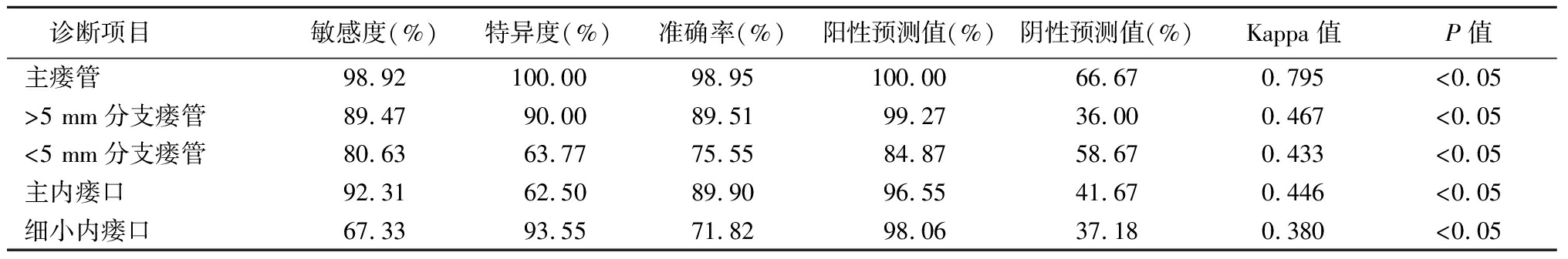
诊断项目敏感度(%)特异度(%)准确率(%)阳性预测值(%)阴性预测值(%)Kappa值P值主瘘管98.92100.0098.95100.0066.670.795<0.05>5 mm分支瘘管89.4790.0089.5199.2736.000.467<0.05<5 mm分支瘘管80.6363.7775.5584.8758.670.433<0.05主内瘘口92.3162.5089.9096.5541.670.446<0.05细小内瘘口67.3393.5571.8298.0637.180.380<0.05
3 讨 论
高位复杂型肛瘘是肛瘘中最严重棘手的情况,常须通过手术治疗,但因存在瘘管和支管多、瘘道行走迂曲、存在继发性和假性闭合的内口等问题致使手术治疗也难以彻底治愈,术后复发率偏高,故术前准确鉴别肛瘘类型、明确瘘道走行与肛门括约肌的位置关系、正确规划手术治疗方式尤为重要[8-11]。目前肛瘘影像学检查以X线瘘管造影、电子计算机断层扫描、肛管内超声、MRI等技术为主,而X线瘘管造影、电子计算机断层扫描等对细小瘘管及周围组织解剖结构显影欠佳;直肠肛管腔内超声属侵入性检查,显示复杂性肛瘘的能力欠缺,无法准确分辨瘢痕与瘘管,尤其针对曾行肛瘘手术的患者,该检查往往会将肛瘘愈合后的瘢痕误诊为瘘管,故临床推广受限[12-14]。
目前MRI已成为高位复杂型肛瘘术前检查的重要手段,具有无辐射损伤、软组织分辨力高、可多参数多方位成像等优势,可综合评估主瘘管、分支瘘管及内瘘口、细小内瘘口、分隔脓肿,在高位复杂型肛瘘术前诊断中意义重大[15]。但以往报道表明,对于高位复杂型肛瘘患者,细小分支瘘管、瘘口漏诊情况时有发生[16-18]。另外,不同患者肛管黏膜层厚度不同,部分黏膜层增厚的肛管肌层内存在细小血管,扫描呈T2抑脂和T1增强点状、条状高信号,类似于肛瘘内口信号,易引起细小瘘管和内瘘口漏诊;此外,复发肛瘘相比新发肛瘘在内口解剖结构方面更加复杂,评估难度高。Waheed等[19]报道MRI瘘管造影联合DCE-MRI诊断可有效提高高位复杂型肛瘘患者瘘管、内口检出率。另有报道也证实MRI钆剂瘘管造影+DCE-MRI在高位复杂型肛瘘患者术前细小分支瘘管及瘘口评估中具有重要指导意义[20-21]。本研究结果显示,MRI钆剂瘘管造影+DCE-MRI诊断的准确率分别为98.95%、89.51%、75.55%、89.90%、71.82%,与手术病理诊断一致性检验的Kappa值分别为0.795、0.467、0.433、0.446、0.380,均明显高于单纯DCE-MRI诊断,证实MRI钆剂瘘管造影联合DCE-MRI技术在高位复杂型肛瘘术前评估中具有重要应用价值,与上述报道相似。分析原因,通过MRI钆剂瘘管造影+DCE-MRI扫描能清晰显示瘘管与肛门周围肌肉、肛管周围组织结构、肛周间隙的关系,直观反映瘘管走行,全面评估主瘘管与括约肌间的关系、内瘘口位置、主内瘘口对侧象限情况及脓肿周围细小结构,准确诊断主瘘管、分支瘘管、主内瘘口和细小内瘘口,与临床术后结果高度一致。对于MRI钆剂瘘管造影+DCE-MRI扫描,可先行冠状位扫描探查主瘘管与括约肌之间的关系,若主瘘管走行于内外括约肌外,需注意主瘘管穿通内括约肌具体位置;再行横断位扫描探查内瘘口位置,通常主瘘管穿通内括约肌后会顺着肛管直肠周围间隙走行一段距离后形成多个内瘘口,须注意主内瘘口对侧象限具体情况,主要因复杂性肛瘘内口形成后细小分支瘘管会向6点位置延伸,后在对侧象限形成细小分支内瘘口;其次,详细观察脓肿周围细小结构,多因脓肿反复发作后周围会形成多个细小分支瘘管;针对术后复发的高位复杂型肛瘘,须仔细探查DCE-MRI信号改变情况,准确区分新生瘘口与原有瘘口。
综上所述,MRI钆剂瘘管造影联合DCE-MRI技术在高位复杂型肛瘘术前评估中价值高,对主瘘管、分支瘘管、主内瘘口和细小内瘘口的诊断准确率优于单纯DCE-MRI诊断,临床应引起足够重视。
[1] 樊文彬,侯艳梅,赵安琪,等.肛瘘诊疗新进展及实用性探讨[J].中国普通外科杂志,2018,27(12):1603-1608.
[2] Emile SH,Khan SM,Adejumo A,et al. Ligation of intersphincteric fistula tract(LIFT) in treatment of anal fistula: An updated systematic review,meta-analysis,and meta-regression of the predictors of failure[J]. Surgery,2020,167(2):484-492.
[3] Hokkanen SR,Boxall N,Khalid JM,et al. Prevalence of anal fistula in the United Kingdom[J]. World J Clin Cases,2019,7(14):1795-1804.
[4] Schlichtemeier S,Tou S. Treatment for complex anal fistula,are we any wiser?[J]. Colorectal Dis,2018,20(12):1067-1068.
[5] 阮卫锋,冯庆瑜,李焯洪,等.磁共振成像不同扫描序列诊断肛瘘的价值研究[J].中国CT和MRI杂志,2018,16(7):136-139.
[6] 张佳文,黄斯灵,刘扬,等.磁共振三维成像3D-SPACE-STIR,3D-SPACE-T2WI序列及图像融合技术对复杂性肛瘘的诊断价值[J].临床放射学杂志,2020,39(3):501-505.
[7] 唐晓雯,王中秋.MRI技术在复杂型肛瘘诊断中的应用进展[J].放射学实践,2016,31(11):1105-1109.
[8] 陈希琳,冯六泉,姜国丹,等.肛瘘的诊治专家共识(2020版)[J].实用临床医药杂志,2020,24(17):1-7.
[9] 张梦慈,乔立超,祝新,等.MRI检查在英夫利昔单克隆抗体联合挂线治疗克罗恩病肛瘘疗效评估中的应用价值及深度愈合影响因素分析[J].中华消化外科杂志,2019,18(3):279-284.
[10] 徐慧磊,张永安,翟敏,等.开窗留桥改道术治疗复杂性肛瘘的临床观察[J].实用临床医药杂志,2018,22(1):107-110.
[11] 金玉明,黄婷,洪桂荣.经直肠腔内超声诊断肛瘘临床价值[J].中国超声医学杂志,2019,35(10):940-942.
[12] 张颖,赵世芬,张春爽.经直肠超声与高频超声联合诊断复杂性肛瘘的临床价值分析[J].结直肠肛门外科,2018,24(5):500-503.
[13] 刘得超,李文儒,王馨华,等.肛瘘磁共振成像分型[J].中华胃肠外科杂志,2018,21(12):1391-1395.
[14] 杨来华,吴如雷,符昕,等.高分辨率MRI-T_2加权成像联合扩散加权成像对肛瘘及其活动性的评价[J].实用医学杂志,2018,34(8):1364-1367.
[15] 李忠华,路通,苏永红,等.肛瘘磁共振技术的应用与研究进展[J].中国现代普通外科进展,2019,22(7):573-575.
[16] 陶禹,韩加刚,王振军,等.肛瘘栓填塞治疗经括约肌型肛瘘的长期疗效及预后影响因素分析[J].中华胃肠外科杂志,2020,23(1):71-75.
[17] 尹玉锑,房文辉,牛忠宝,等.保留括约肌挂线法与瘘管切除术治疗对复杂性肛瘘患者近期疗效愈合时间及并发症的影响[J].河北医学,2019,25(6):1038-1041.
[18] 许顺.切开挂线对口引流术对高位复杂性肛瘘患者术后疼痛程度改善及肛肠动力学的影响分析研究[J].中国全科医学,2019,22(S2):47-49.
[19] Waheed KB,Shah WJ,Altaf B,et al. Magnetic resonance imaging findings in patients with initial manifestations of perianal fistulas[J]. Ann Saudi Med,2020,40(1):42-48.
[20] Thipphavong S,Costa AF,Ali HA,et al. Structured reporting of MRI for perianal fistula[J]. Abdom Radiol(NY),2019,44(4):1295-1305.
[21] Konan A,Onur MR,Özmen MN.The contribution of preoperative MRI to the surgical management of anal fistulas[J]. Diagn Interv Radiol,2018,24(6):321-327.