干细胞治疗已成为近年来研究的热点[1],研究显示干细胞移植能通过分化[2-3]或旁分泌功能[4-6]促进组织修复与再生。阴道缺失是由先天性或获得性疾病引起的。阴道重建是解决这些患者性生活和性角色的主要方法[7-8]。本课题组的前期研究显示:小肠黏膜下基质重建大鼠阴道后1个月阴道上皮再生,3个月才有较明显的阴道平滑肌再生[9-10],因此干细胞标记至少要维持3个月才能满足研究的需要。氯甲基苯甲酰胺(chloromethyl-benzamidodialkylcarbocyanine,CM-DiI)是一种比较稳定的亲脂性羰花青膜荧光染料[7],但膜荧光染料存在信号衰减现象,干细胞用CM-DiI标记后荧光信号的强度及持续时间是否适合均尚待研究。
1 材 料 与 方 法
1.1 实验动物及主要试剂 Sprague-Dawley大鼠(河北省实验动物中心),DMEM/F12 培养基(Hyclone), 胎牛血清(Hyclone),胰蛋白酶溶液(0.25%Trypsin/1 mmol/L EDTA) (GIBICO),L-谷氨酰胺(Sangon),青霉素钠和链霉素钠(华北制药),四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT)(Sigma)及CM-DiI( Molecular Probe) 。
1.2 大鼠骨髓间充质干细胞(bone marrow stem cells,BMSCs)原代培养 颈椎脱臼法处死2~5周的Sprague-Dawley大鼠。 在75%的乙醇中浸泡5 min后,解剖分离出股骨和胫骨,并在无菌条件下仔细地清除黏附组织。用DMEM/F-12培养基(HyClone)冲洗骨髓腔并用200目尼龙滤器过滤去除较大组织后,将分离的骨髓细胞离心,冲洗,再离心,重悬后接种于25 cm2细胞培养瓶中,于37 ℃,5%CO2的培养箱中培养,72 h后更换培养基,此后每隔1 d更换一次。 细胞生长达到70%~80%汇合后,用0.25%胰蛋白酶/ EDTA(Gibco,赛默飞世尔)处理,收集细胞并用DMEM/F-12培养基传代培养。收集第3代BMSCs备用。
1.3 大鼠BMSCs的标记 将CM-DiI配制成浓度为1 mol/L的储存液,用基础培养基将储存液稀释成2.5 μmol/L,5 μmol/L,10 μmol/L和20 μmol/L的标记液。3代BMSCs消化后离心,弃去上清液,PBS洗涤一次,计数细胞,根据细胞数添加适量的细胞标记液(1×106细胞∶1 mL细胞标记液),移液器吹打充分混合后避光孵育,37 ℃ 5 min,4 ℃ 15 min,离心弃上清,PBS洗涤后再次离心,培养基重悬细胞,将玻片放置于24孔板底部,细胞悬液接种于24孔板中,24 h后取出玻片,PBS冲洗后甲醛固定DAPI染色,荧光显微镜观察并拍照。
1.4 标记效率的计算 在荧光显微镜100倍视野下随机选择5个不重合的视野,计数细胞总数及未标记的细胞数,以计算标记效率:(细胞总数-未标记细胞数)/细胞总数×100%。
1.5 细胞增殖能力检测 将不同浓度标记后的细胞按5×104/mL的浓度,分别滴入7个96孔板,每孔100 μL,每板3个复孔,每板均设调零孔。接种24 h后更换培养基,此后每隔一天更换一次。接种后1~7 d每天取出一板测量,每孔加入20 μL MTT溶液(5 g/L),细胞培养箱中孵育4 h后取出,吸去上清液,每孔加入200 μL DMSO,室温下微量振荡器振荡10 min。酶标仪检测各孔吸光度OD值(λ=490 nm),经调零孔校正后结果取平均值,绘制生长曲线。
1.6 BMSCs与小肠黏膜下基质(small intestinal submucosa,SIS)复合 将前期实验制备的SIS剪成2 cm×2 cm的正方形,预湿后置于12孔板中,3代BMSCs标记后以5×105个/cm2的浓度接种于SIS上,复合培养24 h后用于移植[10]。
1.7 大鼠阴道重建动物模型的构建 体重200~250 g的成年雌性Sprague-Dawley大鼠用于阴道重建。1%戊巴比妥钠(30~50 mg/kg)腹腔注射麻醉后将大鼠仰卧位固定于手术台上。在阴道黏膜下注入肾上腺素生理盐水形成水垫,从阴道黏膜和会阴皮肤连接处剪开,牵拉阴道黏膜将阴道黏膜从阴道口向上分离至阴道穹处,切除整个阴道,术中避免尿道和直肠的损伤。将生理盐水预湿的SIS包裹于模具上(自制阴道模具,长13 mm,外径4 mm)再置入原阴道处,上端固定于宫颈处,下端缝合于阴道外口。术后大鼠分笼喂养,术后3 d内抗生素预防感染。术后14 d,1个月,3个月处死大鼠,取阴道组织做冰冻切片,荧光显微镜观察。
1.8 统计学方法 应用SPSS 17.0统计软件进行数据分析。计量资料采用单因素方差分析。P<0.05 为差异有统计学意义。
2 结 果
2.1 大鼠BMSCs的形态学观察 培养72 h后轻轻晃动培养瓶可见瓶底有散在分布的少量贴壁细胞,呈长梭型或多角形,第5天时形成细胞集落,贴壁细胞明显增多,继续培养至7~10 d细胞融合达80%以上。传代后细胞生长加快,4~6 d即可传代,至第3代细胞形态均一,呈漩涡状或束状生长(图1)。
2.2 CM-DiI标记大鼠BMSCs及标记率 CM-DiI标记后,干细胞胞膜发出橙黄色荧光,见图2,各浓度的标记效率都可达98%以上,各组间差异无统计学意义(P>0.05),但荧光强度随浓度的增加而变强。
2.3 不同标记浓度对干细胞增殖的影响 2.5 μmol/L及5 μmol/L标记后的生长曲线与对照组无明显区别,10 μmol/L及20 μmol/L标记后生长曲线较对照组稍降低,见图3。
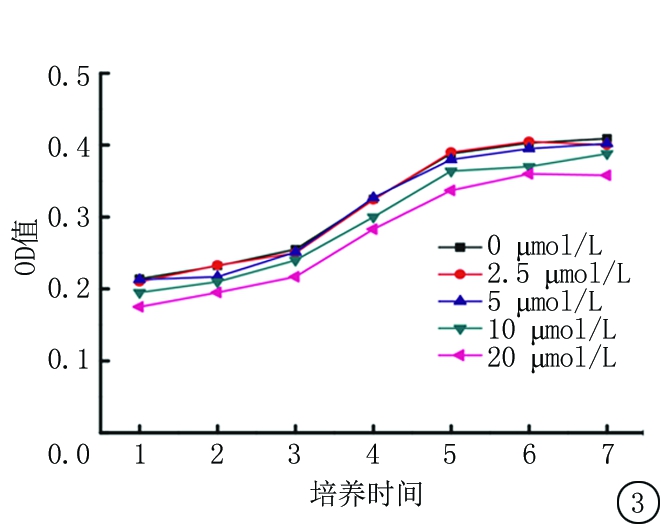
图3 大鼠BMSCs不同浓度CM-Dil标记后的生长曲线
Figure 3 Growth curve of rat bone marrow mesenchymal stem cells labeled with different concentrations of CM-Dil
2.4 干细胞的示踪 橙黄色的BMSCs在术后14 d,1个月,3个月的重建阴道组织中均可见到,随时间延长荧光细胞数量减少,但不论任何时间段橙黄色的BMSCs均主要分布在重建阴道的深部,浅层及上皮中未见橙黄色的BMSCs。DAPI染色后高倍镜下可见清晰的细胞结构,蓝色的细胞核及周围橙黄色的细胞膜,见图4。
3 讨 论
用于干细胞标记的方法比较多,常用的有以下几种,①核酸标记:常用的有5-溴脱氧尿嘧啶核苷(bromodeoxyuridine,BrdU)和5-乙炔基-2′-脱氧尿苷(5-Ethynyl-2′-deoxyuridine,EdU),在细胞DNA合成过程中它们掺入到DNA序列里,应用相应抗体检测被标记细胞。②Y染色体标记:将雄性供体细胞移植到雌性受体中,再使用相应的方法如PCR或原位杂交来检测Y染色体长臂末端的特定重复序列,从而跟踪这些细胞。③磁共振(magnetic resonance,MR)对比剂标记:细胞通过吞噬MR 对比剂[11](如超顺磁氧化铁颗粒)获得标记,然后利用磁共振成像(magnetic resonance imaging,MRI)追踪细胞。④报告基因标记[12]:报告基因是一段DNA序列,整合到宿主细胞基因组中后表达相应蛋白以标记细胞。根据标记后检测方法的不同报告基因又分为MRI报告基因:如铁稳态蛋白;生物发光报告基因:如荧光素酶;荧光呈像报告基因:如绿色荧光蛋白等。⑤荧光染料标记:分为膜荧光染料和核荧光染料。膜荧光染料主要有CM-DiI、PKH26等,他们通过嵌入细胞膜内并侧向扩散使细胞膜着色;核荧光染料主要有DAPI、Hoechst等,其染色原理是与细胞核内双链DNA的AT碱基牢固结合,然后通过紫外光激发后发出荧光。
细胞标记理想的状态是标记后不影响细胞的活性,对细胞无基因修饰,移植后可定量分析,移植细胞分裂后标记不减少,移植细胞死亡后标记不被吞噬,移植后数月甚至数年后仍可检测。目前尚无一种方法能满足这些要求,各种标记方法均有一定的局限性。核酸标记如brdu,可能被周围细胞吞噬造成假阳性,而EdU除了假阳性影响外,有的学者认为它可能影响干细胞活性,不推荐其用于干细胞示标记。Y染色体标记的优势在于移植前无需处理,可用于长期观察,能够应用实时定量RT-PCR检测Y染色体性别决定区(SRY)基因观测移植细胞的存活量[13], 但原位杂交显示定植位置时操作比较复杂,并且只有切片正好通过Y染色体时才能显示,可能造成假阴性结果,不太适合干细胞移植后定位及分化研究。磁共振对比剂标记的优势在于可用于活体示踪并对迁移路线进行确认,但是对设备要求比较高。报告基因标记通过转染的方法把报告基因整合到宿主基因组中,虽然标记比较稳定,但操作复杂,转染效率不稳定,不适合大量细胞的标记。荧光染料标记最突出的优点是操作简单,荧光信号强。虽然随着细胞的分裂荧光信号有衰减现象,但还是可以在一定时间段内检测到荧光信号。文献报道CM-dil标记的细胞可在1个月[14],8周后被检测到,甚至6个月后仍可检测到荧光信号[15-16]。综合比较各种标记方法后选用CM-DiI荧光染料进行标记。本研究显示,各浓度的标记效率均可达98%以上,2.5 μmol/L及5 μmol/L标记后的生长曲线与对照组无明显区别,10 μmol/L及20 μmol/L标记后生长曲线较对照组稍降低,因此5 μmol/L的标记浓度更适合用于干细胞标记。
阴道重建术是解决无阴道患者性生活和性角色的主要方法,目前常用的手术方法如腹膜代阴道[17],结肠代阴道[18]均存在各种不足。近年来组织工程学蓬勃发展[19-20],重建一个接近正常阴道形态和功能的阴道成为可能。干细胞复合小肠黏膜下基质重建阴道是否能促进重建阴道各个组织成分的再生,以及其机制尚不明了,这些研究都需要明确干细胞移植后的定位。本研究显示标记后的干细胞与SIS复合后用于大鼠阴道重建,术后14 d、1个月、3个月重建阴道组织中均可见橙黄色的BMSCs,橙黄色的BMSCs主要分布在深层组织中,在术后3个月仍可见标记的干细胞,有助于研究干细胞向阴道平滑肌及神经的分化,能够满足阴道重建的基础研究的需要。
综上所述, 本研究显示5 μmol/L的CM-DiI可能是BMSCs的最佳标记浓度,体内研究显示干细胞至少能存活至移植后12周,为后期进一步研究干细胞对重建阴道的影响奠定了基础。(本文图见封三)
[1] Kharazi U,Badalzadeh R. A review on the stem cell therapy and an introduction to exosomes as a new tool in reproductive medicine[J]. Reprod Biol,2020,20(4):447-459.
[2] Zhang H,Zhang J,Huang X,et al. The methods and mechanisms to differentiate endothelial-like cells and smooth muscle cells from mesenchymal stem cells for vascularization in vaginal reconstruction[J]. Mol Biotechnol,2018,60(6):396-411.
[3] Jung D,Xiong J,Ye M,et al. In vitro differentiation of human embryonic stem cells into ovarian follicle-like cells[J]. Nat Commun,2017,8:15680.
[4] Chen Q,Liu Y,Ding X,et al. Bone marrow mesenchymal stem cell-secreted exosomes carrying microRNA-125b protect against myocardial ischemia reperfusion injury via targeting SIRT7[J]. Mol Cell Biochem,2020,465(1/2):103-114.
[5] Xu N,Shao Y,Ye K,et al. Mesenchymal stem cell-derived exosomes attenuate phosgene-induced acute lung injury in rats[J]. Inhal Toxicol,2019,31(2):52-60.
[6] Li W,Liu Y,Zhang P,et al. Tissue-Engineered Bone Immobilized with Human Adipose Stem Cells-Derived Exosomes Promotes Bone Regeneration[J]. ACS Appl Mater Interfaces,2018,10(6):5240-5254.
[7] 于欢,郝飞,刘美辰,等.CM-DiI标记的BMSCs在实验性自身免疫性脑脊髓炎大鼠的体内示踪分布[J].基础医学与临床,2019,39(9):1270-1276.
[8] 刘义彬,闫璐,张敬坤,等.MRKH综合征的诊治[J].中国实用妇科与产科杂志,2018,34(4):377-381.
[9] Zhang N,Qin X,Zhang J,et al.Bone marrow mesenchymal stem cells accelerate the morphological and functional recovery of neovaginas[J].Artif Organs,2018,42(12):1206-1215.
[10] 张宁,秦锡静,朱玉林,等.不同处理方法对骨髓间充质干细胞与小肠黏膜下基质复合效果的影响[J].河北医科大学学报,2020,41(4):466-470.
[11] Kremen TJ,Bez M,Sheyn D,et al. In vivo imaging of exogenous progenitor cells in tendon regeneration via superparamagnetic iron oixide particles[J]. Am J Sports Med,2019,47(11):2737-2744.
[12] Jurgielewicz P,Harmsen S,Wei E,et al. New imaging probes to track cell fate:reporter genes in stem cell research[J]. Cell Mol Life Sci,2017,74(24):4455-4469.
[13] 金培峰,王业焕,姜盛,等.心肌梗死后不同移植部位对移植后骨髓间充质干细胞的影响[J].温州医科大学学报,2018,48(7):485-489.
[14] Noory P,Navid S,Zanganeh BM,et al. Human menstrual blood stem cell-derived granulosa cells participate in ovarian follicle formation in a rat model of premature ovarian failure in vivo[J]. Cell Reprogram,2019,21(5):249-259.
[15] Zhang ZY,Liu K,Xing XY,et al. Differentiation of human umblical cord mesenchymal stem cells into Leydig cells in the rat testis interstitium:an experimental study[J]. Zhonghua Nan Ke Xue,2016,22(8):680-685.
[16] 尹飞,郭丽,孟春阳,等.CM-Dil体外标记骨髓间充质干细胞及其在烧伤大鼠模型肠组织内的示踪[J].吉林大学学报(医学版),2012,38(2):211-215.
[17] Wu J,Guo R,Chu D,et al. Comparison of two techniques of laparoscopy-assisted peritoneal vaginoplasty[J]. J Minim Invasive Gynecol,2016,23(3):346-351.
[18] Wang J,Wei G,Yi Z,et al. Total laparoscopic sigmoid vaginoplasty:a novel therapeutic approach[J]. ANZ J Surg,2021,91(1/2):E20-E24.
[19] 章艺群,丁景新,华克勤.组织工程技术在人工阴道成形术的应用新进展[J].现代妇产科进展,2015,24(7):556-558.
[20] Tamadon A,Park KH,Kim YY,et al. Efficient biomaterials for tissue engineering of female reproductive organs[J]. Tissue Eng Regen Med,2016,13(5):447-454.