支气管哮喘是由炎症细胞介导的呼吸系统疾病,以气道慢性炎症、平滑肌紊乱以及气道重塑为主要特征,其中气道重塑是诱发患者发生气道高反应性的重要因素,可引发肺心病、阻塞性肺气肿等疾病[1]。嗜酸粒细胞(eosinnophil,EOS)是引发支气管哮喘的重要炎症细胞,气道受到过敏原刺激可激活机体免疫系统,诱导EOS分泌大量的炎性介质(如多种白细胞介素、趋化因子),进而导致支气管黏膜损伤、功能障碍等[2-3]。戴绍文等[4]通过实验证实EOS参与支气管哮喘的发生发展,EOS的细胞功能活性与气道炎症因子分泌密切关联。磷脂酰肌醇激酶3/蛋白激酶B(phosphatidylinositol kinase 3/Protein Kinase B,PI3K/Akt)信号通路在调控机体免疫、炎症反应方面发挥重要作用,该通路的激活可诱导EOS的生长、增殖、迁移等生物学过程,特别是促进EOS的定向迁移[5]。聚集到气道的EOS通过产生活性氧而介导蛋白质和脂质、DNA的异常生理功能,加剧了支气管高反应性、炎症反应[6]。目前关于支气管哮喘患者气道炎症与EOS的PI3K/Akt信号通路的关系尚未明确,因此,本研究将通过分析临床样本进行论证,旨在探讨EOS与支气管哮喘患者气道炎症的相关机制,从而指导新药开发。现报告如下。
1 资 料 与 方 法
1.1 一般资料 选取2017年10月—2020年4月于我院就诊的36例气管哮喘患者作为观察组,选取同时段于我院的36例健康体检者为对照组。观察组纳入标准:①符合中华医学会呼吸病学会制定的哮喘防治指南中的诊断标准[7];②临床表现:肺部可闻及哮鸣音,咳嗽、胸闷、发作性喘息;③病历资料完整 。排除标准:①治疗前1个月内接受支气管扩张剂、白三烯受体阻滞剂、糖皮质激素治疗;②心、肝、肾等重要脏器功能障碍;③重症哮喘、感染和过敏性疾病;④妊娠期或哺乳期妇女;⑤精神意识障碍。2组一般资料比较差异无统计学意义(P>0.05),具有可比性,见表1。
表1 基线资料比较
Table 1 Comparison of baseline information (n=36)
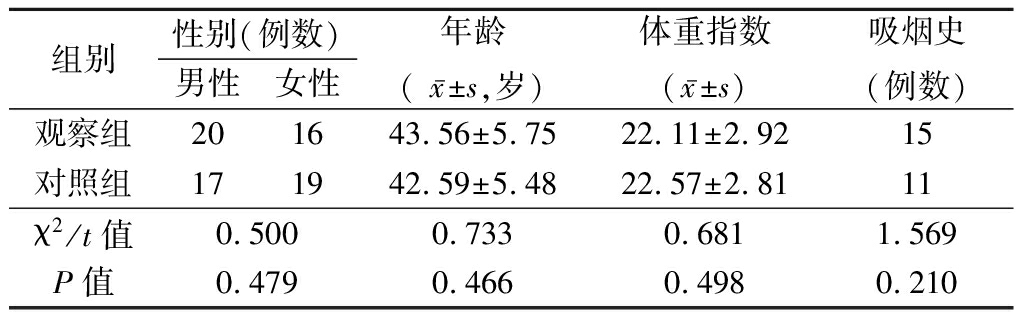
组别性别(例数)男性女性年龄( x-±s,岁)体重指数(x-±s)吸烟史(例数)观察组201643.56±5.7522.11±2.9215对照组171942.59±5.4822.57±2.8111χ2/t值0.500 0.7330.6811.569 P值0.4790.4660.4980.210
本研究经医院伦理委员会批准通过。
1.2 方法
1.2.1 病例资料收集 回顾分析所有患者病历资料,包括性别、年龄、体重指数、吸烟史、呼出气一氧化氮(fractional exhaled nitric oxide,FeNO)体积浓度、血清总IgE水平、气道重塑指标等信息,并对此次研究的病历资料保密性负责。气道重塑指:气道壁面积占气道总横截面积百分比(WA%)=[π(D/2)2-π(L/2)2]/π(D/2)2×100%,支气管管壁厚度与外径比(T/D),T=(D-L)/2,L、D分别为气道内、外径。患者入组后均接受高分辨胸部CT扫描,选取中动脉弓和气管分叉下1 cm、气管分叉处上1 cm、右肺下静脉和横隔顶上 2 cm 处,采用电子标尺测量L、D以及T,均连续测量3次取均值。
1.2.2 诱导痰细胞分布 患者吸入沙丁胺醇,10 min后用清水漱口以及高渗盐水超声雾化,深咳嗽并将痰液放置于培养皿中,收集密度大、黏稠度高的痰液,称重后加入二硫苏糖醇裂解,滤去杂质,离心后PBS悬浮,采用台盼兰鉴定细胞活力。制作细胞涂片,多聚甲醛固定,染色、烘干、封片,光学显微镜下进行细胞(中性粒细胞、巨噬细胞、EOS)分类。
1.2.3 PI3K/Akt信号通路蛋白表达检测 采用Westblot印迹法检测蛋白表达水平。收集诱导痰后,采用梯度离心法分离多形核白细胞。诱导痰在Ficoll-PaquePLUS淋巴分离液(芬兰GE Healthcare)中分层,于室温1 000 g离心30 min,通过EOS、红细胞的低渗溶解分离多形核白细胞,并使用EOS分离试剂盒(美国MiltenyiBiotek)分离EOS。细胞液裂解分离后的EOS后,加入总蛋白提取液,转入1.5 mL EP管中,10 000 r/min离心10 min,采用Bradford方法测定总蛋白浓度,将蛋白质量浓度稀释为5 mg/L。取20 μL蛋白液,变性后上样,十二烷基硫酸钠-聚丙稀酰胺凝胶电泳分离,随后转膜,加入兔抗人Akt、p-Akt、PI3K、β-actin一抗(1∶500),辣根过氧化物酶标记的二抗(1∶1 000),采用化学底物发光法显色。采用Image-Qua NT软件测量显色条带的光密度,计算各组蛋白相对β-actin的表达量。
1.3 统计学方法 应用SPSS 20.0统计软件分析数据。计量资料比较采用t检验,计数资料比较采用χ2检验,采用Pearson分析EOS与各指标的相关性。P<0.05为差异有统计学意义。
2 结 果
2.1 2组诱导痰细胞分布情况 2组诱导痰中的细胞分布情况差异有统计学意义(P<0.05),观察组EOS占比均明显高于对照组,而中性粒细胞、巨噬细胞占比明显低于对照组(P<0.05),见表2。
表2 观察组、对照组诱导痰细胞分布情况比较
Table 2 Comparison of distribution of induced sputum cells in observation group and control group![]()
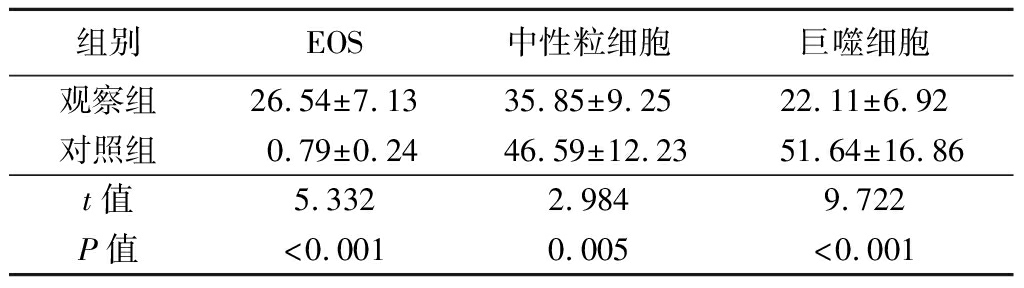
组别EOS中性粒细胞巨噬细胞观察组26.54±7.1335.85±9.2522.11±6.92对照组0.79±0.2446.59±12.2351.64±16.86t值5.3322.9849.722P值<0.0010.005<0.001
2.2 EOS与气道重塑指标、气道炎症标志物的关系 以观察组患者EOS的均值为临界值,将观察组患者分为高EOS组和低EOS组,2组患者的FeNO体积浓度、血清总IgE、T/D、WA差异有统计学意义,其中高EOS组的FeNO体积浓度、血清总IgE、T/D、WA明显高于低EOS组(P<0.05),见表3。
表3 EOS与气道重塑指标、气道炎症标志物的关系
Table 3 Relationship between eosinophils and airway remodeling and airway inflammation markers![]()
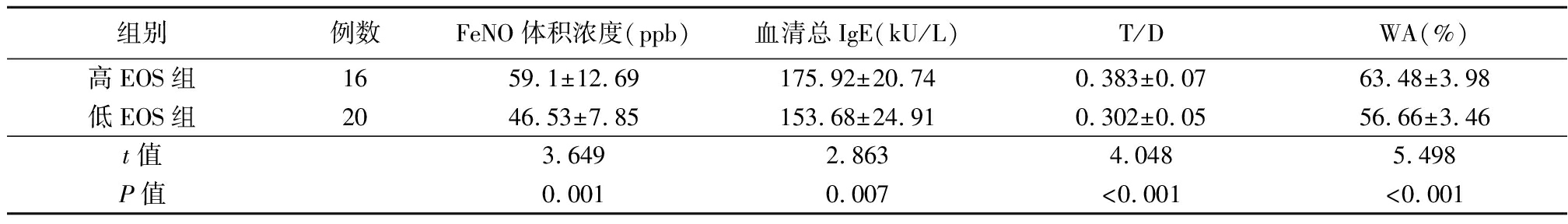
组别例数FeNO体积浓度(ppb)血清总IgE(kU/L)T/DWA(%)高EOS组1659.1±12.69175.92±20.740.383±0.0763.48±3.98低EOS组2046.53±7.85153.68±24.910.302±0.0556.66±3.46t值3.6492.8634.0485.498P值0.0010.007<0.001<0.001
2.3 EOS与PI3K/Akt信号通路的关系 高EOS组和低EOS组的PI3K、p-Akt表达水平差异有统计学意义,其中高EOS组患者的PI3K、p-Akt表达水平明显高于低EOS组(P<0.05),见表4,图1。
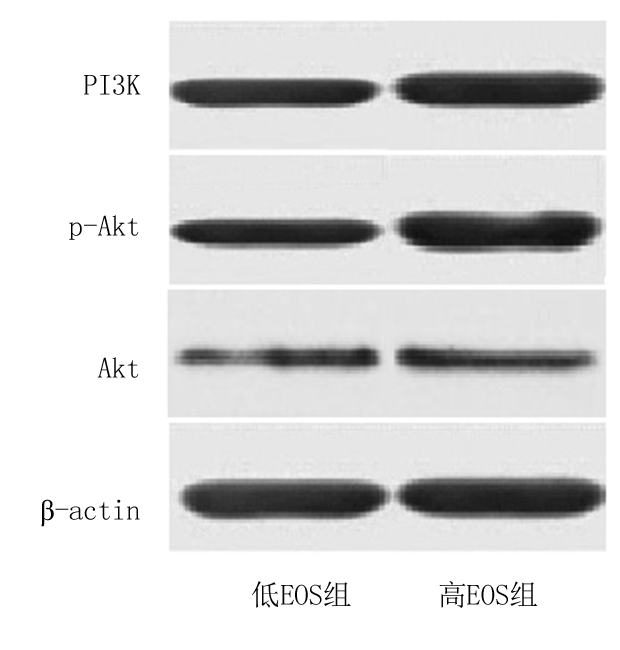
图1 PI3K/Akt信号通路相关蛋白的表达情况
Figure 1 The expression of proteins related to the PI3K/Akt signaling pathway
表4 EOS与PI3K/Akt信号通路的关系
Table 4 Relationship between eosinophils and PI3K/Akt signaling pathways![]()
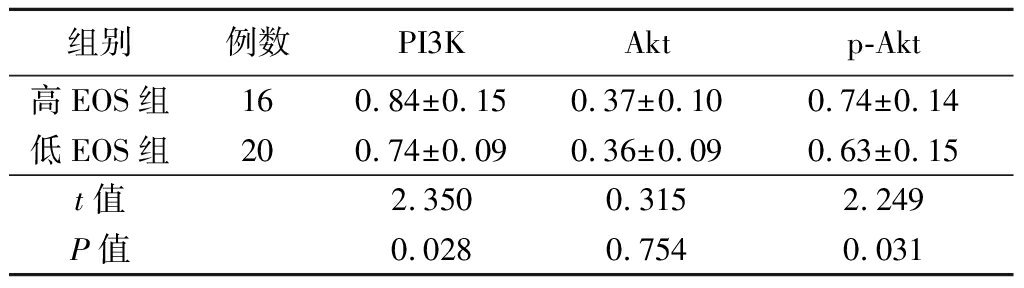
组别例数PI3KAktp-Akt高EOS组160.84±0.150.37±0.100.74±0.14低EOS组200.74±0.090.36±0.090.63±0.15t值2.3500.3152.249P值0.0280.7540.031
2.4 气道炎症标志物与PI3K/Akt信号通路的关系 Pearson分析显示FeNO体积浓度、血清总IgE分别与PI3K、p-Akt具有正相关性(P<0.05),见表5,图2~5。
表5 气道炎症标志物与PI3K/Akt信号通路的关系
Table 5 Relationship between airway inflammatory markers and PI3K/Akt signaling pathways
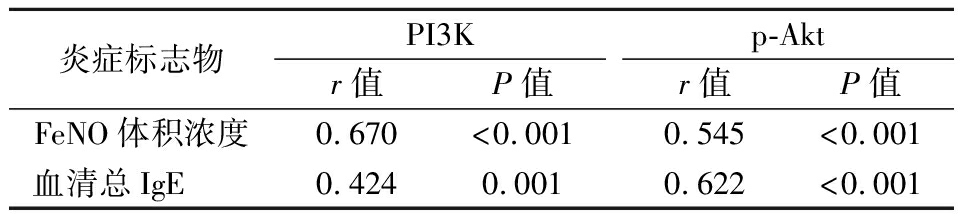
炎症标志物PI3Kr值P值p-Aktr值P值FeNO体积浓度0.670<0.0010.545<0.001血清总IgE 0.4240.0010.622<0.001
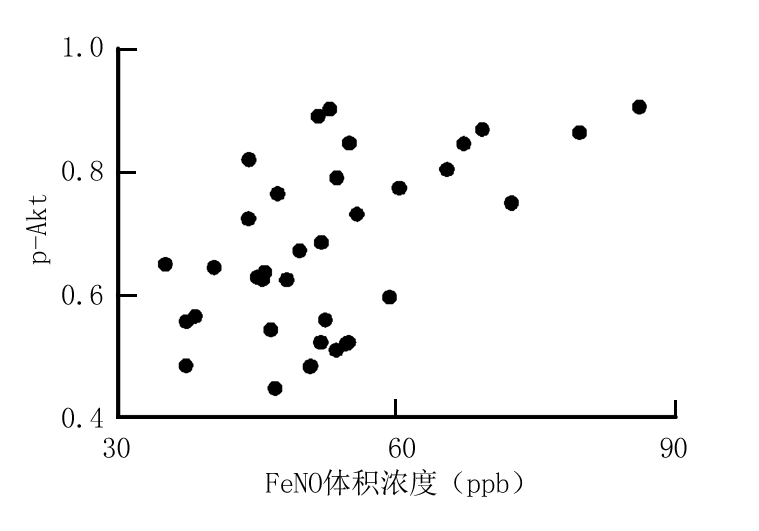
图2 FeNO与p-Akt的关系
Figure 2 The relationship between FeNO and p-Akt
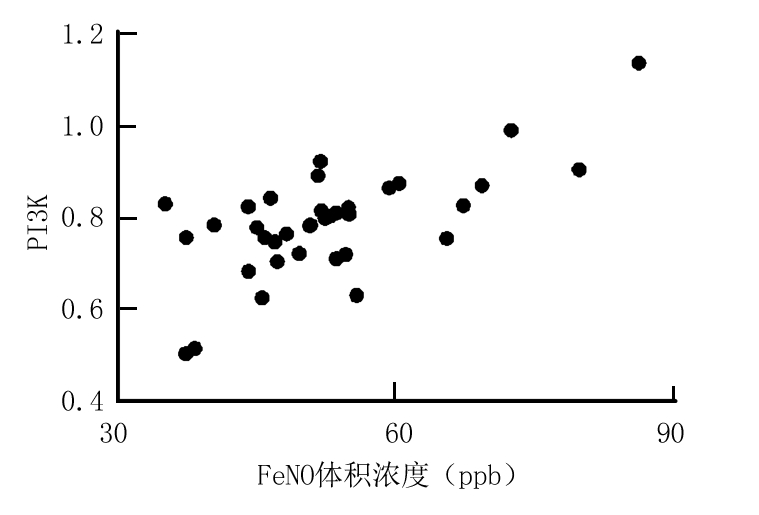
图3 FeNO与PI3K的关系
Figure 3 The relationship between FeNO and PI3K

图4 血清总IgE与p-Akt的关系
Figure 4 The relationship between total serum IgE and p-Akt
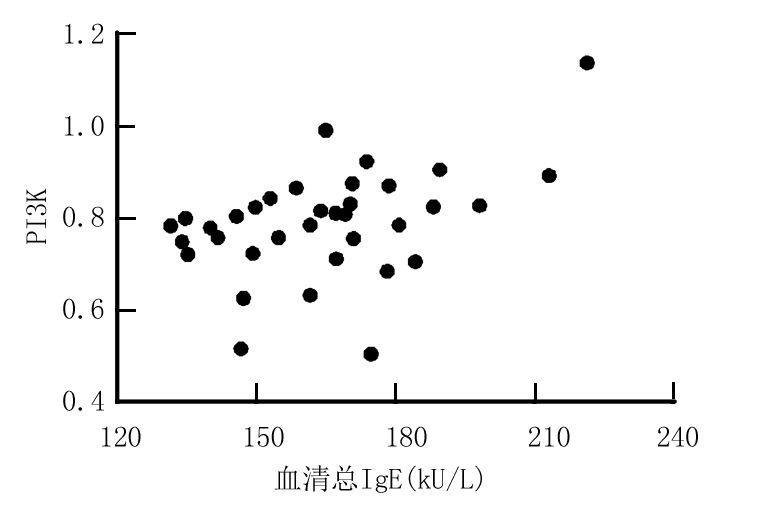
图5 血清总IgE与PI3K的关系
Figure 5 The relationship between serum total IgE and PI3K
3 讨 论
支气管哮喘以反复发作的咳嗽咳痰、胸闷气喘等为主要临床症状,反复发作可损伤气道内皮细胞,并诱导平滑肌细胞、细胞外基质过度增殖,引起气道狭窄,以及加重气道高反应性和气流受限,最终危及患者生命安全[8]。哮喘的发生涉及EOS、T细胞、肥大细胞等多种炎症细胞,其中以EOS最具特征性,临床研究发现随着慢性持续期患者病情的加重,诱导痰EOS呈增加趋势,表明EOS与哮喘病情严重程度存在相关性,通过开展诱导痰细胞学检查可客观反映炎症、气道状态,以及早期评估病情变化[9]。EOS来源于骨髓CD34+祖细胞,参与多种炎症疾病的发生发展,如在过敏性鼻炎中EOS通过分泌嗜酸性粒细胞阳离子蛋白、酸性粒细胞过氧化物、主要碱性蛋白、嗜酸性粒细胞神经毒素等颗粒蛋白而参与炎症反应,如诱导炎性细胞的黏附聚集、刺激炎性因子的分泌等[10]。EOS的血管内皮迁移涉及滚动、牢固黏附、跨内皮迁移等过程,主要由黏附分子、趋化因子、细胞因子间的网络调控细胞进行调节,其中PI3K/Akt信号通路可诱导炎症细胞以及炎症介质的形成和释放,从而引发气道变应性疾病(支气管哮喘、过敏性鼻炎等)[11]。研究发现抑制PI3K/Akt信号通路后,EOS的脱颗粒蛋白、增殖、迁移等过程受到抑制,表明PI3K/Akt信号通路在调控EOS的生物学功能方面发挥重要作用[12]。
本研究结果显示,观察组、对照组诱导痰中的细胞分布(EOS、中性粒细胞、巨噬细胞)差异有统计学意义(P<0.05),其中观察组患者EOS占比明显高于对照组,与既往研究结果一致[13],表明支气管哮喘患者中气道炎症表型以EOS为主,占比高达50%,可通过痰液中EOS的计数评估气道炎症和区分炎症表型。EOS在过敏性气道炎症过程中的趋化性可反映炎症进程,如过敏原激发试验显示支气管哮喘患者血液中EOS对化学物质具有更强的反应性,诱导物可增强EOS的趋化性,并刺激释放毒性颗粒蛋白,引起气道组织活性氧损伤[14]。FeNO、血清总IgE均是气道炎症标志物[13],其中FeNO可评估患者哮喘炎症程度和疾病控制水平,以及反映肺功能状态,IgE是机体受到免疫原刺激后产生的特异性免疫球蛋白,可增加EOS、肥大细胞的敏感性,刺激炎症因子分泌,从而加重支气管哮喘的气道炎症反应。本研究表明观察组患者的气道炎症标志物(FeNO体积浓度、血清总IgE)水平差异有统计学意义(P<0.05),且进一步分析发现随着EOS比例增加,血清总IgE、FeNO体积浓度呈增加趋势,表明EOS比例与炎症标志物存在相关性。另外,观察组患者的T/D、WA均明显高于对照组,与蒋凌志等[15]研究结果一致,气道重塑是引起支气管哮喘持续恶化的病理基础,可导致肺纤维化和肺功能降低。高EOS组的T/D、WA均明显高于低EOS组,分析认为EOS诱导的气道炎症反应可损伤气道内皮组织,刺激平滑肌细胞、杯状细胞的增生,降低气道痉挛可逆性,进而增加气道高反应性及气流受限程度,故而导致气道重塑。
PI3K/Akt 信号通路可调控多种免疫细胞(EOS、肥大细胞、T 淋巴细胞等)的分化、活化,进而参与气道变应性疾病的病理生理过程。本研究显示,高EOS组的PI3K、p-Akt表达水平明显高于低EOS组,进一步证实PI3K/Akt信号通路的活化与EOS的增殖、迁移密切关联。包海鹏等[16]研究发现PI3K/AKT 信号通路通过调节下游p-Akt的表达而调节EOS的生物学过程,EOS通过Eotaxin(可刺激EOS的趋化性)处理可激活PI3K/Akt 途径,促进EOS的增殖、迁移和脱颗粒蛋白的表达,进而诱发气道炎症反应。同时本次研究通过Person相关性分析显示FeNO体积浓度、血清总IgE与PI3K、p-Akt具有正相关性,进一步证实支气管哮喘患者气道炎症与EOS的PI3K/Akt信号通路活化程度具有相关性。Huang等[17]研究发现哮喘患者气道周围浸润着大量的炎症细胞,阻断PI3K/Akt信号通路后可阻断炎症细胞浸润,降低炎症因子的表达(纤维连接蛋白1、I型胶原等),以及增加黏钙蛋白的表达,从而阻断上皮间质转化,进而减轻哮喘患者气道重塑过程。PI3K信号通路还可以通过刺激气道平滑肌细胞的增殖以及调控气道平滑肌细胞的生长周期而加重支气管哮喘气道炎症反应,另外,哮喘动物模型实验以及支气管哮喘患者的临床观察均能发现PI3K信号通路的异常活化,且通过PI3K抑制剂处理后可明显抑制支气管哮喘的发生发展,进一步表明PI3K/Akt信号通路与支气管哮喘的炎症、气道重塑等病理过程密切关联。
综上所述,支气管哮喘患者的EOS的PI3K/Akt信号通路处于活化状态,与气道炎症(FeNO、血清IgE)具有正相关性。
[1] Bergmann KC. Bronchial asthma-many types,different therapies[J]. Dtsch Med Wochenschr,2016,141(10):687-692.
[2] Podwysocka M,Dabrowska K,Fendler W,et al. Analysis of the impact of bronchial asthma and hypersensitivity to aspirin on the clinical course of chronic sinusitis with nasal polyps[J]. Otolaryngol Pol,2019,73(5):37-43.
[3] 包海鹏,阎明,史琦,等.嗜酸性粒细胞凋亡在支气管哮喘作用中的研究进展[J].中华中医药学刊,2019,37(5):1095-1098.
[4] 戴绍文,郑燕冰,梁雪玲,等.嗜酸性粒细胞功能活性在哮喘患者中过敏原诱导的晚期气道炎症中的作用[J].广东医学,2018,39(18):2783-2786.
[5] Stark AK,Davenport ECM,Patton DT,et al. Loss of phosphatidylinositol 3-kinase activity in regulatory T cells leads to neuronal inflammation[J]. J Immunol,2020,205(1):78-89.
[6] 刘楠,李纳,朱琳,等.和厚朴酚通过PI3K/Akt信号通路对哮喘小鼠的作用及其对TLR2、TLR4表达的影响[J].中草药,2019,50(6):132-137.
[7] 中华医学会呼吸病学分会哮喘学组.支气管哮喘防治指南(2016年版)[J].中华结核和呼吸杂志,2016,39(9):675-697.
[8] 柳亚慧,时国朝.支气管哮喘的精准治疗[J].中国实用内科杂志,2020,40(5):25-30.
[9] 吴思仿,周丽芹,吴峰.支气管哮喘患者ICAM-1、EOS水平与病情严重程度的相关性分析[J].临床肺科杂志,2019,24(5):803-806.
[10] Bel EH,Brinke TA. New anti-eosinophil drugs for asthma and COPD:targeting the trait![J]. Chest,2017,152(6):1276-1282.
[11] 傅相均,庹芳旭,唐寅,等.PI3K/Akt信号通路在环境内分泌干扰物影响哮喘发作中的作用[J].实用医学杂志,2018,34(6):1030-1032.
[12] 咸哲民,王重阳,朴玉华,等.欧前胡素通过TGF-β1/Smad3和PI3K/Akt信号通路对哮喘小鼠气道重塑模型的影响[J].中国药理学通报,2018,34(12):1719-1724.
[13] 李红雯,林江涛,农英,等.支气管哮喘患者气道炎症表型分布及其与控制水平的相关性[J].中华医学杂志,2019,99(22):1692-1697.
[14] 杜威,杜娟,周俊,等.白细胞介素-25及其受体对过敏性哮喘患者嗜酸性粒细胞的调控作用[J].中国呼吸与危重监护杂志,2019,18(3):247-253.
[15] 蒋凌志,许丹媛,杨志雄.支气管哮喘患者血清25-(OH)D3、TGF-β1水平与气道重塑的关系[J].山东医药,2018,58(12):54-56.
[16] 包海鹏,阎玥,史琦,等.嗜酸性粒细胞凋亡在支气管哮喘作用中的研究进展[J].中华中医药学刊,2019,37(5):1095-1098.
[17] Huang L,Wang M,Yan Y,et al. OX40L induces helper T cell differentiation during cell immunity of asthma through PI3K/AKT and P38 MAPK signaling pathway[J]. J Transl Med,2018,16(1):74.