小细胞肺癌(small cell lung cancer,SCLC)是一种肺部恶性神经内分泌肿瘤,约占肺癌的15%,在所有癌症中占到了11.6%[1-2]。SCLC的特点是具有很强的侵袭性,在早期能够发生转移并且增长迅速[3]。尽管医疗技术在不断的发展,SCLC的预后仍不容乐观,中位生存期往往不足6个月[4],因此,寻找新的评价患者预后的生物标志物,进而指导SCLC患者的临床治疗,进行早期干预显得至关重要。近年来,全身炎症与肿瘤的关系已成为一个重要的研究热点。研究表明炎症参与了肿瘤发生发展的各个方面[5]。炎症是造成肿瘤的一个重要原因,抑制机体的免疫反应,扰乱免疫细胞间的相互作用,其对肿瘤微环境的破坏会导致基因组不稳定,增加癌症发生的风险。多篇文献报道了以中性粒细胞、血小板和淋巴细胞为基础的系统免疫炎症指数(systemicimmuneinflammation index, SII)在预测多种实体瘤预后中的价值[6-8],但目前对于治疗前SII与SCLC患者预后的关系却鲜有报道。本研究通过回顾性分析的方法,对98例SCLC患者治疗前SII水平和临床病例特征及预后的关系进行分析,旨在确定SII是否可以用于预测SCLC患者的临床预后,报告如下。
1 资 料 与 方 法
1.1 一般资料 选取2013年1月—2018年1月在河北省人民医院初治的经病理确诊为SCLC患者98例为研究对象。收集患者病历中的临床资料主要包括年龄、性别、吸烟史、卡氏表现状态(Karnofsky performance status,KPS)评分、有无基础疾病、临床分期、治疗方法、治疗后的效果、诊断日期、复发日期和随访情况。根据美国退伍军人肺癌协会(Veterans Administration Lung Study Group,VALSG)的标准进行分期。治疗效果采用实体瘤疗效评价标准(Response Evaluation Criteria In Solid Tumour, RECIST)1.1版本进行评定。本研究经医院医学伦理委员会审查批准。
1.2 纳入标准与排除标准 纳入标准:病理学诊断为SCLC的初治患者;预计生存期>3个月;治疗前均已完善血液学指标检查、影像评估,临床资料完整;可随访到患者总生存期。排除标准:非初治患者;病理诊断不明确或合并其他肿瘤;临床资料不完整;合并急性感染、慢性炎症、自身免疫性疾病和血液系统等疾病的患者;不可随访到患者总生存期。
1.3 方法 主要包括化疗和(或)放疗,其中接受化疗联合放疗的49例,单纯接受化疗的49例。对初始治疗的疗效评价分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)和疾病进展(progression disease,PD)。将CR+PR规定为对初始治疗有良好效果;将SD+PD规定为对初始治疗疗效差。在治疗前1周之内,采集所有患者的空腹外周静脉血用于临床指标的检测,根据血常规结果计算SII值(SII=血小板数×中性粒细胞数/淋巴细胞数)。
1.4 随访 随访方式主要包括门诊复查、电话或短信等。患者出院后的第1年每2个月随访1次,之后每3~6个月随访1次。随访内容主要有患者的一般情况、复发进展状况及生存结局等。随访截止时间为2020年6月1日。无进展生存期(progression free survival,PFS)定义为肿瘤患者接受治疗至肿瘤进展时间;总生存时间(overall survival,OS)定义为肿瘤患者接受治疗至患者死亡或末次随访时间。
1.5 统计学方法 应用SPSS 22.0统计软件分析数据。计数资料比较采用χ2检验。用受试者工作特征曲线(receiver operating characteristic curve, ROC)确定SII的最佳截断值, 应用曲线下面积 (area under the curve,AUC)评价其诊断价值。采用Kaplan-Meier法比较OS和PFS,用Log-Rank检验比较组间生存曲线间的差异。使用Graphpad 8.0.2绘制生存率曲线。Cox风险比例回归模型用于多变量分析,以确定与该疾病相关的预后因素。P<0.05为差异有统计学意义。
2 结 果
2.1 SII的ROC曲线及界值 以患者死亡或存活作为生存结局的指标,绘制出ROC曲线图,见图1。其AUC为0.724(95%CI:0.515~0.932,P=0.049),Youden指数最大值为0.428,所对应的最佳判读值为571.5,敏感度为57.1%,特异度为85.7%。SII以571.5为界值,定义SII<571.5为低SII水平组,SII≥571.5为高SII水平组。根据SII的最佳截断值,将98例SCLC患者划分为高SII组53例(54.08%),低SII组45例(45.92%)。
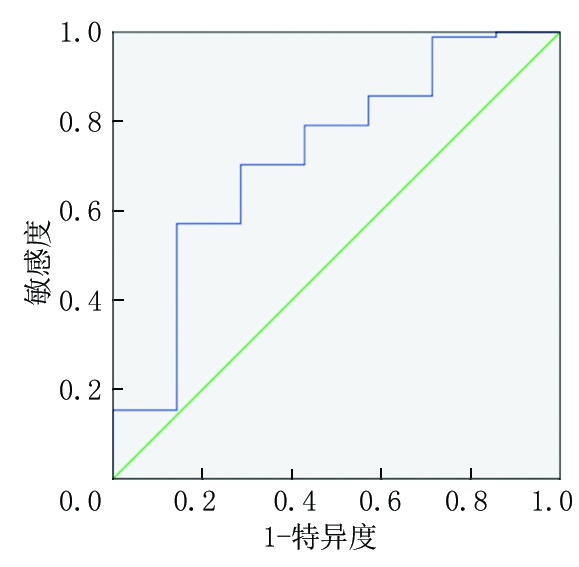
图1 SII水平预测98例SCLC患者预后的ROC曲线
Figure 1 ROC curve of SII level in predicting gprognosis of 98 SCLC patients
2.2 不同SII水平与患者一般临床病理特征间的关系 SII与SCLC患者的临床分期有关,低SII组临床分期中局限期的比例高于高SII组,差异有统计学意义(P<0.05);高SII组和低SII组在不同年龄、性别、有无吸烟史的分布比较差异无统计学意义(P>0.05)。见表1。
表1 不同SII水平与98例SCLC患者临床病理特征的关系
Table 1 The relationship between different SII levels and clinicopathological characteristics in 98 SCLC patients (例数,%)
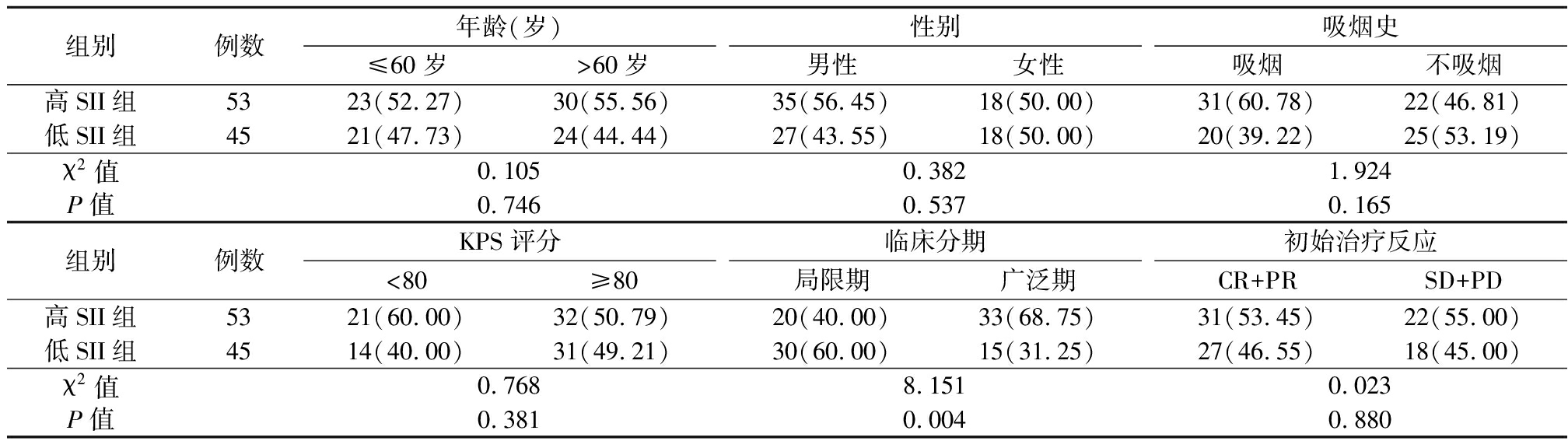
组别例数年龄(岁)≤60岁>60岁性别男性女性吸烟史吸烟不吸烟高SII组5323(52.27)30(55.56)35(56.45)18(50.00)31(60.78)22(46.81)低SII组4521(47.73)24(44.44)27(43.55)18(50.00)20(39.22)25(53.19)χ2值0.1050.3821.924P值0.7460.5370.165组别例数KPS评分<80≥80临床分期局限期广泛期初始治疗反应CR+PRSD+PD高SII组5321(60.00)32(50.79)20(40.00)33(68.75)31(53.45)22(55.00)低SII组4514(40.00)31(49.21)30(60.00)15(31.25)27(46.55)18(45.00)χ2值0.7688.1510.023P值0.3810.0040.880
2.3 不同SII水平与SCLC患者预后的关系 通过Log-Rank检验得出低SII组与高SII组的中位PFS分别为10.0个月和5.0个月,差异有统计学意义(χ2=12.606,P<0.001);低SII组与高SII组的中位OS分别为16.0个月和10.0个月,差异有统计学意义(χ2=15.198,P<0.001),从上述数据可以得出低SII组生存率明显高于高SII组,低SII组预示较好的预后结局。不同SII水平对OS的影响通过Graphpad 8.0.2绘制生存率曲线,见图2。
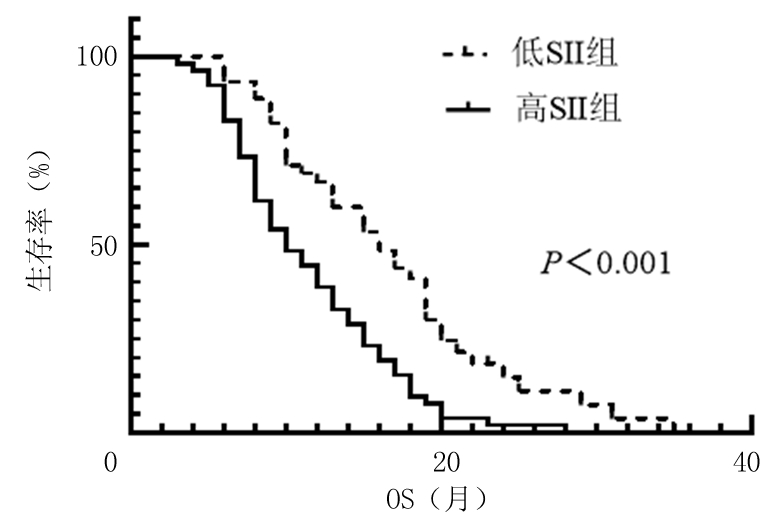
图2 不同SII水平对OS的影响
Figure 2 The effect of different SII levels on OS
2.4 影响患者预后的单因素分析 单在SCLC患者中,吸烟者中位PFS及中位OS差于不吸烟者;KPS评分<80者中位PFS及中位OS差于KPS评分≥80者;临床分期广泛期者中位PFS及中位OS差于局限期者;初始治疗反应SD+PD者中位PFS及中位OS差于CR+PR者;SII水平≥571.5者中位PFS及中位OS差于SII水平<571.5者,差异均有统计学意义(P均<0.05)。见表2。
表2 98例SCLC患者生存单因素分析
Table 2 Univariate analysis of survival of 98 SCLC patients
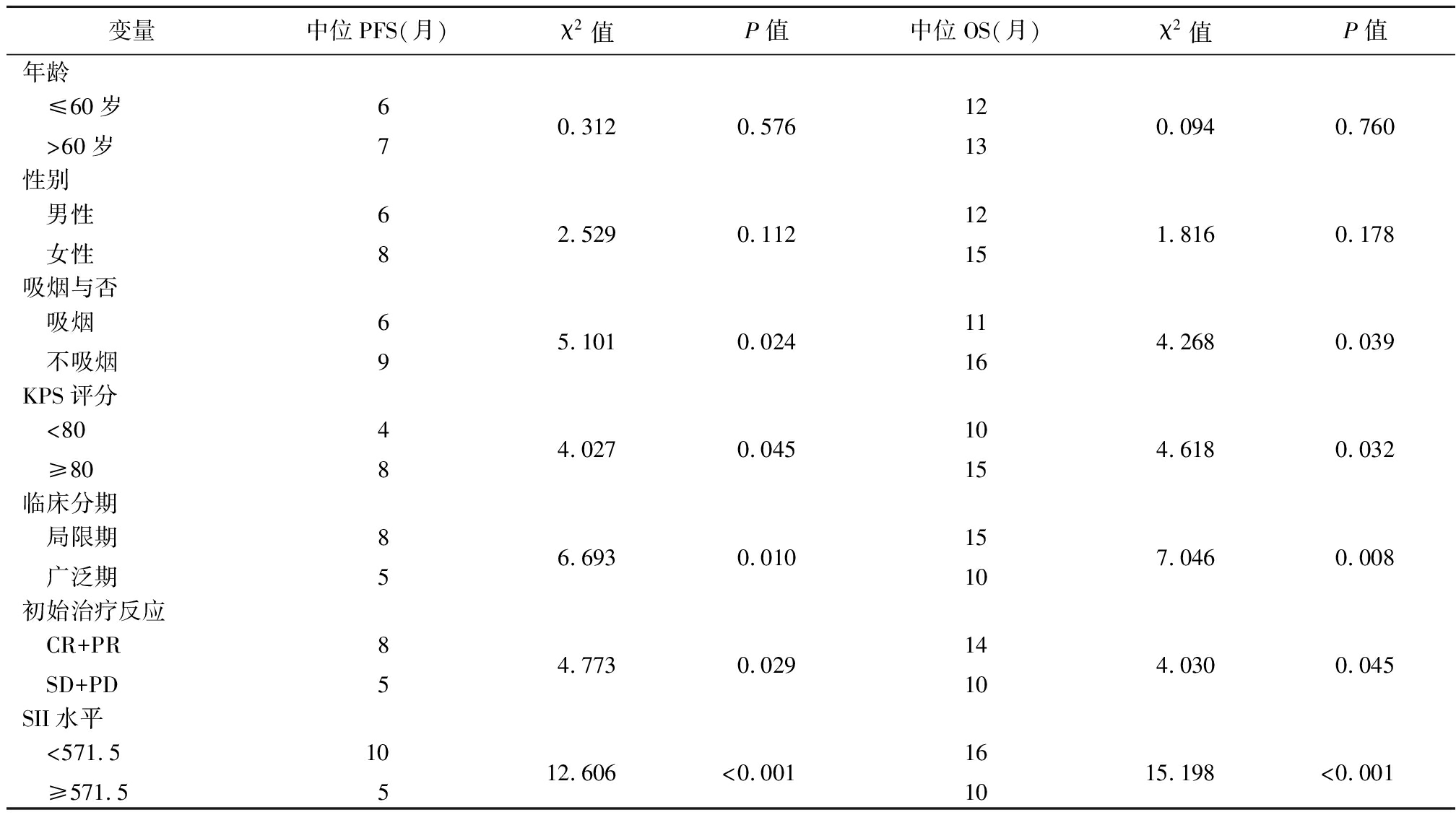
变量中位PFS(月)χ2值P值中位OS(月)χ2值P值年龄 ≤60岁 >60岁670.3120.57612130.0940.760性别 男性 女性682.5290.11212151.8160.178吸烟与否 吸烟 不吸烟69 5.1010.02411164.2680.039KPS评分 <80 ≥80484.0270.04510154.6180.032临床分期 局限期 广泛期856.6930.01015107.0460.008初始治疗反应 CR+PR SD+PD854.7730.02914104.0300.045SII水平 <571.5 ≥571.510512.606<0.001161015.198<0.001
2.5 Cox风险比例回归模型分析 对于患者单因素分析有统计学意义的指标进行Cox风险比例回归模型多因素分析,结果显示初始治疗反应(HR=0.589,95%CI:0.364~0.951,P=0.031)和SII水平(HR=0.562,95%CI:0.361~0.875,P=0.011)是SCLC患者PFS的独立预后因素,而SII水平是SCLC患者OS的独立预后因素(HR=0.508,95%CI:0.326~0.794,P=0.003)。见表3~4。
表3 影响SCLC患者PFS的Cox回归分析
Table 3 Cox regression analysis of PFS in patients with SCLC
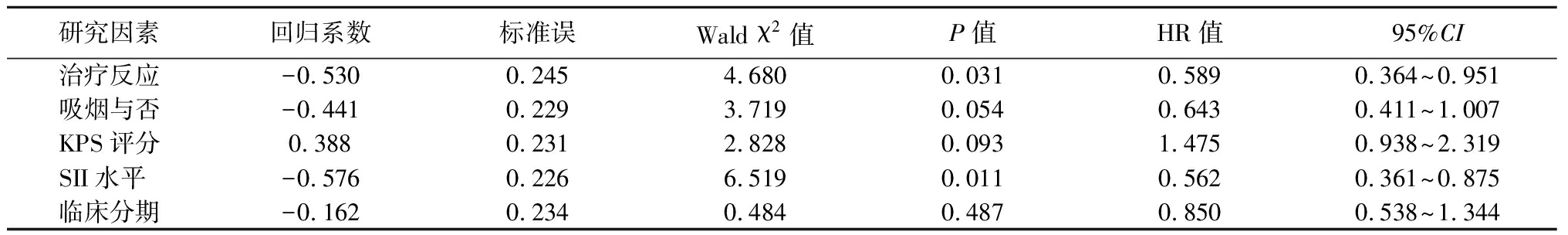
研究因素回归系数标准误Wald χ2值P值HR值95%CI治疗反应-0.5300.2454.6800.0310.5890.364~0.951吸烟与否-0.4410.2293.7190.0540.6430.411~1.007KPS评分0.3880.2312.8280.0931.4750.938~2.319SII水平 -0.5760.2266.5190.0110.5620.361~0.875临床分期-0.1620.2340.4840.4870.8500.538~1.344
表4 影响SCLC患者OS的Cox回归分析
Table 4 Cox regression analysis of OS in patients with SCLC
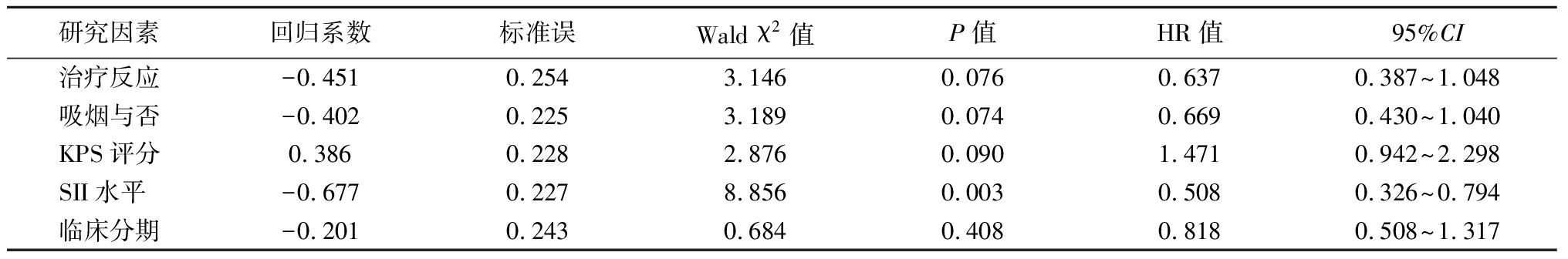
研究因素回归系数标准误Wald χ2值P值HR值95%CI治疗反应-0.4510.2543.1460.0760.6370.387~1.048吸烟与否-0.4020.2253.1890.0740.6690.430~1.040KPS评分0.3860.2282.8760.0901.4710.942~2.298SII水平 -0.6770.2278.8560.0030.5080.326~0.794临床分期-0.2010.2430.6840.4080.8180.508~1.317
3 讨 论
肿瘤的发生与肿瘤细胞所处的微环境密切相关,炎症作为构成肿瘤微环境的核心组成部分,是肿瘤的重要特征之一[5]。近年来,一些以全身炎症细胞为基础的相关生物标志物,例如血小板与淋巴细胞比值(platelet to lymphocyte ratio,PLR)、淋巴细胞与单核细胞比值(lymphocyte to monocyte ratio,LMR)、中性粒细胞与淋巴细胞比值(neutrophil lymphocyte ratio,NLR)已被证实对包括肺癌在内的多种肿瘤具有预测价值[9-14]。然而,这些预测因子通常基于2个炎性细胞参数,系统免疫炎症指数则是基于3个外周血参数(血小板计数、中性粒细胞计数和淋巴细胞计数),可以更为全面、客观地反映机体免疫与炎症之间的平衡状态[15]。
SII已被证明与食管鳞状细胞癌、胃癌、胰腺癌和鼻咽癌的预后密切相关[6-8, 16]。Tang等[17]对包括患者4 104例在内的13项研究进行Meta分析,研究结果表明,SII升高预示着较差的OS(HR:1.80,95%CI:1.43~2.28)和PFS(HR:1.18,95%CI:0.55~2.52),本研究结果与其一致。本研究通过生存分析显示,低SII组生存率好于高SII组,多因素分析显示,SII是OS、PFS的独立预测因素。另外,在接受化疗和(或)放疗后,近60%患者对初始治疗有良好效果,疗效较好组的生存时间长于疗效较差组,多因素分析显示初始治疗反应是PFS的独立预测因素,与既往报道[18]相似,侧面说明了本研究病例资料的可靠性。
高SII代表血小板和中性粒细胞计数增高或淋巴细胞计数减少的状态,可能机制为血小板通过分泌血管内皮生长因子(vascular endothelial growthfactor,VEGF)、转化生长因子β和血小板衍生生长因子(platelet derived growth factor,PDGF)促进肿瘤的发展[19]。PDGF可通过激活相关通路促进上皮间质转化,这是肿瘤转移的关键。同时,肿瘤细胞可以诱导 巨核细胞向血小板分化,促进血小板增殖[20]。另外,肿瘤细胞也可通过诱导血小板聚集逃避机体的免疫监视。中性粒细胞在循环血中分泌VEGF,增加血管通透性及肿瘤新生血管的形成,导致肿瘤细胞向远处器官侵袭和转移[21]。淋巴细胞是机体免疫的主体细胞,通过抑制肿瘤细胞的增殖、侵袭和迁移,在免疫监视中起着关键作用[22]。当淋巴细胞衰竭时,机体的免疫能力大打折扣,患者的预后则受到影响。由此可见,高SII水平表明机体炎性反应增强,而免疫反应减弱。
刘倩倩等[23]报道,治疗前外周血SII水平是SCLC脑转移患者预后的独立影响因素。以968.50为最佳截断值,治疗前SII≥968.50的患者预后较差。本研究中,SII的最佳截断值为571.5。造成截断值不同的原因可能是两个研究选择的患者的临床分期不同,本研究中多数患者处于局限期,而在刘倩倩等[23]研究中所有患者均已处于广泛期,进一步佐证本研究得出的低SII组临床分期中局限期的比例高于高SII组的结论。炎症标志物水平的升高往往与更晚期的癌症有关,这应该是更高的肿瘤负荷或持续的慢性炎症过程造成的结果[24]。
SII可以反映肿瘤进展过程中全身炎症与机体免疫反应的关系,SII较高的患者意味着肿瘤负荷较重,免疫抑制更为严重。临床上可以根据SII调整治疗强度和用药策略,保守治疗可能更适合肿瘤负荷高、体质差的患者,以减少继发性损伤。另外,SII可能在间接预测免疫治疗的疗效方面有一定帮助。对于高SII患者,提示其免疫能力较差,免疫治疗可能有助于取得良好的疗效。因此,SII可以作为SCLC诊断和治疗的有效标志。然而本研究存在一定局限性:本研究是一个单中心回顾性研究,登记的患者数量较少。因此,今后需要招募更多的SCLC患者,并且进行多中心前瞻性研究以此使预测更具有说服力。综上,SII水平是观察SCLC患者生存预后的有效指标,高SII水平提示患者生存预后差。
[1] Siegel RL,Miller KD,Jemal A. Cancer statistics,2019[J]. CA Cancer J Clin,2019,69(1):7-34.
[2] Bray F,Ferlay J,Soerjomataram I,et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin,2018,68(6):394-424.
[3] Tartarone A,Giordano P,Lerose R,et al. Progress and challenges in the treatment of small cell lung cancer[J]. Med Oncol,2017,34(6):110.
[4] Oronsky B,Reid TR,Oronsky A,et al. What′s new in SCLC? A Review[J]. Neoplasia,2017,19(10):842-847.
[5] Lu Y,Jiang J,Ren C. The clinicopathological and prognostic value of the pretreatment neutrophil-to-lymphocyte ratio in small cell lung cancer:a meta-analysis[J]. PLoS One,2020,15(4):e230979.
[6] Zhu Z,Cong X,Li R,et al. Preoperative systemic immune-inflammation index(SII) for predicting the survival of patients with stage Ⅰ-Ⅲ gastric cancer with a signet-ring cell(SRC) component[J]. Biomed Res Int,2020,2020:5038217.
[7] Murthy P,Zenati MS,Al AA,et al. Prognostic value of the systemic immune-inflammation index(SII) after neoadjuvant therapy for patients with resected pancreatic cancer[J]. Ann Surg Oncol,2020,27(3):898-906.
[8] Gao Y,Guo W,Cai S,et al. Systemic immune-inflammation index(SII) is useful to predict survival outcomes in patients with surgically resected esophageal squamous cell carcinoma[J]. J Cancer,2019,10(14):3188-3196.
[9] Minami S,Ihara S,Kim SH,et al. Lymphocyte to monocyte ratio and modified glasgow prognostic score predict prognosis of lung adenocarcinoma without driver mutation[J]. World J Oncol,2018,9(1):13-20.
[10] Liu D,Jin J,Zhang L,et al. The neutrophil to lymphocyte ratio may predict benefit from chemotherapy in lung cancer[J]. Cell Physiol Biochem,2018,46(4):1595-1605.
[11] Toda M,Tsukioka T,Izumi N,et al. Platelet-to-lymphocyte ratio predicts the prognosis of patients with non-small cell lung cancer treated with surgery and postoperative adjuvant chemotherapy[J]. Thorac Cancer,2018,9(1):112-119.
[12] Kang KH,Efird JT,Sharma N,et al. Prognostic potential of neutrophil-to-lymphocyte ratio and lymphocyte nadir in stage Ⅲ non-small-cell lung cancer[J]. Future Oncol,2017,13(16):1405-1414.
[13] Kasmann L,Bolm L,Schild SE,et al. Neutrophil-to-lymphocyte ratio predicts outcome in limited disease small-cell lung cancer[J]. Lung,2017,195(2):217-224.
[14] 王洪玲,李琳,王键玮,等.中性粒细胞淋巴细胞比值与小细胞肺癌预后关系的分析[J].河北医科大学学报,2018,39(4):391-395.
[15] Zhang Y,Chen B,Wang L,et al. Systemic immune-inflammation index is a promising noninvasive marker to predict survival of lung cancer:a meta-analysis[J]. Medicine (Baltimore),2019,98(3):e13788.
[16] Jiang W,Chen Y,Huang J,et al. Systemic immune-inflammation index predicts the clinical outcome in patients with nasopharyngeal carcinoma:a propensity score-matched analysis[J]. Oncotarget,2017,8(39):66075-66086.
[17] Tang JN,Goyal H,Yu S,et al. Prognostic value of systemic immune-inflammation index (SII) in cancers:a systematic review and meta-analysis[J]. J Lab Precis Med,2018,3(3):29.
[18] Hong X,Cui B,Wang M,et al. Systemic immune-inflammation index,based on platelet counts and neutrophil-lymphocyte ratio,is useful for predicting prognosis in small cell lung cancer[J]. Tohoku J Exp Med,2015,236(4):297-304.
[19] Lim JU,Yeo CD,Kang HS,et al. Prognostic value of platelet count and lymphocyte to monocyte ratio combination in stage Ⅳ non-small cell lung cancer with malignant pleural effusion[J]. PLoS One,2018,13(7):e200341.
[20] Sharma D,Brummel-Ziedins KE,Bouchard BA,et al. Platelets in tumor progression:a host factor that offers multiple potential targets in the treatment of cancer[J].J Cell Physiol,2014,229(8):1005-1015.
[21] Cao S,Jin S,Shen J,et al. Selected patients can benefit more from the management of etoposide and platinum-based chemotherapy and thoracic irradiation-a retrospective analysis of 707 small cell lung cancer patients[J]. Oncotarget,2017,8(5):8657-8669.
[22] Suzuki R,Wei X,Allen PK,et al. Prognostic significance of total lymphocyte count,neutrophil-to-lymphocyte ratio,and platelet-to-lymphocyte ratio in limited-stage small-cell lung cancer[J]. Clin Lung Cancer,2019,20(2):117-123.
[23] 刘倩倩,杨卫华.系统免疫-炎性反应指数与小细胞肺癌脑转移患者预后的关系[J].肿瘤,2019,39(8):649-657.
[24] Templeton AJ,McNamara MG,Seruga B,et al. Prognostic role of neutrophil-to-lymphocyte ratio in solid tumors:a systematic review and meta-analysis[J]. J Natl Cancer Inst,2014,106(6):u124.