食管癌在我国的发病率和病死率居于世界之首,已成为肿瘤防治的重点。统计学数据表明,进展期食管癌的总生存率较低,但早期食管癌的5年生存率高达90%[1],因此,提高早期食管癌及癌前病变的检出率并给予适当的治疗,是改善食管癌预后的关键。随着内镜设备的快速发展,窄带成像放大内镜(narrow-banding imaging system with magnifying endoscopy,NBI-ME)逐渐用于食管表型病变的诊治,其中,以NBI-ME下食管上皮乳头内毛细血管袢(intrapapillary capillary loop,IPCL)分型应用最广。IPCL分型是日本食道学会制定的食管癌分型标准,随着排序的向后,肿瘤浸润程度和食管癌恶变的可能均加深,与食管癌的病变程度和预后相关[2]。由于食管癌是基因调控下多种信号通路协同作用导致的细胞病变,故而相应的肿瘤蛋白在食管癌组织中特异性表达,与肿瘤的浸润转移密切相关。细胞周期素D1(Cyclin D1)是鼻咽癌相关基因6调控EGFR/K-ras/JNK/c-Jun/ CyclinD1通路的蛋白产物,能够促进细胞由G1期转化为S期间,促进细胞增殖[3];血小板衍生生长因子受体(platelet derived growth factor,PDGFR)是癌相关成纤维细胞分泌的特异性蛋白,能够促进肿瘤细胞增殖,提高侵袭力[4],二者均为食管癌早期诊断、预后评估的潜在分子标志物。本研究分析IPCL分型联合Cyclin D1、PDGFR在食管癌早期诊断和预后评估的价值,报告如下。
1 资 料 与 方 法
1.1 一般资料 选取我院消化疾病中心2012年12月—2013年12月收治的经NBI-ME检查的食管浅表型病变患者118例(病变118处),男性76例,女性42例,年龄45~88岁,平均(67±8)岁。病变位于食管上段17例,中段77例,下段24例。按照2009年日本食道学会定值的食管癌分级标准进行病理分析,结果显示食管炎14例,低级别上皮内瘤变(1ow grade intraepithelial neoplasia, LGIN)6例,早期食管癌83例,SM1期食管癌5例,SM2期及深食管癌10例。
本研究获得医院伦理委员会批准。
1.2 纳入标准与排除标准 纳入标准:①有完整的病理临床资料;②病变长度1~5 cm;③无食管癌病史,入组前未经任何放化疗或药物治疗;④无其他肿瘤病史;⑤未发现远处转移;⑥自愿参与本研究,并签署知情同意书。排除标准:①合并严重心、脑、肺、肾部疾病;②合并食管内镜检查禁忌证;③年龄≥90岁;④合并精神性疾病;⑤合并多处病变者。
1.3 方法
1.3.1 IPCL分型 所有研究对象均经NBI-ME检查,设备为NBI、Olympus H260Z/Olympus CV-260SL放大内镜,依据井上晴洋分型方法[5]进行IPCL分型,分为Ⅰ型(形态正常,碘染色呈阴性)、Ⅱ型(碘染色轻度着色,出现延长或扩张表现)、Ⅲ型(血管形态有或者无轻微改变)、Ⅳ型(血管出现扩张、蛇行、管径粗细不均或形态不规则等2种或3种变化)、V1型(血管出现扩张、蛇行、管径粗细不均或形态不规则等4种变化)、V2型(在V1型基础上出现血管延长)、V3A型(水平血管结构高度破坏,扩张的IPCL沿表层水平方向走行)、V3B型(在V3A的基础上血管延长向深部扩展,异常血管间呈树枝状连接)、VN型(明显新增肿瘤血管,管径增粗)。
1.3.2 食管癌组织Cyclin D1、PDGFR检测 取食管癌组织,常规石蜡切片,脱蜡水化处理后,经免疫组化染色,检测食管癌组织Cyclin D1、PDGFR表达情况。试剂盒购自于北京中杉金桥公司,操作参照试剂盒说明书进行。
结果判断:出现棕黄色颗粒为Cyclin D1表达阳性,出现红色阳性颗粒为PDGFR阳性染色。由2位病理学家使用同一光学显微镜读片,各自选择3个高倍镜视野,每个视野计数200个细胞,计算阳性肿瘤细胞所占的百分比,依据百分比记为0分(<5%)、1分(5%~25%)、2分(26%~50%)、3分(51%~75%)和4分(>75%)。染色强度:不染色记为0分,淡黄色记为1分,棕黄色记为2分,棕褐色记为3分。将二者乘积后判断染色结果:0~1分为阴性(-),2~4分为弱阳性(+),5~7分为阳性(++),≥8分为强阳性(+++)。
1.3.3 治疗方法 所有患者均经内镜下黏膜切除术或内镜黏膜下剥离术治疗。
1.3.4 随访及预后判断 所有患者术后均进行随访,随访时间5年以上,记录患者病死情况。
1.4 统计学方法 应用SPSS 19.0统计软件分析数据。计数资料比较采用χ2检验比较,等级资料比较采用秩和检验,早期食管癌预后影响因素采用Cox回归分析。P<0.05为差异有统计学意义。
2 结 果
2.1 IPCL分型与病理结果分析 食管癌浅表型病变IPLC分型Ⅲ型、Ⅳ型以食管炎、LGIN为主,V1型、V2型、V3A型以早期食管癌为主,V3B型、VN型以SM1、SM2及深食管癌为主。见表1,图1。
表1 食管浅表病变IPCL分析与病理诊断结果分析
Table 1 IPCL analysis and pathological diagnosis of superficial esophageal lesions (例数)
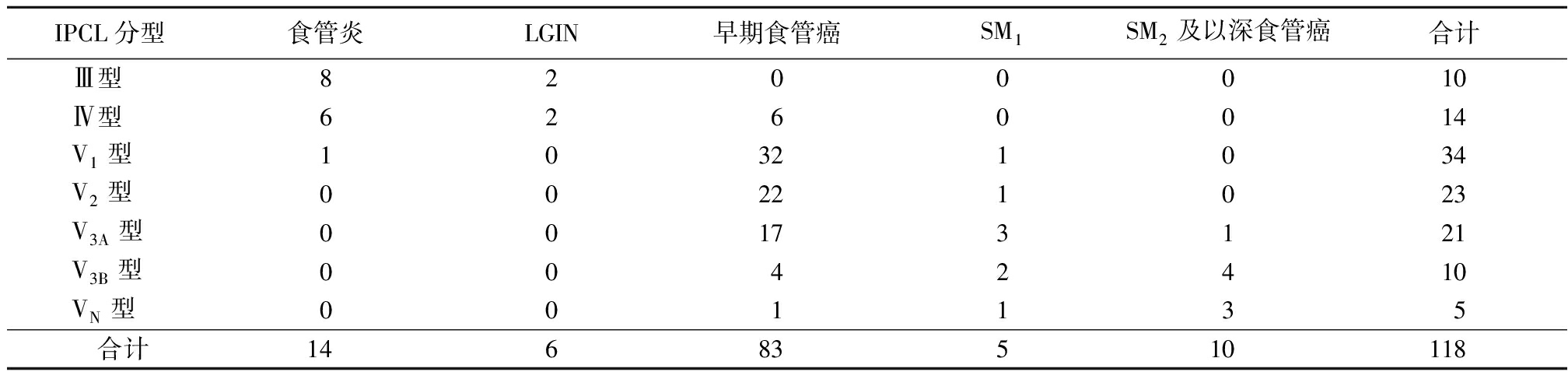
IPCL分型食管炎LGIN早期食管癌SM1SM2及以深食管癌合计Ⅲ型8200010Ⅳ型6260014V1型10321034V2型00221023V3A型00173121V3B型0042410VN型001135 合计14683510118
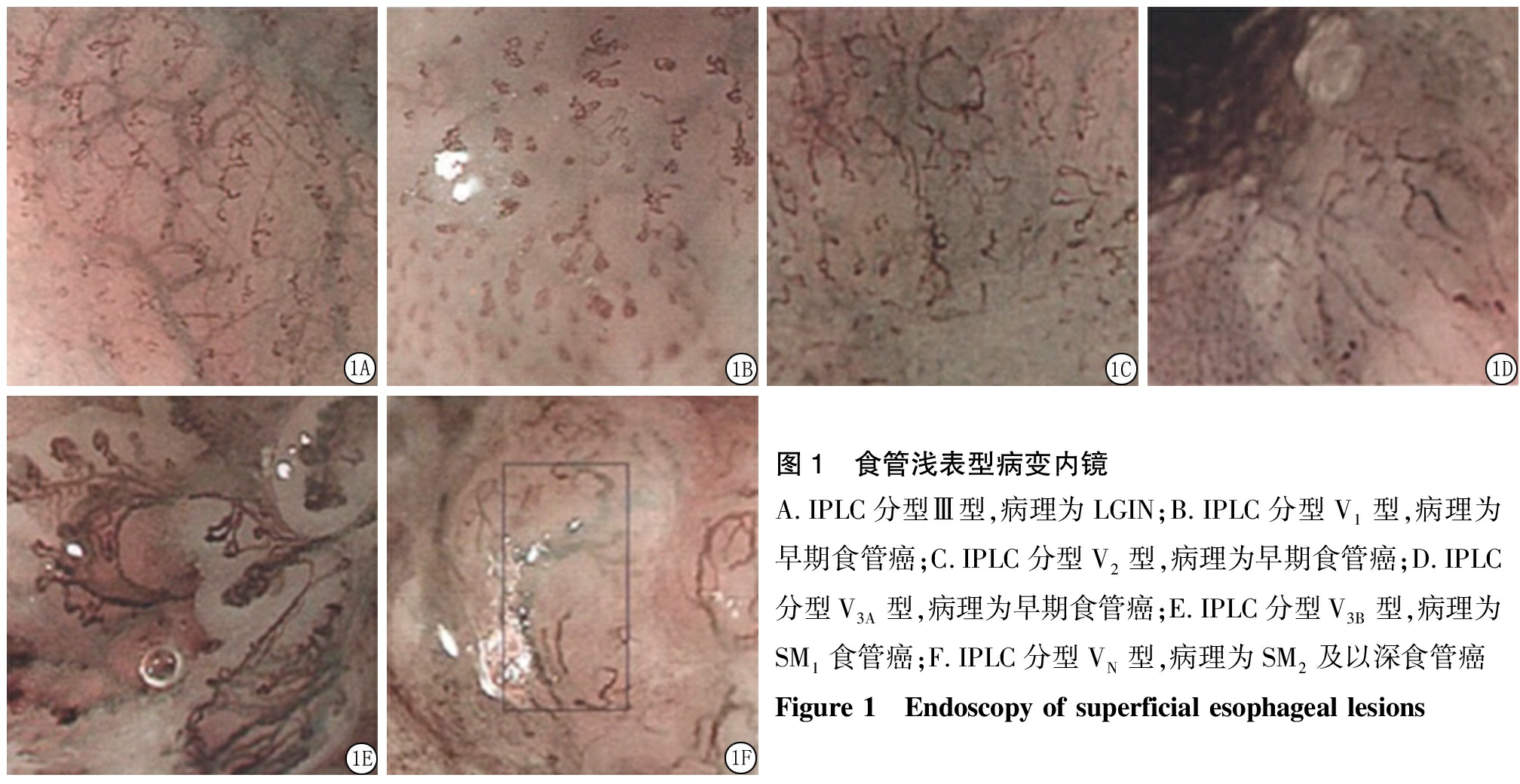
图1 食管浅表型病变内镜A.IPLC分型Ⅲ型,病理为LGIN;B.IPLC分型V1型,病理为早期食管癌;C.IPLC分型V2型,病理为早期食管癌;D.IPLC分型V3A型,病理为早期食管癌;E.IPLC分型V3B型,病理为SM1食管癌;F.IPLC分型VN型,病理为SM2及以深食管癌Figure 1 Endoscopy of superficial esophageal lesions
2.2 IPLC分型诊断食管癌的效果 V1型、V2型、V3A型诊断早期食管癌的敏感度、特异度、阳性预测值、阴性预测值分别为85.5%、80.0%、91.0%、83.9%;以V3B型、VN型诊断SM2及以深食管癌的敏感度、特异度、阳性预测值、阴性预测值分别为70.0%、92.6%、46.7%、90.7%;以Ⅲ型、Ⅳ型、V3B型、VN型诊断早期食管癌的敏感度、特异度、阳性预测值、阴性预测值分别为13.3%、20.0%、29.2%、8.9%,见表2。
表2 IPLC分型诊断食管癌的效果
Table 2 Effect of IPLC typing in the diagnosis of esophageal cancer (%)
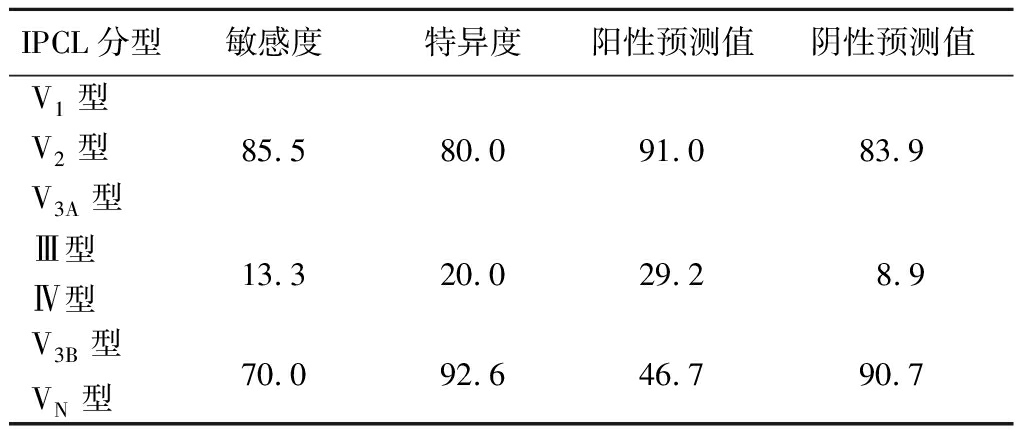
IPCL分型敏感度特异度阳性预测值阴性预测值V1型V2型85.580.091.083.9V3A型Ⅲ型Ⅳ型13.320.029.28.9V3B型VN型70.092.646.790.7
2.3 Cyclin D1、PDGFR在食管癌组织中表达情况分析 食管炎、LGIN、早期食管癌、SM1、SM2及以深食管癌组织中Cyclin D1、PDGFR表达程度差异有统计学意义(P<0.05),早期食管癌、SM1、SM2及以深食管癌组表达程度显著高于食管炎、LGIN组,差异有统计学意义(P<0.05),见表3。
表3 Cyclin D1、PDGFR在食管癌组织中表达情况分析
Table 3 Analysis of Cyclin D1 and PDGFR expression in esophageal cancer tissues (例数)
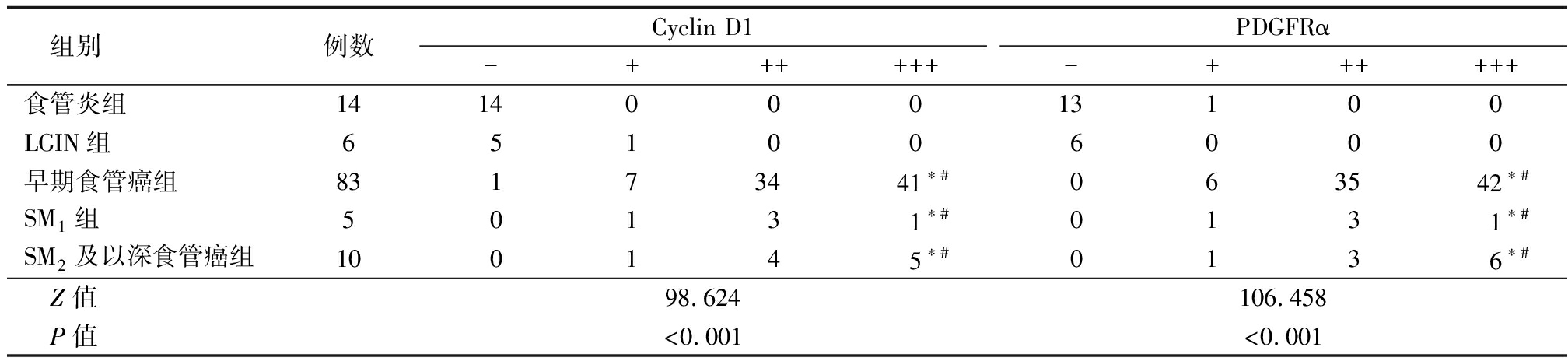
组别例数Cyclin D1-++++++PDGFRα-++++++食管炎组141400013100LGIN组651006000早期食管癌组83173441∗#063542∗#SM1组50131∗#0131∗#SM2及以深食管癌组100145∗#0136∗# Z值98.624106.458 P值<0.001<0.001
*P值<0.05与食管炎组比较 #P值<0.05与LGIN组比较(秩和检验)
2.4 早期食管癌预后影响因素的Cox回归分析 定义自变量为:PCL分型V3A型=1,V1型、V2型=0;Cyclin D1强阳性表达=1,其他=0;PDGFR强阳性表达=1,其他=0。食管癌预后情况作为因变量。结果显示,早期食管癌IPCL分型、Cyclin D1及PDGFR的表达均为早期食管癌预后的独立危险因素。见表4。
表4 Cox回归分析结果
Table 4 Results of Cox regression analysis

指标回归系数标准误Wald χ2值P值RR值95%CIPCL分型0.8360.24313.039<0.0012.3381.473~3.745Cyclin D10.7930.22512.034<0.0012.0931.402~3.293PDGFR 0.7830.2179.834<0.0012.0341.372~3.271
3 讨 论
食管癌多发于亚洲国家,居于全球死因的第6位。进展期食管癌预后极差,手术切除治愈率在20%以下,手术前后的放疗仅为辅助作用,对于提高生存率无益,因此,食管癌的早发现、早切除是改善预后的重点[6]。目前,消化道肿瘤的早期诊断主要依靠内镜常规内镜、放大内镜、色素内镜等,操作简单,诊断效果较好。然而,肿瘤发病机制复杂,单独依靠内镜直观观察肿瘤组织形态诊断食管癌,预测预后,容易漏诊或误诊[7]。随着肿瘤发病机制研究的深入,特异性分子标志物逐渐用于肿瘤诊断。本研究分析IPCL分型联合肿瘤标志物Cyclin D1、PDGFR在早期食管癌诊断和预测中的效果。
国内外多篇文章研究显示,NBI-ME下观察IPCL形态并进行分型有助于食管癌病灶的诊断[8-9],但诊断标准不统一。本研究选取国际广泛使用的井上晴洋的方法,分析浅表型病灶118例IPLC分型与病理结果的相关性,结果显示IPLC分型Ⅲ型、Ⅳ型以食管炎、LGIN为主,不需要进行进一步的治疗;V1型、V2型、V3A型以早期食管癌为主,需要进行手术切除,其诊断早期食管癌的敏感度和特异度均在80%以上,诊断效果较好,对于早期食管癌的诊断具有重要价值[10]。而V3B型、VN型以SM1、SM2及以深食管癌为主,需经手术或放化疗治疗,其诊断的敏感度和特异度分别为70.0%、92.6%。尽管IPCL分型能够有效诊断早期食管癌,并评估病灶浸润程度,有助于指导医师治疗方案的选择,但是,肿瘤生长过程中伴随着血管的异型增生,导致IPCL分型的准确量化存在困难,且内镜检查受心跳、呼吸、黏膜蠕动等影响,诊断具有一定的主观性[11]。
肿瘤特异性分子标志物弥补了IPCL分型的不足,能够客观评估肿瘤的恶化程度,对于食管癌的早期诊断和预后预测具有重要意义。Cyclin D1是细胞周期家族的重要成员,是细胞周期的正性调控因子,其高表达可激活CDK4,降低抑癌基因表达产物Rb蛋白对细胞周期的制动作用,促进细胞周期由G1期间向S期变化[12]。CAFs是肿瘤微环境中最主要的细胞类型,PDGFR是由CAFs分泌的细胞因子,具有促进上皮恶性转化、肿瘤的发生、侵袭和转移的作用,是食管癌发生和发展的必要条件[13]。目前,Cyclin D1、PDGFR均已成为食管癌潜在的诊断和治疗靶点[14-15]。本研究结果显示,Cyclin D1、PDGFR在食管炎、LGIN、早期食管癌、SM1、SM2及以深食管癌组织中表达存在差异,随着肿瘤恶性程度的增加,表达程度增强。因此,对于Cyclin D1、PDGFR表达程度较高的早期食管癌患者,浸润和淋巴转移的风险较高,在手术切除后应密切监测复发和转移情况,并依据术后复发情况给予相应的放疗或化疗等措施,以改善患者预后。
IPCL分型、Cyclin D1及PDGFR的表达均与早期食管癌的预后有关,Cox回归分析显示,三者均为早期食管癌预后的独立危险因素,表明三项指标联合应用,有助于全面评估食管癌病灶的危险程度及预后,以便医生为患者选择最佳的治疗方案,改善预后。
由于本研究样本量较少,结果还有待于进一步扩大化的前瞻性试验加以证实。另外,本文尚未对IPCL分型、Cyclin D1及PDGFR三者联合诊断和预测预后的联合方式进行研究,后续研究将进一步进行。
[1] 薛冰.食管癌术后肠内、肠外营养支持临床疗效比较[J].河北医科大学学报,2017,38(4):464-468.
[2] Chiu PW,Teoh AY,Wong VW,et al. Robotic-assisted minimally inva-sive esophagectomy for treatment of esophagealcarcinoma[J]. J Robot Surg,2017,11(2):193-199.
[3] Park SY,Kim DJ,Yu WS,et al. Robot-assisted thoracoscopic esophagec-tomy with extensive mediastinal lymphadenectomy:experience with 114 consecutive patients with intrathoracic esophageal cancer[J]. Dis Esoph-agus,2016,29(4):326-332.
[4] Cao ZH,Cheng JL,Zhang Y,et al. MicroRNA-375 inhibits oral squamous cell carcinoma cell migration and invasion by targeting platelet-derived growth factor-A[J]. Molecular Medicine Reports,2017,15(2):922-928.
[5] Lee JM,Chen SC,Yang SM,et al. Comparison of single-and multi-incision minimally invasive esophagectomy(MIE ) for treating esopha-geal cancer:a propensity-matched study[J]. Surg Endosc,2017,31(7):2925-2931.
[6] 侯跃龙,韩洪利.食管癌微创手术的研究进展[J].临床医学,2019,39(9):123-126.
[7] Xu J,Gao ZG,Wang L. Endoscopic analysis of early esophageal cancer and precancerous lesions in Kazakh patients[J]. Nan Fang Yi Ke Da Xue Xue Bao,2017,37(10):1415-1417.
[8] Gao QY,Fang JY. Early esophageal cancer screening in China[J]. Best Pract Res Clin Gastroenterol,2015,29(6):885-893.
[9] Mizumoto T,Hiyama T,Quach DT,et al. Magnifying endoscopy with narrow band imaging in estimating the invasion depth of superficial esophageal squamous cell carcinomas[J]. Digestion,2018,98(4):249-256.
[10] 田秋实.IPCL对非糜烂性胃食管反流病诊断价值的探讨[J/CD].临床医药文献电子杂志,2020,7(99):148-156.
[11] He YQ,Li AQ,Wang X,et al. Endoscopic submucosal dissection of high grade intraepithelial neoplasia of the head and neck in a patient after surgical resection of esophageal cancer[J]. Endoscopy,2015,47(S1):E49-E50.
[12] Qie S,Diehl JA. Cyclin D1,cancer progression,and opportunities in cancer treatment[J]. J Mol Med(Berl),2016,94(12):1313-1326.
[13] Lv W,Zeng G,Wu W,et al. Application of single-port videoassisted thoracoscope in treating thoracic oesophageal squamous cell carcinoma using McKeown approach[J]. J Minim Access Surg,2018,14(2):105-110.
[14] 李铁志,石彦涛,刘瑞林,等.P16,P38,P53 和 CyclinD1 在食道癌中表达的意义[J].中国病原生物学杂志,2016,11(1):73-78.
[15] 石红,陈盈.血小板源性生长因子及血管内皮生长因子与食管鳞状细胞癌肿瘤血管生成的关系研究[J].检验医学与临床,2016,13(13):1864-1866.