卵巢癌(ovarian cancer)每年大约新增240 000例患者,世界上第七常见的女性癌症,全球女性死亡最常见原因之一,探索卵巢癌发病机制、诊断标记物、潜在治疗靶点、预后相关指标已成为热门研究领域。尽管卵巢癌的诊断和治疗有了显著的改善,但许多患者的预后仍然很差,特别是晚期卵巢癌患者。为解决这一难题,研究者们试图寻找生物标记物来辅助卵巢癌的临床诊断和预后评价[1-3]。富含半胱氨酸肠蛋白1(cysteine-rich intestinal protein 1,CRIP1)是相对分子质量为8 000的小分子蛋白[4]。近年来已有文献报道其在多种类型肿瘤中过表达,包括甲状腺癌[5]、结直肠癌[6-7]、宫颈癌[8]等,并对疾病的预后有重要的影响,然而在卵巢癌发生发展过程中的作用至今尚不清楚,也未曾有文献报道,因此本研究通过采用生物信息学方法探究CRIP1在卵巢癌中表达水平、与患者预后关系以及相关生物学功能,建议CRIP1成为卵巢癌诊治的重要靶点和预后判断的关键指标。
1 资 料 与 方 法
1.1 CRIP1基因在各类癌症中的表达水平 使用Oncomine数据库(https://www. oncomine.org/)分析CRIP1基因在不同类型癌症研究中的表达水平以及在不同病理分型的卵巢癌中的表达分布。筛选条件:①Gene,CRIP1;②Analysis type,Cancer vs Normal analysis;③P-value,0.05;④Fold change,1.5;⑤Gene rank,All;⑥Date type,Mrna。
1.2 CRIP1表达与卵巢癌患者预后关系 运用Kaplan-Meier Plotter(http://kmplot.com/analysis/)分析高表达CRIP1的卵巢癌患者和低表达CRIP1的卵巢癌患者总生存期、无进展生存期、进展后生存期的关系,筛选条件:①Spite patients by:auto select best cutoff;②Follow up threshold:all;③Probe set options:user selected probe set;④Survival:overall survival/progression-free survival/post pro-gression survival。根据临床特征,包括不同肿瘤分期、肿瘤分级、不同化疗药方案对卵巢癌患者进行分组,分析CRIP1基因表达与卵巢癌患者总生存期的关系。
1.3 分析卵巢癌中CRIP1相互作用功能蛋白 使用STRING数据库(https://string-db.org/)11.0版本在人类物种中检索目的基因CRIP1,绘制蛋白互作网络(protein protein interaction network,PPI network),并且基于关键蛋白节点进行Go-Biological Process分析。筛选条件:①protein name:CRIP1;②organism: Homo sapiens。
1.4 分析卵巢癌中与CRIP1紧密相关蛋白 使用GEPIA数据库(http://gepia.cancer-pku.cn)分析CRIP1与紧密相关蛋白的P值和Pearson相关系数。筛选条件:①Gene A,CRIP1;②Gene B,相关蛋白;③Correlation Coefficient,Pearson;④Used Expression Datasets,TCGA Tumor,Ovarian serous cystadenocarcinoma。
1.5 统计学方法 应用Oncomine数据库分析CRIP1基因的表达水平,比较采用独立样本t检验;Kaplan-Meier Plotter分析CRIP1基因表达与卵巢癌患者预后关系,采用Log-rank检验比较其高表达和低表达的卵巢癌患者生存差异; GEPIA数据库分析Pearson相关系数,筛选与CRIP1具有正、负相关性的功能蛋白。P<0.05为差异有统计学意义。
2 结 果
2.1 CRIP1基因在多种类型肿瘤中差异性表达 在卵巢癌中高表达 Oncomine数据库收集到337项CRIP1基因与肿瘤相关研究,166项研究中肿瘤组织与正常组织的CRIP1 mRNA表达水平差异有统计学意义(P<0.05),其中有102项研究中CRIP1在肿瘤组织中表达呈现升高水平,包括乳腺癌(24项)、肾癌(8项)、淋巴瘤(12项)、白血病(8项)以及卵巢癌(6项)等。64项研究中CRIP1在肿瘤组织中表达呈现下降水平,包括结直肠癌(9项)、头颈癌(8项)、肾癌(6项)、以及肺癌(15项)等,其中在卵巢癌的研究中CRIP1 mRNA在癌组织中均过表达分布,未发现有表达下调的研究(图1)。在卵巢癌不同病理分型的6项研究中,CRIP1在各类卵巢癌中的表达水平均高于正常卵巢组织(差异倍数>1.5),差异有统计学意义(P<0.05),见表1。
表1 不同分型卵巢癌与正常卵巢组织间CRIP1表达 显著性变化
Table 1 The significant changes of CRIP1 expression between different types of ovarian cancer and normal ovary tissue
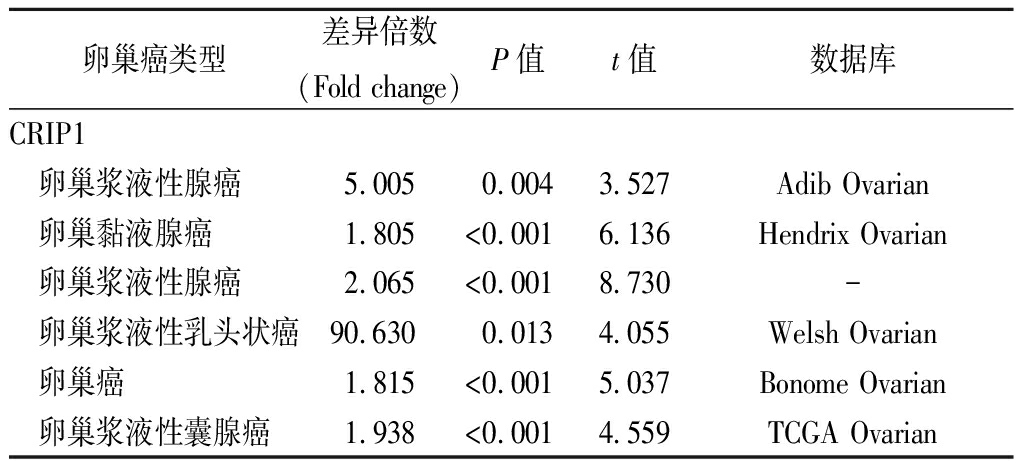
卵巢癌类型差异倍数(Fold change)P值t值数据库CRIP1 卵巢浆液性腺癌5.0050.0043.527Adib Ovarian 卵巢黏液腺癌1.805<0.0016.136Hendrix Ovarian 卵巢浆液性腺癌2.065<0.0018.730- 卵巢浆液性乳头状癌90.6300.0134.055Welsh Ovarian 卵巢癌1.815<0.0015.037Bonome Ovarian 卵巢浆液性囊腺癌1.938<0.0014.559TCGA Ovarian
数据库:Adib Ovarian,Br J Cancer,2004;Hendrix Ovarian,Cancer Res,2006;Welsh Ovarian,Proc Natl Acad Sci USA,2001;Bonome Ovarian,Cancer Res,2008;TCGA Ovarian,2013
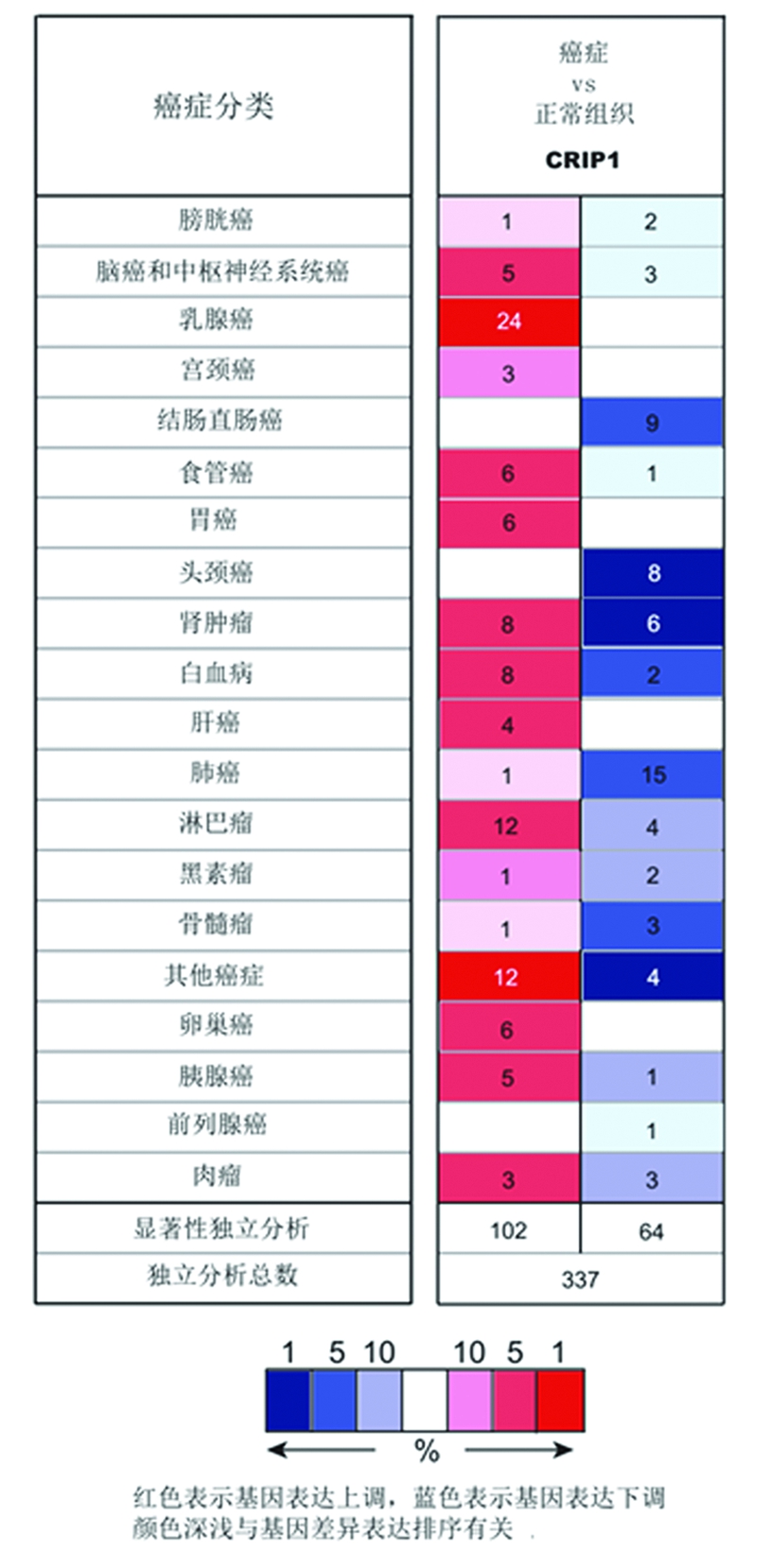
图1 CRIP1基因在不同类型肿瘤中表达水平
Figure 1 The expression of CRIP1 gene in different types of tumors
2.2 CRIP1高表达的卵巢癌患者预后较差 运用Kaplan-Meier Plotter分析CRIP1基因表达与卵巢癌患者预后的相关性,包括卵巢癌患者10年总生存期、无进展生存期以及进展后生存期3个指标。总生存期关系:CRIP1高表达组卵巢癌患者总生存期显著低于低表达组卵巢癌患者(P<0.05;HR=1.14);无进展生存期关系:CRIP1低表达组卵巢癌患者无进展生存期显著高于高表达组患者(P<0.05;HR=1.19);进展后生存期关系:CRIP1低表达组和高表达组卵巢癌患者进展后生存期差异无统计学意义(P>0.05;HR=0.86),以上数据预示CRIP1基因可作为卵巢癌预后诊断标记物(图2)。接下来根据临床特征分析CRIP1基因表达与卵巢癌患者总生存期的关系,把卵巢癌患者按照不同肿瘤分期和肿瘤分级进行分组,并未发现CRIP1高表达组和低表达组患者总生存期在不同阶段存在显著差异。然而按照卵巢癌患者接受不同的化疗方案进行分组,发现使用紫杉醇、多西他赛、拓扑替康化疗药的患者中,CRIP1高表达组总生存期显著低于低表达组(P<0.01,HR=1.88;P<0.05,HR=1.75;P<0.05,HR=1.57),说明CRIP1高表达的卵巢癌患者接受上述3种化疗方案后预后较差,见表2。
表2 根据临床特征分析CRIP1高表达与 低表达组卵巢癌患者总生存期关系
Table 2 The analysis of overall survival of ovarian cancer patients with high or low expression of CRIP1 according to the clinical characteristics
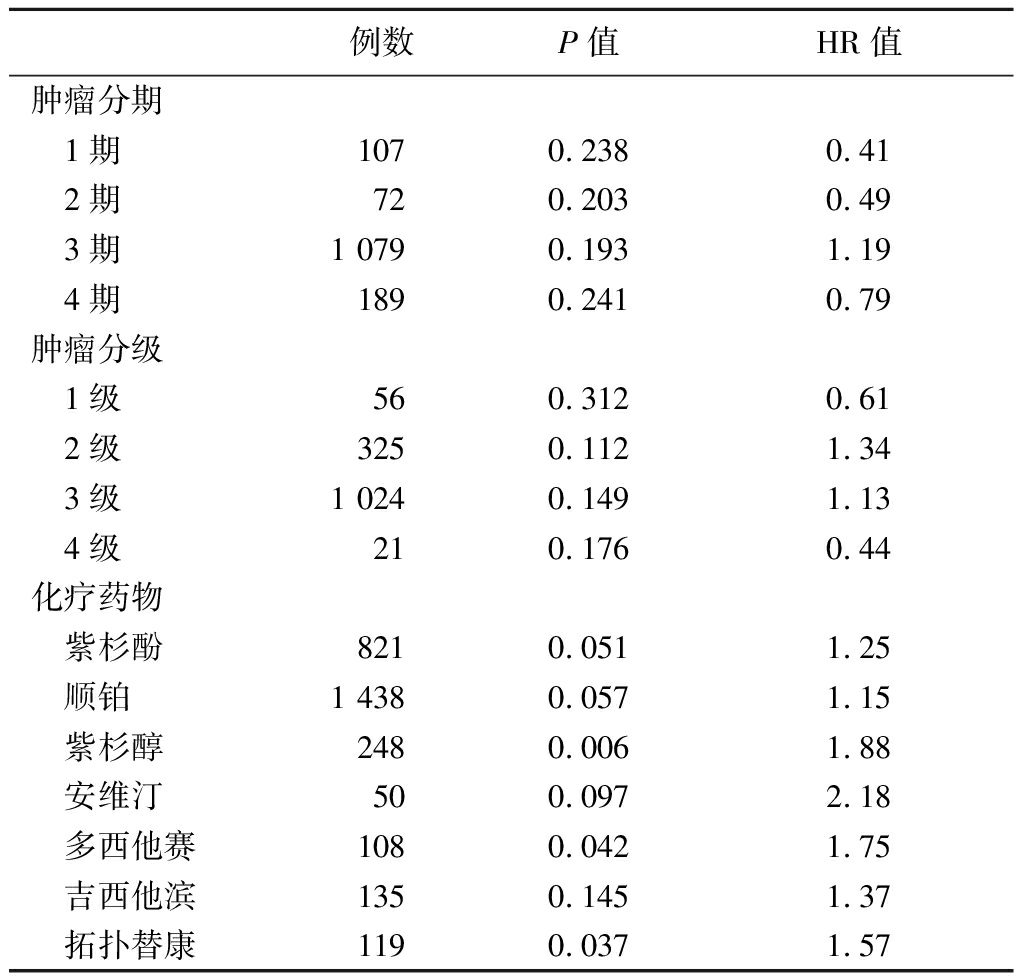
例数P值HR值肿瘤分期 1期1070.2380.41 2期720.203 0.49 3期1 0790.1931.19 4期1890.2410.79肿瘤分级 1级560.3120.61 2级3250.1121.34 3级1 0240.1491.13 4级210.1760.44化疗药物 紫杉酚8210.0511.25 顺铂1 4380.0571.15 紫杉醇2480.006 1.88 安维汀500.0972.18 多西他赛1080.042 1.75 吉西他滨1350.1451.37 拓扑替康1190.037 1.57
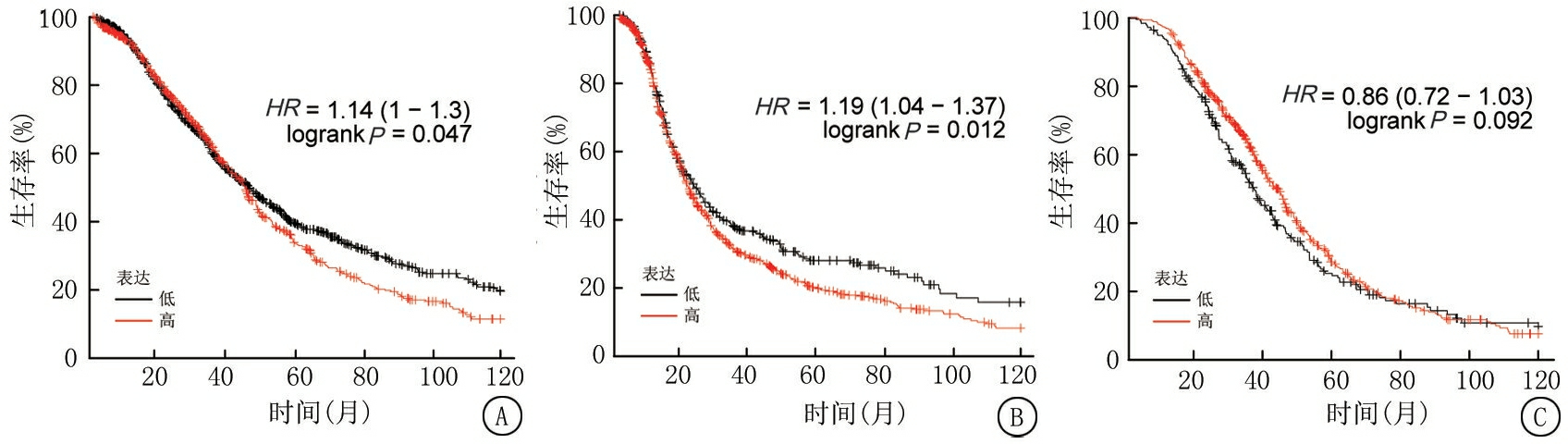
图2 CRIP1基因高表达和低表达的卵巢癌患者预后关系
A.CRIP1基因高表达和低表达的卵巢癌患者总生存期关系;B.无进展生存期关系;C.进展后生存期关系
Figure 2 The prognosis of ovarian cancer patients with high and low expression of CRIP1 gene
2.3 探索CRIP1相互作用的功能蛋白,并进行GO分析 使用STRING数据库预测到CRIP1蛋白与20个功能蛋白有相互作用,构建蛋白网络图,发现LMO1、LMO2、LMO3、PQLC3、CBFB、DBI、LGALS3、YAP1、STK3、STK4、CEBPE、CAPG、LIMS2、NME1、TAGLN2、ATOX1、KBTBD11、FGD2、ANKLE1、DSTN与CRIP1蛋白相互作用。进一步使用GEPIA数据库分析,获得4个功能蛋白在卵巢浆液性囊腺癌中与CRIP1蛋白关系更为密切,其中与STK4(r=-0.24,P<0.001)和YAP1(r=-0.24,P<0.001)呈负相关,与LGALS3(r=0.23,P<0.001)和ATOX1(r=0.22,P<0.001)呈正相关(图3);基于相互作用蛋白网络的构建,进行CRIP1蛋白生物过程Go分析,发现CRIP1蛋白参与造血干细胞分化的调控、调节造血功能、Hippo信号通路、发育过程调节、胚胎细胞分化调节、凋亡信号通路调节、造血功能调节、脂肪细胞分化调节等生物学过程,见表3。
表3 CRIP1相互作用蛋白网络的生物过程Go分析
Table 3 Gobiological process of CRIP1-interacting protein network
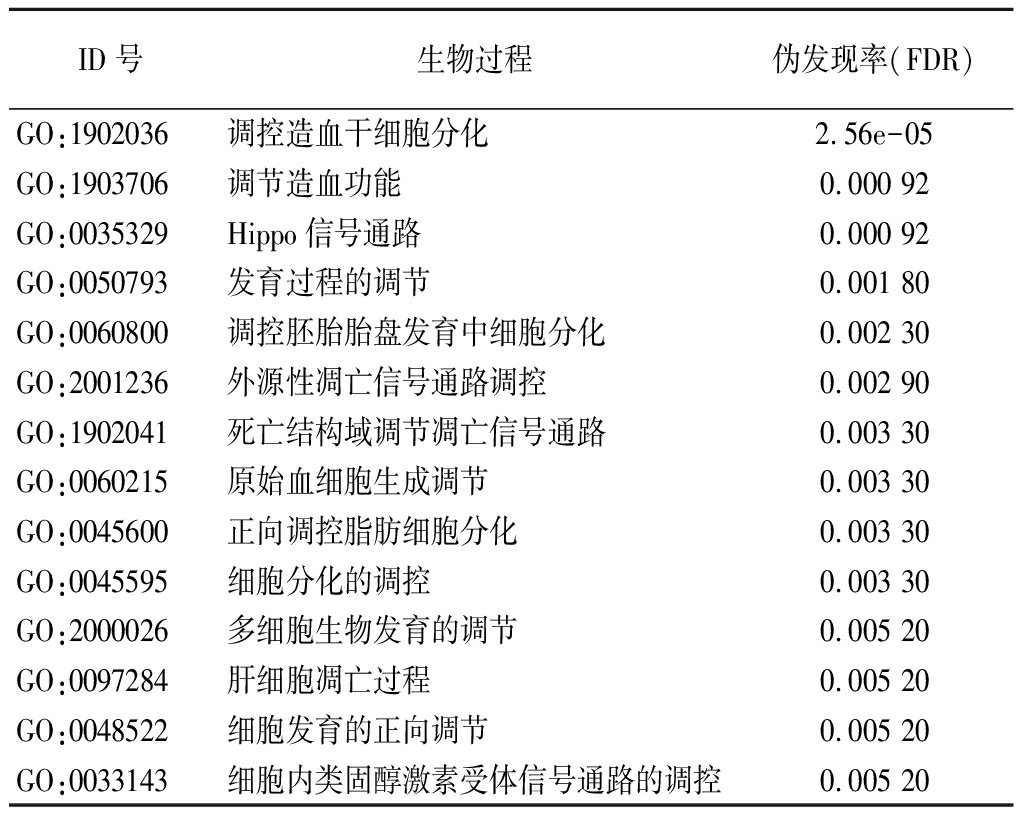
ID号生物过程伪发现率(FDR)GO:1902036调控造血干细胞分化2.56e-05GO:1903706调节造血功能0.000 92GO:0035329Hippo信号通路0.000 92GO:0050793发育过程的调节0.001 80GO:0060800调控胚胎胎盘发育中细胞分化0.002 30GO:2001236外源性凋亡信号通路调控0.002 90GO:1902041死亡结构域调节凋亡信号通路0.003 30GO:0060215原始血细胞生成调节0.003 30GO:0045600正向调控脂肪细胞分化0.003 30GO:0045595细胞分化的调控0.003 30GO:2000026多细胞生物发育的调节0.005 20GO:0097284肝细胞凋亡过程0.005 20GO:0048522细胞发育的正向调节0.005 20 GO:0033143细胞内类固醇激素受体信号通路的调控0.005 20
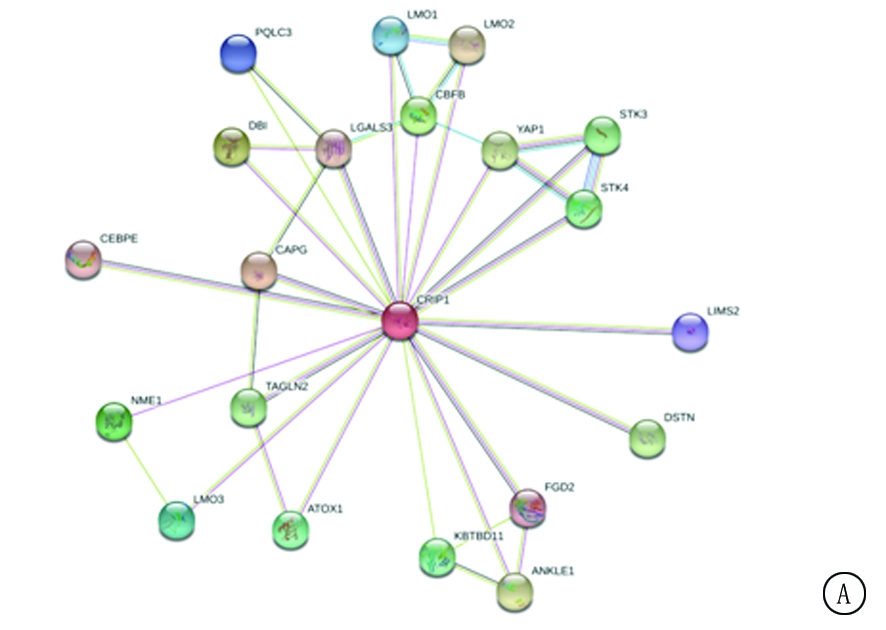
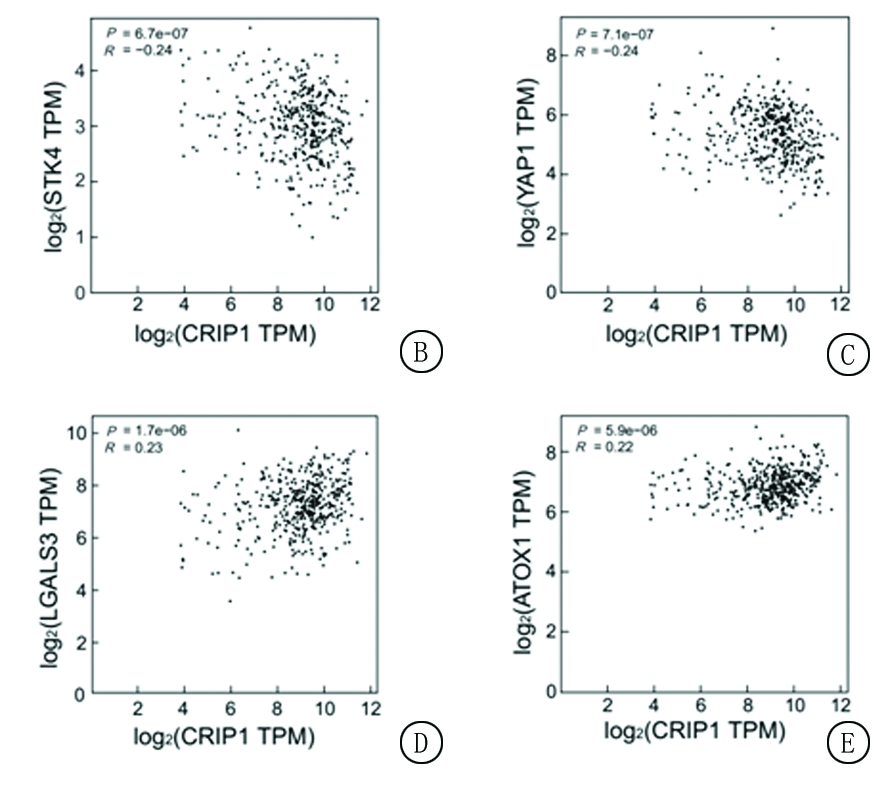
图3 与CRIP1相互作用的功能蛋白
A.蛋白互作网络图;B.STK4与CRIP1相关性;C.YAP1与与CRIP1相关性;D.LGALS3与CRIP1相关性;E.ATOX1与CRIP1相关性
Figure 3 CRIP1-interacting functional proteins
3 讨 论
富含半胱氨酸肠蛋白(cysteine-rich intestinal protein,CRIP)属于LIM(Lin-1,Isl1,Mec3)蛋白家族的一个亚家族,因富含9%的半胱氨酸而得名。CRIP家族成员包括CRIP1、CRIP2和CRIP3。CRIP1广泛分布在人体中,如小肠、结肠、肺、胸腺、脾等,也可通过锌、细胞因子和激素体外诱导,在真核细胞的生长发育以及分化过程中发挥重要调节作用[4]。CRIP1基因在肿瘤方面的研究较为热门,已经发现在人类宫颈癌、胰腺癌、甲状腺癌等肿瘤中高表达分布[9-10]。有文章指出,CRIP1在甲状腺癌中高表达,并且在肿瘤细胞的增殖、迁移以及侵袭过程中扮演致癌基因的角色[5]。有研究证明,CRIP1基因异常表达与结直肠癌的转移程度有关,沉默CRIP1基因能有效抑制肿瘤的迁移和侵袭,有助于结肠癌预后和转移生物标志物的开发[7]。研究报道了CRIP1在人类宫颈癌进展中的作用,发现CRIP1在宫颈癌细胞系中高表达,通过介导上皮间质转化,激活Wnt /β-连环蛋白信号通路,促进肿瘤细胞迁移和侵袭[8]。以上研究说明CRIP1在多种类型肿瘤进展中发挥重要的作用,有望成为肿瘤治疗的新靶点,但是至今并没有文章报道CRIP1在人类卵巢癌发生发展过程中起到怎样的作用?因此本研究通过采用生物信息学方法探究CRIP1在卵巢癌中表达水平、与患者生存期的关系以及相关生物学功能。
研究发现CRIP1在不同类型的肿瘤中差异性表达,102项研究中肿瘤表达呈显著上升水平,64项研究其表达呈显著下降水平,但是在6项卵巢癌研究中其肿瘤组织中的表达水平显著高于正常卵巢组织,并且在不同病理分型的卵巢癌中,如卵巢浆液性腺癌(卵巢浆液性囊腺癌、卵巢浆液性乳头状癌)、卵巢黏液腺癌中均高表达分布,预示着CRIP1过表达水平对卵巢癌发生发展会有重要作用。接下来分析CRIP1基因与卵巢癌患者预后的关系,CRIP1基因高表达的卵巢癌患者总生存期和无进展生存期均显著降低;根据不同的临床特征进行分组,CRIP1表达虽与不同分期和不同分级的卵巢癌患者总生存期无密切相关性,但是CRIP1高表达的患者在接受紫杉醇、多西他赛、拓扑替康化疗后总生存期显著降低,说明CRIP1高表达的患者应合理选择化疗方案,规避风险,说明CRIP1基因高表达是卵巢癌预后的危险因素,提示CRIP1作为预后分子诊断标志物具有一定的应用前景。为了更好的了解CRIP1蛋白的作用机制以及与其他蛋白的功能联系,进一步通过STRING数据库构建CRIP1相关蛋白网络图,预测20个功能蛋白与CRIP1相互作用,进一步GEPIA数据库分析获得4个紧密相关蛋白,通过查阅文献均在卵巢癌中发挥作用:STK4,压力激活的、促凋亡的激酶,是Hippo信号通路的关键成分,STK4/Hippo信号的异常或者缺失会导致机体发育障碍、致癌作用、癌症预后较差等[11-12];YAP1,作为Hippo信号通路的效应因子,在许多癌症中Yap1的动态表达会导致表型改变,在肝癌、胃癌、卵巢癌等多种癌症类型中过表达的Yap1被认为是不良预后标志物[13-14];LGALS3,参与多种细胞功能,如细胞凋亡、先天免疫、细胞黏附和T细胞调节等,在多种癌症中表达上调或下调,与患者预后紧密相关[15-16];ATOX1,作为抗超氧化物和过氧化氢的抗氧化剂,可能在癌症的发生中产生重要作用。基于CRIP1相互作用蛋白网络的构建,进行Go聚类分析发现CRIP1蛋白参与造血干细胞分化、造血功能、Hippo信号通路以及发育调节等生物学过程,以上分析提供了CRIP1在卵巢癌中可能的作用机制,明确的机制还需要进一步实验研究。
本研究通过生物信息学方法和大数据分析从不同层面揭示了CRIP1在卵巢癌中的表达及其临床意义,研究证明CRIP1高表达与卵巢癌患者预后负相关,提示CRIP1在卵巢癌发生发展过程中可能扮演致癌基因的角色,有望成为卵巢癌诊治的重要靶点和预后判断的关键指标。
[1] Stewart C,Ralyea C,Lockwood S. Ovarian cancer:an integrated review[J]. Semin Oncol Nurs,2019,35(2):151-156.
[2] Koeger PT Jr,Drapkin R. Pathogenesis and heterogeneity of ovarian cancer[J]. Curr Opin Obstet Gynecol,2017,29(1):26-34.
[3] 王平,王中显,王冬花,等.下调CTNNB1表达对人卵巢癌HO8910细胞内质网应激和凋亡的影响[J].郑州大学学报(医学版),2020,55(4):480-483.
[4] 李明月.CRIP1与相关疾病关联性的研究进展[J].当代医药论丛,2019,17(23):83-84.
[5] Li HG,Zhao LH,Zhang ZH,et al. The impact of cysteine-rich intestinal protein 1(CRIP1) on thyroid carcinoma[J]. Cell Physiol Biochem,2017,43(5):2037-2046.
[6] Zhang L,Zhou R,Zhang W,et al. Cysteine-rich intestinal protein 1 suppresses apoptosis and chemosensitivity to 5-fluorouracil in colorectal cancer through ubiquitin-mediated fas degradation[J]. J Exp Clin Cancer Res,2019,38(1):120.
[7] He G,Zou L,Zhou L,et al. Cysteine-rich intestinal protein 1 silencing inhibits migration and invasion in human colorectal cancer[J]. Cell Physiol Biochem,2017,44(3):897-906.
[8] Zhang LZ,Huang LY,Huang AL,et al. CRIP1 promotes cell migration,invasion and epithelial-mesenchymal transition of cervical cancer by activating the Wnt/β catenin signaling pathway[J]. Life Sci,2018,207:420-427.
[9] Cai H,Chen J,Liu J,et al. CRIP1,a novel immune-related protein,activated by Enterococcus faecalis in porcine gastrointestinal epithelial cells[J]. Gene,2017,598:84-96.
[10] He G,Zhu H,Yao Y,et al. Cysteine-rich intestinal protein 1 silencing alleviates the migration and invasive capability enhancement induced by excessive zinc supplementation in colorectal cancer cells[J]. Am J Transl Res,2019,11(6):3578-3588.
[11] Pombo CM,Iglesias C,Sartages M,et al. MST kinases and metabolism[J]. Endocrinology,2019,160(5):1111-1118.
[12] Lin CH,Hsu TI,Chiou PY,et al. Downregulation of STK4 promotes colon cancer invasion/migration through blocking β-catenin degradation[J]. Mol Oncol,2020,14(10):2574-2588.
[13] Feng S,Sun H,Zhu W. MiR-92 overexpression suppresses immune cell function in ovarian cancer via LATS2/YAP1/PD-L1 pathway[J]. Clin Transl Oncol,2020,23(3):450-458.
[14] Wei X,Jia Y,Lou H,et al. Targeting YAP suppresses ovarian cancer progression through regulation of the PI3K/Akt/mTOR pathway[J]. Oncol Rep,2019,42(6):2768-2776.
[15] Wang D,You D,Li L. Galectin-3 regulates chemotherapy sensitivity in epithelial ovarian carcinoma via regulating mitochondrial function[J]. J Toxicol Sci,2019,44(1):47-56.
[16] Luk HM,Wang DY,Xie LL,et al. Expression and clinical significance of Gal-3 and NFκB pathway-related factors in epithelial ovarian carcinoma[J]. Int J Clin Exp Pathol,2020,13(5):1197-1205.