肺炎支原体肺炎(mycoplasma pneumoniae pneumonia,MPP)是儿科常见呼吸系统疾病,一般预后良好,但部分患儿经大环内酯类抗生素治疗1周及以上病情仍未得到缓解,甚至导致严重肺内外并发症(如塑型性支气管炎),被定义为难治性MPP(refractory MPP,RMPP),严重影响患儿生命健康[1-2]。积极探寻简单、快速的临床判断指标具有重要意义。血常规是RMPP的常规检查项目,但易受饮食、药物等多因素影响,临床应用存在一定局限性[3-4]。近年来研究发现,RMPP患儿存在明显免疫功能紊乱,免疫球蛋白异常表达可能是RMPP发生发展的重要因素之一[5]。此外,D-二聚体(D-Dimer,D-D)作为反映机体纤溶状态的生物学指标,在重症感染监测方面的作用越来越受到临床重视[6-7]。基于此,本研究旨在探讨RMPP患儿免疫球蛋白、血常规、D-D联合预测塑型性支气管炎发生风险的效能,以及N%、CRP预测不同分型塑型性支气管炎的价值,为临床治疗RMPP提供参考。报告如下。
1 资 料 与 方 法
1.1 一般资料 选取2016年3月—2020年2月我院收治的RMPP患儿125例作为RMPP组, MPP患儿125例作为MPP组。RMPP组男性60例,女性65例,年龄1~14岁,平均(6.59±2.68)岁;体重(23.05±6.33) kg;RMPP组男性64例,女性64例,年龄1~14岁,平均(6.82±2.75)岁;体重(22.78±5.97) kg。2组性别、年龄、体重差异无统计学意义(P>0.05),具有可比性。
本研究经医院医学伦理委员会审批通过。
1.2 纳入标准和排除标准 纳入标准:①均符合《儿童肺炎支原体肺炎诊治专家共识(2015年版)》[8]中MPP诊断标准;②RMPP组均经大环内酯类抗生素(如红霉素、罗红霉素、阿奇霉素)治疗1周及以上,仍持续发热,体温≥38.5 ℃,临床症状及胸部影像学仍持续进展;③均无结核病、自身免疫性疾病;④患儿监护人知晓本研究,并签署知情同意书。排除标准:①恶性肿瘤;②入院前1个月有糖皮质激素、免疫抑制剂用药史者;③血液系统疾病患儿;④先天性心脏病患儿;⑤合并其他呼吸系统疾病患儿;⑥近期有严重创伤、烧伤或手术史者。
1.3 方法 实验室指标检测方法:所有患儿入组第2天采集空腹静脉血5 mL,2 mL血液标本采用深圳市凯特生物医疗电子科技有限公司生产的CT-3180型全自动血液分析仪进行血常规检查,检查指标包括白细胞计数(white blood cell count,WBC)、中性粒细胞百分比(percentage of neutrophils,N%)、淋巴细胞百分比(percentage of lymphocytes,L%)、血小板(platelet,PLT)、乳酸脱氢酶(lactate dehydro-genase,LDH)、C反应蛋白(C-reactive protein,CRP)、红细胞分布宽度(red blood cell distribution width,RDW)、前清蛋白(pre-albumin,PAB)。3 mL血液标本以3 500 r/min离心处理5 min后取血清,置于-70 ℃冷藏室内备用,采用免疫比浊法检测血清免疫球蛋白(immunoglobulin,Ig)A、IgM、IgE、IgG水平,试剂盒购自深圳市生科源技术有限公司,采用免疫荧光法检测血清D-D水平,试剂盒购自深圳微点生物技术有限公司。
1.4 观察指标 ①比较2组血常规、免疫球蛋白、D-D水平。②比较RMPP组是否发生塑型性支气管炎患儿血常规、免疫球蛋白、D-D水平,塑型性支气管炎[9]经支气管镜检查可见呼吸道黏膜充血、水肿、黏液性分泌物增多,支气管部分管腔被痰栓堵塞,通过灌洗、吸引及活检钳取出后浸于生理盐水中,展开后均呈“树枝样”质韧塑型物改变。③探究发生塑型性支气管炎的影响因素。④探究免疫球蛋白、血常规、D-D与塑型性支气管炎严重程度的相关性,塑型性支气管炎严重程度采用第三代小儿死亡危险评分(pediatric risk of mortalityⅢ,PRISMⅢ)[10]评分表示,根据入院12 h内查体及实验室检查最差值进行评估,分值越高表示病情越严重。⑤探究免疫球蛋白、血常规、D-D预测塑型性支气管炎的效能。⑥比较RMPP组发生塑型性支气管炎的患儿中不同分型塑型性支气管炎的免疫球蛋白、血常规、D-D水平,探究各指标预测不同分型塑型性支气管炎的价值,Ⅰ型指炎症细胞浸润性,Ⅱ型指非炎症细胞浸润性。
1.5 统计学方法 应用SPSS 22.0统计软件分析数据。计数资料比较采用χ2检验,计量资料比较采用独立样本t检验,相关性分析采用Pearson相关系数模型,影响因素确定采用Logistic多因素回归分析,预测效能分析采用受试者工作特征(receiver operating characteristic,ROC)曲线,获取曲线下面积(area under the curve,AUC)、可信区间、敏感度、特异度及cut-off值,不同预测方案间曲线下面积比较采用DeLong检验,联合诊断实施Logistic二元回归拟合,返回预测概率logit(p),将其作为独立检验变量。P<0.05为差异有统计学意义。
2 结 果
2.1 2组血常规、免疫球蛋白、D-D水平比较 RMPP组WBC、N%、LDH、CRP、IgM、IgE、D-D水平高于MPP组,L%、PLT、PAB水平低于MPP组,差异有统计学意义(P<0.05);2组RDW、IgA、IgG水平差异无统计学意义(P>0.05)。见表1。
表1 2组血常规、免疫球蛋白、D-D水平比较
Table 1 Comparison of blood routine,immunoglobulin,D-D between two groups![]()
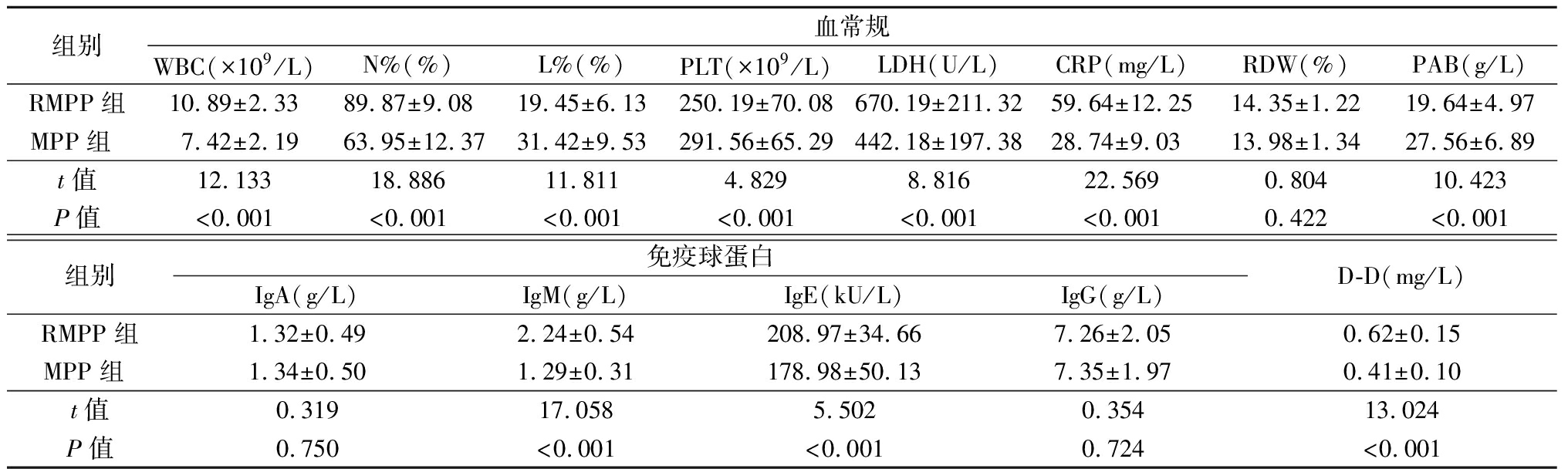
组别血常规WBC(×109/L)N%(%)L%(%)PLT(×109/L)LDH(U/L)CRP(mg/L)RDW(%)PAB(g/L)RMPP组10.89±2.3389.87±9.0819.45±6.13250.19±70.08670.19±211.3259.64±12.2514.35±1.2219.64±4.97MPP组 7.42±2.1963.95±12.3731.42±9.53291.56±65.29442.18±197.3828.74±9.0313.98±1.3427.56±6.89t值12.13318.88611.8114.8298.81622.5690.80410.423P值<0.001<0.001<0.001<0.001<0.001<0.0010.422<0.001组别免疫球蛋白IgA(g/L)IgM(g/L)IgE(kU/L)IgG(g/L)D-D(mg/L)RMPP组1.32±0.492.24±0.54208.97±34.667.26±2.050.62±0.15MPP组 1.34±0.501.29±0.31178.98±50.137.35±1.970.41±0.10t值0.31917.0585.5020.35413.024P值0.750<0.001<0.0010.724<0.001
2.2 RMPP组是否发生塑型性支气管炎患儿免疫球蛋白、血常规、D-D水平比较 RMPP组中发生塑型性支气管炎19例,未发生塑型性支气管炎106例。塑型性支气管炎患儿N%、LDH、CRP、IgM、IgE、D-D水平高于无塑型性支气管炎患儿,L%、PLT、PAB低于无塑型性支气管炎患儿,差异有统计学意义(P<0.05);2组WBC、RDW、IgA、IgG水平差异无统计学意义(P>0.05)。见表2。
表2 RMPP组是否发生塑型性支气管炎患儿免疫球蛋白、血常规、D-D比较
Table 2 Comparison of immunoglobulin, blood routine and D-D in children with plastic bronchitis in RMPP group![]()
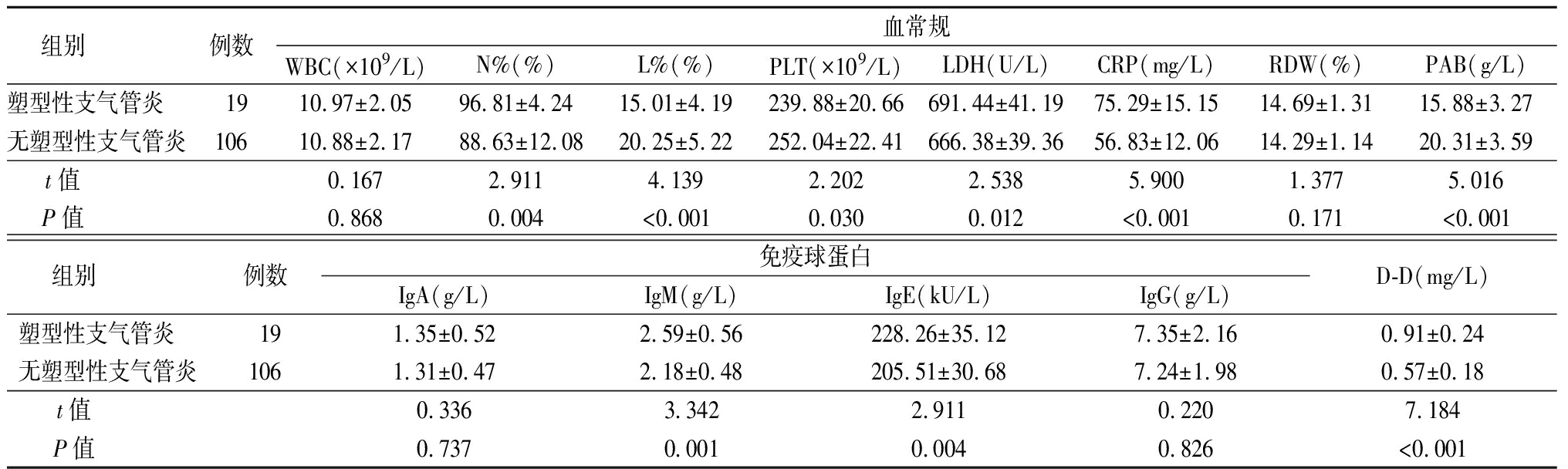
组别 例数血常规WBC(×109/L)N%(%)L%(%)PLT(×109/L)LDH(U/L)CRP(mg/L)RDW(%)PAB(g/L)塑型性支气管炎 1910.97±2.0596.81±4.2415.01±4.19239.88±20.66691.44±41.1975.29±15.1514.69±1.3115.88±3.27无塑型性支气管炎10610.88±2.1788.63±12.0820.25±5.22252.04±22.41666.38±39.3656.83±12.0614.29±1.1420.31±3.59t值 0.1672.9114.1392.2022.5385.9001.3775.016P值 0.8680.004<0.0010.0300.012<0.0010.171<0.001组别 例数免疫球蛋白IgA(g/L)IgM(g/L)IgE(kU/L)IgG(g/L)D-D(mg/L)塑型性支气管炎 191.35±0.522.59±0.56228.26±35.127.35±2.160.91±0.24无塑型性支气管炎1061.31±0.472.18±0.48205.51±30.687.24±1.980.57±0.18t值 0.3363.3422.9110.2207.184P值 0.7370.0010.0040.826<0.001
2.3 塑型性支气管炎的影响因素分析 以塑型性支气管炎(未发=0,发生=1)作为因变量,以N%(<89.87%=0,≥89.87%=1)、L%(<19.45%=0,≥19.45%=1)、PLT(<250.19×109/L=0,≥250.19×109/L=1)、LDH(<670.19 U/L=0,≥670.19 U/L=1)、CRP(<59.64 mg/L=0,≥59.64 mg/L=1)、PAB(<19.64 g/L=0,≥19.64 g/L=1)、IgM(<2.24 g/L=0,≥2.24 g/L=1)、IgE(<208.97 kU/L=0,≥208.97 kU/L=1)、D-D(<0.62 mg/L=0,≥0.62 mg/L=1)为自变量进行多因素Logistic回归分析,结果显示,N%、CRP、IgM、IgE、D-D升高是发生塑型性支气管炎的危险因素(P<0.05)。见表3。
表3 塑型性支气管炎影响因素的Logistic回归分析
Table 3 Logistic analysis of influencing factors of plastic bronchitis
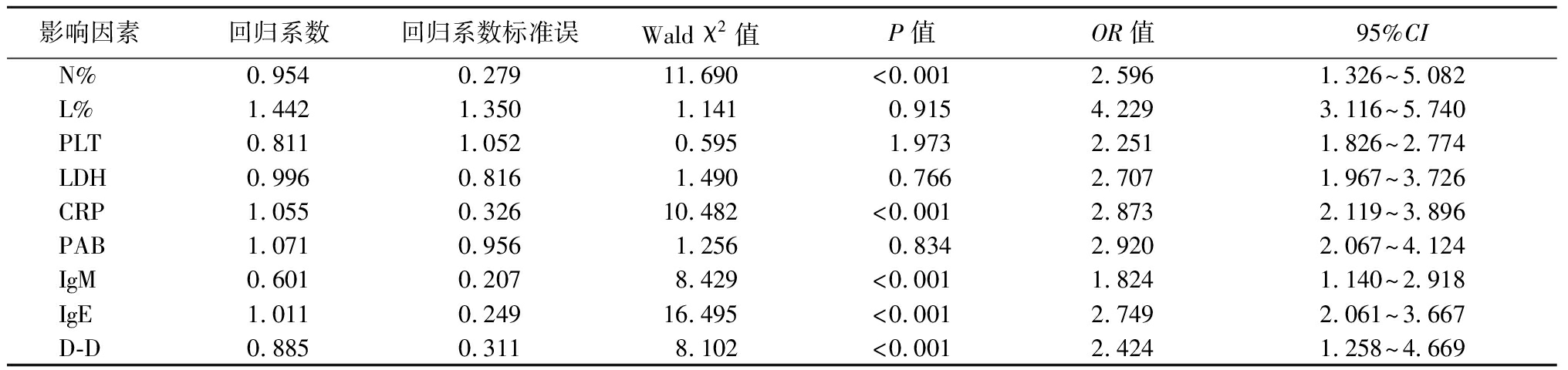
影响因素回归系数回归系数标准误Wald χ2值P值OR值95%CIN%0.9540.27911.690<0.0012.5961.326~5.082L%1.4421.3501.1410.9154.2293.116~5.740PLT0.8111.0520.5951.9732.2511.826~2.774LDH0.9960.8161.4900.7662.7071.967~3.726CRP1.0550.32610.482<0.0012.8732.119~3.896PAB1.0710.9561.2560.8342.9202.067~4.124IgM0.6010.2078.429<0.0011.8241.140~2.918IgE1.0110.24916.495<0.0012.7492.061~3.667D-D0.8850.3118.102<0.0012.4241.258~4.669
2.4 各指标与塑型性支气管炎严重程度的相关性 发生塑型性支气管炎患儿的PRISMⅢ评分为(14.68±3.52)分。经Pearson分析显示,N%、CRP、IgM、IgE、D-D与PRISMⅢ评分呈正相关(P<0.05)。见表4。
表4 各指标与PRISMⅢ评分的相关性 Figure 4 The correlation between each index and PRISMⅢ score
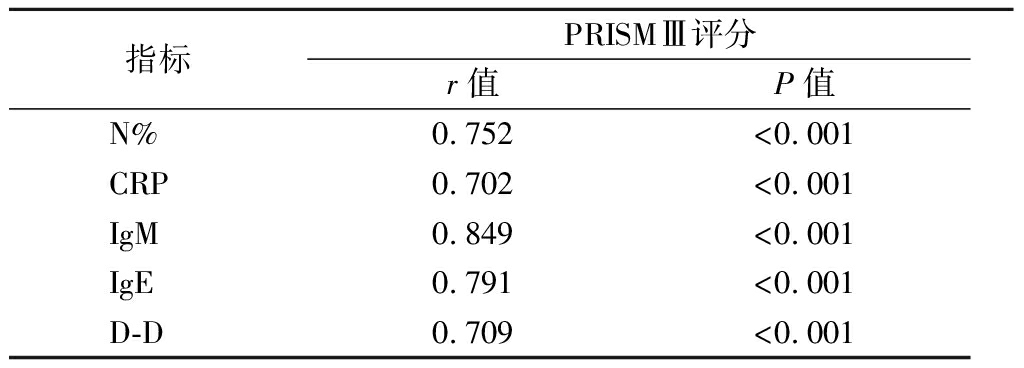
指标PRISMⅢ评分r值P值N%0.752<0.001CRP0.702<0.001IgM0.849<0.001IgE0.791<0.001D-D0.709<0.001
2.5 各指标预测塑型性支气管炎的效能 绘制N%、CRP、IgM、IgE、D-D预测塑型性支气管炎的ROC曲线,显示各指标联合预测的AUC最高为0.896,其次是N%、CRP、IgM、IgE、D-D(P<0.05)。见表5,图1。
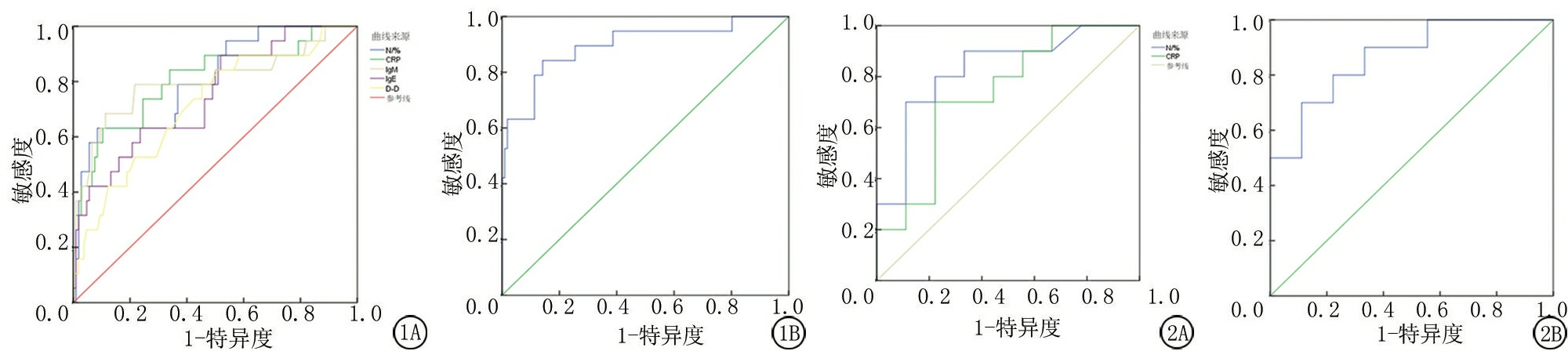
图1 各指标预测塑型性支气管炎的ROC曲线
A.各指标单独预测;B. 各指标联合预测
Figure 1 The ROC curve of each index predicting plastic bronchitis
图2 N%、CRP预测Ⅰ型塑型性支气管炎的ROC曲线
A.N%、CRP单独预测;B. N%、CRP联合预测
Figure 2 ROC of type Ⅰ plastic bronchitis predicted by N% and CRP
表5 各指标预测塑型性支气管炎的ROC分析结果
Table 5 ROC analysis results of each index predicting plastic bronchitis
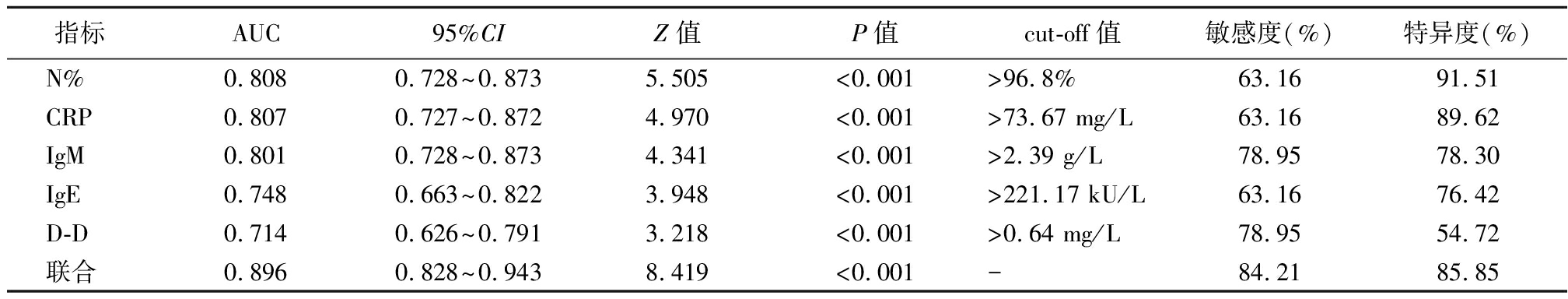
指标AUC95%CIZ值P值cut-off值敏感度(%)特异度(%)N%0.8080.728~0.8735.505<0.001>96.8%63.1691.51CRP0.8070.727~0.8724.970<0.001>73.67 mg/L63.1689.62IgM0.8010.728~0.8734.341<0.001>2.39 g/L78.9578.30IgE0.7480.663~0.8223.948<0.001>221.17 kU/L63.1676.42D-D0.7140.626~0.7913.218<0.001>0.64 mg/L78.9554.72联合0.8960.828~0.9438.419<0.001-84.2185.85
2.6 各指标预测不同分型塑型性支气管炎的价值 RMPP组发生塑型性支气管炎的19例患儿中,Ⅰ型10例,Ⅱ型9例。Ⅰ型塑型性支气管炎患儿N%、CRP高于Ⅱ型,差异有统计学意义(P<0.05)。N%预测Ⅰ型塑型性支气管炎的AUC为0.828(95%CI:0.588~0.959),截断值>97.93%,敏感度为70.00%,特异度为88.89%;CRP预测Ⅰ型塑型性支气管炎的AUC为0.733(95%CI:0.484~0.906),截断值>78.7 mg/L,敏感度为70.00%,特异度为77.78%,N%+CRP预测Ⅰ型塑型性支气管炎的AUC为0.867(95%CI:0.634~0.977),敏感度为70.00%,特异度为88.89%(P<0.05)。见表6,图2。
表6 不同分型塑型性支气管炎各指标比较
Table 6 Comparison of various indexes of different types of plastic bronchitis![]()
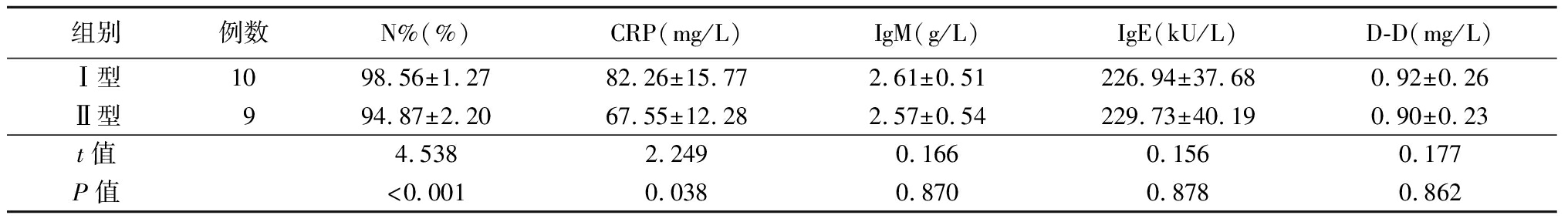
组别例数N%(%)CRP(mg/L)IgM(g/L)IgE(kU/L)D-D(mg/L)Ⅰ型1098.56±1.2782.26±15.772.61±0.51226.94±37.680.92±0.26Ⅱ型994.87±2.2067.55±12.282.57±0.54229.73±40.190.90±0.23t值4.5382.2490.1660.1560.177P值<0.0010.0380.8700.8780.862
3 讨 论
MP是儿童社区获得性肺炎的主要病原体之一,报道显示,3%~10%MP上呼吸道感染会发展为MPP,占肺炎总数的15%~30%,流行年可高达40%~60%,其中部分患儿为RMPP,临床表现严重,治疗困难,如何进行早期有效地治疗、改善患儿的远期预后是目前研究的热点[11-13]。
关于RMPP的发病机制目前尚未完全明确,一般认为与对大环内酯类抗生素耐药、过激的免疫与炎症反应、混合感染及存在诊断与治疗延迟等密切相关[14-15]。血常规为临床检查各种感染性疾病的最常用方法,MPP可引起患儿血常规指标轻度变化或不变化,但RMPP病情严重,可引起多项血常规指标发生明显变化。本研究结果显示,RMPP组患儿WBC、N%、LDH、CRP表达水平明显高于MPP患儿,L%、PLT、PAB表达水平低于MPP组患儿,与国内多项研究[16-17]结果基本一致。提示上述指标可作为MPP患儿病情判断的参考指标,对于血常规检查中WBC、N%、LDH、CRP、L%、PLT、PAB水平发生明显变化者,应重点考虑为RMPP。虽然血常规指标在MPP检查中具有较高敏感度,但存在特异度较差的不足,且患儿患病后饮食不规律、情绪明显波动均会影响血常规指标变化,从而影响其应用价值[18]。目前观点认为,MPP引起的肺外器官损伤不仅仅是T淋巴细胞亚群发生紊乱,还与免疫球蛋白功能密切相关[19-20]。本研究选取IgA、IgM、IgE、IgG 4种免疫球蛋白指标,发现RMPP组患儿血清IgM、IgE水平明显高于MPP组患儿。张新星等[21]通过对63例RMPP患儿的研究分析发现,RMPP患儿存在明显的免疫球蛋白表达异常。常春霞[22]研究发现,RMPP患儿血清IgM、IgE水平高于非RMPP患儿,均支持本研究结果。周晓飞等[23]研究指出,RMPP患儿血清IgA、IgM、IgG水平与MPP患儿比较差异无统计学意义。本研究结果与之存在一定差异,这可能与检测方法、患儿病程等因素有关,但可以肯定的是RMPP患儿存在明显的免疫球蛋白表达紊乱。提示血清IgM、IgE水平升高可能促进RMPP的发生发展。本研究结果显示,RMPP患儿血清D-D水平呈异常高表达状态。D-D为继发性纤溶亢进的降解产物,是反映机体高凝状态及血栓形成的灵敏指标[24]。Tashiro等[25]研究指出,MPP对凝血系统的影响主要来源于病原直接损伤和MPP引起的过度免疫应答。MP感染后可通过呼吸道上皮黏附及直接侵袭作用对内皮细胞造成直接损伤,刺激组织因子上调,从而启动凝血,且内皮细胞造成损伤可释放多种促凝物质,打破了凝血与抗凝系统的平衡,凝血系统功能亢进增加,导致局部血管炎或血栓性血管闭塞,从而加重患儿病情[26-27]。进一步通过相关性分析发现,N%、CRP、IgM、IgE、D-D升高与RMPP患儿病情程度呈明显正相关,可在一定程度上反映患儿病情,指导临床开展合理治疗。
目前,RMPP发生塑型性支气管炎被认为是疾病治疗困难的重要因素之一[28-29]。塑型性支气管炎具有发病急骤、治疗难度大、病死率高的特点,积极预防RMPP并发塑型性支气管炎极为重要[30]。本研究结果显示,随着%、CRP、IgM、IgE、ND-D水平升高RMPP患儿发生塑型性支气管炎风险越高,因此推测上述指标可能用于塑型性支气管炎发生的预测,进一步通过ROC曲线分析发现,N%、CRP、IgM、IgE、D-D预测RMPP发生塑型性支气管炎的AUC均在0.7以上,具有较好预测价值,尤其是各指标联合的AUC高达0.896,可为临床判定塑型性支气管炎发生风险提供更准确数据。此外,不同分型塑型性支气管炎患儿N%、CRP水平差异有统计学意义,且N%、CRP在预测塑型性支气管炎方面具有良好效果,可辅助临床进一步制定针对性治疗方案,有助于改善患儿预后。
综上所述,RMPP患儿存在明显血常规、免疫球蛋白、D-D表达增高,可增加塑型性支气管炎发生风险,且在反映塑型性支气管炎严重程度、预测塑型性支气管炎方面具有良好作用。本研究创新之处在于明确了RMPP患儿血常规、免疫球蛋白、D-D表达及预测塑型性支气管炎发生风险的效能,但各指标在RMPP患儿预后改善方面的具体作用尚未明确,后续工作中仍需通过大量研究进一步探讨。
[1] 许姜姜,舒林华.儿童难治性肺炎支原体肺炎临床特征分析[J].中国当代儿科杂志,2018,20(1):37-42.
[2] Man G,Kuo W,Mingyue Y,et al. Transcriptome analysis of bronchoalveolar lavage fluid from children with mycoplasma pneumoniae pneumonia reveals natural killer and T cell-proliferation responses[J]. Front Immunol,2018,9(1):1403.
[3] 罗玲云,邱基庆,曹冰冰,等.LDH、CRP在重症及难治性肺炎支原体肺炎诊断中的临床应用价值[J].临床医学工程,2018,25(1):67-68.
[4] 杜东坡.血常规联合血清PA、CRP水平检测对小儿细菌感染性疾病诊断符合率的影响[J].河南医学研究,2018,27(1):3154-3155.
[5] 李娟,崔莹伟,罗金燕,等.肺炎支原体肺炎患儿免疫球蛋白水平及意义[J].解放军预防医学杂志,2019,37(4):116-117.
[6] 曹琪,戚晓梅.恶性淋巴瘤PICC导管相关性血流感染患者NLR、D-二聚体等因子的表达及其意义[J].现代医学,2018,46(10):12-16.
[7] Prochaska JH,Frank B,Nagler M,et al. Age-related diagnostic value of D-dimer testing and the role of inflammation in patients with suspected deep vein thrombosis[J]. Sci Rep,2017,7(1):4591.
[8] 中华医学会儿科学分会呼吸学组.儿童肺炎支原体肺炎诊治专家共识(2015年版)[J].中华实用儿科临床杂志,2015,30(17):1304-1308.
[9] 江李莉,万姣,索风涛,等.肺炎支原体塑型性支气管炎5例临床分析[J].临床儿科杂志,2019,37(4):273-276.
[10] Wang F,Cui Y,Wang CX,et al. Effects of continuous veno-venous hemodiafiltration in patients with severe Kawasaki disease complicated with multiple organ dysfunction syndrome[J]. Chin J Pediat,2018,56(9):691-694.
[11] 高孟娜,陈述英,杨晓雯.儿童肺炎支原体感染的流行病学特征分析[J].泰山医学院学报,2018,39(4):385-387.
[12] Ning G,Wang X,Wu D,et al. The etiology of community-acquired pneumonia among children under 5 years of age in mainland China, 2001-2015:a systematic review[J]. Hum Vaccin Immunother,2017,13(11):2742-2750.
[13] 辛德莉,王良玉.肺炎支原体肺炎流行病学特点及耐药现状[J].医学与哲学,2018,39(2):9-11.
[14] 张巧,符州,田代印.儿童难治性肺炎支原体肺炎发病机制及治疗研究进展[J].儿科药学杂志,2019,25(6):61-63.
[15] 王亨,赵顺英.儿童难治性肺炎支原体肺炎的发病机制和诊治研究进展[J].世界临床药物,2020,41(5):389-398.
[16] 吴莹莹,叶燕娟,周晓飞,等.儿童难治性支原体肺炎早期血清学诊断指标比较[J].中国优生与遗传杂志,2019,27(11):1402-1404,1408.
[17] 李娜,穆亚平,陈静,等.淋巴细胞亚群绝对计数对儿童难治性肺炎支原体肺炎的早期预测作用[J].中国当代儿科杂志,2019,21(6):511-516.
[18] 熊维,钱柯,伍剑.血清Ig、CRP联合肺功能检测在RMPP诊治中的应用[J].重庆医学,2017,46(27):3822-3824.
[19] Wijesooriya LI,Kok T,Perera J,et al. Mycoplasma pneumoniae DNA detection and specific antibody class response in patients from two tertiary care hospitals in tropical Sri Lanka[J]. Medl Microbiol,2018,67(9):1232-1242.
[20] 李俊梅,郑成中,张曼,等.儿童难治性肺炎支原体肺炎的临床特点及血清IL-4、IL-6、IL-10、IFN-γ的变化分析[J].现代生物医学进展,2018,18(24):178-182.
[21] 张新星,顾文婧,陈正荣,等.儿童难治性肺炎支原体肺炎临床及实验室检查特征分析[J].儿科药学杂志,2018,24(2):7-11.
[22] 常春霞.难治性肺炎支原体肺炎患儿实验室指标及临床特点分析[J].中国妇幼保健,2019,34(5):1086-1089.
[23] 周晓飞,过毅.儿童难治性肺炎支原体肺炎血清中IL-6、IL-10及免疫功能的变化及临床意义[J].中国优生与遗传杂志,2019,27(10):1270-1272,1275.
[24] 陈学高.C-反应蛋白与D-二聚体在不同影像学表现肺炎支原体肺炎患儿中的作用[J].临床医药实践,2018,27(10):733-735.
[25] Tashiro M,Fushimi K,Kawano K,et al. Adjunctive corticosteroid therapy for inpatients with Mycoplasma pneumoniae pneumonia[J]. BMC Pulm Med,2017,17(1):219.
[26] 贺艺璇,张春峰,吴润晖,等.D-二聚体在肺炎支原体肺炎患儿病情及预后判断中的应用[J].中华实用儿科临床杂志,2019,34(22):1702-1706.
[27] Li T,Yu H,Hou W,et al. Evaluation of variation in coagulation among children with Mycoplasma pneumoniae pneumonia:a case-control study[J]. J Int Med Res,2017,45(6):2110-2118.
[28] 张嵘,王婷,蒋吴君,等.影响难治性肺炎支原体肺炎患儿支气管镜下灌洗治疗次数的危险因素[J].中华实用儿科临床杂志,2018,33(22):1694-1698.
[29] Xu QY,Zhang LQ,Hao CL,et al. Prediction of bronchial mucus plugs formation in patients with refractory mycoplasma pneumoniae pneumonia[J]. J Trop Pediatr,2017,63(2):148-154.
[30] 华军.儿童难治性肺炎支原体肺炎发生塑型性支气管炎的危险因素分析[J].中华实用儿科临床杂志,2019,34(16):1219-1222.