脓毒症是人体对感染反应失调导致的器官功能障碍综合征,临床上证实有细菌存在或有高度可疑感染者,本质上是机体对感染性因素的反应,临床上主要表现为气促、心悸、寒战、低体温以及精神状态改变等症状[1-2]。脓毒症是由感染引起的全身炎症反应综合征,与炎症介质、免疫功能障碍等因素相关[3]。部分脓毒症患儿因一些非客观原因导致病情无法被控制,疾病进展为严重脓毒症、脓毒性休克,导致器官功能不全及循环障碍,故病死率较高,对儿童的健康造成极大的威胁[4]。脓毒症的主要病因为感染,故临床上针对脓毒症患儿多采取病因治疗、支持治疗和免疫调理治疗[5]。乌司他丁、肾上腺皮质激素在脓毒症患儿的治疗中均具有一定疗效,但目前临床上两者联合用于脓毒症患儿的研究鲜少,故本研究主要探究乌司他丁联合肾上腺皮质激素对脓毒症患儿肠黏膜屏障功能、中性粒细胞明胶酶相关脂质运载蛋白(neutrophil gelatinase associated lipocalin,NGAL)、可溶性髓样细胞触发性受体1(soluble triggering receptor expressed on myeloid cells-1,TREM-1)水平的影响,现报告如下。
1 资 料 与 方 法
1.1 一般资料 选取2018年2月—2020年5月我院接诊的儿童脓毒症患儿82例作为研究对象,按照随机数字表法分为乌司他丁组和联合治疗组41例。乌司他丁组男性20例,女性21例,年龄62 d~5岁,平均(2.38±0.46)岁,基础疾病:中枢神经系统感染14例、支气管肺炎11例、手足口病9例、其他7例;联合治疗组男性22例,女性19例,年龄58 d~5岁,平均(2.41±0.45)岁,基础疾病:中枢神经系统感染14例、支气管肺炎12例、手足口病10例、其他5例。2组患儿在一般资料差异无统计学意义(P>0.05),具有可比性。
患儿及家属知情本次研究且签署知情同意书,且经我院伦理委员会批准。
纳入标准:符合《中国脓毒症/脓毒性休克急诊治疗指南(2018)》[6]中诊断标准;病程6~48 h;小儿危重症评分<80分。
排除标准:药物中毒、免疫缺陷、慢性肝病或肾病患儿;严重心肝肾等器官疾病患儿;入院前1个月进行手术患儿;住院前输注白蛋白或血制品患儿;住院前使用过影响血乳酸水平的酸性或碱性药物;对研究药物过敏患儿。
药物来源:乌司他丁(广东天普生化医药股份有限公司;国药准字:H20040506;2 mL:10万U);肾上腺皮质激素(福安药业集团湖北人民制药有限公司;国药准字:H20058653;50 mg)。
1.2 方法
1.2.1 治疗方法 2组患儿在入院后均针对其原发病进行治疗,并给予抗感染、液体复苏以及呼吸道支持等常规治疗。乌司他丁组采用乌司他丁进行治疗,将2 000 U·kg-1·d-1乌司他丁加入至0.9% 20 mL的氯化钠注射液中,每次注射剂量不超过20 000 U,持续1 h,3次/d,连续用药7 d。联合治疗组在乌司他丁组基础上增加肾上腺皮质激素(福安药业集团湖北人民制药有限公司;国药准字:H20058653;50 mg)进行治疗,1~2 mg/kg甲泼尼龙琥珀酸钠静脉滴注,2次/d,持续治疗7 d。
1.2.2 LA、LCR、APACHEⅡ评分评价 分别于治疗前、治疗2周后采集两组患儿清晨空腹静脉血3 mL,离心10 min(3 000 r/min、r=5 cm),分离上层血清,-80 ℃保存,待用。采用上海玉研科学仪器有限公司的血气分析仪检测乳酸(lactic acid,LA)水平;乳酸清除率(lactate clearance rate ,LCR)=(入院LA值-24 h后LA值)/24 h后LA值×100%;采用急性生理和慢性健康(acute physiology and chronic health evaluation-Ⅱ,APACHEⅡ)评分评估疾病严重程度,包括年龄、急性生理学和慢性健康状况3项内容,总分为71分,其中分值越高则说明患儿病情越严重。
1.2.3 HBP、PA、RBP、IL-6、IL-10、DAO、IFABP、D-乳酸、NGAL、TREM-1水平评价 采用酶联免疫吸附测定法(enzyme-linked immunosorbent assay,ELISA)检测肝素结合蛋白(heparin binding protein,HBP)、前白蛋白(prealbumin,PA)、视黄醇结合蛋白(retinol binding protein,RBP)、白细胞介素6(interleukin-6,IL-6)、白细胞介素10(interleukin-10,IL-10)、二胺氧化酶(diamine oxidase,DAO)、肠脂肪酸结合蛋白(intestinal fatty acid binding protein,IFABP)、D-乳酸、NGAL、TREM-1水平,实验步骤:设置10个标准孔并准备相应水平标准品,设置1个空白孔及若干待测样品在10 μL待测样品中加入40 μL样本稀释液,封板膜封板,置于37 ℃水浴箱温育30 min,清洗反应板5次,每次间隔30 s,拍干,在除空白孔以外的各孔中加入酶标液50 μL,封膜温育30 min,清洗反应板5次,每次间隔30 s,拍干,在各孔中加入显色A液、B液各50 μL,轻轻震荡混匀,37 ℃避光环境下显色15 min,在反应孔内加入终止液50 μL/孔以终止反应,450 nm波长测量每孔吸光度,查出上述指标水平。
1.2.4 CK-MB、cTnI水平评价 采用上海帝博思生物科技有限公司的全自动生化分析仪检测肌酸激酶同工酶(creatine kinase isoenzyme,CK-MB)、肌钙蛋白I(Troponin I,cTnI)水平。
1.2.4 免疫功能指标评价 采用常州必达科生物科技有限公司的流式细胞仪检测CD3+、CD4+、CD8+、NK水平。
1.2.5 治疗效果比较 将治疗效果分为显效、有效、无效3个标准,其中显效为患者临床症状体征完全消失,IL-6明显下降;有效为患者临床症状体征部分消失,IL-6下降;无效为未达到上述标准。治疗总有效率=显效+有效。
1.3 统计学方法 应用SPSS 26.0统计软件分析数据。计量资料比较采用独立样本t检验、配对t检验,计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 LA、LCR、APACHEⅡ评分比较 LA、LCR、APACHEⅡ评分治疗前对比,差异无统计学意义(P>0.05),LA水平、APACHEⅡ评分治疗后低于治疗前,LCR治疗后高于治疗前,且联合治疗组LA水平、APACHEⅡ评分低于乌司他丁组,LCR高于乌司他丁组,差异有统计学意义(P<0.05)。见表1。
表1 LA、LCR、APACHEⅡ评分比较
Table 1 Comparison of LA, LCR and Apache Ⅱ scores![]()
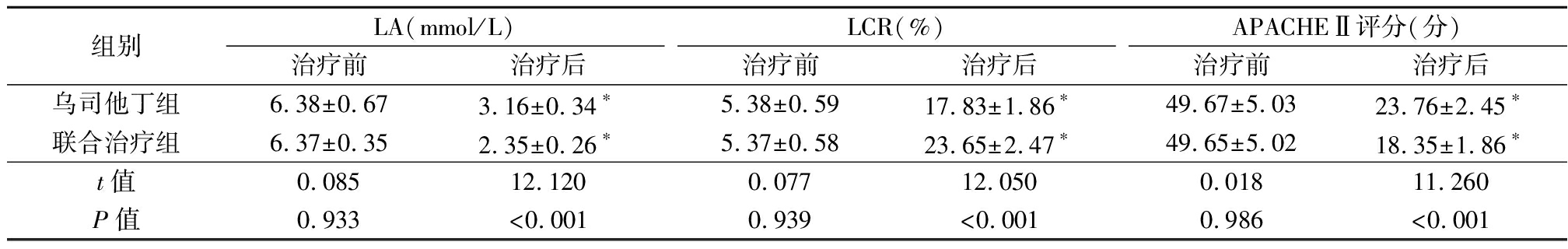
组别LA(mmol/L)治疗前治疗后LCR(%)治疗前治疗后APACHEⅡ评分(分)治疗前治疗后乌司他丁组6.38±0.673.16±0.34∗5.38±0.5917.83±1.86∗49.67±5.0323.76±2.45∗联合治疗组6.37±0.352.35±0.26∗5.37±0.5823.65±2.47∗49.65±5.0218.35±1.86∗t值0.08512.1200.07712.0500.01811.260P值0.933<0.0010.939<0.0010.986<0.001
*P值<0.05与治疗前比较(配对t检验)
2.2 HBP、PA、RBP水平比较 HBP、PA、RBP水平治疗前对比,差异无统计学意义(P>0.05),HBP水平治疗后低于治疗前,PA、RBP水平治疗后高于治疗前,且联合治疗组HBP水平低于乌司他丁组,PA、RBP水平高于乌司他丁组,差异有统计学意义(P<0.05)。见表2。
表2 HBP、PA、RBP水平比较
Table 2 Comparison of HBP, PA and RBP levels![]()
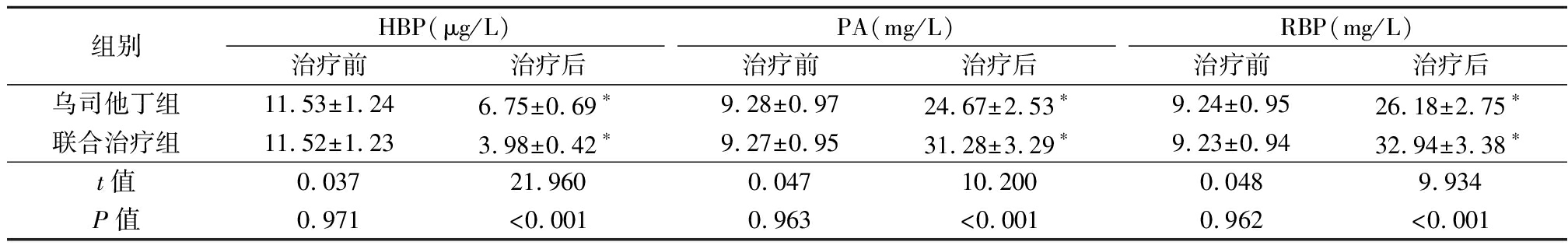
组别HBP(μg/L)治疗前治疗后PA(mg/L)治疗前治疗后RBP(mg/L)治疗前治疗后乌司他丁组11.53±1.246.75±0.69∗9.28±0.9724.67±2.53∗9.24±0.9526.18±2.75∗联合治疗组11.52±1.233.98±0.42∗9.27±0.9531.28±3.29∗9.23±0.9432.94±3.38∗t值0.03721.9600.04710.2000.0489.934P值0.971<0.0010.963<0.0010.962<0.001
*P值<0.05与治疗前比较(配对t检验)
2.3 IL-6、IL-10、CK-MB、cTnI水平比较 IL-6、IL-10、CK-MB、cTnI水平治疗前对比,无统计学差异(P>0.05),IL-6、CK-MB、cTnI水平治疗后低于治疗前,IL-10水平治疗后高于治疗前,且联合治疗组IL-6、CK-MB、cTnI水平低于乌司他丁组,IL-10水平高于乌司他丁组,差异有统计学意义(P<0.05)。见表3。
表3 IL-6、IL-10、CK-MB、cTnI水平比较
Table 3 Comparison of IL-6, IL-10, CK-MB and cTnI levels![]()

组别IL-6(ng/L)治疗前治疗后IL-10(ng/L)治疗前治疗后CK-MB(U/L)治疗前治疗后cTnI(μg/L)治疗前治疗后乌司他丁组92.76±9.3876.25±7.73∗81.39±8.25116.34±11.78∗58.37±5.9436.15±3.74∗1.74±0.211.32±0.15∗联合治疗组92.75±9.3666.38±6.74∗81.37±8.24139.45±14.06∗58.35±5.9326.39±2.74∗1.73±0.190.86±0.09∗t值0.0056.1620.0118.0670.01513.4800.22616.840P值0.996<0.0010.991<0.0010.988<0.0010.822<0.001
*P值<0.05与治疗前比较(配对t检验)
2.4 免疫功能指标比较 免疫功能指标治疗前比较差异无统计学意义(P>0.05),CD3+、CD4+、NK水平治疗后高于治疗前,CD8+水平治疗后低于治疗前,且联合治疗组CD3+、CD4+、NK水平高于乌司他丁组,CD8+水平低于乌司他丁组,差异有统计学意义(P<0.05)。见表4。
表4 免疫功能指标比较
Table 4 Comparison of immune function indicators![]()
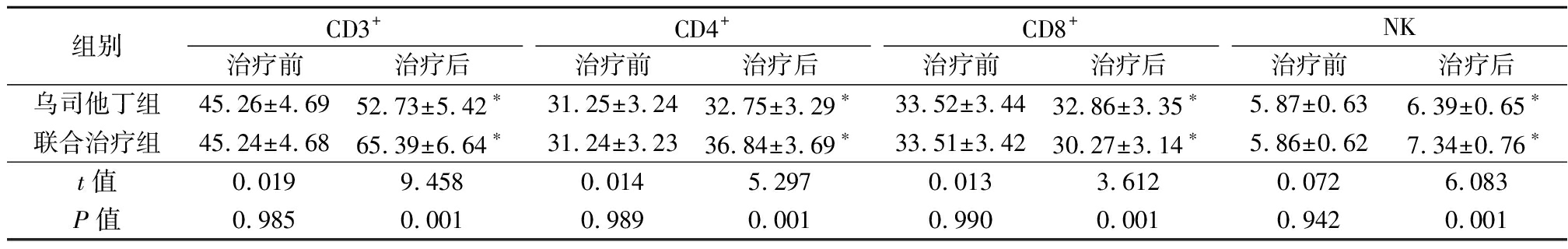
组别CD3+治疗前治疗后CD4+治疗前治疗后CD8+治疗前治疗后NK治疗前治疗后乌司他丁组45.26±4.6952.73±5.42∗31.25±3.2432.75±3.29∗33.52±3.4432.86±3.35∗5.87±0.636.39±0.65∗联合治疗组45.24±4.6865.39±6.64∗31.24±3.2336.84±3.69∗33.51±3.4230.27±3.14∗5.86±0.627.34±0.76∗t值0.0199.4580.0145.2970.0133.6120.0726.083P值0.9850.0010.9890.0010.9900.0010.9420.001
*P值<0.05与治疗前比较(配对t检验)
2.5 肠黏膜屏障功能、NGAL、TREM-1水平比较 肠黏膜屏障功能、NGAL、TREM-1水平治疗前对比,差异无统计学意义(P>0.05),治疗后DAO、IFABP、D-乳酸、NGAL、TREM-1水平均低于治疗前,且联合治疗组DAO、IFABP、D-乳酸、NGAL、TREM-1水平低于乌司他丁组,差异有统计学意义(P<0.05)。见表5。
表5 肠黏膜屏障功能、NGAL、TREM-1水平比较
Table 5 Comparison of intestinal mucosal barrier function, NGAL and TREM-1 levels![]()
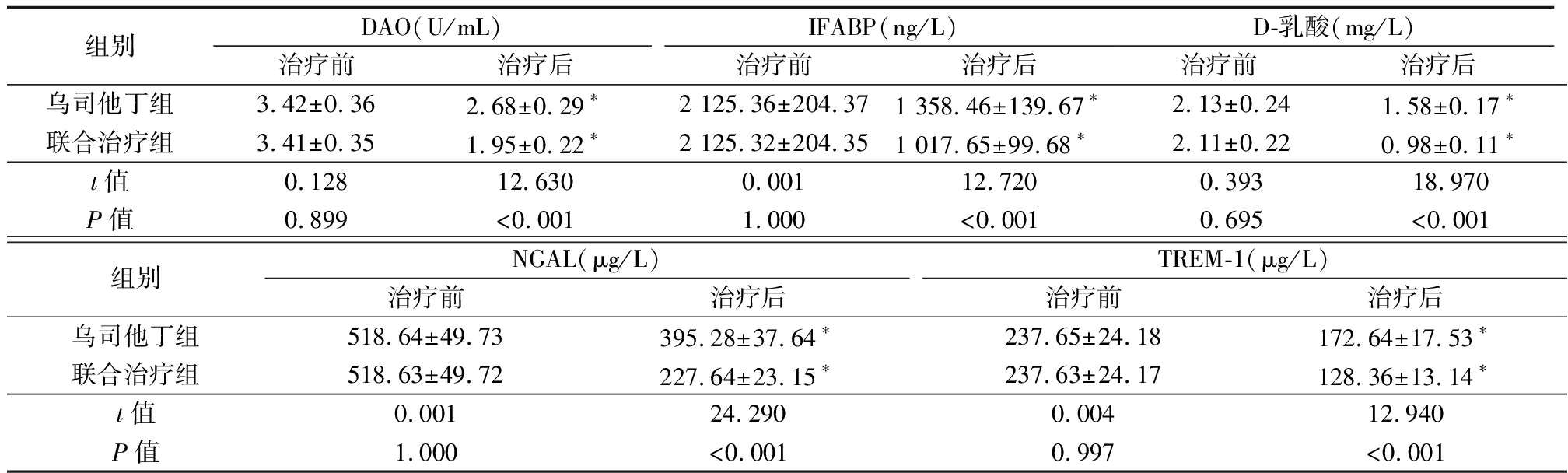
组别DAO(U/mL)治疗前治疗后IFABP(ng/L)治疗前治疗后D-乳酸(mg/L)治疗前治疗后乌司他丁组3.42±0.362.68±0.29∗2 125.36±204.371 358.46±139.67∗2.13±0.241.58±0.17∗联合治疗组3.41±0.351.95±0.22∗2 125.32±204.351 017.65±99.68∗ 2.11±0.220.98±0.11∗t值0.12812.6300.00112.7200.39318.970P值0.899<0.0011.000<0.0010.695<0.001组别NGAL(μg/L)治疗前治疗后TREM-1(μg/L)治疗前治疗后乌司他丁组518.64±49.73395.28±37.64∗237.65±24.18172.64±17.53∗联合治疗组518.63±49.72227.64±23.15∗237.63±24.17128.36±13.14∗t值0.00124.2900.00412.940P值1.000<0.0010.997<0.001
*P值<0.05与治疗前比较(配对t检验)
2.6 治疗效果比较 联合治疗组治疗总有效率高于乌司他丁组,差异有统计学意义(P<0.05)。见表6。
表6 治疗效果比较
Table 6 Comparison of therapeutic effects (n=41,例数,%)
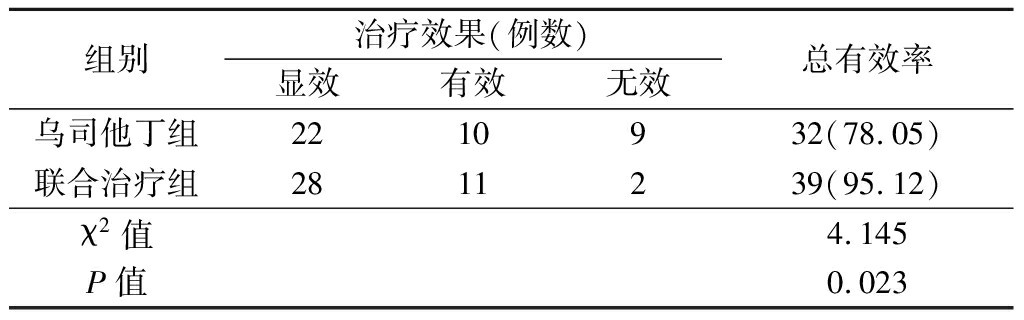
组别治疗效果(例数)显效有效无效总有效率乌司他丁组2210932(78.05)联合治疗组2811239(95.12)χ2值4.145P值0.023
3 讨 论
儿童脓毒症是儿科临床危重疾病之一,常由中枢神经系统感染、支气管肺炎、手足口病等原发病引起,病情进展较快且严重,易发展为重症脓毒症[7-8]。故如何有效控制与缓解脓毒症患儿病情并提高其治疗效果仍是目前学术研究的热点。有研究显示,乌司他丁是一种广谱的蛋白酶抑制剂,可改善免疫功能、蛋白代谢异常,还可减轻内脏器官与细胞损伤并改善休克时的循环状态[9-10]。肾上腺皮质激素在脓毒症以及感染性休克治疗中运用广泛,具有较强的抗炎作用,可逆转休克和脏器功能障碍[11-12]。在本研究中,乌司他丁联合肾上腺皮质激素在脓毒症患儿治疗中疗效较佳,其原因可能为乌司他丁为蛋白酶 抑制剂,可抑制蛋白酶水解蛋白质,进而有效抑制病院微生物繁殖,可改善循环障碍,再加之肾上腺皮质激素具有抗感染、抗休克的作用,故治疗效果提高。
有研究显示,在脓毒症过程中,因机体有效循环血量急剧减少,组织呈低灌注,组织细胞缺氧导致LA大量堆积[13]。LCR在一定程度上可反映器官的功能状态,其水平与脓毒症病情严重程度呈负相关[14]。HBP是一种由成熟中性粒细胞分泌的蛋白质,可减少有效循环血量、增强毛细血管渗透性,是细菌感染最早升高的标志物之一,与脓毒症的病理生理过程密切相关[15]。PA是一种蛋白质,也是一种急性负时相反应蛋白,在机体应激反应、坏死物质清除等生理过程中扮演重要的角色[16]。在本研究中,乌司他丁联合肾上腺皮质激素可有效降低HBP水平,升高PA、RBP水平,其原因可能为两药联合发挥互补作用,从源头和过程中改善疾病症状,阻断机体炎性反应和凝血功能障碍严重絮乱导致的恶性循环。脓毒症患者存在炎性细胞因子、T淋巴细胞亚群水平失衡现象,其中IL-6、IL-10是常见的炎性细胞因子,在病原菌感染发生时其在血液中浓度会发生显著性改变,甚至对各脏器功能造成损伤[17-19]。CK-MB、cTnI为心肌损伤标志物,若其水平升高则提示心肌功能障碍。在薛秋丽等[20]研究中,T淋巴细胞在脓毒症发病机制中起关键作用,可预防T细胞丢失、加快其数值恢复以及增强细胞功能和阻断免疫抑制途径,进而降低脓毒症发病率、病死率。在本研究中,乌司他丁联合肾上腺皮质激素具有较高的临床应用价值,其原因可能为两药联合可拮抗炎性细胞释放、维持免疫约谈正调节功能平衡,调节机体免疫功能,增加CD3+、CD4+、NK比值,促进免疫功能恢复,进而改善预后。
胃肠道是脓毒症患者最易受累的器官,若肠黏膜屏障功能受到损伤,则会降低免疫功能、增加并发症发生的危险性,对脓毒症相互影响[21]。当肠道黏膜损伤、通透性增高时,DAO及D-乳酸被大量释放进入循环,对肠道黏膜造成一定损伤[22]。NGAL是一种分泌型蛋白,在正常生理状态下呈低表达,在脓毒症中因肾脏组织发生毒性损伤或缺血其水平显著升高[23]。TREM-1是重要的炎性介质及调控因子,在脓毒症患者体内其水平呈高表达[24]。在本研究中,两药联合可促进肠黏膜屏障功能恢复正常,降低NGAL、TREM-1水平,其原因可能为两药联合可有效减轻对胃肠功能的损害、改善患者细胞内炎症因子的合成与分泌。
综上所述,本研究结果显示,乌司他丁联合肾上腺皮质激素可有效改善儿童脓毒症患儿肠黏膜屏障功能、降低NGAL、TREM-1水平,还可改善机体炎症反应、免疫功能障碍,保护心肌细胞,值得在临床脓毒症的治疗中推广。
[1] Balamuth F,Alpern ER,Kan M,et al. Gene Expression profiles in children with suspected sepsis[J]. Ann Emerg Med,2020,75(6):744-754.
[2] 张小明,蒲洁华.不同剂量甲泼尼龙对严重脓毒症患儿的免疫功能及炎症因子指标的影响分析[J].检验医学与临床,2020,17(19):2865-2867.
[3] Weiss SL,Nicolson SC,Naim MY. Clinical update in pediatric sepsis:focus on children with pre-existing heart disease[J]. J Cardiothorac Vasc Anesth,2020,34(5):1324-1332.
[4] 汪俊,李元海,孙盈盈,等.右美托咪定对脓毒症患儿外周血淋巴细胞亚群和炎性因子的影响[J].中国临床药理学杂志,2020,36(9):1070-1072.
[5] Balamuth F,Alpern ER,Kan M,et al. Gene expression profiles in children with suspected sepsis[J]. Ann Emerg Med,2020,75(6):744-754.
[6] 中国医师协会急诊医师分会,中国研究型医院学会休克与脓毒症专业委员会.中国脓毒症/脓毒性休克急诊治疗指南(2018)[J].感染、炎症、修复,2019,20(1):3-22.
[7] 凌宝田,梅昭均,许峰.糖皮质激素治疗儿童脓毒症疗效的Meta分析[J].中国小儿急救医学,2020,27(3):216-221.
[8] 赵小彩,吉茂英,闵焕娣.脓毒血症患儿血浆肝素结合蛋白、降钙素原和C-反应蛋白与病情严重程度的关系[J].中国急救复苏与灾害医学杂志,2020,15(4):448-451.
[9] 祁卫华,王鑫.乌司他丁联合血液滤过治疗脓毒症疗效观察[J].现代中西医结合杂志,2020,29(15):1631-1635.
[10] 陶言言,齐本权,张弘,等.参附注射液联合乌司他丁治疗脓毒症的疗效观察[J].蚌埠医学院学报,2020,45(5):581-584.
[11] 卢琳,陆召麟.库欣综合征患者围手术期的糖皮质激素替代治疗现状及应用策略[J].中华医学杂志,2020,100(36):2801-2803.
[12] 韩玫瑰,李烁,韩子明,等.促皮质素治疗儿童频复发型肾病综合征复发的临床观察[J].中华实用儿科临床杂志,2020,35(8):637-640.
[13] 郑立斌.热毒宁注射液辅助治疗脓毒症初期患者的效果观察及其对炎性因子水平的影响[J].中国中医药科技,2019,26(2):172-175.
[14] 李兴华,刘颖,吕艳超.脓毒血症患者乳酸清除率、红细胞分布宽度和血乳酸水平及与预后的关系[J].中国现代医学杂志,2020,30(12):22-26.
[15] 常青,陈豆豆,吴魏芹,等.乌司他丁联合丹红注射液对脓毒症患者的疗效以及对sTREM-1、HBP水平及th17/treg的影响[J].河北医科大学学报,2020,41(8):899-904.
[16] 张瑞芬,张文凯.肝功能指标对脓毒症患者预后预测价值研究[J].现代消化及介入诊疗,2020,25(3):325-329.
[17] 杨轶男,毕小朵,杨光路.血清IL-6联合PCT检验对儿童脓毒症病情的评估[J].中国妇幼健康研究,2020,31(10):1384-1387.
[18] 苏秦,高进,付俊鲜,等.血流动力学指标和IL-6在脓毒症肾损伤患儿中的表达及其与免疫指标的相关性[J].中国免疫学杂志,2020,36(10):1235-1239.
[19] 邢静,卢艳辉,王艳飞,等.小儿脓毒血症血清NT-proBNP、CRP、IL-10及TNF-α水平变化及其与预后的关系[J].河北医科大学学报,2020,41(5):519-523.
[20] 薛秋丽,董丽华,刘忠民.T淋巴细胞在脓毒症发病机制中的作用[J].中国实验诊断学,2019,23(2):329-332.
[21] 白准,刘旭丽,曾维忠,等.不同剂量CRRT对严重脓毒症患者免疫功能、肠黏膜屏障功能及预后转归的影响研究[J].河北医药,2020,42(12):1856-1859.
[22] 刘福生,刘锦,孙琛琛,等.温下健脾法联合抗菌药物治疗脓毒症的实验研究[J].中国中西医结合急救杂志,2019,26(5):533-538.
[23] 刘瑞清,孟志云,褚洪光,等.脓毒症患者血清NGAL、KIM-1、Cys-C对急性肾损伤的诊断能效[J].中国医药导报,2019,16(29):128-131.
[24] 沈丽娟,吴锡平,王金桂,等.大黄牡丹汤对脓毒症急性肠功能障碍大鼠肠道髓系细胞触发受体-1表达的影响[J].中国实验方剂学杂志,2019,25(2):20-27.