热性惊厥是临床小儿发生率极高的疾病,会对发育期间的脑组织造成一定的损伤[1]。正常的机体可以通过调节功能、缓冲系统对体内的酸碱平衡维持稳定,但是,如果患儿的病情比较严重,且由于调节机制异常或者是酸碱超负荷会使体内的酸碱平衡遭到破坏。热性惊厥在小儿中容易反复发作,该疾病发生的特点为小儿大脑发育不是很成熟,各功能发育不是很完善,对酸碱不平衡、兴奋性的抑制较差,惊厥阈值比较低,外界的一点刺激就会使大脑的兴奋性明显提高,最终会使大脑神经细胞发出异常电波引发惊厥。神经细胞发出异常电波会对大脑皮质造成损伤,加之抽搐发作时又会使大脑发生缺氧缺血,后期疾病发作次数会更加频繁,时间也会更长,患儿的脑损伤也会越严重,频繁的发生热性惊厥会使患儿的学习记忆能力、运动能力受到严重的损伤[2]。有关研究显示,导致热性惊厥发生的原因可能与遗传、免疫、脑内部分物质发生变化、中枢神经系统发育异常等有关[3]。近年来,人们在热性惊厥研究中发现,血清脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)、热休克蛋白70(heat shock protein 70,HSP70)发挥了重要的作用[4]。HSP70在脑组织细胞发生凋亡、再灌注损伤、缺氧缺血的期间发挥着保护作用。而在热性惊厥患儿在惊厥持续状态时脑缺氧损伤中血清BDNF、HSP70水平是如何变化的在临床上有关的研究较少[5]。本研究主要对在热性惊厥患儿惊厥持续状态时脑缺氧损伤中血清BDNF、HSP70水平变化进行研究,以便为临床治疗热性惊厥提供科学的依据,研究结果报告如下。
1 资 料 与 方 法
1.1 一般资料 选取2018年2月—2019年8月我院收治的热性惊厥患儿70例作为研究组,根据患儿热性惊厥发作时间分为单纯惊厥组(45例)、惊厥持续状态组(25例)。同时选择同期健康体检儿童70例作为对照组。纳入标准:①患儿符合《热性惊厥诊断治疗与管理专家共识(2017实用版)》中单纯性热性惊厥、惊厥持续状态的诊断标准[6];②对照组儿童经临床检查一切正常;排除标准:①以往存在癫痫病史的患儿;②合并有低钙血症的患儿;③精神异常,认知功能异常的患儿;④存在外伤、严重感染的患儿;⑤中途退出研究的患儿。对照组70例,男性43例,女性27例,年龄1~4岁,平均(2.1±0.1)岁;单纯惊厥组男性25例,女性20例,年龄1~5岁,平均(2.3±0.1)岁;体温38.6~40.5 ℃,平均(39.8±0.3)℃;惊厥持续状态组,男性15例,女性10例,年龄1~5岁,平均(2.3±0.1)岁;体温38.6~40.4 ℃,平均(39.7±0.2)℃。三组性别、年龄资料差异无统计学意义(P>0.05),具有可比性。
本研究经医院伦理委员会审批通过,患儿家属知情同意并签署知情同意书。
1.2 方法
1.2.1 BDNF、HSP70水平检测 三组均在抽取静脉血5 mL,后离心分取血清,使用双抗体夹心酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)对BDNF、HSP70水平进行检测,试剂盒由加拿大Stressgen公司生产,操作时严格按照步骤进行[7]。
1.2.2 pH值、氧分压(arterial partial pressure of oxygen,PaO2)、二氧化碳分压(arterial partial pressure of carbon dioxide,PaCO2)、二氧化碳总量( total carbon dioxide,TCO2)、血气水平检测 三组抽取动脉血5 mL,后使用血气分析仪对pH值、PaCO2、TCO2进行检测,仪器由强生公司提供[8]。
1.3 观察指标 比较三组人群BDNF、HSP70、pH值、PaO2、PaCO2、TCO2血气水平。
1.4 统计学方法 应用SPSS 20.0软件分析数据。计量资料比较采用F检验和SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 三组BDNF、HSP70水平比较 惊厥持续状态组BDNF、HSP70水平高于对照组和单纯惊厥组(P<0.05),见表1。
表1 BDNF、HSP70水平比较
Table 1 Comparison of BDNF and HSP70 levels![]()

组别例数BDNFHSP70对照组701.80±0.500.80±0.30单纯惊厥组452.10±0.30∗1.00±0.40∗惊厥持续状态组255.00±1.10∗#2.90±0.80∗# F值14.21412.115 P值0.0060.003
*P值<0.05与对照组比较 #P值<0.05与单纯惊厥组比较(SNK-q检验)
2.2 三组pH值、PaO2、PaCO2、TCO2血气水平比较 对照组与单纯惊厥组pH值、PaO2、PaCO2、TCO2差异无统计学意义(P>0.05),惊厥持续状态组pH值、PaO2低于对照组和单纯惊厥组,惊厥持续状态组PaCO2、TCO2高于对照组,差异有统计学意义(P<0.05),见表2。
表2 三组pH值、PaO2、PaCO2、TCO2血气水平比较
Table 2 Comparison of pH value, PaO2,PaCO2, TCO2 blood gas level among three groups![]()
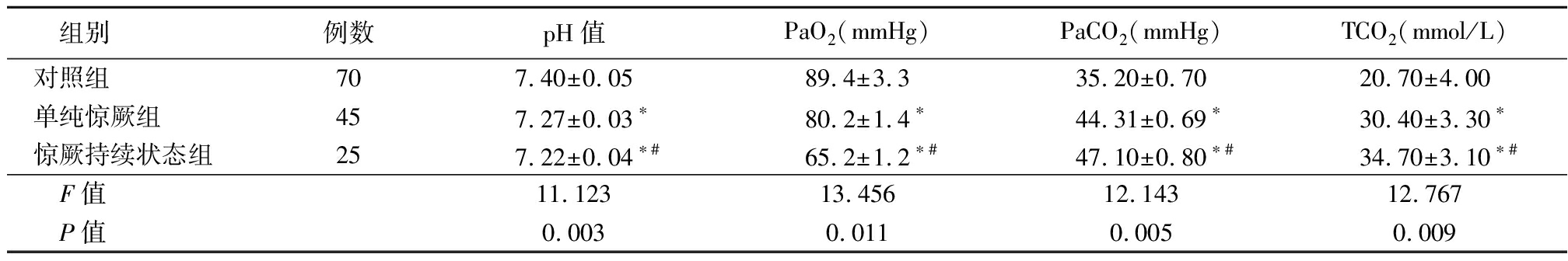
组别例数pH值PaO2(mmHg)PaCO2(mmHg)TCO2(mmol/L)对照组707.40±0.0589.4±3.335.20±0.7020.70±4.00单纯惊厥组457.27±0.03∗80.2±1.4∗44.31±0.69∗30.40±3.30∗惊厥持续状态组257.22±0.04∗#65.2±1.2∗#47.10±0.80∗#34.70±3.10∗#F值11.12313.45612.14312.767P值0.0030.0110.0050.009
*P值<0.05与对照组比较 #P值<0.05与单纯惊厥组比较(SNK-q检验) 1 mmHg=0.133 kPa
3 讨 论
热性惊厥是临床小儿发生率非常高的疾病,也是导致神经系统异常的高危因素,该疾病的发生主要与婴幼儿大脑发育不成熟,对神经介质紊乱、兴奋性的抑制作用较差,对惊厥的阈值较低有关,当发热时中枢神经系统对外界环境的刺激非常敏感,容易使神经细胞发生异常放电而引发惊厥[9]。相关研究显示,在热性惊厥发生、发展期间炎症反应发挥着重要的作用[10]。
BDNF属于神经营养因子中的一员,它在中枢神经元的生长、分化、生存、周围神经元的分化、生长、维持神经元正常功能方面发挥着重要的作用[11]。BDNF可以对受体蛋白P75、受体蛋白TrkB进行调控,从而会对钠通道的开放进行控制,同时可以对具有兴奋性的神经递质进行调控[12]。BDNF还可以对Cl-的分泌进行调控,最终有利于降低GABA受体所介导的电流传导,会使大脑神经兴奋性明显提高,对脑组织产生损伤[13]。另外,BDNF可以作为大脑神经元受损的标志物,BDNF水平升高会使大脑神经兴奋性显著提高,使钠离子通透性显著提高,最终容易对惊厥阈值进行降低,促使惊厥再次发作[14]。且患儿惊厥持续时间与今后的行为、智力存在明显的联系,时间越长,受损越严重。HSP70属于应激蛋白的一种,当前被临床上认为是一种抗凋亡蛋白[15]。脑缺血再灌注损伤发生时,HSP70mRNA在下丘脑等部位的水平明显升高,可以对凋亡蛋白酶激活因子、抗活性氧自由基毒性进行抑制来达到保护神经元免受损伤的效果。HSP70水平显著升高会对神经细胞凋亡进行抑制。
本研究结果显示,惊厥持续状态组BDNF、HSP70水平高于对照组和单纯惊厥组(P<0.05),这说明,在热性惊厥发生的期间,各种因子水平会发生明显的变化,且可以将各种因子水平作为判断患儿疾病严重程度的指标。这就提示患儿的疾病越严重,各种因子水平就越高。发生热性惊厥的患儿体内酸碱平衡被破坏,血气指标较正常儿童存在一定的改变[16]。因此,酸碱失衡也是导致热性惊厥发生的危险因素。这与其他学者的研究结果基本相同。随着患儿体温的不断升高,过度通气会引发低碳酸血症的发生,进而会使患儿发生呼吸性碱中毒,颅内压也明显升高,大脑皮质神经兴奋性显著提高,最终引发了热性惊厥发生[17]。患儿的脑缺氧损伤严重程度越严重,大脑皮质神经兴奋性就越高,脑组织会受到进一步损伤,其他因子的水平也会发生明显变化[18]。另外,其他因子的水平与患儿脑缺氧损伤严重程度存在明显的联系,热性惊厥患儿体内血清因子水平明显升高可能提示病情严重[19]。这与其他学者的研究结果基本相同。
研究显示,惊厥持续状态组pH值、PaO2低于对照组和单纯惊厥组(P<0.05),惊厥持续状态组PaCO2、TCO2高于对照组和单纯惊厥组(P<0.05),这说明,在热性惊厥发生的期间,患儿的血气指标也会发生明显的变化。另外,在热性惊厥患儿的体内,各因子水平发生明显的变化,可以为临床判断患儿情况提供科学的依据[20]。小儿热性惊厥一般发生在患儿体温骤然升高时,如果不及时止惊,可能会导致其他严重的并发症发生,对患儿的生命安全造成严重的威胁,大部分患儿在发生热性惊厥时会引发全身性阵发性强直痉挛的发生,由于小儿的大脑发育不是很成熟,受到刺激后对刺激的防御能力较低,进一步加重了脑组织的损伤[21]。热性惊厥频繁反复发作会对脑功能造成损伤,最终会使患儿的智力受到影响。因此,对患儿进行有效地治疗,对惊厥复发进行有效预防是改善患儿预后的关键点。有关研究显示,热性惊厥发生时,患儿的呼吸会暂时停止、换气会出现不足,机体就会出现二氧化碳潴留、缺氧症状,高碳酸血症会使脑血流量明显升高并使其受到损伤,在发病期间,患儿的食欲也明显下降,机体的代谢提高使得机体消耗量明显升高,机体内的线粒体三磷酸腺苷也会明显减少,最终对线粒体能量的储备功能造成了严重的影响,这也会使脑组织受到严重的损伤。
综上所述,热性惊厥患儿在惊厥持续状态时脑缺氧损伤研究中,发现发生热性惊厥的患儿脑缺氧损伤与BDNF、HSP70水平存在很大的关系,应深入研究。
[1] 田杨,侯池,王秀英,等.STX1B基因突变致遗传性癫痫伴热性惊厥附加症——家系分析并文献复习[J].中华儿科杂志,2019,57(3):206-210.
[2] 娄季鹤,赵孝开,李树仁,等.烧伤并发严重阵发性交感神经过度兴奋综合征的早期诊断与处理[J].中华烧伤杂志,2019,35(8):599-603.
[3] Yang B,Wei ZY,Wang BQ,et al. Down-regulation of the long noncoding RNA-HOX transcript antisense intergenic RNA inhibits the occurrence and progression of glioma[J]. J Cell Biochem,2018,119(2):1235-2449.
[4] Simon L,Lemal R,Luc-Matthieu F,et al. High-dose therapy with autologous stem cells transplantation in Bing-Neel syndrome:a retrospective analysis of 14 cases[J]. Am J Hematol,2019,94(9):E227-E229.
[5] 闫礼照,王家祥.LMO1基因rs4758051多态性与神经母细胞瘤易感性关系的Meta分析[J].中国实用医刊,2019,46(12):23-27.
[6] 中华医学会儿科学分会神经学组.热性惊厥诊断治疗与管理专家共识[J].中华实用儿科临床杂志,2017,32(18):1379-1382.
[7] Kobayashi D. Food poisoning by ginkgo seeds through vitamin B6 depletion[J]. Yakugaku Zasshi,2019,139(1):1-6.
[8] Polat M,Tapisiz A. Amikacin monotherapy for treatment of febrile urinary tract infection caused by extended-spectrum β-lactamase-producing escherichia coli in children[J]. Pediatr Infect Dis J,2018,37(4):378-379.
[9] 左英熹,贾月萍,吴珺等.嵌合抗原受体T细胞治疗儿童复发、难治急性B淋巴细胞白血病48例的长期疗效分析[J].中华血液学杂志,2019,40(4):270-275.
[10] Walker JS,Shaver DJ,Stacy BA,et al. Brevetoxin exposure in sea turtles in south Texas during Karenia brevis red tide[J]. Dis Aquat Organ,2017,127(2):145-150.
[11] Stefanatou M,Gatzonis S,Peskostas A,et al. Drug-responsive versus drug-refractory mesial temporal lobe epilepsy:a single-center prospective outcome study[J]. Postgrad Med,2019,131(7):479-485.
[12] 夏毅,张伟,井晓蓉,等.儿童癫痫持续状态的临床特点,治疗及预后分析[J].中华神经外科杂志,2021,37(1):16-20.
[13] Wilkinson N,Tsakok T,Dand N,et al. Defining the therapeutic range for adalimumab and predicting response in psoriasis:a multicenter prospective observational cohort study[J]. J Invest Dermatol,2019,139(1):115-123.
[14] Tiraboschi E,Martina S,van der Ent W,et al.New insights into the early mechanisms of epileptogenesis in a zebrafish model of Dravet syndrome[J]. Epilepsia,2020,61(3):549-560.
[15] Kunju PA,Subir HA. Pediatric convulsive status epilepticus:act fast,no matter with what![J]. Indian Pediatrics,2020,57(3):211-212.
[16] Lorenzo CD,Ferretti F,Mora E,et al. Identification and quantification of thujone in a case of poisoning due to repeated ingestion of an infusion of artemisia vulgaris L:thujone in artemisia vulgaris poisoning[J]. J Food Sci,2018,83(7/9):2257-2264.
[17] Rissardo JP,Caprara ALF,Silveira JOF. Generalized convulsive status epilepticus secondary to jarisch-herxheimer reaction in neurosyphilis[J]. Neurologist,2019,24(1):29-32.
[18] Park S,Kelaidi C,Meunier M,et al. Correction to:The prognostic value of serum erythropoietin in patients with lower-risk myelodysplastic syndromes:a review of the literature and expert opinion[J]. Ann Hematol,2020,99(1):21.
[19] Smith ZZ,Benison AM,Bercum FM,et al. Progression of convulsive and nonconvulsive seizures during epileptogenesis after pilocarpine-induced status epilepticus[J]. J Neurophysiol,2018,119(5):1818-1835.
[20] Leitinger M,Trinka E,Zimmermann G,et al. Salzburg criteria for nonconvulsive status epilepticus:Details matter[J]. Epilepsia,2019,60(11):2334-2336.
[21] Chambers JM,Wingert RA. New zebrafish model for monitoring proximal tubule physiology in genetic and acquired renal Fanconi syndromes[J]. Kidney International,2020,97(6):1097-1099.