中枢神经系统感染性疾病是因病毒、真菌、细菌等各种致病微生物感染引起的脑实质或脊髓炎症性病变。因中枢神经系统缺乏淋巴管,蛛网膜下腔缺少毛细血管,感染后炎症反应症状往往病情严重,病情进展迅速[1-2]。这就对疾病的早期诊断提出更高要求,以便针对性治疗,避免延误最佳治疗时机。高通量测序,即二代测序技术(next-generation sequencing,NGS),利用现有微生物群基因信息群,采用生物信息学方法,与测序结果比对,进而鉴别微生物种类[3-4]。但目前有关NGS在中枢神经系统感染性疾病中的诊断价值,却少有报道。本研究回顾性分析81例中枢神经系统感染性疾病患儿临床资料,探讨NGS的应用价值,报告如下。
1 资 料 与 方 法
1.1 一般资料 纳入2019年2月—2020年8月我院收治的81例中枢神经系统感染性疾病患儿作为研究对象。纳入标准:①中枢神经系统感染性疾病诊断参照脑脊液病原体培养结果[5];②患儿年龄0~14岁;③患儿病历资料完整。排除标准:①凝血功能障碍者;②拒绝腰椎穿刺者;③合并有颅脑外伤、颅内出血或脑肿瘤者;④肝肾功能不全或有严重心肺基础性疾病者。根据脑脊液病原体培养结果将81例患儿分为A组(病毒性脑炎,20例)、B组(结核性脑膜炎,28例)、C组(化脓性脑膜炎,24例)及D组(隐球菌性脑膜炎,9例)。四组患儿基本资料比较,差异均无统计学意义(P>0.05)。见表1。
表1 四组患儿基本资料比较
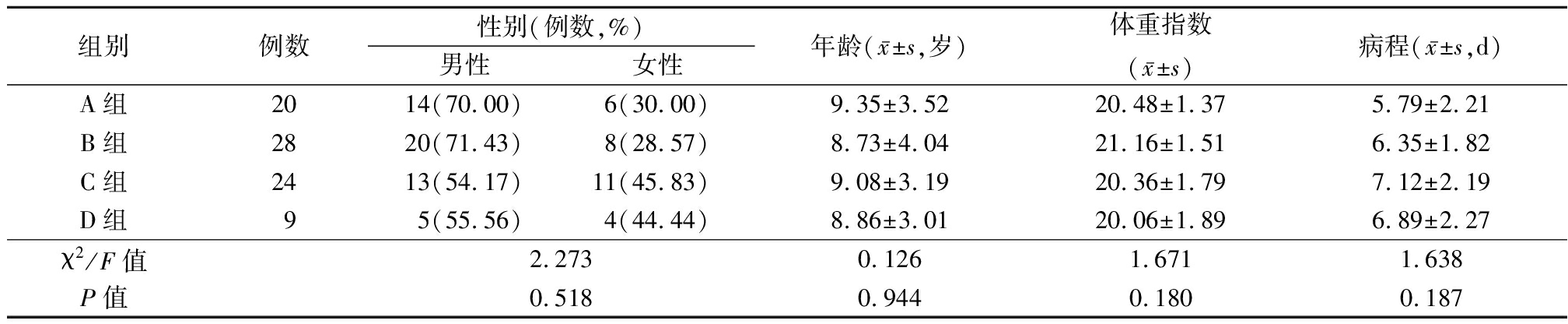
组别例数性别(例数,%)男性女性年龄(x-±s,岁)体重指数(x-±s)病程(x-±s,d)A组2014(70.00)6(30.00)9.35±3.5220.48±1.375.79±2.21B组2820(71.43)8(28.57)8.73±4.0421.16±1.516.35±1.82C组2413(54.17)11(45.83)9.08±3.1920.36±1.797.12±2.19D组95(55.56)4(44.44)8.86±3.0120.06±1.896.89±2.27χ2/F值2.2730.1261.6711.638P值0.5180.9440.1800.187
1.2 仪器和试剂 Select BioProducts型涡旋震荡仪(广州菲罗门科学仪器有限公司)。蛋白酶K(上海云序生物科技有限公司),裂解液(按GB:Carrier RNA=100∶1比例配置,杭州开泰生物技术有限公司),洗脱缓冲液(赫澎生物科技有限公司)。
1.3 脑脊液采集 在发病急性期(入院周内)行常规腰椎穿刺术:患者侧卧、屈膝,脊柱后凸,以髂后上棘连线与脊柱后正中线交点为穿刺点(一般为第3~4腰椎棘突间隙),采用2%利多卡因进行局部麻醉,麻醉起效后进针,进针深度4~6 cm,在患者感到有阻力消失的落空感时,缓慢抽出,留取3 mL脑脊液,冷冻保存备用,24 h内送检。
1.4 NGS 检查时先解冻,将样本置于离心管内,采用Select Bio Products型涡旋震荡仪进行震荡破壁,再次离心后取上清液。取600 μL样本,加入10 μL蛋白酶K。加入300 μL裂解液,37 ℃温浴1 h,加入无水乙醇。吸取样本混合物,离心后弃滤液。依次向吸附柱中加入500 μL缓冲液GD、600 μL漂洗液PW,离心后弃滤液。将吸附柱晾干,转入离心管中,再加入50 μL洗脱缓冲液TB,静置后离心,取滤液,作为DNA溶液。采用SinapTec超声波破碎仪将样本DNA打断至150~200 bp。采用Qubit dsDNA HS Assay Kit质控DNA文库浓度,采用BGISEQ-500/50 NGS系统进行测序。采用BWA去除人源性序列、低质量序列及含N序列。与细菌库、病毒库及真菌库比对,计算相关参数。
1.5 诊断标准[6-7] 以Unique reads条数≥2为NGS结果阳性,判定为病毒性脑膜炎;以结核分枝杆菌复合群种水平序列数(mycobacterium tuberculosis complex species level sequence number,MRN)≥1为结果阳性,判定为结核性脑膜炎;以Unique reads条数≥5为NGS结果阳性,判定为化脓性脑膜炎;以NGS发现隐球菌DNA为结果阳性。以脑脊液病原学检测结果为金标准,病毒性脑炎:脑脊液检测特异性病毒抗体,脑脊液中白细胞计数正常或数十倍增高,临床可见颅内压升高、发热或意识障碍、惊厥;隐球菌性脑膜炎:脑脊液培养发现病原菌,临床可见发热、渐进性头痛、精神错乱、嗜睡;结核性脑膜炎:以脑脊液病原学检测出阳性结果为金标准,临床可见间断头痛、发热、惊厥、反射消失或肢体瘫痪;化脓性脑膜炎:以脑脊液病原学检测出阳性结果为金标准,临床可见颅内压升高,脑膜刺激征。
1.6 统计学方法 应用SPSS 20.0统计学软件分析数据。计量资料组间比较采用F检验,计数资料组间比较采用χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1 NGS判断中枢神经系统感染性疾病价值分析 NGS检测隐球菌性脑膜炎NGS诊断化脓性脑膜炎和隐球菌性脑膜炎的 Kappa值高于病毒性脑炎好结核性脑炎。见表2。
表2 NGS诊断中枢神经系统感染性疾病结果 (例数,%)
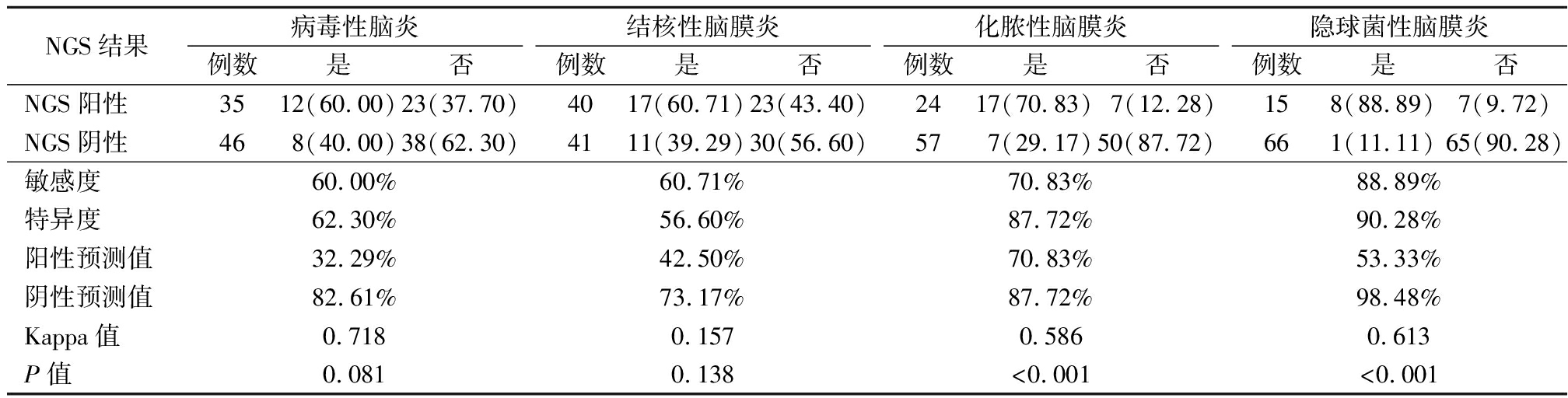
NGS结果病毒性脑炎例数是否结核性脑膜炎例数是否化脓性脑膜炎例数是否隐球菌性脑膜炎例数是否NGS阳性3512(60.00)23(37.70)4017(60.71)23(43.40)2417(70.83)7(12.28)158(88.89)7(9.72)NGS阴性468(40.00)38(62.30)4111(39.29)30(56.60)577(29.17)50(87.72)661(11.11)65(90.28)敏感度60.00%60.71%70.83%88.89%特异度62.30%56.60%87.72%90.28%阳性预测值32.29%42.50%70.83%53.33%阴性预测值82.61%73.17%87.72%98.48%Kappa值0.7180.1570.5860.613P值0.0810.138<0.001<0.001
2.2 NGS诊断中枢神经系统感染性疾病价值比较 NGS诊断病毒性脑炎、结核性脑膜炎、化脓性脑膜炎及隐球菌性脑炎的特异度、阳性预测值及阴性预测值比较,差异均有统计学意义(P<0.05),其中NGS诊断隐球菌性脑膜炎的特异度、准确度及阴性预测值显著高于其诊断病毒性脑炎和结核性脑炎的价值,差异均有统计学意义(P<0.05)。见表3。
表3 NGS诊断中枢神经系统感染性疾病的价值比较 (例数,%)
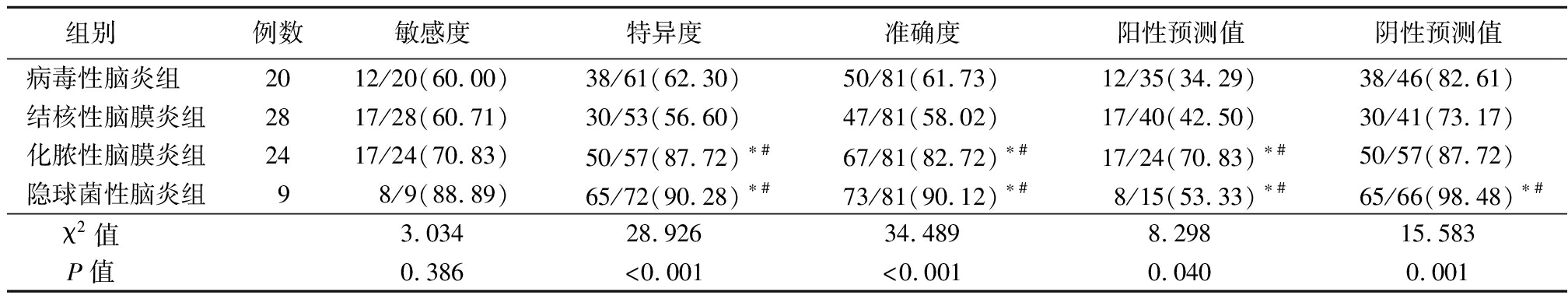
组别 例数敏感度特异度准确度阳性预测值阴性预测值病毒性脑炎组 2012/20(60.00)38/61(62.30)50/81(61.73)12/35(34.29)38/46(82.61)结核性脑膜炎组2817/28(60.71)30/53(56.60)47/81(58.02)17/40(42.50)30/41(73.17)化脓性脑膜炎组2417/24(70.83)50/57(87.72)∗#67/81(82.72)∗#17/24(70.83)∗#50/57(87.72)隐球菌性脑炎组98/9(88.89)65/72(90.28)∗#73/81(90.12)∗#8/15(53.33)∗#65/66(98.48)∗#χ2值 3.03428.92634.4898.29815.583P值 0.386<0.001<0.0010.0400.001
*P<0.05与病毒性脑炎比较 #P值<0.05与结核性脑膜炎组比较 △P值<0.05与化脓性脑膜炎组比较(χ2检验)
3 讨 论
中枢神经系统感染性疾病发病范围广泛,多发生于老年和儿童,尤其以儿童最为多见,且儿童机体功能尚未发育成熟,自身免疫抵抗能力低下,病情进展迅速,部分患儿可造成后遗症,甚至致残致死,导致不良预后的发生[8]。近年来研究显示,因颅脑有创检查的开展、免疫功能降低及抗生素的滥用等原因,儿童中枢神经系统感染性疾病发生率有上升趋势[9]。早期准确诊断中枢神经系统感染性疾病是有效治疗和改善预后的关键,因而本研究重点探讨NGS在中枢神经系统感染性疾病患儿诊疗中的应用价值。
病毒性脑炎多因带状疱疹病毒和单纯疱疹病毒感染引发,是临床最常见中枢神经系统感染性疾病类型之一[10]。脑组织病毒分离检测是目前病毒性脑炎的金标准,但脑组织活检创伤大、耗时长[11],难以在临床广泛推广。而NGS则无需使用特异性病原体引物,实现了对病原体的无靶向、无偏移筛查[12]。因RNA易降解,本研究采用DNA进行测序,对于感染累及软脑膜的患儿,因血脑屏障的存在,病原体先进入脑脊液,然后随脑脊液回收进入血液循环[13],因而以脑脊液为实验标本进行病原体检测,敏感度更高。另外,对于病毒性脑炎疑似患儿,经抗生素干预治疗后,病毒核酸逐渐被降解,这可能是NGS阳性检出率较低的原因[14],因而对于疑似患儿应尽早进行NGS检查,以实现病毒性脑炎的早诊断和早处理,改善患儿预后。化脓性脑炎可经血行感染、医源性感染等多途径感染导致,病情凶险。脑脊液细菌培养作为诊断化脓性脑炎的金标准,虽然特异度高,但敏感度仅0.25[15]。而隐球菌性脑膜炎虽然发病率低,但隐球菌性脑膜炎影像检查结果和临床症状缺乏特异性,具有多变性。既往多依靠实验室进行诊断,但此种方法阳性率低,且结果依赖与操作者技术水平,临床推广受到局限。NGS根据酶级联化学发光反应原理,获得互补链序列信息,完成样品分析,为临床诊断提供依据[16-17]。本研究采用NGS进行,发现NGS判断化脓性脑膜炎和隐球菌性脑膜炎的Kappa值较为满意,准确度分别为82.72%和90.12%。本研究以Unique reads≥5为阳性判断依据,结果显示其判断化脓性脑炎的敏感度和特异度均尚可。而NGS诊断隐球菌性脑膜炎的特异度和阴性预测值分别达90.28%和98.48%,高于对其他类型疾病的识别率,提示NGS对诊断隐球菌性脑膜炎价值较高,这与Zhang等[18]结果一致。NGS可对病原体进行分子诊断,与脑脊液病原菌培养相比,诊断时间也显著缩短,这为早期诊断和治疗创造条件,有助于改善患儿预后。目前有关NGS在结核性脑膜炎诊疗中的专项报道还较为少见,本研究显示NGS诊断结核性脑膜炎的敏感度、特异度及准确度均低于65.00%,提示NGS诊断结核性脑膜炎的价值有限,这可能是因在提取脑脊液上清液标本过程中,大量胞内寄生的结核分枝杆菌被遗漏有关[19]。这说明NGS可能作为结核性脑膜炎的辅助检查手段。
但NGS需要检测医师具备一定专业技能和知识。另外,人源性核酸和共存微生物核酸数量较大,可影响致病菌在提取核酸中的比例,进而降低NGS的敏感度[20]。因而,减少外源性污染可能有助于提高NGS的应用价值。有学者提出宏基因组NGS技术,以缩短检测时间,提高病原体检测敏感度,但该技术在人源性序列干扰、定植及致病菌鉴别方面缺乏标准化依据[21],这可称为NGS未来发展方向。
综上所述,NGS对诊断中枢神经系统感染性疾病具有重要价值,尤其是对于化脓性脑膜炎和隐球菌性脑膜炎,诊断准确度高。
[1] 岳新胜,张云峰,李胜迪.中枢神经系统感染患者脑脊液检查的结果分析[J].中华医院感染学杂志,2015,25(16):3729-3730,3813.
[2] Hong HL,Lee EM,Sung H,et al. Clinical features,outcomes,and cerebrospinal fluid findings in adult patients with central nervous system(CNS) infections caused by varicella-zoster virus:comparison with enterovirus CNS infections[J].J Med Virol,2015,86(12):2049-2054.
[3] 童永清,李艳.高通量测序平台发展及在临床分子诊断中的应用与展望[J]. 中华检验医学杂志,2019,42(2):73-76.
[4] Brown JR,Bharucha T,Breuer J. Encephalitis diagnosis using metagenomics:application of next generation sequencing for undiagnosed cases[J]. J Infect,2018,76(3):225-240.
[5] 中华医学会神经外科学分会,中国神经外科重症管理协作组.神经外科脑脊液外引流中国专家共识(2018版)[J].中华医学杂志,2018,98(21):1646-1649.
[6] 林爱清,张璐,成宝涛,等.二代测序技术应用于脑脊液检测在结核性脑膜炎中的早期诊断价值[J/CD]. 中华实验和临床感染病杂志(电子版),2020,14(4):291-295.
[7] Pentsova EI,Shah RH,Tang J,et al. Evaluating cancer of the central nervous system through next-generation sequencing of cerebrospinal fluid[J]. J Clin Oncol,2016,34(20):2404-2415.
[8] 高建国. 中枢神经系统感染性疾病的流行特征分析[J]. 安徽医药,2019,23(8):1604-1607.
[9] 韩冰,王志红,王明栋,等.河北省中南部地区成人中枢神经系统感染性疾病流行病学分析[J]. 河北医药,2013,35(4):599-601.
[10] 李慧,刘威,赵建民.2015-2016年病毒性脑炎流行病学分析[J].中国病原生物学杂志,2018,13(1):72-75.
[11] 张庆,何红彦,马爱蕊,等.中枢神经系统感染性疾病的脑脊液细胞学分析[J].河北医科大学学报,2016,37(6):644-646,651.
[12] Bolotin DA,Mamedov IZ,Britanova OV,et al. Next generation sequencing for TCR repertoire profiling:Platform-specific features and correction algorithms[J]. Eur J Immunol,2012,42(11):3073-3083.
[13] 冯国栋,贺旻,汪昕. 二代测序技术在诊断神经系统感染性疾病中的应用[J].诊断学理论与实践,2018,17(4):391-395.
[14] Wu Q,Ding SW,Zhang Y,et al. Identification of viruses and viroids by next-generation sequencing and homology-dependent and homology-independent algorithms[J]. Ann Rev Phytopathol,2015,53(1):425-444.
[15] 李轲,谢付静,杨亚培,等.单独及联合检测脑脊液中3种标志物对儿童病毒性脑炎与不典型化脓性脑炎的鉴别诊断价值[J].中华实用诊断与治疗杂志,2018,32(4):375-377.
[16] 徐素华,杨琳,吴冰冰,等.疑似遗传代谢病的高危新生儿行质谱检测与高通量测序检测诊断准确性研究[J].中国循证儿科杂志,2019,14(1):1-7.
[17] 张益,李洋,杨梦婕,等. 应用宿主应答分析与VSITA宏基因组测序技术在疑似脑炎患者脑脊液中检出病原体[J]. 中华实验和临床病毒学杂志,2019,33(3):231-235.
[18] Zhang JZ,Zheng P,Sun HM,et al. Next-generation sequencing combined with routine methods to detect the pathogens of encephalitis/meningitis from a Chinese tertiary pediatric neurology center[J]. J Infect,2019,78(5):409-421.
[19] Friedensohn S,Khan TA,Reddy ST. Advanced methodologies in high-throughput sequencing of immune repertoires[J]. Trends Biotechnol,2017,35(3):203-214.
[20] 谢浩,赵明,胡志迪,等.DNA测序技术方法研究及其进展[J].生命的化学,2015,35(6):811-816.
[21] 郭凌云,李勤静,刘钢.宏基因组测序技术在中枢神经系统感染病原体检测中的应用现状[J].中华传染病杂志,2019,37(5):314-317.