帕金森疾病(Parkinson′s disease,PD)是目前世界排名第二的神经元变性疾病,已严重危及老年人的生命健康[1]。目前PD的临床治疗主要为多巴胺替代治疗,如左旋多巴能够在一定程度上减轻PD患者的症状,但其并不能够阻止疾病的进程,且治疗时患者会对药物的敏感性降低[2-3]。因此,亟待探寻新的药物研发以减缓PD疾病进程。京尼平苷(geniposide,GP)的主要药效成分为中药栀子。有研究显示其能够透过用于阿尔茨海默病的治疗,并能够通过哺乳动物雷帕霉素靶点(Mammalian target of rapamycin,mTOR)信号通路发挥神经保护作用[4-6]。自噬是依赖溶酶体体内异常蛋白以及受损细胞器降解的一种分解机制。研究证实细胞自噬途径的调控异常,例如磷酸腺苷依赖的蛋白激酶/mTOR(adenosine 5′-monophosphate-activated protein kinase/mTOR,AMPK/mTOR)信号通路调控,在PD疾病进展中发挥着重要的作用[7-8]。但是目前关于GP是否能够通过调控AMPK/mTOR信号通路来发挥抑制帕金森模型氧化应激损伤、细胞凋亡及自噬的作用还尚不清楚。本研究使用1-甲基4-苯基-四氢吡啶离子(1-methyl-4-phenyl 1,2,3,6-tetrahydropyridine,MPP+)预处理人神经母细胞瘤株SH-SY5Y细胞构建PD细胞模型,探究GP对PD细胞模型的细胞凋亡、氧化应激损伤及自噬的影响,并进一步探究GP是否通过AMPK/mTOR信号通路调控PD细胞模型的细胞凋亡及自噬。
1 材料与方法
1.1 材料 人神经母细胞瘤株SH-SY5Y购自于上海中科院细胞库。MPP+、兔抗AMPK、p-AMPK、mTOR、p-mTOR、LC3B单克隆抗体、大鼠抗β-actin单克隆抗体和辣根过氧化物酶标记的山羊抗兔与兔抗大鼠二抗均购自于美国Sigma公司;胎牛血清、胰酶、青链霉素混合液及RPMI 1640培养基均购自于美国Gibco公司;CCK-8检测试剂盒及BCA蛋白检测试剂盒购自于英国Abcam公司;丙二醛(malondialdehyde,MDA)含量检测试剂盒、乳酸脱氢酶(lactate dehydrogenase,LDH)活性检测试剂盒及超氧化物歧化酶(superoxide dismutase,SOD)活性检测试剂盒及购自于北京索莱宝科技有限公司;Annexin V-FITC/PI细胞凋亡试剂盒购自于美国Invitrogen公司;Efficient chemiluminescence(ECL)化学发光显色试剂盒购自于美国Millipore公司;AMPK激动剂Metformin及mTOR抑制剂Rapamycin购自于美国Cell signaling technology公司;京尼平苷(≥98%)购自于成都锦泰和医药化学技术有限公司。
1.2 方法
1.2.1 细胞培养 将SH-SY5Y细胞置于含有10%胎牛血清及1%青链霉素的Roswell Park Memorial Institute(RPMI) 1640培养基中,在5% CO2条件下的37 ℃恒温培养箱中常规培养。用倒置显微镜观察细胞的生长状况,每3~4 d更换一次培养基。待细胞汇合度达80%左右时,1∶3胰酶消化传代,取3~7代生长状况良好的细胞用于后续试验。
1.2.2 筛选最适MPP+浓度及作用时间以建立急性PD细胞损伤模型 取适量MPP+溶于细胞培养液中,终浓度调整为1 mmol/L,0.22 μm孔径滤膜过滤除菌,置于4 ℃冰箱保存备用。取处于指数生长期的SH-SY5Y细胞,调整细胞密度,按1×104个/孔接种于96孔板中,常规培养12 h,取不同终浓度(0 mmol/L、0.5 mmol/L、1 mmol/L、2.5 mmol/L、5 mmol/L)的MPP+添加至细胞培养板中作用24 h,及1 mmol/L MPP+添加至细胞培养板中作用不同时间(0 h、6 h、12 h、24 h及48 h),按照CCK-8试剂盒说明书添加试剂后,使用酶标仪于450 nm波长处检测不同浓度MPP+处理后细胞的吸光度,以0 mmol/L为对照,计算分析细胞活力。
1.2.3 试验分组及处理 ①对照(Control)组:正常培养的SH-SY5Y细胞,无任何特殊处理;②MPP+组:单独使用1 mmol/L MPP+进行处理的SH-SY5Y细胞;③GP 组:根据预试验结果,单独使用100 μmol/L GP进行处理SH-SY5Y细胞;④MPP+联合GP处理组(MPP++GP):使用1 mmol/L MPP+进行SH-SY5Y细胞的预处理,培养24 h后添加100 μmol/L GP。
上述各组细胞均置于5% CO2条件下的37 ℃恒温培养箱中培养, 48 h后进行后续相关实验。此外,分别采用AMPK激动剂Metformin(Met)及mTOR抑制剂Rapamycin(Rap)处理MPP+组及MPP++GP组,明确GP是否通过AMPK/mTOR通路影响MPP+诱导的SH-SY5Y细胞的增殖及自噬能力。
1.2.4 CCK-8法测定细胞活性 将各组细胞按照1×104个/孔接种于96孔板中,置于细胞培养箱中常规培养24 h;待检测前4 h弃去细胞培养基,使用磷酸缓冲液(phosphate buffered saline,PBS)洗涤3次,每孔加入10 μL 细胞计数试剂(cell counting kit-8,CCK-8)混匀,置于培养箱中孵育4 h,使用酶标仪于450 nm处检测细胞吸光度,计算分析细胞的增殖活性。实验重复3次。
1.2.5 流式细胞术检测细胞凋亡 收集各组细胞,将细胞密度调整为5×105/mL,使用预冷磷酸缓冲液漂洗细胞,加入100 μL Binding buffer溶液重悬细胞,随后依次加入5 μL Annexin V-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)及10 μL 碘化丙啶染色液(propidium iodide,PI),于室温条件下避光染色处理15 min,随即上流式细胞仪检测各组细胞的凋亡率。实验重复3次。
1.2.6 氧化应激指标检测 收集上述待测细胞,取细胞培养上清液,分别按照LDH试剂盒、SOD试剂盒及MDA试剂盒说明书操作检测细胞的LDH表达、SOD活性以及MDA含量。实验重复3次。
1.2.7 LC3蛋白定位 将生长条件良好的SH-SY5Y细胞,调整细胞密度,并按2×105个/孔细胞接种于6孔板中,使用不含抗生素及血清的培养基进行转染试剂PEI的稀释,室温放置5 min;向混合液中加入1 μg GFP-LC3质粒DNA混匀,室温放置15 min;将混合液加入细胞培养孔中,常规条件培养6 h并更换新鲜培养基;按方法1.2.3进行细胞处理及分组,培养48 h后,室温条件下加入4%多聚甲醛固定细胞30 min;加入0.1 mg/L DAPI染液,室温条件下染色2 min,PBS洗涤细胞一次后封片,最后于荧光显微镜下观察细胞荧光。
1.2.8 Western blot 取上述各组细胞,弃去培养基,PBS洗涤细胞,加入细胞裂解液,混匀并收集细胞至1.5 mL离心管中,BCA法测定蛋白浓度,100 ℃水浴加热10 min,12 000 r/min离心10 min;配置相应浓度的浓缩胶,将蛋白样品及Maker依次上样后60 V电泳,待样品进入分离胶后,调整为110 V继续电泳至样品达分离胶底部。使用甲醇激活过的聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜进行蛋白质转膜。结束后将PVDF膜置于5%脱脂奶粉中封闭2 h;分别使用稀释好的AMPK(1∶1 000)、p-AMPK(1∶1 000)、mTOR(1∶1 000)、p-mTOR(1∶1 000)、LC3B(1∶1 000)及β-actin(1∶1 000)一抗孵育至PVDF膜上,置于湿盒中4 ℃孵育过夜,回收一抗并使用TBST洗膜3次,每次10 min;使用偶联辣根过氧化物酶二抗室温条件下孵育2 h,TBST洗膜3次,每次10 min;按照ECL试剂盒说明书进行蛋白质显色,置于化学发光检测仪中检测蛋白质条带进行,使用Image J软件进行图像分析。
1.3 统计学方法 应用SPSS 19.0软件进行统计学分析。计量资料多组间差异比较采用F检验,组间差异多重比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 MPP+对SH-SY5Y细胞损伤的作用 CCK-8法检测MPP+处理后SH-SY5Y细胞活性,结果显示随着MPP+作用浓度的增加,SH-SY5Y细胞活力呈现逐渐降低的趋势,其中1.0 mmol/L、2.5 mmol/L及5.0 mmol/L浓度MPP+作用后SH-SY5Y细胞活力相较于0 mmol/L显著降低(P<0.01),鉴于2.5 mmol/L及5.0 mmol/L浓度的MPP+作用后SH-SY5Y细胞活力下降至50%以下,因此本研究选择1.0 mmol/L作为MPP+的给药浓度。随后再次应用CCK-8进一步明确MPP+的最佳作用时间,结果显示随MPP+作用时间的延长,SH-SY5Y细胞活力也呈现逐渐降低的趋势,其中1 mmol/L的MPP+作用细胞12 h、24 h及48 h后SH-SY5Y细胞活力相较于0 h显著降低(P<0.01),鉴于1.0 mmol/L浓度的MPP+作用48 h后SH-SY5Y细胞活力也下降至50%以下。因此本研究应用1 mmol/L的MPP+处理细胞24 h作为最佳条件进行构建急性PD细胞模型,见表1~2。
表1 不同浓度MPP+处理后SH-SY5Y细胞活性变化 Table 1 Changes in SH-SY5Y cell viability after treatment with different concentrations of MPP+ ![]()

组别细胞活力 MPP+0 mmol/L浓度组112.3±5.4MPP+0.5 mmol/L浓度组104.7±6.8MPP+1.0 mmol/L浓度组74.3±10.2*#MPP+2.5 mmol/L浓度组32.7±6.5*#△MPP+5.0 mmol/L浓度组10.7±1.7*#△☆F值19.288P值<0.001
*P值<0.05与MPP+0 mmol/L浓度组比较 #P值<0.05与MPP+0.5 mmol/L浓度组比较 △P值<0.05与MPP+1.0 mmol/L浓度组比较 ☆P值<0.05与MPP+2.5 mmol/L浓度组比较(SNK-q检验)
表2 1.0 mmol/L MPP+处理不同时间下SH-SY5Y细胞活性变化
Table 2 Changes of SH-SY5Y cell viability at different time of 1.0 mmol/L MPP+ treatment ![]()

组别细胞活力 处理时间0 h组124.0±5.3处理时间6 h组114.2±4.9处理时间12 h组85.7±9.1*#处理时间24 h组74.3±10.2*#△处理时间48 h组47.1±4.1*#△☆F值15.142P值<0.001
*P值<0.05与处理时间0 h组比较 #P值<0.05与处理时间6 h组比较 △P值<0.05与处理时间12 h组比较 ☆P值<0.05与处理时间24 h组比较(SNK-q检验)
2.2 GP抑制MPP+诱导SH-SY5Y细胞凋亡的作用 流式细胞检测SH-SY5Y细胞凋亡的结果显示,相较于Control组,MPP+组及MPP++GP组的SH-SY5Y细胞凋亡率显著增加(P<0.01),GP组SH-SY5Y细胞凋亡率差异无统计学意义(P>0.05);相较于MPP+组,MPP++GP组SH-SY5Y细胞凋亡率均显著减少(P<0.01)。 见图1,表3。
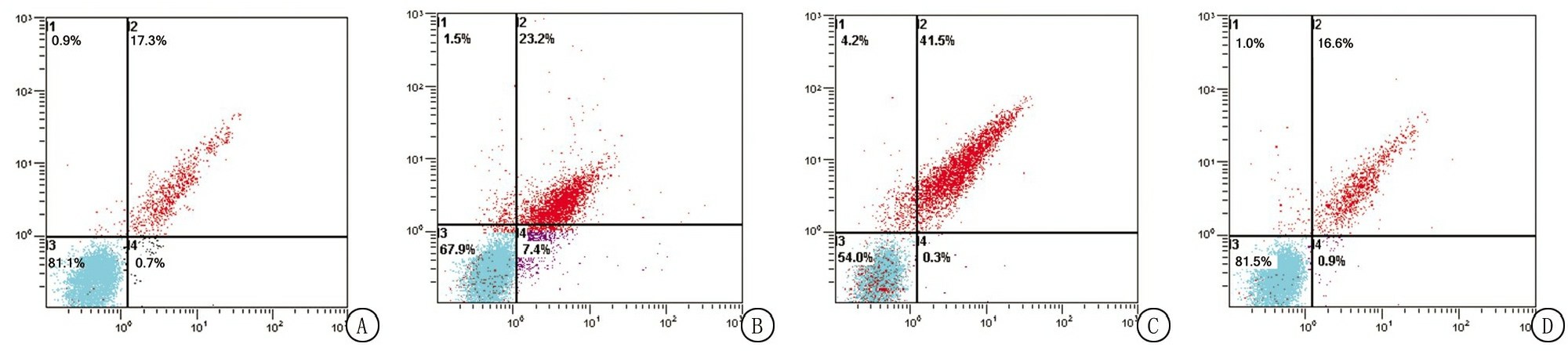
图1 京尼平苷对MPP+诱导的SH-SY5Y细胞凋亡的流式细胞图
A.对照组;B.MPP+组;C.GP组;D.MPP++GP组
Figure 1 Flow cytometry of geniposide on the apoptosis of SH-SY5Y cells induced by MPP+
表3 京尼平苷对MPP+诱导的SH-SY5Y细胞凋亡率的影响
Table 3 Effect of geniposide on the apoptosis rate of SH-SY5Y cells induced by MPP+ ![]()
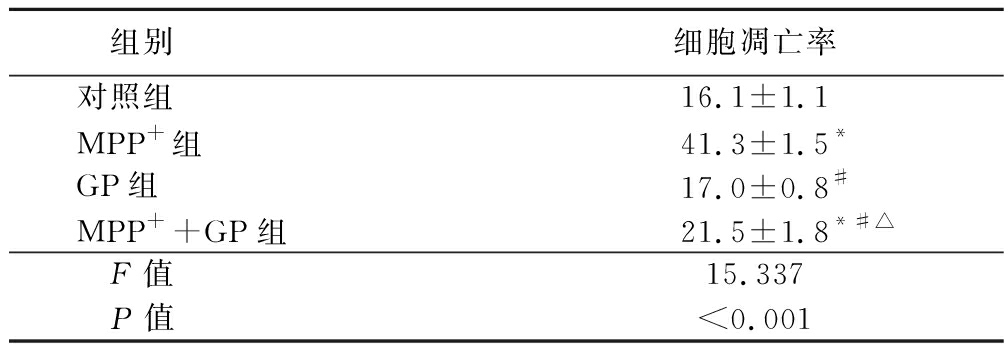
组别细胞凋亡率对照组16.1±1.1MPP+组41.3±1.5*GP组17.0±0.8#MPP++GP组21.5±1.8*#△F值15.337P值<0.001
*P值<0.05与对照组比较 #P值<0.05与MPP+组比较 △P值<0.05与GP组比较(SNK-q检验)
2.3 京尼平苷减轻MPP+诱导SH-SY5Y细胞氧化应激的作用 相较于Control组,MPP+组LDH活性及MDA含量显著增加(P<0.01),且SOD活性显著降低(P<0.01),而GP组及MPP++GP组的LDH、SOD活性及MDA含量均差异无统计学意义(P>0.05);相较于MPP+组, MPP++GP组LDH活性及MDA含量显著降低(P<0.01),SOD活性显著增加(P<0.01),见表4。
表4 京尼平苷对MPP+诱导SH-SY5Y细胞分泌LDH、SOD活性及MDA含量的影响
Table 4 Effect of geniposide on the secretion of LDH,SOD and MDA content in SH-SY5Y cells induced by MPP+ ![]()
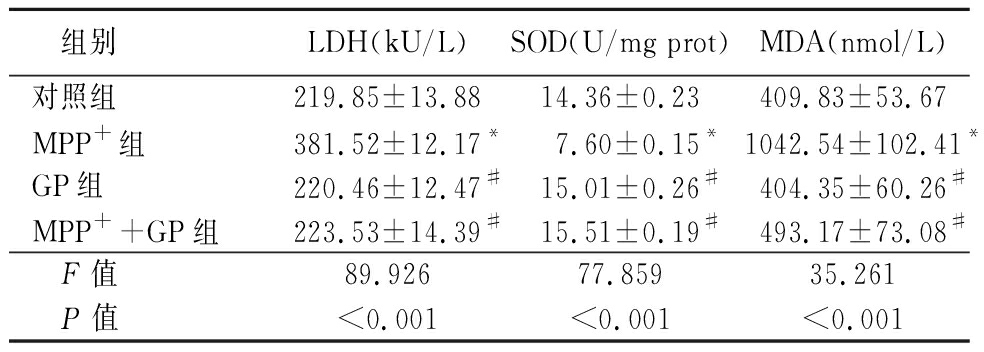
组别LDH(kU/L)SOD(U/mg prot)MDA(nmol/L)对照组219.85±13.8814.36±0.23409.83±53.67MPP+组381.52±12.17*7.60±0.15*1042.54±102.41*GP组220.46±12.47#15.01±0.26#404.35±60.26#MPP++GP组223.53±14.39#15.51±0.19#493.17±73.08# F值89.92677.85935.261 P值<0.001<0.001<0.001
*P值<0.05与对照组比较 #P值<0.05与MPP+组比较(SNK-q检验)
2.4 京尼平苷对MPP+诱导SH-SY5Y细胞自噬的作用 荧光染色结果显示,与Control组细胞相比,MPP+组细胞内绿色荧光聚集点明显增加,GP组及MPP++GP组无明显变化。与MPP组比较,MPP++GP组细胞绿色荧光聚集现象明显降低(图2)。
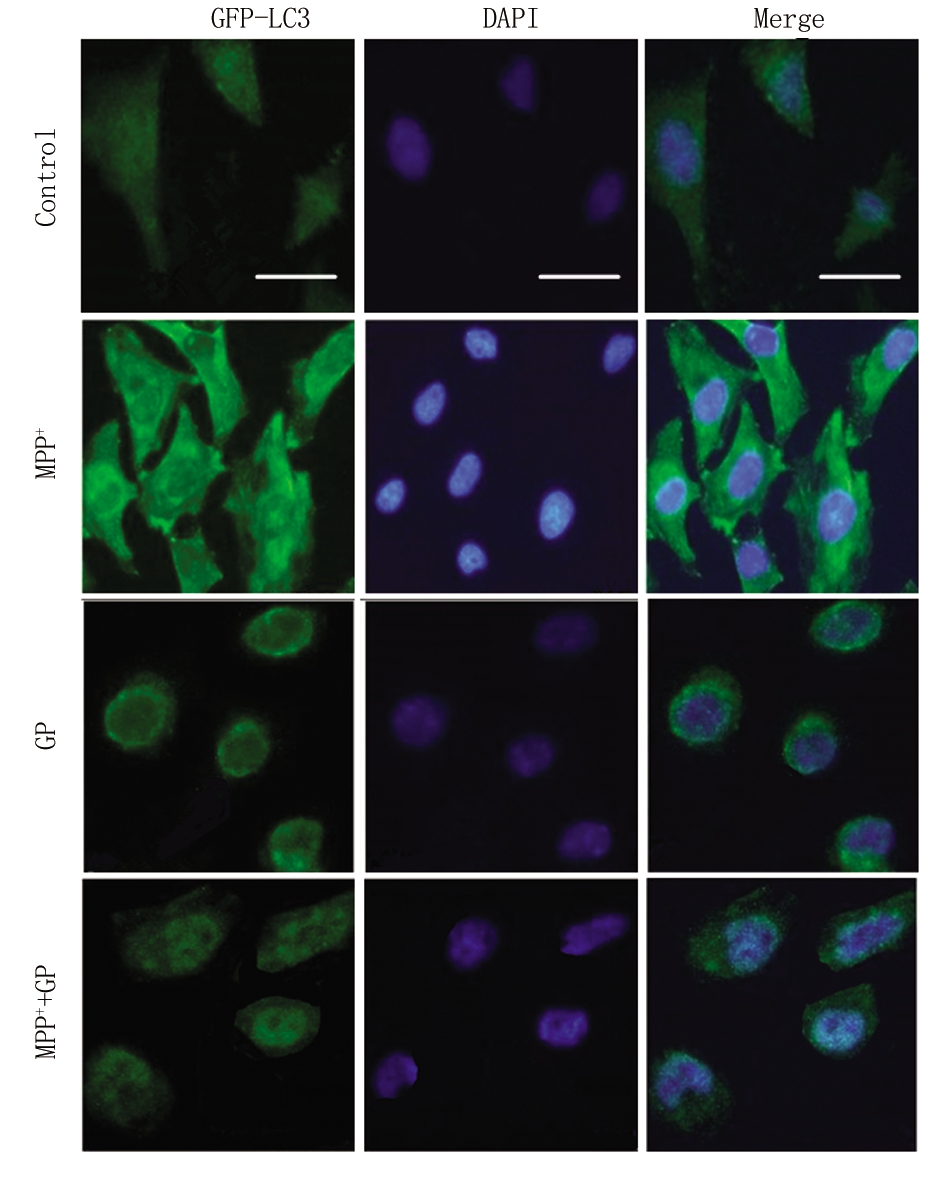
图2 外源性表达GFP-LC3后观察GP对MPP+诱导的SH-SY5Y细胞自噬的影响(绿色荧光为GFP-LC3染色,蓝色荧光为DAPI染色,×400,标尺为10 μm)
Figure 2 Effectof GP on MPP+ induced autophagy in SH-SY5Y cells after exogenous expression of GFP-LC3 (Green fluorescence is GFP-LC3 staining, blue fluorescence is DAPI staining, ×400, scar bar=10 μm)
2.5 GP对MPP+诱导SH-SY5Y细胞自噬相关蛋白表达的作用 相较于Control组,MPP+组细胞中自噬标记分子LC3-Ⅱ/LC3-Ⅰ比值及AMPK/mTOR信号通路中AMPK蛋白磷酸化水平均显著增高(P<0.01),而mTOR蛋白磷酸化水平显著降低(P<0.01),GP组及MPP++GP组的细胞中LC3-Ⅱ/LC3-Ⅰ比值、AMPK及mTOR磷酸化水平间差异无统计学意义(P>0.05);相较于MPP+组,GP组及MPP++GP组自噬标记分子LC3-Ⅱ/LC3-Ⅰ比值及AMPK/mTOR信号通路中AMPK蛋白磷酸化水平均显著降低(P<0.01),而mTOR蛋白磷酸化水平显著增高(P<0.01)。Western blot结果见图3,表5。
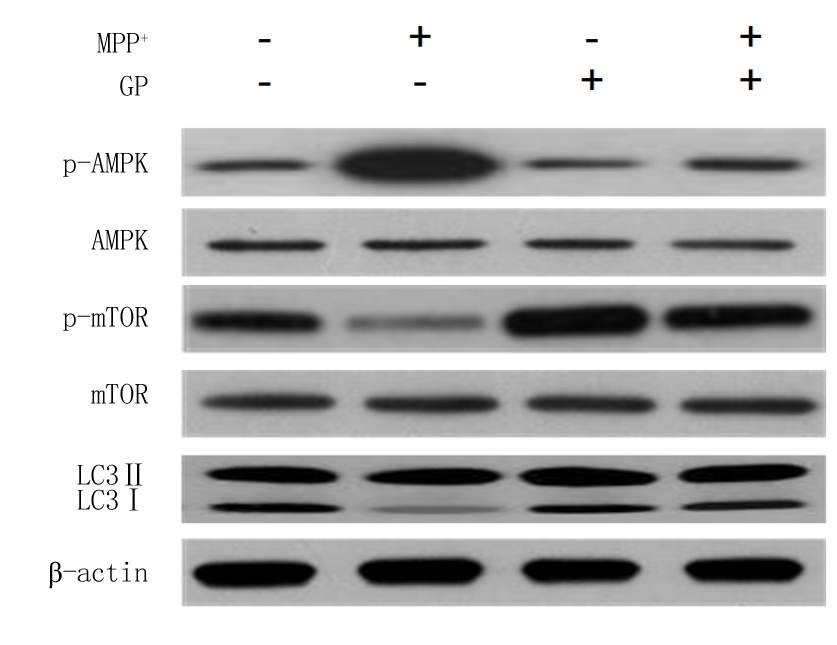
图3 GP对MPP+诱导的SH-SY5Y细胞自噬相关蛋白表达的Western blot图
Figure 3 Western blot of MPP+ induced autophagy-related protein expression in SH-SY5Y cells induced by GP
表5 GP对MPP+诱导的SH-SY5Y细胞自噬相关蛋白表达的影响
Table 5 Effect of MPP+ induced autophagy-related protein expression in SH-SY5Y cells induced by GP ![]()
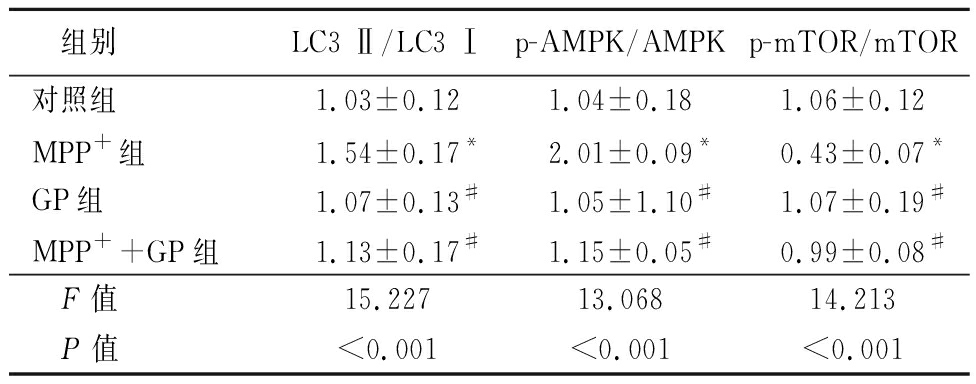
组别LC3 Ⅱ/LC3 Ⅰp-AMPK/AMPKp-mTOR/mTOR对照组1.03±0.121.04±0.181.06±0.12MPP+组1.54±0.17*2.01±0.09*0.43±0.07*GP组1.07±0.13#1.05±1.10#1.07±0.19#MPP++GP组1.13±0.17#1.15±0.05#0.99±0.08# F值15.22713.06814.213 P值<0.001<0.001<0.001
*P值<0.05与对照组比较 #P值<0.05与MPP+组比较(SNK-q检验)
2.6 GP通过AMPK/mTOR通路调控MPP+诱导的SH-SY5Y细胞自噬 Western blot结果显示,在添加AMPK激动剂Met或mTOR抑制剂Rap后,与MPP+组比较,MPP++Met组或MPP++Rap组细胞中LC3-Ⅱ/LC3-Ⅰ比值与p-MAPK磷酸化水平明显增加(P<0.01),mTOR蛋白磷酸化水平显著降低(P<0.01);而与MPP++GP组比较,MPP++GP+Met组或MPP++GP+Rap组细胞中,LC3-Ⅱ/LC3-Ⅰ比值与p-MAPK磷酸化水平明显增加(P<0.01),mTOR蛋白磷酸化水平显著降低(P<0.01)。Western blot结果见图4,表6。
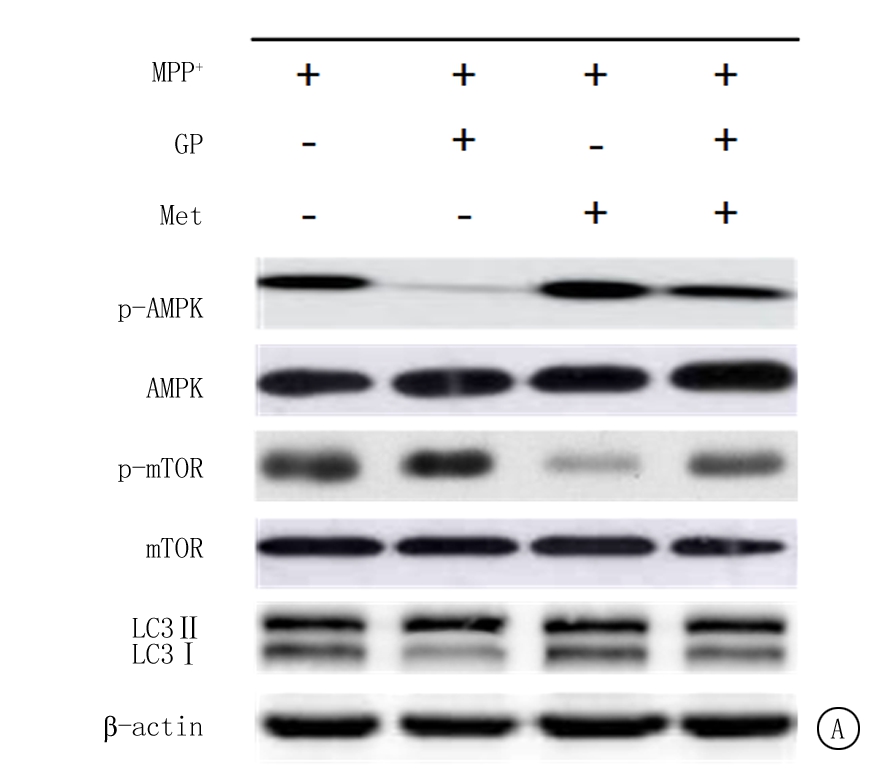
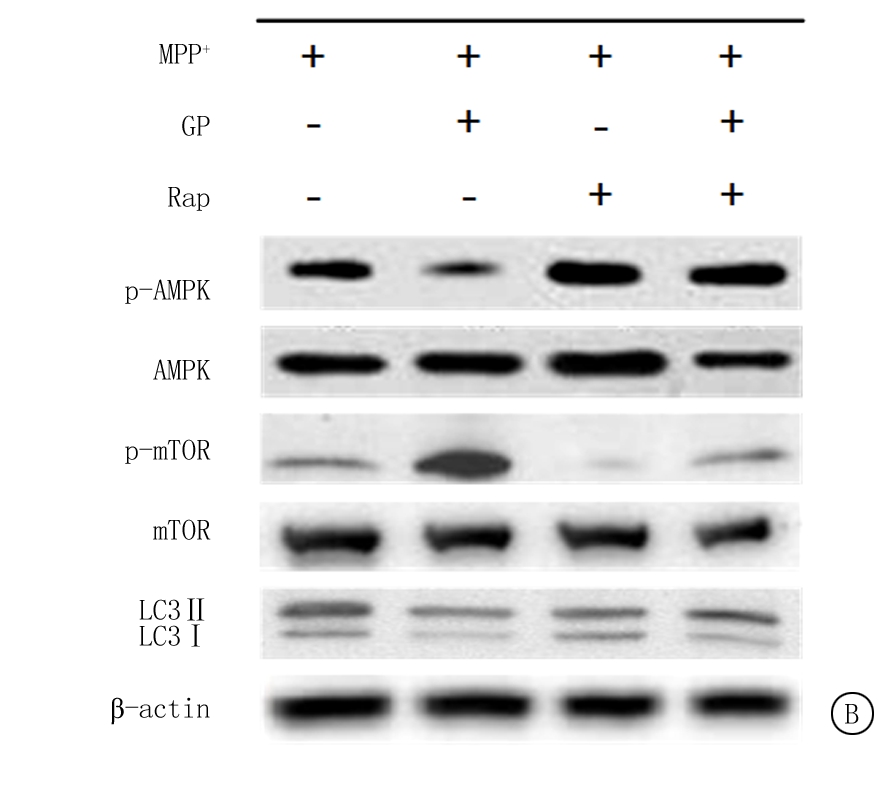
图4 添加Met或Rap后GP对MPP+诱导的SH-SY5Y细胞自噬相关蛋白表达的Western blot图
A.添加Met后检测结果;B.添加Rap后检测结果
Figure 4 Western blot of autophagy-related protein expression in SH-SY5Y cells induced by MPP+ after GP treatment after adding Met or Rap
表6 添加Met或Rap后GP对MPP+诱导的SH-SY5Y细胞自噬相关蛋白表达的影响
Table 6 Effect of autophagy-related protein expression in SH-SY5Y cells induced by MPP+ after GP treatment after adding Met or Rap ![]()
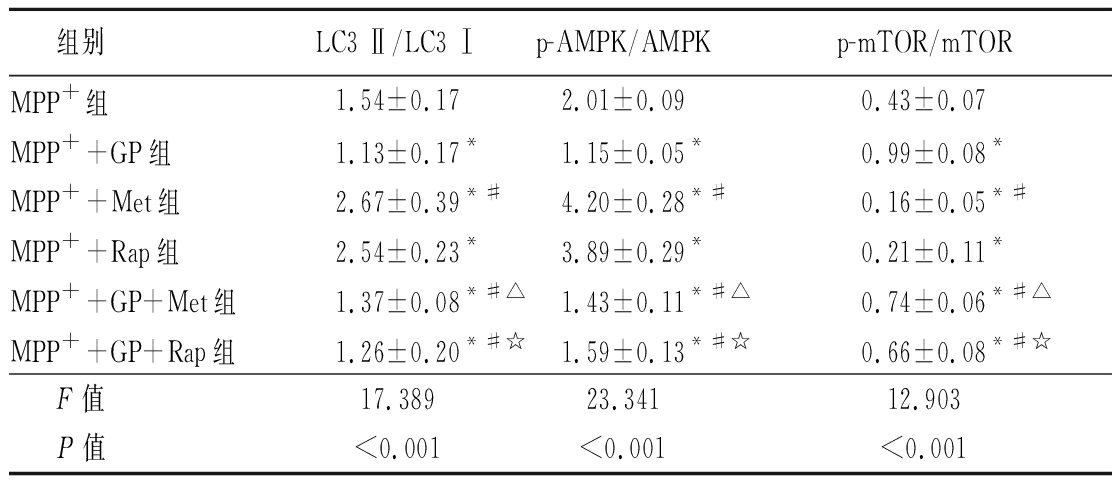
组别LC3 Ⅱ/LC3 Ⅰp-AMPK/AMPKp-mTOR/mTORMPP+组1.54±0.172.01±0.090.43±0.07MPP++GP组1.13±0.17*1.15±0.05*0.99±0.08*MPP++Met组2.67±0.39*#4.20±0.28*#0.16±0.05*#MPP++Rap组2.54±0.23*3.89±0.29*0.21±0.11*MPP++GP+Met组1.37±0.08*#△1.43±0.11*#△0.74±0.06*#△MPP++GP+Rap组1.26±0.20*#☆1.59±0.13*#☆0.66±0.08*#☆ F值17.38923.34112.903 P值<0.001<0.001<0.001
*P值<0.05与MPP+组比较 #P值<0.05与MPP++GP组比较 △P值<0.05与MPP++Met组比较 ☆P值<0.05与MPP++Rap组比较(SNK-q检验)
3 讨 论
PD的发病机制十分复杂,临床用于治疗PD的药物主要包含左旋多巴、抗胆碱药及多巴胺受体激动剂等。由于上述药物应用于临床会引起严重的不良反应,例如低血压、恶心呕吐及不自主运动等[9],因此探究新型治疗药物对PD的神经保护作用十分重要。MPP+能够引起神经细胞的氧化应激损伤以及细胞凋亡的神经毒性,因此常作为帕金森细胞模型的诱导剂[10]。所以本研究首先利用MPP+诱导SH-SY5Y细胞构建了PD细胞模型,结果显示诱导后的细胞活力明显下降,且细胞凋亡率明显增高,氧化应激损伤严重,表明成功制备了PD细胞模型,为后续的实验奠定了基础。PD的发病与细胞自噬密切相关,而细胞内的大分子蛋白及受损细胞器均由大自噬降解,通过调控细胞中的自噬活性来找寻PD的治疗潜在靶点,将是未来的研究热点。mTOR是一种丝氨酸/苏氨酸激酶,其参与细胞增殖、凋亡及自噬等多种生物学过程。且mTOR蛋白的磷酸化水平变化能够调控下游的自噬信号激活途径。当mTOR蛋白的磷酸化水平增加时,mTOR信号通路被激活,则细胞自噬受到抑制[11-12]。AMPK是mTOR的上游信号通路,且AMPK能够抑制mTOR,进而间接激活细胞自噬。AMPK主要通过两种途径参与细胞自噬的调控,一是AMPK可以直接磷酸化mTOR的抑制蛋白,促进自噬;二是直接磷酸化Raptor,进而激活自噬[13]。Arsikin等[14]研究发现药物能够通过AMPK抑制mTOR,进而诱导细胞发生自噬,最终造成PD细胞模型的细胞毒性作用。而本研究发现MPP+药物诱导SH-SY5Y细胞后,发生了AMPK磷酸化水平的增加并伴随着mTOR磷酸化水平的抑制,这提示MPP+介导的SH-SY5Y细胞自噬中存在AMPK/mTOR信号通路的参与。
GP是一类环烯醚萜葡萄糖苷,是栀子的主要药效成分。有研究表明GP对心血管疾病及中枢神经疾病治疗效果显著之外,还具有一定的抗炎及抗软组织损伤的作用[15-16]。同时,近年来有研究证实,GP对帕金森动物模型具有神经保护作用[17]。为了进一步确认GP对PD细胞模型氧化应激及凋亡的调控作用,本研究使用GP处理MPP+诱导SH-SY5Y细胞的PD细胞模型,结果表明使用GP药物处理后的PD细胞模型凋亡率明显降低。探究细胞氧化应激的作用时,本研究检测了处理后细胞中MDA含量、SOD及LDH活性的变化。LDH活性能够反映出细胞膜发生损伤的严重程度;MDA含量能够间接反映出机体受到自由基攻击的程度;而SOD活性能够间接反映出机体清除自由基的能力;上述三种指标常用于评估细胞的氧化应激反应[18-20]。本研究发现添加GP处理后,MPP+诱导的SH-SY5Y细胞上清液中LDH活性及MDA含量明显降低,SOD活性明显升高。同时GP能够抑制MPP+诱导的SH-SY5Y细胞的AMPK磷酸化,激活mTOR的磷酸化,且显著的修复了这些细胞自噬调控蛋白的磷酸化水平。表明GP能够降低MPP+诱导的SH-SY5Y细胞的氧化应激损伤,并且能够通过阻断自噬调节中的AMPK/mTOR信号通路,发挥抑制细胞自噬的作用。
本研究为了进一步确认GP抑制细胞自噬依赖于AMPK/mTOR信号通路,分别利用AMPK激动剂Metformin及mTOR抑制剂Rapamycin进行MPP+诱导的SH-SY5Y细胞的处理。结果显示,GP处理后细胞的自噬相关蛋白LC3-Ⅱ表达水平降低,AMPK磷酸化水平降低,而mTOR磷酸化水平上升。而Metformin或Rapamycin能够明显加剧MPP+诱导的SH-SY5Y细胞的自噬水平,表现出LC3-II表达水平上升,AMPK磷酸化水平上升,而mTOR磷酸化水平降低。表明GP能够通过AMPK/mTOR信号通路调控PD细胞自噬,且AMPK激动剂Metformin及mTOR抑制剂Rapamycin在一定程度上能够激活PD细胞自噬。但是有研究证明自噬在PD中能够起到保护神经元细胞的作用[21-23]。自噬是一把双刃剑,自噬的启动能够有助于神经元稳态的维持,继而减少继发性损伤;但自噬的过度激活会导致神经元细胞的死亡,进而加速神经元变性的进程。因此后续还需要继续探究GP对PD自噬水平的调控作用,同时探究AMPK激动剂Metformin及mTOR抑制剂Rapamycin对帕金森细胞凋亡的影响机制。
综上所述,GP能够通过AMPK/mTOR信号通路调控MPP+诱导SH-SY5Y细胞的凋亡、自噬及氧化应激过程。本研究结果能够为找寻安全且高效治疗PD疾病的药物提供理论及实验依据。
[1] 李余斌,耿鑫,戚仁莉,等. 双侧STN-DBS治疗中晚期帕金森患者运动症状短期疗效[J]. 昆明医科大学学报,2018,39(9):47-51.
[2] 刘亘梁,陈慧敏,张美美,等. 左旋多巴剂量与帕金森病异动症风险的相关性分析[J]. 中华老年心脑血管病杂志,2019,21(2):15-18.
[3] LeWitt PA. Levodopa therapy for Parkinson′s disease:Pharmacokinetics and pharmacodynamics[J]. Mov Disord,2015,30(1):64-72.
[4] Liu W,Li G,Hölscher C,et al. Neuroprotective effects of geniposide on Alzheimer′s disease pathology[J]. Rev Neurosci,2015,26(4):371-383.
[5] Zhang Z,Wang X,Zhang D,et al. Geniposide-mediated protection against amyloid deposition and behavioral impairment correlates with downregulation of mTOR signaling and enhanced autophagy in a mouse model of Alzheimer′s disease[J]. Aging (Albany NY),2019,11(2):536-548.
[6] Chen Y,Zhang Y,Li L,et al. Neuroprotective effects of geniposide in the MPTP mouse model of Parkinson′s disease[J]. Eur J Pharmacol,2015,768:21-27.
[7] Ho PW,Leung CT,Liu H,et al. Age-dependent accumulation of oligomeric SNCA/α-synuclein from impaired degradation in mutant LRRK2 knockin mouse model of Parkinson disease:role for therapeutic activation of chaperone-mediated autophagy (CMA)[J]. Autophagy,2020,16(2):347-370.
[8] Wen Z,Zhang J,Tang P,et al. Overexpression of miR-185 inhibits autophagy and apoptosis of dopaminergic neurons by regulating the AMPK/mTOR signaling pathway in Parkinson′s disease[J]. Mol Med Rep,2018,17(1):131-137.
[9] Chung SJ,Yoo HS,Lee HS,et al. Does the side onset of parkinson′s disease influence the time to develop levodopa-induced dyskinesia?[J]. J Parkinsons Dis,2019,9(1):241-247.
[10] Qu M. The neuroprotective effect of steroid receptor coactivator-interacting protein(SIP) in astrocyte model of 1-methyl-4-phenylpyridinium(MPP+)-induced Parkinson′s disease[J]. Med Sci Monit,2019,25:5776-5784.
[11] Zhu Z,Yang C,Iyaswamy A,et al. Balancing mTOR signaling and autophagy in the treatment of Parkinson′s disease[J]. Int J Mol Sci,2019,20(3):728.
[12] Al-Bari MAA,Xu P. Molecular regulation of autophagy machinery by mTOR-dependent and -independent pathways[J]. Ann N Y Acad Sci,2020,1467(1):3-20.
[13] Curry DW,Stutz B,Andrews ZB,et al. Targeting AMPK signaling as a neuroprotective strategy in Parkinson′s disease[J]. J Parkinsons Dis,2018,8(2):161-181.
[14] Arsikin K,Kravic-Stevovic T,Jovanovic M,et al. Autophagy-dependent and -independent involvement of AMP-activated protein kinase in 6-hydroxydopamine toxicity to SH-SY5Y neuroblastoma cells[J]. Biochim Biophys Acta,2012,1822(11):1826-1836.
[15] 刘倩,冯琴,胡义扬,等. 京尼平苷治疗非酒精性脂肪性肝病的潜在生物学效应[J]. 中西医结合肝病杂志,2019,29(3):285-288.
[16] 周张玖智,丁杨芳,胡艳丽. 京尼平苷酸对D-半乳糖/亚硝酸钠诱导的阿尔茨海默病小鼠学习记忆的影响[J]. 中国老年学杂志,2019,39(5):170-173.
[17] 陈毅美,李琳,张彦芳,等. 京尼平苷对MPTP所致帕金森病小鼠模型的神经保护作用研究[J]. 神经解剖学杂志,2015,31(5):629-634.
[18] 郑晓珂,杨方方,张莉,等. 南葶苈子抑制氧化应激与自噬通路抗H2O2诱导的H9c2细胞损伤作用研究[J]. 中草药,2019,50(1):160-168.
[19] Zhang Q,Ju Y,Ma Y,et al. N-acetylcysteine improves oxidative stress and inflammatory response in patients with community acquired pneumonia:a randomized controlled trial[J]. Medicine (Baltimore),2018,97(45):e13087.
[20] He R,Cui M,Lin H,et al. Melatonin resists oxidative stress-induced apoptosis in nucleus pulposus cells[J]. Life Sci,2018,199:122-130.
[21] Paudel YN,Angelopoulou E,Piperi C,et al. Emerging neuroprotective effect of metformin in Parkinson′s disease:a molecular crosstalk[J]. Pharmacol Res,2020,152:104593.
[22] Mor DE,Sohrabi S,Kaletsky R,et al. Metformin rescues Parkinson′s disease phenotypes caused by hyperactive mitochondria[J]. Proc Natl Acad Sci U S A,2020,117(42):26438-26447.
[23] Fitzgerald JC,Zimprich A,Carvajal Berrio DA,et al. Metformin reverses TRAP1 mutation-associated alterations in mitochondrial function in Parkinson′s disease[J]. Brain,2017,140(9):2444-2459.