糖尿病(diabetes mellitus,DM)是由多种病因引起的以慢性高血糖为主要特征的代谢性疾病,其中约90%为2型糖尿病(type 2 diabetes mellitus,T2DM)[1-2]。微血管病变为DM特异性并发症,可累及全身各器官组织,引起非创伤性截肢、失明、慢性肾脏病等,巨大疾病负担已构成我国公共卫生问题,阻止及延缓T2DM并发症发生、发展为临床医师共同努力目标[3-4]。血清中同型半胱氨酸(homocysteine,Hcy)含量升高,可促进血小板聚集,增加大血管、微血管并发症危险性[5];谭锦玲[6]研究指出,T2DM患者因胰岛素抵抗,长期慢性高血糖基础上易发生脂质代谢紊乱。近期研究报道,载脂蛋白A1/载脂蛋白B(apolipoprotein A1/apolipoprotein B,ApoA1/B)、脂蛋白a[lipoprotein(a),Lp(a)]在预测血管并发症发生方面优于低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)[7]。现有文献对DM微血管并发症的研究多为单一分析上述指标,较少三者综合分析探究。本研究旨在探究血清ApoA1/B、Hcy、Lp(a)在T2DM合并微血管并发症患者中的变化及预测价值,以期为临床诊治、预防T2DM患者微血管并发症提供指导。报告如下。
1 资 料 与 方 法
1.1 一般资料 选取2018年1月—2020年7月我院收治的T2DM患者134例,根据是否合并微血管并发症分为合并微血管并发症组(56例)与无微血管并发症组(78例)。纳入标准:①符合《中国T2DM防治指南(2017年版)》诊断标准[8];②合并微血管并发症组符合《基层糖尿病微血管病变筛查与防治专家共识》诊断标准[9];③无家族性高胆固醇血症者;④患者及家属均自愿签署知情同意书;⑤无意识障碍。排除标准:①妊娠期糖尿病、1型糖尿病或其他特殊类型DM;②严重肝肾功能不全者;③伴有DM酮症酸中毒或高血糖高渗状态等急性并发症;④合并内分泌系统疾病,如多囊卵巢综合征、甲状腺功能异常等;⑤近1个月应用阿托伐他汀等降脂药物者;⑥妊娠试验阳性;⑦自身免疫系统疾病;⑧合并良恶性肿瘤。
本研究经医院医学伦理委员会审批通过。
1.2 方法
1.2.1 资料收集 收集所有患者性别、年龄、吸烟、病程、饮酒比例、合并高血压、体重指数(body mass index,BMI)、注射胰岛素及实验室指标等临床资料。
1.2.2 样本采集与处理 采血前1 d患者禁食高脂饮食、停服相关药物,采集所有患者空腹12 h以上(通常8~12 h)外周静脉血2份,一份为EDTA-K3抗凝血,一份为普通真空采血管,于室温条件下,4 000 r/min离心10 min,待测。
1.2.3 实验室指标检测 选用糖化血红蛋白分析仪(东曹-G8)及配套试剂,利用高效液相色谱法测定糖化血红蛋白(glycosylated hemoglobin,HbA1c)水平;选用全自动生化仪(贝克曼AU5800)及其配套试剂,利用葡萄糖氧化酶法测定空腹血糖(fasting blood-glucose,FBG)、餐后2 h血糖(2 h postprandial plasma glucose,2 hPG)水平,测定血清总胆固醇(total cholesterol,TC)、丙氨酸转氨酶(alanine aminotransferase,ALT)、高密度脂蛋白胆固醇(high density lipoprotein-cholesterol,HDL-C)、三酰甘油(triglyceride,TG)、天冬氨酸转氨酶(aspartateaminotransferase,AST)、LDL-C、尿素氮(blood usea nitrogen,BUN)、肌酐(serum creatinine,Scr)水平。FBG、2 hPG、TC、HDL-C、TG、LDL-C、BUN、Scr试剂盒购自中生北控生物科技股份有限公司,ALT、AST采用贝克曼试剂盒。
1.2.4 血清ApoA1/B、Hcy、Lp(a)检测 选用全自动生化分析仪(贝克曼AU5800)进行测定,采用免疫比浊法测定ApoA1/B水平;采用循环酶法测定Hcy水平;采用胶乳免疫比浊法测定血清Lp(a)水平,试剂盒均购自中生北控生物科技股份有限公司。
1.3 观察指标 ①比较2组血清ApoA1/B、Hcy、Lp(a)水平。②分析血清ApoA1/B、Hcy、Lp(a)与实验室指标(FBG、2 hPG、HbA1c、TC、TG)的相关性。③采用多因素Logistic回归方程分析T2DM合并微血管并发症的影响因素。④分析血清ApoA1/B、Hcy、Lp(a)对T2DM合并微血管并发症的预测价值。⑤分析血清ApoA1/B、Hcy、Lp(a)联合对T2DM合并微血管并发症的预测价值。
1.4 统计学方法 应用SPSS19.0统计软件处理数据。计数资料比较采用χ2检验,计量资料比较采用独立样本t检验;相关性分析采用 Pearson 相关系数模型;预测效能分析采用受试者工作特征(receiver operator characteristic curve,ROC)曲线,获取曲线下面积、95%可信区间、敏感度、特异度及cut-off值,不同预测方案间曲线下面积比较采用DeLong 检验,联合诊断实施Logistic二元回归拟合,返回预测概率logit(p),将其作为独立检验变量。P<0.05为差异有统计学意义。
2 结 果
2.1 2组临床资料比较 2组性别、年龄、吸烟、饮酒比例、注射胰岛素、AST、ALT、Scr、BUN、HDL-C、LDL-C差异无统计学意义(P>0.05);合并微血管并发症组病程、BMI、合并高血压、FBG、2 hPG、HbA1c、TC、TG水平高于无微血管并发症组,差异有统计学意义(P<0.05)。见表1。
表1 2组临床资料比较
Table 1 Comparison of clinical data between two groups ![]()
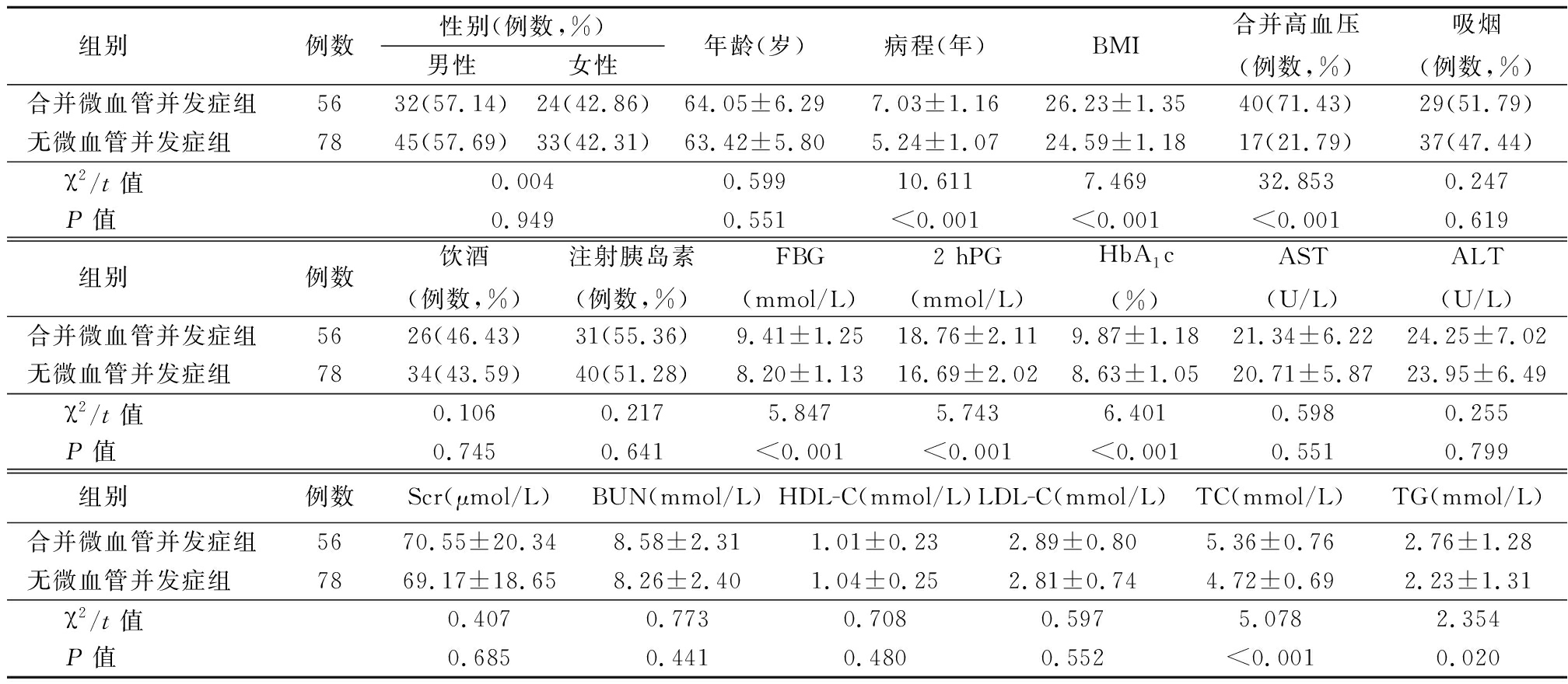
组别 例数性别(例数,%)男性女性年龄(岁)病程(年)BMI合并高血压(例数,%)吸烟(例数,%)合并微血管并发症组5632(57.14)24(42.86)64.05±6.297.03±1.1626.23±1.3540(71.43)29(51.79)无微血管并发症组 7845(57.69)33(42.31)63.42±5.805.24±1.0724.59±1.1817(21.79)37(47.44)χ2/t值 0.0040.59910.6117.46932.8530.247P值 0.9490.551<0.001<0.001<0.0010.619组别 例数饮酒(例数,%)注射胰岛素(例数,%)FBG(mmol/L)2 hPG(mmol/L)HbA1c(%)AST(U/L)ALT(U/L)合并微血管并发症组5626(46.43)31(55.36)9.41±1.2518.76±2.119.87±1.1821.34±6.2224.25±7.02无微血管并发症组 7834(43.59)40(51.28)8.20±1.1316.69±2.028.63±1.0520.71±5.8723.95±6.49χ2/t值 0.1060.2175.8475.7436.4010.5980.255P值 0.7450.641<0.001<0.001<0.0010.5510.799组别 例数Scr(μmol/L)BUN(mmol/L)HDL-C(mmol/L)LDL-C(mmol/L)TC(mmol/L)TG(mmol/L)合并微血管并发症组5670.55±20.348.58±2.311.01±0.232.89±0.805.36±0.762.76±1.28无微血管并发症组 7869.17±18.658.26±2.401.04±0.252.81±0.744.72±0.692.23±1.31χ2/t值 0.4070.7730.7080.5975.0782.354P值 0.6850.4410.4800.552<0.0010.020
2.2 2组血清ApoA1/B、Hcy、Lp(a)水平比较 合并微血管并发症组血清ApoA1/B水平低于无微血管并发症组,Hcy、Lp(a) 水平高于无微血管并发症组,差异有统计学意义(P<0.05)。见表2。
表2 2组血清ApoA1/B、Hcy、Lp(a)水平比较
Table 2 Comparison of serum ApoA1/B, Hcy and Lp(a) levels between two groups ![]()
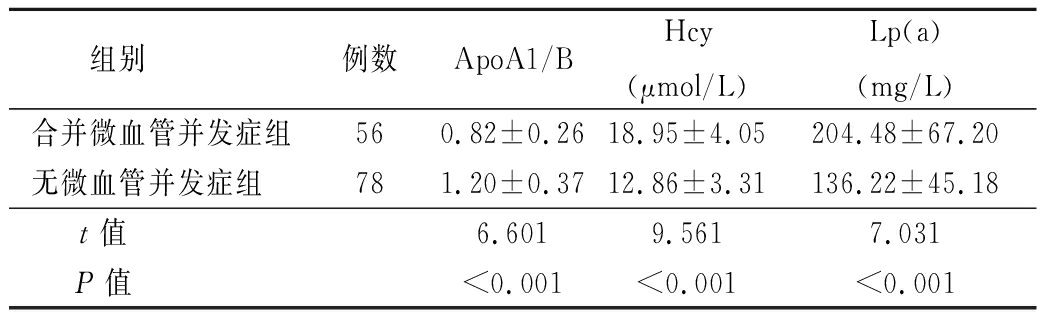
组别 例数ApoA1/BHcy(μmol/L)Lp(a)(mg/L)合并微血管并发症组560.82±0.2618.95±4.05204.48±67.20无微血管并发症组 781.20±0.3712.86±3.31136.22±45.18t值 6.6019.5617.031P值 <0.001<0.001<0.001
2.3 血清ApoA1/B、Hcy、Lp(a)与实验室指标的相关性 Pearson相关性分析结果显示,血清ApoA1/B与FBG、2 hPG、HbA1c、TC、TG呈负相关,Hcy、Lp(a)与FBG、2 hPG、HbA1c、TC、TG呈正相关(P<0.05)。见表3。
表3 血清ApoA1/B、Hcy、Lp(a)与实验室指标相关性
Table 3 Correlation between serum ApoA1/B, Hcy, Lp(a) and laboratory indicators
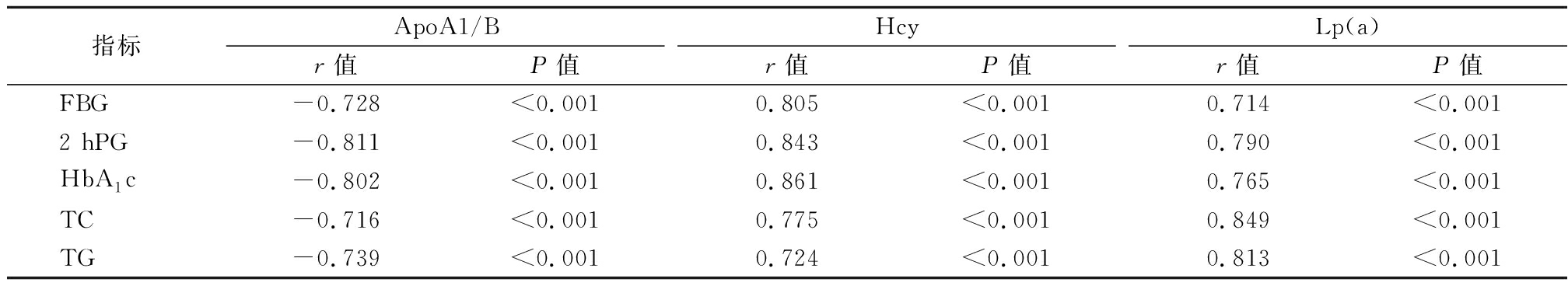
指标ApoA1/Br值P值Hcyr值P值Lp(a)r值P值FBG-0.728<0.0010.805<0.0010.714<0.0012 hPG-0.811<0.0010.843<0.0010.790<0.001HbA1c-0.802<0.0010.861<0.0010.765<0.001TC-0.716<0.0010.775<0.0010.849<0.001TG-0.739<0.0010.724<0.0010.813<0.001
2.4 T2DM合并微血管并发症的影响因素分析 将T2DM是否合并微血管并发症作为因变量(否=0,是=1),以病程(<5.99年=0,≥5.99年=1)、BMI(<25.28=0,≥25.28=1)、合并高血压(否=0,是=1)、血清ApoA1/B(<1.04=0,≥1.04=1)、Hcy(<15.41 μmol/L=0,≥15.41 μmol/L=1)、Lp(a)(<164.75 mg/L=0,≥164.75 mg/L=1)作为自变量,纳入Logistic回归方程,结果显示,病程、BMI、合并高血压、血清ApoA1/B、Hcy、Lp(a)是T2DM合并微血管并发症的影响因素(P<0.05)。见表4。
表4 T2DM合并微血管并发症的影响因素分析
Table 4 Influencing factors of T2DM with microvascular complications
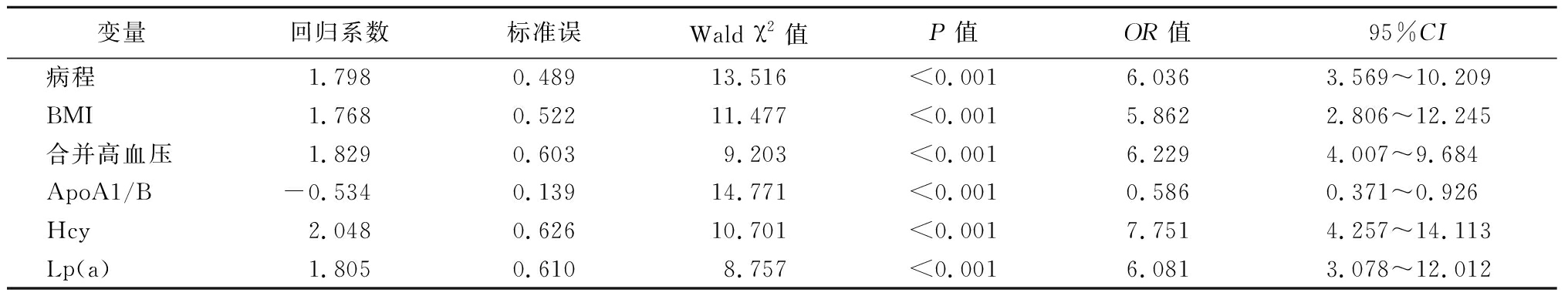
变量回归系数标准误Wald χ2值P值OR值95%CI病程1.7980.48913.516<0.0016.0363.569~10.209BMI1.7680.52211.477<0.0015.8622.806~12.245合并高血压1.8290.6039.203<0.0016.2294.007~9.684ApoA1/B-0.5340.13914.771<0.0010.5860.371~0.926Hcy2.0480.62610.701<0.0017.7514.257~14.113Lp(a)1.8050.6108.757<0.0016.0813.078~12.012
2.5 血清ApoA1/B、Hcy、Lp(a)对T2DM合并微血管并发症的预测价值 绘制ROC曲线,结果显示,ApoA1/B预测T2DM合并微血管并发症的AUC为0.771,敏感度为71.79%,特异度为75.00%;Hcy预测T2DM合并微血管并发症的AUC为0.824,敏感度为66.07%,特异度为89.74%;Lp(a) 预测T2DM合并微血管并发症的AUC为0.788,敏感度为55.36%,特异度为93.59%。见表5,图1。
表5 血清ApoA1/B、Hcy、Lp(a)对T2DM合并微血管并发症的预测价值
Table 5 The predictive value of serum ApoA1/B, Hcy, and Lp(a) in T2DM with microvascular complications

指标AUC95%CIP值截断值敏感度(%)特异度(%)ApoA1/B0.7710.688~0.853<0.001≤1.01 71.7975.00Hcy 0.8240.748~0.899<0.001>17.12 μmol/L66.0789.74Lp(a) 0.7880.708~0.868<0.001>199.95 mg/L55.3693.59
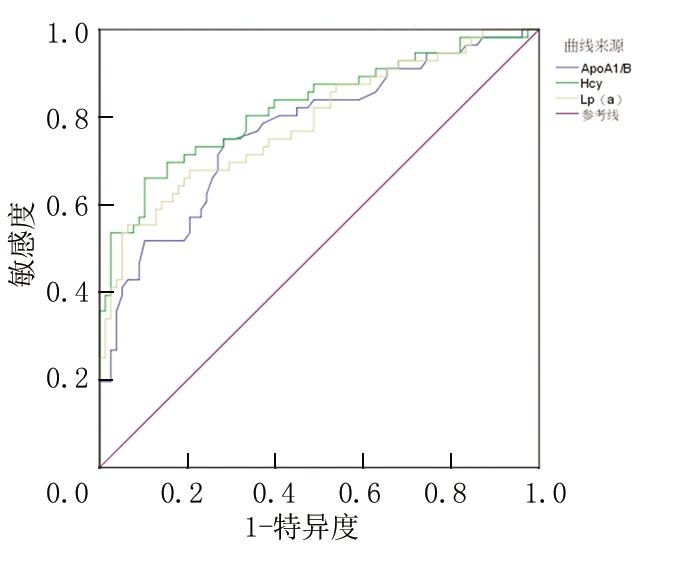
图1 血清ApoA1/B、Hcy、Lp(a)对T2DM合并微血管并发症的预测价值
Figure 1 The predictive value of serum ApoA1/B, Hcy, and Lp(a) in T2DM with microvascular complications
2.6 联合预测价值 将血清ApoA1/B、Hcy、Lp(a)进行Logistic二元回归拟合,返回预测概率Logit(P)作为独立检验变量,获取联合预测的AUC为0.878,95%CI:0.814~0.941,P<0.001,敏感度为73.21%,特异度为88.46%,优于各指标单独预测(P<0.05),见图2。
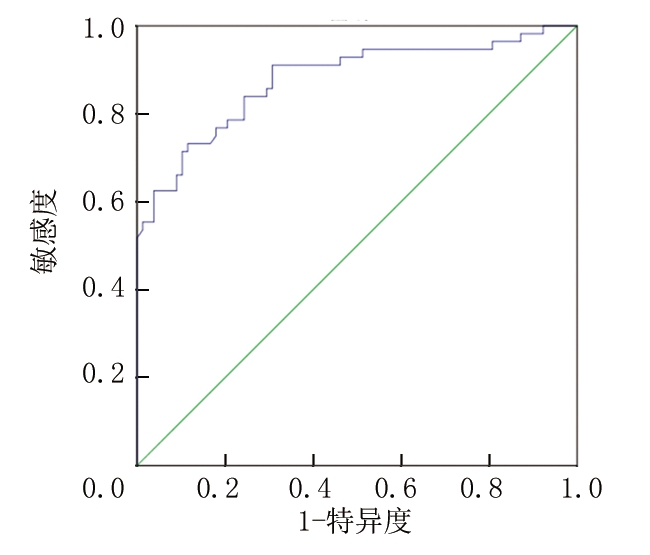
图2 联合预测价值
Figure 2 Combined forecast value
3 讨 论
T2DM患者体内存在多种代谢紊乱,其微血管并发症发生发展机制较为复杂,目前尚未完全明确,可能是由多种病理机制共同作用、相互联系所致的结果。近来T2DM与载脂蛋白在机体脂代谢过程中的研究备受广大学者重视,ApoA1为载脂蛋白主要成分,主要负责血浆中大部分胆固醇酯转化,ApoB为LDL主要载脂蛋白,可打开细胞导入胆固醇,ApoA1/B反映血液中促动脉粥样硬化与抗动脉粥样硬化脂蛋白的平衡状态[10]。本研究结果显示,合并微血管并发症组血清ApoA1/B水平低于无微血管并发症组,分析其机制在于,T2DM患者因发生胰岛素抵抗,对脂肪分解抑制作用减弱,致使TG生成增多,HDL-C水平降低;国内外研究指出[11-12],ApoA1、ApoB分别为HDL-C和LDL-C主要结构蛋白,LDL-C水平升高具有较强致动脉粥样硬化作用,HDL-C水平升高代表抗动脉粥样硬化能力增强,故血清ApoA1/B降低,可加速动脉粥样硬化,致使微血管并发症发生。Lp(a)是在肝脏中合成的大分子复合物,为临床评价炎症所致内皮损伤重要指标,在DM合并高血压患者并发DM周围神经病变中呈高表达[13-14];既往研究显示,Hcy与心血管疾病密切相关,Hcy水平升高为微血管病变独立危险因素[15-16]。本研究结果显示,合并微血管并发症组血清Hcy、Lp(a) 水平高于无微血管并发症组(P<0.05),与上述研究结果一致。推测其原因可能为,Lp(a)主要抑制纤维蛋白溶解酶原活性,Lp(a)水平升高干扰机体纤溶系统正常运转,间接引起血管内皮细胞损伤,造成机体微循环障碍和微血管阻塞;Hcy为蛋氨酸代谢过程中重要中间产物,正常情况下其含量极低,T2DM患者Hcy无法代谢转化时,呈现异常高表达,引起血液中氧自由基生成增加,对血管内皮细胞一氧化氮活性产生抑制,造成血管内皮损害,机体凝血-纤溶平衡被打破,进而引起微血管病变发生[17-18]。
国内外研究显示,血糖水平升高可致使一氧化氮合成减少、糖化反应亢进、多元醇代谢异常等,进而引起相应损害,通过控制FBG、2 hPG、HbA1c水平,可降低相应并发症发生率[19-20]。脂肪组织除贮存能量外,还具有重要内分泌功能,可分泌多种生物活性肽,即脂肪细胞因子。脂肪细胞因子可参与调节能量代谢、免疫应答及胰岛素敏感性,TC、TG通过调节糖脂代谢、细胞分化,参与T2DM患者微血管并发症发生过程。本研究结果显示,血清ApoA1/B与FBG、2 hPG、HbA1c、TC、TG呈负相关,Hcy、Lp(a)与FBG、2 hPG、HbA1c、TC、TG呈正相关(P<0.05),提示ApoA1/B、Hcy、Lp(a)是反映T2DM患者微血管并发症发生的敏感指标。绘制ROC曲线发现,血清ApoA1/B、Hcy、Lp(a)联合预测的AUC为0.878,敏感度为73.21%,特异度为88.46%,优于各指标单独预测(P<0.05),可在一定程度上提高预测效能,为临床预测T2DM患者微血管并发症发生提供更准确数据参考,对T2DM患者微血管并发症预防、控制与治疗具有重要临床意义。此外,对于病程较长、BMI较高、合并高血压患者,微血管病变发生风险较高,需作为重点观察对象,进一步加强相关治疗或干预措施,以降低微血管病变发生率。
综上可知,T2DM合并微血管并发症患者血清ApoA1/B表达水平较低、Hcy、Lp(a)表达水平较高,三者联合检测在预测T2DM患者微血管并发症发生方面具有较高临床应用价值,可为T2DM患者微血管并发症发生诊断、预防及治疗提供新的线索与思路。但本研究选取样本量较少,可能造成数据偏移,需扩大样本量做进一步探究,以获取更为可靠的数据支持。
[1] Bullard KM,Cowie CC,Lessem SE,et al. Prevalence of diagnosed diabetes in adults by diabetes type-united states,2016[J]. MMWR Morb Mortal Wkly Rep,2018,67(12):359-361.
[2] 张波,杨文英.中国糖尿病流行病学及预防展望[J].中华糖尿病杂志,2019,11(1):7-10.
[3] Kautzky-Willer A,Harreiter J,Pacini G. Sex and gender differences in risk,pathophysiology and complications of type 2 diabetes mellitus[J]. Endocr Rev,2016,37(3):278-316.
[4] 王晓燕,马丽,李丽丽.社区2型糖尿病患者自我管理行为现状及影响因素研究[J].宁夏医科大学学报,2017,39(4):436-442.
[5] Samarron SL,Miller JW,Cheung AT,et al.Homocysteine is associated with severity of microvasculopathy in sickle cell disease patients[J].Br J Haematol,2020,190(3):450-457.
[6] 谭锦玲.代谢综合征与2型糖尿病慢性并发症的相关性探讨[J].中国现代医生,2017,55(14):41-43.
[7] 唐仁强,张肃川,肖勇强.糖尿病合并冠心病患者血脂水平及载脂蛋白B/载脂蛋白A1比值与患者预后相关性分析[J].实用医院临床杂志,2019,16(5):242-244.
[8] 中华医学会糖尿病学分会.中国2型糖尿病防治指南(2017年版)[J].中国实用内科杂志,2018,38(4):292-344.
[9] 中国微循环学会糖尿病与微循环专业委员会.基层糖尿病微血管病变筛查与防治专家共识[J/CD].中国医学前沿杂志(电子版),2018,10(2):17-25.
[10] 韩爽,杨秀静,朱月平,等.sdLDL-C在T2DM及其并发症患者中血清水平变化及临床应用分析[J].齐齐哈尔医学院学报,2019,40(9):1080-1081.
[11] 吕剑,高征环,冯晓涛.2型糖尿病血清载脂蛋白A1,B及脂蛋白(a)水平的变化及临床意义[J].海南医学,2020,31(9):1097-1099.
[12] Qiu L,Yin RX,Khounphinith E,et al. Association of the APOA1 rs964184 SNP and serum lipid traits in the chinese maonan and han populations[J]. Lipids Health Dis,2018,17(1):105.
[13] 钱凤娟,刘震宇,杨洁,等.脂蛋白(a)、淀粉样蛋白A及胱抑素C水平在糖尿病合并高血压患者并发糖尿病周围神经病变中的临床意义[J].中华高血压杂志,2018,26(6):577-581.
[14] 刘俊才.2型糖尿病(T2DM)合并心血管病患者BNP水平变化及与hs-CRP和Lp(a)浓度的关系分析[J].中国保健营养,2017,27(3):7.
[15] 戴宏斌,尹春琼,李晓东,等.血清同型半胱氨酸,胱抑素C,D-二聚体联合检测对2型糖尿病微血管早期病变的诊断价值[J].实用检验医师杂志,2020,12(3):150-152.
[16] 李玉婷,王嘉欣,吴美巧,等.血浆同型半胱氨酸水平与2型糖尿病患者微血管病变的关系分析[J].中国实验诊断学,2019,23(11):1873-1877.
[17] 陈贞艳,何雷,张群.同型半胱氨酸,胱抑素C与2型糖尿病微血管并发症的相关性[J].现代仪器与医疗,2019,25(5):75-78.
[18] 江孔梅,李海炜,黄芝丽,等.1型和2型糖尿病患者血清HCY水平及其与糖尿病微血管并发症的关系研究[J].广西医科大学学报,2017,34(4):530-533.
[19] Barrett EJ,Liu Z,Khamaisi M,et al. Diabetic microvascular disease:an endocrine society scientific statement[J]. J Clin Endocrinol Metab,2017,102(12):4343-4410.
[20] 周光宁,陈霞.血糖控制水平对降低高血压糖尿病合并脑出血患者并发症的效果观察[J].糖尿病新世界,2017,20(19):68-69.