2型糖尿病肾病(type 2 diabetic nephropathy,T2DN)可增加心脑血管疾病发生风险。研究指出,并发心脑血管疾病是T2DN患者病死的主要原因[1]。而目前有关T2DN患者并发心脑血管疾病的机制尚未明确,可能与多种危险因素有关,其中动脉粥样硬化是心脑血管疾病发生的重要生理病理过程之一[2]。及早预测T2DN患者颈动脉粥样硬化程度,对评估患者心脑血管疾病发生风险,实施合理抗动脉粥样硬化治疗有重要意义。既往临床将数字减影血管造影(digital subtraction angiography,DSA)作为诊断颈动脉粥样硬化的金标准,诊断准确度高,但造影剂对T2DN患者危害较大,可诱发造影剂肾病,检查风险较高。有关文献指出,干扰素调节因子(interferon regulatory facto,IRF)与动脉粥样硬化的形成及表型密切相关[3]。推测IRF可能参与颈动脉粥样硬化进程,可用于颈动脉粥样硬化预测中。但有关IRF与颈动脉粥样硬化的相关性尚无较多研究报道。基于此,本研究将进一步观察IRF1、IRF8水平与T2DN患者颈动脉粥样硬化的相关性。现将结果报告如下。
1 资 料 与 方 法
1.1 一般资料 选取2017年1月—2020年1月我院收治的149例符合入选条件的T2DN患者作为研究对象,男性85例,女性64例;年龄53~84岁,平均(61.96±5.85)岁;2型糖尿病病程6~11年,平均(7.51±1.36)年;T2DN病程1~2年,平均(1.43±0.36)年;有高血脂史51例;有高血压史17例;慢性肾脏病(chronic kidney disease,CKD)[4]分期:1期74例,2期53例,3期22例。
本研究经医院医学伦理委员会批准,患者及家属知情并签署知情同意书。
1.2 纳入标准及排除标准 纳入标准:①符合2型糖尿病诊断标准[5];②符合T2DN诊断标准[6];③患者意识清晰、可配合完成颈动脉粥样硬化评估。排除标准:①合并原发性肾病的患者;②合并肿瘤疾病的患者;③入组前已患有心脑血管疾病的患者;④入组前1个月接受过抗动脉粥样硬化治疗的患者;⑤合并急性或慢性炎症性疾病的患者;⑥合并慢性阻塞性肺疾病、支气管哮喘的患者;⑦合并自身免疫性疾病的患者;⑧入组时已有颈动脉粥样硬化的患者。
1.3 方法
1.3.1 收集基线资料 于患者入院时,收集基线资料,包括性别、年龄、2型糖尿病病程、T2DN病程、高血脂史、高血压史、CKD分期,检测相关的血清标志物水平。血清标志物包括C反应蛋白(C-reactive protein,CRP)、纤维蛋白原(fibrinogen,FIB),检测方法为:抽取患者空腹肘静脉血3 mL,以3 000 r/min的速度离心15 min,取血清,采用迈瑞BS-280型全自动生化分析仪检测CRP、FIB水平。
1.3.2 IRF1、IRF8水平检测 于患者入院时进行检测,检测所用试剂盒均为碧云天生物技术有限公司提供。抽取患者空腹肘静脉血6 mL,以3 000 r/min的速度离心15 min,取血清。后采用Ficoll-Hypaque密度梯度离心法分离外周血单个核细胞,向单个核细胞内添加200 μL蛋白裂解液,采用的RNA提取试剂盒提取单个核细胞的总RNA,采用Takara反转录试剂盒合成cDNA,引物、反应体系、反应条件均按照试剂盒说明书进行。采用Bio-Rad PCR仪进行扩增,方法为实时荧光定量PCR法,采用2-△△Ct方法计算IRF1、IRF8 mRNA相对表达量。
1.3.3 治疗 两组均于治疗期间进行饮食、运动指导,督促患者戒烟、戒酒,应用胰岛素类、格列奈类等药物实施积极降血糖治疗,将患者血糖水平控制在正常范围内;对高血压患者应用血管紧张素转换酶抑制剂、血管紧张素Ⅱ受体阻滞剂等药物,实施积极降血压治疗;对高血脂患者应用他汀类、贝特类等药物,纠正脂质代谢紊乱。
1.3.4 颈动脉粥样硬化评估方法 于治疗6个月时,行彩色超声检查,观察患者颈动脉血管内壁厚度、斑块形成情况及大小,由2~3名超声科医生共同评估患者颈动脉粥样硬化程度。根据颈动脉粥样硬化评估结果将患者划分为颈动脉粥样硬化组与无颈动脉粥样硬化组。
1.4 统计学方法 应用SPSS 24.0统计软件处理数据。计量资料比较采用独立样本t检验;计数资料比较采用χ2检验;采用多因素回归分析检验主要指标水平与T2DN患者颈动脉粥样硬化的关系;绘制受试者工作曲线(receiver operating curve,ROC),得到曲线下面积(area under curve,AUC),检验血清标志物、IRF1、IRF8水平对T2DN患者颈动脉粥样硬化的预测效能,AUC≤0.50表示无预测效能,0.50
2 结 果
2.1 颈动脉粥样硬化组与无颈动脉粥样硬化组基线资料比较 治疗6个月时,行彩色超声检查显示,149例T2DN患者中,有68例(45.64%)颈动脉粥样硬化,有81例(54.36%)无颈动脉粥样硬化;颈动脉粥样硬化组入院时CRP、FIB、IRF1及IRF8 mRNA相对表达量均高于无颈动脉粥样硬化组,差异有统计学意义(P<0.05);两组年龄、性别、2型糖尿病病程、T2DN病程、高血脂史、高血压史、CKD分期比较,差异无统计学意义(P>0.05)。见表1。
表1 颈动脉粥样硬化组与无颈动脉粥样硬化组基线资料比较
Table 1 Comparison of baseline data between carotid atherosclerosis group and non-carotid atherosclerosis group
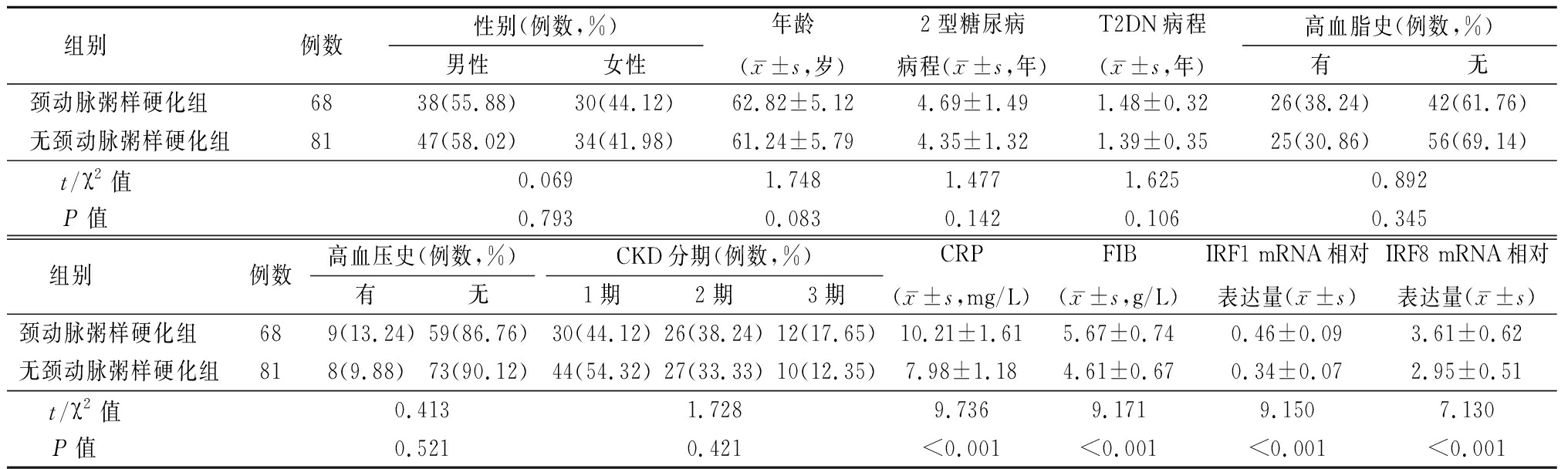
组别 例数性别(例数,%)男性女性年龄(x-±s,岁)2型糖尿病病程(x-±s,年)T2DN病程(x-±s,年)高血脂史(例数,%)有无颈动脉粥样硬化组 6838(55.88)30(44.12)62.82±5.124.69±1.491.48±0.3226(38.24)42(61.76)无颈动脉粥样硬化组8147(58.02)34(41.98)61.24±5.794.35±1.321.39±0.3525(30.86)56(69.14)t/χ2值 0.0691.7481.4771.6250.892P值 0.7930.0830.1420.1060.345组别 例数高血压史(例数,%)有无CKD分期(例数,%)1期2期3期CRP(x-±s,mg/L)FIB(x-±s,g/L)IRF1 mRNA相对表达量(x-±s)IRF8 mRNA相对表达量(x-±s)颈动脉粥样硬化组 689(13.24)59(86.76)30(44.12)26(38.24)12(17.65)10.21±1.615.67±0.740.46±0.093.61±0.62无颈动脉粥样硬化组818(9.88)73(90.12)44(54.32)27(33.33)10(12.35)7.98±1.184.61±0.670.34±0.072.95±0.51t/χ2值 0.4131.7289.7369.1719.1507.130P值 0.5210.421<0.001<0.001<0.001<0.001
2.2 颈动脉粥样硬化的危险因素分析 将初步基线资料比较结果显示差异有统计学意义的CRP、FIB、IRF1及IRF8 mRNA相对表达量纳入作为自变量并说明,均为连续变量无需赋值,将T2DN患者颈动脉粥样硬化发生情况作为因变量(颈动脉粥样硬化=1,无颈动脉粥样硬化=0);经回归分析检验结果显示,入院时CRP、FIB、IRF1、IRF8表达上调可能是T2DN患者颈动脉粥样硬化发生的危险因素(OR>1,P<0.05)。见表2。
表2 多因素回归分析T2DN颈动脉粥样硬化的危险因素
Table 2 Multivariate regression analysis of risk factors for carotid atherosclerosis in T2DN

指标回归系数标准误WaId χ2值P值OR值95%CI常量25.9196.47116.044<0.001 --CRP1.3870.35015.706<0.0014.0012.015~7.943FIB1.9340.57411.368<0.0016.9152.247~21.280IRF1 mRNA相对表达量18.6323.10935.905<0.001123.60127.587~547.638IRF8 mRNA相对表达量1.8290.7495.9540.0156.2251.433~27.042
2.3 T2DN患者血清标志物、IRF1、IRF8水平预测颈动脉粥样硬化的ROC结果 绘制ROC(图1)发现,T2DN患者入院时CRP、FIB、IRF1、IRF8水平预测颈动脉粥样硬化的AUC分别为:0.863、0.855、0.842、0.806,AUC均>0.80,均有一定预测价值,cut-off值分别取8.850 mg/L、5.150 g/L、0.450、3.250时可获得最佳预测效能,各检验变量对应的cut-off值、特异度、敏感度等相关参数见表3。
表3 T2DN患者入院时血清标志物、IRF1、IRF8水平预测颈动脉粥样硬化的ROC检验结果
Table 3 ROC test results of serum markers, IRF1 and IRF8 levels in predicting carotid atherosclerosis in patients with T2DN at admission
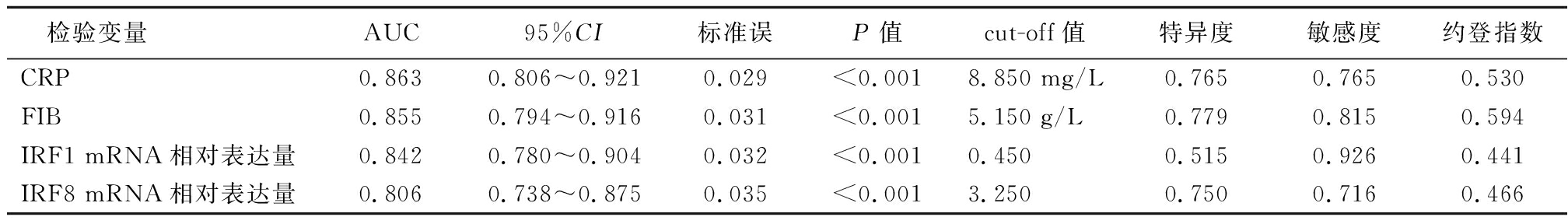
检验变量AUC95%CI标准误P值cut-off值特异度敏感度约登指数CRP0.8630.806~0.9210.029<0.0018.850 mg/L0.7650.7650.530FIB0.8550.794~0.9160.031<0.0015.150 g/L0.7790.8150.594IRF1 mRNA相对表达量0.8420.780~0.9040.032<0.0010.4500.5150.9260.441IRF8 mRNA相对表达量0.8060.738~0.8750.035<0.0013.2500.7500.7160.466
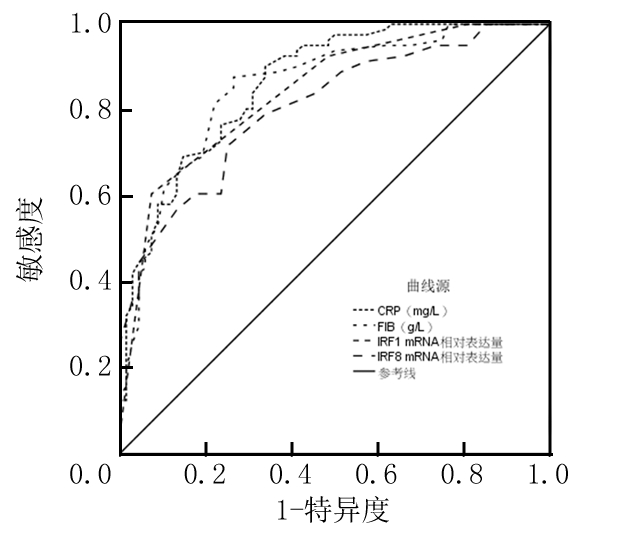
图1 T2DN患者入院时血清标志物、IRF1、IRF8水平预测颈动脉粥样硬化的ROC曲线图
Figure 1 ROC curve of serum markers, IRF1 and IRF8 levels in predicting carotid atherosclerosis in patients with T2DN at admission
3 讨 论
文献指出,动脉粥样硬化是全身性病变,可侵犯体循环中型、大型动脉,颈动脉是最常被累及的部位之一,检测颈动脉粥样硬化程度,可反馈全身动脉粥样硬化程度[7]。因此检测T2DN患者颈动脉粥样硬化程度已被作为评估心脑血管疾病发生风险的重要手段。
熊晓清等[8]研究结果显示,T2DN患者颈动脉内膜中层厚度明显高于单纯2型糖尿病患者,说明T2DN患者颈动脉粥样硬化风险较高。本研究结果显示,治疗6个月时,行彩色超声检查显示,149例T2DN患者中,有68例发生颈动脉粥样硬化,颈动脉粥样硬化发生率高达45.64%,证实T2DN患者有较高的颈动脉粥样硬化风险。而颈动脉粥样硬化可造成血管内皮损伤、血管腔变窄、血流量减少,进而可引起颅内供血减少,患者有头晕、耳鸣、视物模糊等症状[9]。此外,颈动脉粥样硬化斑块破裂还可堵塞脑部供血血管、眼底血管等,易引发急性脑梗死、失明、认知功能障碍[10]。及早预测患者颈动脉粥样硬化风险并指导治疗有重要意义。尽管彩色超声可显示颈动脉狭窄、闭塞及斑块形成情况,进而反馈颈动脉粥样硬化程度[11]。但彩色超声检查费用较高,且该技术属于诊断类技术,尚不能用于患者早期粥样硬化的风险预测评估,应用受限[12]。近年,外周血指标被逐渐用于颈动脉粥样硬化预测,本研究重点探讨外周血相关指标与T2DN患者颈动脉粥样硬化发生的关系。初步比较发生与未发生颈动脉粥样硬化的T2DN患者的基线资料后,经回归分析检验结果显示,入院时CRP、FIB、IRF1、IRF8表达水平上调是T2DN患者颈动脉粥样硬化发生的风险因素。
分析各主要指标与颈动脉粥样硬化的关系在于:CRP是炎症标志物之一,表达水平与颈动脉斑块大小密切相关,CRP表达水平越高,说明斑块中脂质沉积较严重,动脉粥样硬化程度越严重;此外,CRP可抑制内皮细胞型一氧化氮合酶蛋白分泌,减少血管内皮舒张因子一氧化氮合成,进而促进血管收缩、白细胞黏附,加重局部严重,加速动脉粥样硬化进程[13]。FIB可作为凝血因子及炎性因子,具有多种功能。FIB过表达时,呈现为纤溶亢进,纤维蛋白降解产物增多,不断于血管壁沉积,可持续破坏血管内皮细胞,促进平滑肌细胞移行、增殖,脂质易渗透及积聚于局部,炎性因子释放,继而加速颈动脉粥样硬化进程[14]。此外,FIB可激活凝血因子Ⅶ,增强血液凝固性,促进血小板聚集,易形成附壁血栓,也参与颈动脉粥样硬化发生及进展[15]。因此T2DN患者入院时CRP、FIB过表达可能提示患者颈动脉粥样硬化发生风险较高。但CRP、FIB在炎症、感染等状态下也可出现表达上调,预测特异度差,临床还需持续探索新型血液指标,以作为T2DN患者早期颈动脉粥样硬化发生风险预测的辅助评估手段。
IRF主要定位在细胞核,属于转录因子的一种,可经γ-干扰素/Jak/STATI信号通路参与多种基因表达,并可调控细胞免疫、细胞分化。IRF1与IRF8均为IRF家族成员。IRF1可通过与白细胞介素12 p40亚基的启动子结合,刺激白细胞介素12产生,白细胞介素12可诱导幼稚T细胞分化为辅助T细胞1。此外,动物实验证实,IRF1可与干扰素γ形成自分泌环路,持续维持辅助T细胞1应答,并可与白细胞介素4启动子的3个不同部位结合,抑制白细胞介素4基因转录,减少辅助T细胞2分化[16]。IRF1过表达时,辅助T细胞1/辅助T细胞2失衡,其中辅助T细胞1主要分泌白细胞介素2、肿瘤坏死因子α等促炎细胞因子,可加剧局部炎症,且过量生成的免疫复合物可于血管壁沉积,进一步增加颈动脉粥样硬化发生风险[17]。IRF8是先天免疫反应的转录调节因子,可协同IRF1发挥作用,调节白细胞介素12表达,在IRF8过表达时,辅助T细胞1/辅助T细胞2失衡加剧,细胞免疫功能异常;此外,IRF8自身还可分泌白细胞介素12,进一步促进辅助T细胞1分化,导致患者细胞免疫功能受损,造成炎性损伤,增加颈动脉粥样硬化风险[18]。
基于上述分析,推测T2DN患者入院时CRP、FIB、IRF1、IRF8表达水平可用于预测颈动脉粥样硬化发生风险。绘制ROC发现,T2DN患者CRP、FIB、IRF1、IRF8水平预测颈动脉粥样硬化的AUC均>0.80,均有一定预测价值,证实推测成立。临床可在对T2DN患者实施治疗期间,定期检测CRP、FIB、IRF1、IRF8水平,并对颈动脉粥样硬化高危患者实施积极抗动脉粥样硬化治疗,可能对减少患者颈动脉粥样硬化的发生有积极意义。但本研究未纳入高敏C反应蛋白、同型半胱氨酸、D-二聚体等指标,且纳入T2DN患者CKD分期主要为早中期,结论仍有局限,还应在未来增加上其他相关的指标进行研究,纳入各分期T2DN患者,进一步分析与T2DN患者颈动脉粥样硬化发生相关的指标,证实将IRF1、IRF8水平检测应用于T2DN患者颈动脉粥样硬化预测中有确切价值。
综上所述,T2DN患者颈动脉粥样硬化发生风险高,CRP、FIB、IRF1、IRF8水平是T2DN患者颈动脉粥样硬化的危险因素密切相关,IRF1、IRF8水平可作为预测患者颈动脉粥样硬化发生风险的重要辅助手段,可能对指导早期为患T2DN患者实施针对性抗动脉粥样硬化治疗有积极意义。
[1] Maqbool M,Cooper ME,Jandeleit-Dahm KAM. Cardiovascular disease and diabetic kidney disease[J]. Semin Nephrol,2018,38(3):217-232.
[2] Seo DH,Kim SH,Song JH,et al. Presence of carotid plaque is associated with rapid renal function decline in patients with type 2 diabetes mellitus and normal renal function[J]. Diabetes Metab J,2019,43(6):840-853.
[3] Seneviratne AN,Edsfeldt AO,Cole JE,等.干扰素调节因子5通过损伤胞葬作用控制动脉粥样硬化病变中的坏死核心形成[J].中华高血压杂志,2017,25(8):799.
[4] 陈香美.临床诊疗指南——肾脏病学分册[M].北京:人民卫生出版社,2009:42.
[5] 中华医学会糖尿病学分会.中国2型糖尿病防治指南(2013年版)[J].中华糖尿病杂志,2014,6(7):447-498.
[6] 中华医学会糖尿病学分会微血管并发症学组.糖尿病肾病防治专家共识(2014年版)[J].中华糖尿病杂志,2014,6(11):792-801.
[7] Forgo B,Medda E,Hernyes A,et al. Carotid artery atherosclerosis:a review on heritability and genetics[J]. Twin Res Hum Genet,2018,21(5):333-346.
[8] 熊晓清,张扬,朱平,等.2型糖尿病肾病血清胱抑素C与颈动脉内膜中层厚度的关系[J].广东医学,2018,39(13):1980-1984.
[9] 陈丽,王凤娇,薛雅卓,等.颈动脉粥样硬化影响内皮祖细胞功能的研究进展[J].中国动脉硬化杂志,2018,26(4):419-423.
[10] 沈鹏,张淑岩.颈动脉粥样硬化与认知功能障碍关系的研究进展[J].卒中与神经疾病,2018,25(5):620-622,封3.
[11] Sultana N,Islam MR. Doppler evaluation of carotid vessels in type 2 diabetes[J]. Mymensingh Med J,2020,29(3):572-578.
[12] 黎燕飞,刘华敢.高频彩超与多层螺旋CT诊断颈动脉粥样硬化斑块的对照分析[J].中国数字医学,2018,13(8):116-117.
[13] Tuttolomondo A,Pinto A. C-reactive protein and efficacy of antiplatelet therapy in(intracranial) atherosclerosis[J]. Neurology,2018,90(6):253-254.
[14] 叶卫丰,董丽华,张茜,等.血胆红素和纤维蛋白原与2型糖尿病合并动脉粥样硬化性脑梗死的相关性[J].临床和实验医学杂志,2018,17(6):607-610.
[15] 刘瑞双,陈茂.纤维蛋白原对冠状动脉粥样硬化性心脏病影响的研究进展[J].华西医学,2018,33(3):342-347.
[16] Du M,Wang XJ,Mao XX,et al. Absence of interferon regulatory factor 1 protects against atherosclerosis in apolipoprotein e-deficient mice[J]. Theranostics,2019,9(16):4688-4703.
[17] Shen YB,Sun ZF,Mao S,et al. Irf-1 contributes to the pathological phenotype of vsmcs during atherogenesis by increasing ccl19 transcription[J]. Aging(Albany NY),2020,13(1):933-943.
[18] Clement M,Haddad Y,Raffort J,et al. Deletion of irf8(interferon regulatory factor 8)-dependent dendritic cells abrogates proatherogenic adaptive immunity[J]. Circ Res,2018,122(6):813-820.