入住重症医学科(intensivecare unit,ICU)的患者由于受到多种刺激因素的作用,机体处于高度应激状态,应激反应可诱发代谢功能紊乱及免疫系统障碍,促使患者机体为抵抗病原菌侵害而不断提高能量代谢和消耗效率,甚至造成肌肉组织分解,使得ICU患者在收住院的早期即处于负氮平衡的状态之中,蛋白质等营养物质大量消化、营养状态严重低下。营养不良会对ICU患者的预后情况造成不利影响,导致患者病情恶化,甚至危及生命[1-3]。最新临床实践指南推荐肠内营养为首选营养支持方式[4]。然而,有研究表明[5],单独应用肠内营养只能提供机体所需能量的45%~60%,且接受单独肠内营养的患者中30%~70% 会出现肠道不耐受情况。补充肠外营养能够纠正单独肠内营养造成的营养缺乏,然而目前对于肠内营养联合肠外营养的临床应用价值存在争议。最近国外的研究显示,对于危重患者足量的蛋白供应比足量的热卡供应更能取得较好的临床结果[6],国外有文献指出高蛋白营养支持可在一定程度上改善患者预后,但国内常用的肠内营养制品均难以达到上述目标,均需额外补充。而国内在营养支持方面更多的关注热卡的补充,在蛋白方面关注较少,相关研究亦较少,因此开展此项研究有重要意义。本研究从营养状态、免疫功能等方面探讨不同方式高蛋白营养支持对危重症患者的应用价值,现报告如下。
1 资 料 与 方 法
1.1 一般资料 选取2019年1月—2020年1月我院危重症患者90例,纳入标准:①营养风险筛查标准(NRS2002)评分≥3分;②存在不同程度吞咽困难或意识障碍;③急性生理与慢性健康指标评分(Acute Physiology and Chronic Helath Evaluation,APACHEⅡ)≥18分;④患者胃肠功能存在;排除标准:①脑死亡者;②各种原因所致胃肠功能障碍,不宜实施肠内营养者;③凝血机制紊乱或活动性出血者;④各种原因所致不能放置或不宜长期放置鼻饲管者;⑤严重肝肾功能异常者;⑥近期有免疫抑制剂使用史者;⑦特殊类型患者,如合并妊娠、恶性肿瘤等。应用简单随机化分组方法,将符合标准患者按照1∶1∶1分配,每位患者赋予1位随机数,其中1~30号者为对照组,31~60号者为蛋白粉组,61~90号者为氨基酸组。本研究经我院医学伦理委员会批准,所有研究对象均签署知情同意书。
1.2 方法
1.2.1 营养支持方法 3组均在入ICU3 d内予以肠内营养支持。应用胃管并予以机械通气辅助治疗、抗感染、抗休克、解痉、平喘、化痰等对症支持治疗。同时,3组均按照患者理想体重计算每日能量供应总量,即每日非蛋白质能量(kcal)=25(kcal/kg)×理想体重(kg),而理想体重=身高(cm)-105。3组均予以肠内营养乳剂TPF(瑞先)(华瑞制药有限公司,国药准字H20040188,规格:500 mL/瓶);蛋白粉组予以瑞先的同时按照1.5~2.0 g·kg-1·d-1的总蛋白摄入标准以乳清蛋白粉(西安力邦临床营养股份有限公司,生产许可证编号QS610127016001,规格:360 g/罐)给予营养支持;氨基酸组予以瑞先的同时按照1.5~2.0 g·kg-1·d-1的总蛋白摄入标准以复方氨基酸注射液(18AA-II)(华瑞制药有限公司,国药准字H10980032,规格:250 mL:21.25 g)给予营养支持;肠内营养液采用胃管持续泵入,输注速度为30~60 mL/h。首日给予总能量的50%喂养,观察有无呕吐、腹胀、腹泻、胃潴留等不良反应发生,若喂养顺利,第2天全量喂养。乳清蛋白粉按照所需剂量以温开水按照0.2 g/mL溶解后于第2天开始经胃管注入,1次/d。复方氨基酸按照所需剂量经中心静脉导管静脉滴注,1次/d。鼻饲过程中随机血糖控制在10 mmol/L左右,血糖过高者予以胰岛素对症处理。三组均持续干预2周。
1.2.2 检测方法 (1)将患者上臂屈曲90°,标记肩峰与鹰突连线中点,使用标准肌皮尺测量肱三头肌皮褶厚度(trieps skinfold thickness,TSF),以软尺环绕测量上臂围径(arm circumference,AC),均为3次,取其平均值,计算上臂肌围(arm muscle cirumference,AMC)(AMC=AC-3.14×TSF);(2)准确地收集患者24 h尿液,记录总量,搅拌均匀后取5 mL样品,采用免疫比浊法检测其肌酐水平,严格参照上海高创化学科技有限公司提供的试剂盒说明书操作,根据结果计算总肌酐排出量,与相同身高的健康人尿肌酐排出量对比,得出肌酐-身高指数(creatinine height index,CHI);(3)空腹取4 mL静脉血:①3 000 r/min离心12 min(离心半径10 cm),分离取血清,置于-20 ℃低温保存,采用免疫比浊法检测白蛋白(albumin,ALB)水平,严格参照上海高创化学科技有限公司提供的试剂盒说明书操作。②采用流式细胞仪测定T淋巴细胞亚群(CD3+、CD4+、CD4+/CD8+)水平,严格参照北京友华照钦医疗器械有限公司提供的仪器及其配套试剂盒说明书操作。
1.3 观察指标 ①一般资料。②比较3组住ICU时间、机械通气时间。③比较3组干预前、干预1周、2周后营养状态,包括AMC、CHI、ALB水平。④比较3组干预前、干预1周、2周后T细胞亚群指标,包括CD3+、CD4+、CD4+/CD8+水平。⑤统计2组不良事件(便秘、腹泻、腹胀、导管相关感染、低蛋白血症)发生率。
1.4 统计学方法 应用SPSS 25.0统计软件处理数据。计量资料采用单因素方差分析、SNK-q检验重复测量的方差分析检验,计数资料采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料 3组性别、年龄、体重指数、APACHEⅡ评分、疾病类型差异均无统计学意义(P>0.05),具有可比性。见表1。
表1 3组一般资料比较
Table 1 Comparison of general information among three groups (n=30)
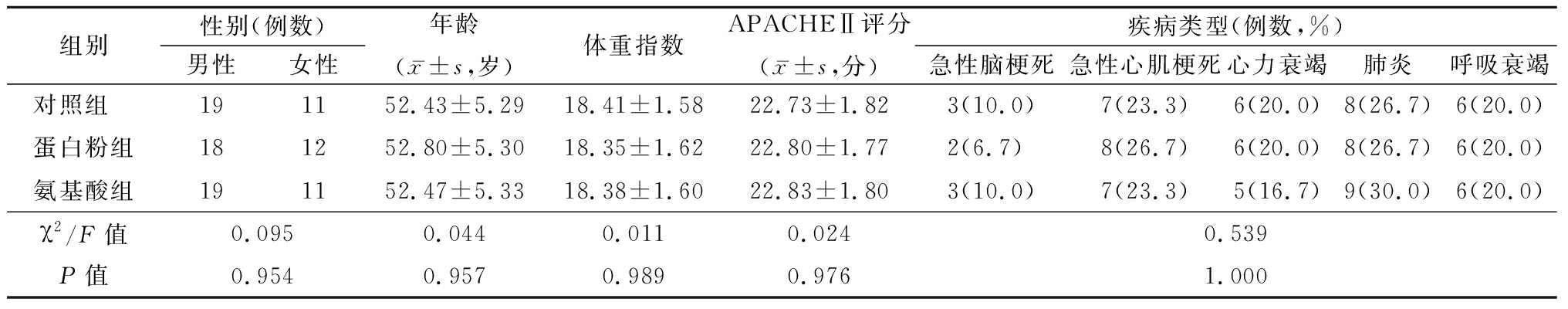
组别性别(例数)男性女性年龄(x-±s,岁)体重指数APACHEⅡ评分(x-±s,分)疾病类型(例数,%)急性脑梗死急性心肌梗死心力衰竭肺炎呼吸衰竭对照组 191152.43±5.2918.41±1.5822.73±1.823(10.0)7(23.3)6(20.0)8(26.7)6(20.0)蛋白粉组181252.80±5.3018.35±1.6222.80±1.772(6.7) 8(26.7)6(20.0)8(26.7)6(20.0)氨基酸组191152.47±5.3318.38±1.6022.83±1.803(10.0)7(23.3)5(16.7)9(30.0)6(20.0)χ2/F值0.0950.0440.0110.0240.539P值0.9540.9570.9890.9761.000
2.2 治疗情况 蛋白粉组及氨基酸组的住ICU时间、机械通气时间均短于对照组,差异有统计学意义(P<0.05)。见表2。
表2 3组治疗情况比较
Table 2 Comparison of treatment conditions among three groups ![]()
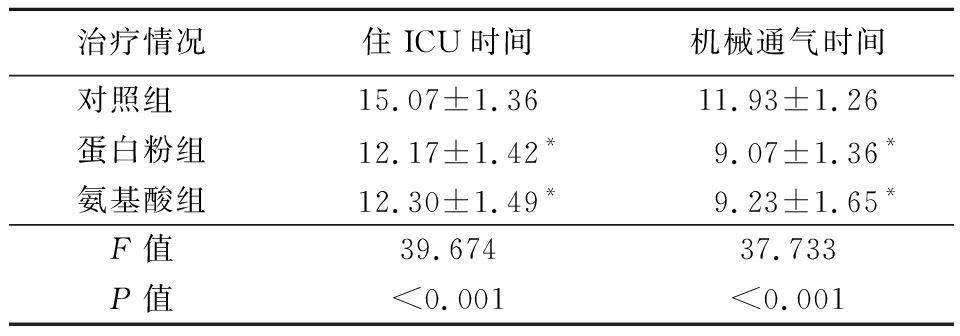
治疗情况住ICU时间机械通气时间对照组 15.07±1.3611.93±1.26蛋白粉组12.17±1.42*9.07±1.36*氨基酸组12.30±1.49*9.23±1.65*F值39.67437.733P值<0.001<0.001
*P值<0.05与对照组比较(SNK-q检验)
2.3 营养状态 在各组别中,随干预时间延长, AMC、CHI、ALB均呈升高趋势,差异均具有统计学意义(P<0.05)。在干预1周后,蛋白粉组及氨基酸组的AMC、CHI及ALB均高于对照组,差异有统计学意义(P<0.05),氨基酸组的AMC、CHI及ALB均高于蛋白粉组,差异有统计学意义(P<0.05);干预2周后,蛋白粉组及氨基酸组的AMC、CHI及ALB均高于对照组,差异有统计学意义(P<0.05),氨基酸组与蛋白粉组的AMC、CHI及ALB差异均无统计学意义(P>0.05)。各组AMC、CHI及ALB在组间、时点间、组间·时点间交互作用差异均有统计学意义(P<0.05)。见表3。
表3 3组营养状态比较
Table 3 Comparison of nutritional status among three groups ![]()
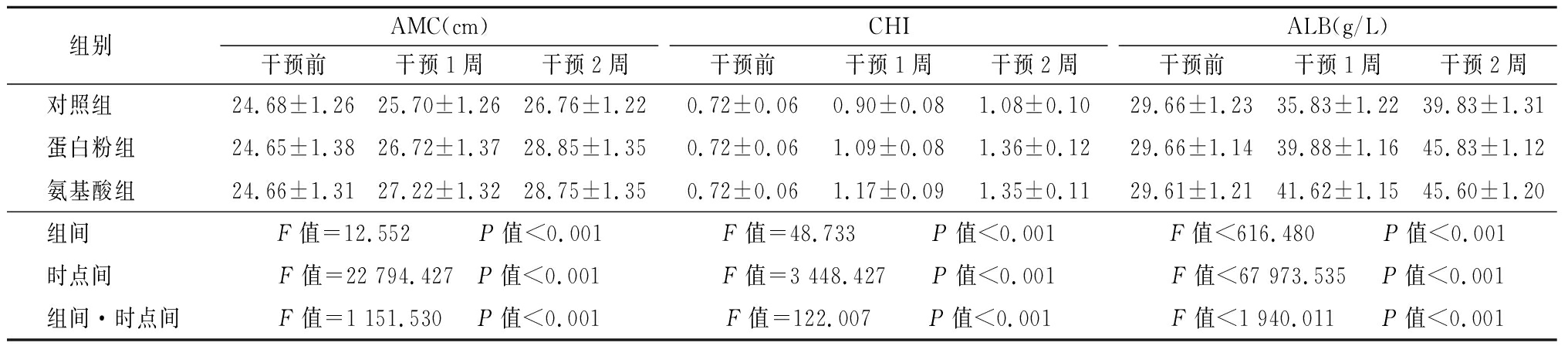
组别 AMC(cm)干预前干预1周干预2周CHI干预前干预1周干预2周ALB(g/L)干预前干预1周干预2周对照组 24.68±1.2625.70±1.2626.76±1.220.72±0.060.90±0.081.08±0.1029.66±1.2335.83±1.2239.83±1.31蛋白粉组 24.65±1.3826.72±1.3728.85±1.350.72±0.061.09±0.081.36±0.1229.66±1.1439.88±1.1645.83±1.12氨基酸组 24.66±1.3127.22±1.3228.75±1.350.72±0.061.17±0.091.35±0.1129.61±1.2141.62±1.1545.60±1.20组间 F值=12.552 P值<0.001F值=48.733 P值<0.001F值<616.480 P值<0.001时点间 F值=22 794.427 P值<0.001F值=3 448.427 P值<0.001F值<67 973.535 P值<0.001组间·时点间F值=1 151.530 P值<0.001F值=122.007 P值<0.001F值<1 940.011 P值<0.001
2.4 T细胞亚群指标 在干预1周后,蛋白粉组及氨基酸组的CD3+、CD4+及CD4+/CD8+均高于对照组,差异有统计学意义(P<0.05),氨基酸组与蛋白粉组的CD3+、CD4+及CD4+/CD8+差异均无统计学意义(P>0.05)。干预2周后,蛋白粉组及氨基酸组的CD3+、CD4+及CD4+/CD8+均高于对照组,差异有统计学意义(P<0.05),氨基酸组与蛋白粉组的CD3+、CD4+及CD4+/CD8+差异均无统计学意义(P>0.05)。在各组别中,随干预时间延长,CD3+、CD4+及CD4+/CD8+均呈升高趋势,差异均有统计学意义(P<0.05)。各组CD3+、CD4+及CD4+/CD8+在组间、时点间、组间·时点间交互作用差异均有统计学意义(P<0.05)。见表4。
表4 3组T细胞亚群指标比较
Table 4 Comparison of T cell subgroup indexes among three groups ![]()
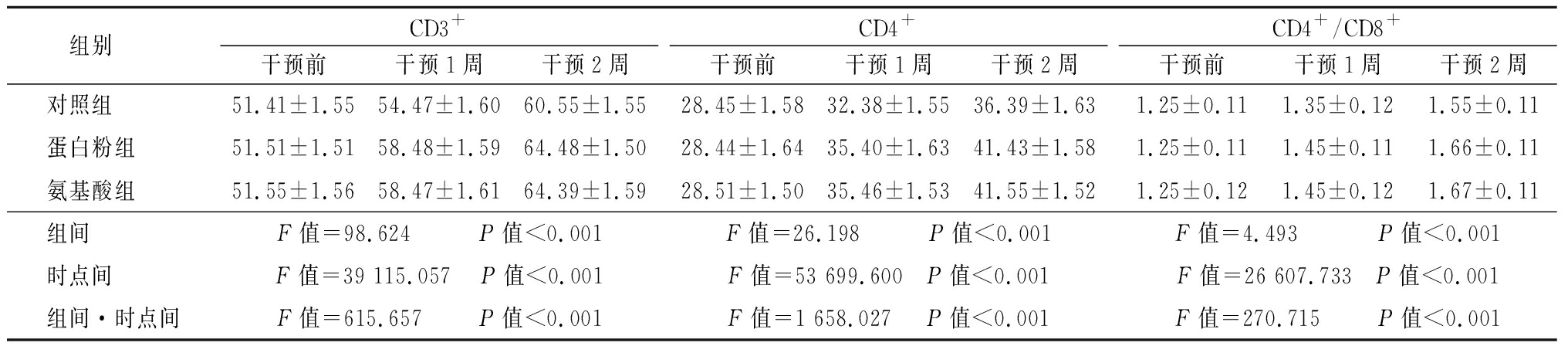
组别 CD3+干预前干预1周干预2周CD4+干预前干预1周干预2周CD4+/CD8+干预前干预1周干预2周对照组 51.41±1.5554.47±1.6060.55±1.5528.45±1.5832.38±1.5536.39±1.631.25±0.111.35±0.121.55±0.11蛋白粉组 51.51±1.5158.48±1.5964.48±1.5028.44±1.6435.40±1.6341.43±1.581.25±0.111.45±0.111.66±0.11氨基酸组 51.55±1.5658.47±1.6164.39±1.5928.51±1.5035.46±1.5341.55±1.521.25±0.121.45±0.121.67±0.11组间 F值=98.624 P值<0.001F值=26.198 P值<0.001F值=4.493 P值<0.001时点间 F值=39 115.057 P值<0.001F值=53 699.600 P值<0.001F值=26 607.733 P值<0.001组间·时点间F值=615.657 P值<0.001F值=1 658.027 P值<0.001F值=270.715 P值<0.001
2.5 不良事件发生率 3组便秘、腹泻、腹胀、呕吐发生率比较差异无统计学意义(P>0.05)。见表5。
表5 3组不良事件发生率比较
Table 5 Comparison of the incidence of adverse events among three groups (n=30,例数,%)
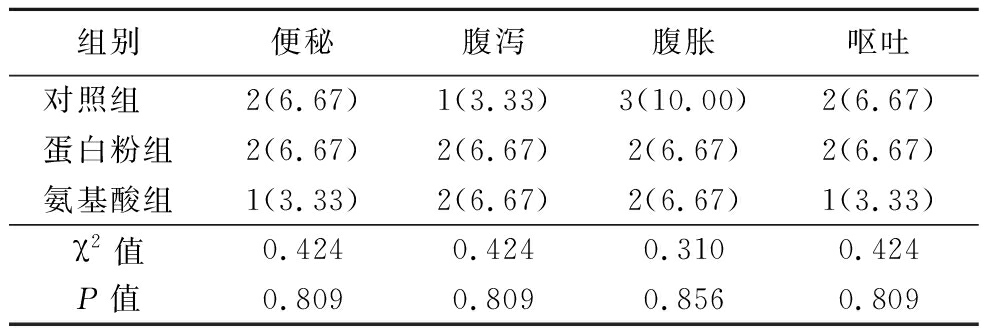
组别便秘腹泻腹胀呕吐对照组 2(6.67)1(3.33)3(10.00)2(6.67)蛋白粉组2(6.67)2(6.67)2(6.67)2(6.67)氨基酸组1(3.33)2(6.67)2(6.67)1(3.33)χ2值0.4240.4240.3100.424P值0.8090.8090.8560.809
3 讨 论
入住ICU的危重患者在入院的前10 d内肌损失可高达30%,机械通气时间≥48 h的患者中,ICU获得性衰弱的患病率为25%~40%,而在脓毒症或ICU住院时间延长的患者中,这个比例甚至更高[7]。在正常的运动中,肝脏和骨骼肌的糖原通过糖酵解提供能量。停止运动后,糖原储存通过适当的营养得到补充。然而,ICU患者的代谢需求是人类最极端的代谢需求。有研究显示,ICU的危重患者体内糖原的储备仅为优秀的耐力运动员在大型比赛(如长时间自行车比赛或马拉松)后的1/20~1/10[8]。在运动等生理应激状态下,蛋白质分解占糖原负荷下运动总热量消耗的4%,约5.8 g/h。然而,在糖原消耗的情况下,蛋白质分解显著增加,占总热量消耗的10%约为13.7 g/h[9]。由此可见,早期营养支持可减少危重患者骨骼肌蛋白质分解和代谢,同时,高蛋白营养支持对改善危重患者蛋白分解和代谢具有重要作用。许多观察性研究表明,与低蛋白摄入量相比,提供更多的蛋白质与降低发病率和死亡率有关[10]。本研究结果显示,高蛋白营养支持可明显改善危重患者住ICU时间及机械通气时间,这可能与高蛋白营养支持改善营养状况,纠正负氮平衡,为骨骼肌蛋白合成提供充足底物有关。
肌酐作为多见于肌肉组织中的肌酸的代谢产物,其产生与肌肉量、体表面积和体重密切相关,不受输液与体液潴留的影响。肌酐在一天中以相对恒定的速度排泄到尿液中,故而CHI是评估包括营养不良在内的多种疾病下患者蛋白状况的有效且非常简单的指标[11-12],是机械通气患者成功脱机和存活的有效预测因子[13]。而且有学者指出,CHI与BMI等指标结合,可更精确地评估营养状况,并最终可用来预测肺移植后的结果[14]。本研究结果显示,蛋白粉组与氨基酸组在干预1周及2周后AMC、CHI、ALB水平均高于对照组,提示高蛋白营养支持能有效改善危重患者的营养状态,这可能是由于大量蛋白质和氨基酸可以抵消危重患者的高代谢反应,这种反应通过蛋白质(以肌蛋白为主)分解来动员氨基酸,以保证底物输送到重要组织。有文献证实,外源性氨基酸的应用被认为可以避免内源性氨基酸释放的需要,并刺激肌蛋白质的合成[15]。本研究结果显示,在干预1周后,氨基酸组的CHI及ALB水平均高于蛋白粉组,而干预2周后则没有明显差别,这提示静脉补充氨基酸在短期内(1周)可较明显的改善患者的营养指标,但长期效果与应用蛋白粉无差别。同时本研究还发现,干预1周及2周后,氨基酸组和蛋白粉组的AMC均无明显差别,这提示单纯营养支持只是影响人体肌储备的一个方面,其它诸如神经内分泌功能、康复锻炼等也会影响人体肌肉总量[16]。
在生命的各个阶段,免疫细胞的发育、维持和表达均依赖于充足的营养[17],营养不良导致免疫细胞数量减少。有研究显示,禁食48 h的小鼠与喂食对照组小鼠相比,胸腺细胞和脾细胞数量显著减少,与喂食对照组小鼠相比,喂食缺乏蛋白质饮食的小鼠脾脏萎缩,T细胞数量减少[18]。而低蛋白水平也会导致功能性活性免疫球蛋白和肠道相关淋巴组织的数量减少[19],笔者在肠道黏膜抵御感染方面发挥着重要作用。T淋巴细胞亚群是反映机体细胞免疫功能的重要指标,本研究显示,随着营养支持的进行,氨基酸组和蛋白粉组的CD3+、CD4+、CD4+/CD8+水平均进行性升高,且明显高于对照组,这表示积极的高蛋白饮食可更好的促进T淋巴细胞的分裂与分化,抑制炎症反应,更好的改善患者的免疫功能,而这种效果与给予的方式没有差别。
综上可知,高蛋白营养支持有助于提高机体免疫力,更好的纠正营养不良,改善治疗结局,同时通过本研究可对于临床工作中营养支持方式的选择起到一定的指导作用。但由于本研究仅选择本院患者作为研究对象且涉及样本量较小,故仅能得出初步结论,今后需采取多中心的研究方法并进一步扩大样本量,以得到更加可靠的结果。
[1] 吴可嘉. ICU重症患者治疗中应用营养支持疗法的效果[J].医学食疗与健康,2020,18(3):24-25.
[2] 朱瑞,徐凤玲,汪璐璐,等. 喂养不耐受风险评估表评估神经重症患者肠内营养不耐受风险的有效性[J]. 广东医学,2019,40(20):2902-2906.
[3] Bertrand G,Dylan W,Ariane B,et al. The contribution of frailty,cognition,activity of daily life and comorbidities on outcome in acutely admitted patients over 80 years in European ICUs:the VIP2 study[J]. Intensive Care Med,2020,46(1):57-69.
[4] Ps A,Arbb C,Mmb D,et al. ESPEN guideline on clinical nutrition in the intensive care unit-ScienceDirect[J]. Clin Nutr,2019,38(1):48-79.
[5] Allen K,Hoffman L. Enteral nutrition in the mechanically ventilated patient[J]. Nutr Clin Pract,2019,34(4):540-557.
[6] Bernhard F,Oliver N,David C S,et al. Dietary protein,muscle and physical function in the very old[J]. Nutrients,2018,10(7):935-947.
[7] Charles L,Gabriel W,Ka C,et al. Association between malnutrition and 28-Day mortality and intensive care length-of-stay in the critically ill:aprospective cohort study[J]. Nutrients,2017,10(1):10-19.
[8] Fagoni N. Intensive care unit-acquired weakness:unanswered questions and targets for future research[J]. F1000 Res,2019,8:508-518.
[9] Nakanishi N,Tsutsumi R,Hara K,et al. Urinary titin N-fragment as a biomarker of muscle atrophy,intensive care unit-acquired weakness,and possible application for post-intensive care syndrome[J]. J Clin Med,2021,10(4):614-628.
[10] Wang CY,Fu PK,Chao WC,et al. Full versus trophic feeds in critically Ill adults with high and low nutritional risk scores:arandomized controlled trial[J]. Nutrients,2020,12(11):3518-3529.
[11] Morishita T,Sato M,Kume H,et al. Skeletal muscle mass of old Japanese women suffering from walking difficulty in nursing home[J].J Med Invest,2018,65(1/2):122-130.
[12] Wang W,Du C,Lin L,et al. Anthropometry-based 24-h urinary creatinine excretion reference for Chinese children[J]. PLoS One,2018,13(5):e0197672.
[13] Datta D,Foley R,Wu R,et al. Can creatinine height index predict weaning and survival outcomes in patients on prolonged mechanical ventilation after critical illness?[J]. J Intensive Care Med,2018,33(2):104-110.
[14] Gulling MW,Schaefer M,Bishop-Simo L,et al. Optimizing nutrition assessment to create better outcomes in lung transplant recipients:a review of current practices[J]. Nutrients,2019,11(12):2884-2893.
[15] Van Goudoever JB,Carnielli V,Darmaun D,et al. ESPGHAN/ESPEN/ESPR/CSPEN guidelines on pediatric parenteral nutrition:Amino acids[J]. Clin Nutr,2018,37(6 Pt B):2315-2323.
[16] Vanhorebeek I,Latronico N,Berghe GVD. ICU-acquired weakness[J]. Intensive Care Med,2020,46(4):637-653.
[17] Gombart AF,Pierre A,Maggini NJ. A Review of micronutrients and the immune system-working in harmony to reduce the risk of infection[J]. Nutrients,2020,12(1):236-277.
[18] Yazan A,Kaitlin K,Maciver NJ. Changes in nutritional status impact immune cell metabolism and function[J]. Front Immunol,2018,9:1055-1069.
[19] Iddir M,Brito A,Dingeo G,et al. Strengthening the immune system and reducing inflammation and oxidative stress through diet and nutrition:considerations during the COVID-19 crisis[J]. Nutrients,2020,12(6):1562-1601.