人类辅助生殖技术已成为当今医疗解决不孕症的有效手段之一。控制性超促排卵(controlled ovarian hyperstimulation,COH)是体外受精-胚胎移植(in vitro fertilization-embryo transfer,IVF-ET)成功的关键。但是,由于卵巢对COH的反应存在差异,可产生两种不良结局,即卵巢过度刺激或卵巢低反应[1]。对卵巢反应性的正确预测则对提高周期结具有重要意义[2]。目前尚没有直接预测卵巢反应性的指标,常使用卵巢储备评估指标去预测卵巢的反应性[3],抗苗勒管激素(anti-müllerian hormone,AMH)是近年常用的新指标,不受月经周期的影响[4],对卵巢反应有较好的预测价值[5],也可作为绝经的预测指标[6]。很多学者认为年龄、AMH、窦卵泡数(antral follicle count,AFC)是卵巢反应的重要预测因子,还用之构成了预测卵巢反应的模型[7],但是,一些学者认为上述参数的评估效果在临床实践中并不令人满意且不准确,尚无可无条件评估卵巢储备功能的因子。且AMH虽得到较广的认可,但也有研究提出其对卵巢低反应的评估较差[8],AMH正常人群中仍存在卵巢低反应人群。另有人提出促卵泡激素与黄体生成素比值(follicle-stimulating hormone/luteinizing hormone,FSH/LH)升高是卵巢储备功能下降的首先表现,并且提出其不仅是卵巢年龄的标志也是卵巢反应性标志[9-10]。卵巢敏感指数(ovarian sensitivity index,OSI)是近年提出可对COH后的患者进行卵巢反应性评估。并于2013年通过大数据研究认为,OSI<1.7即为卵巢低反应[11],但OSI不具备预测卵巢反应性的价值。本研究旨在以OSI为评估卵巢低反应的标准,探索FSH/LH在AMH正常人群中预测卵巢低反应的价值,以期为临床预测卵巢低反应提供有效的依据。
1 资 料 与 方 法
1.1 一般资料 选取2018年1月1日—2020年12月31日于河北医科大学第二医院生殖中心行IVF/ICSI-ET的患者进行回顾性研究。
纳入标准:①年龄<40岁;②FSH<25 U/L;③行IVF/ICSI(intracytoplasmic sperm injection)助孕。排除标准:①多囊卵巢综合征患者或卵巢早衰患者;②卵巢高反应高危人群;③卵巢肿瘤等恶性肿瘤病史;④甲状腺功能减退或亢进、糖尿病等内分泌疾病史。
符合以上标准共4 363个周期,将入组周期按AMH水平分组,分为AMH正常水平组:1.1~6.5 μg/L;AMH低水平组:<1.1 μg/L。用以分析FSH/LH在AMH不同的两组中,是否对卵巢低反应性有阈值及饱和效应,再以找到的FSH/LH值分组,比较组间相应的监测指标,以验证FSH/LH在识别卵巢低反应人群中的价值。
1.2 指标收集 患者基本信息收集:年龄、体重指数(body mass index,BMI)、不孕类型、不孕年限、月经史、孕产史。
临床指标采集:AMH,基础促卵泡激素与黄体生成素比值(follicle-stimulating hormone/luteinizing hormone,FSH/LH)、雌激素(estrogen,E2)、孕激素(progesterone,P),窦卵泡数(antral follicle count,AFC),周期方案,Gn启动剂量,Gn总剂量,Gn总时间,扳机日E2、LH、P水平,获卵数,临床妊娠,流产,妊娠类型。
实验室指标采集:可移植胚胎数,优质胚胎数,MII卵子数,2PN受精数。
OSI=获卵数×1 000/Gn总剂量。
着床率=着床胚胎数/移植胚胎数。
临床妊娠率=妊娠周期数/移植周期数。
优质胚胎率=优质胚胎数/正常受精数。
可移植胚胎率=可移植胚胎数/正常受精数。
鲜胚移植率=新鲜周期移植/总周期数。
MII卵子率=ICSIMII卵子数/ICSI获卵总数。
1.3 研究方法
1.3.1 促排卵方案 所有入组周期均为我中心常规促排卵方案,给予个体化Gn方案,常规Gn为:丽申宝,丽珠,中国珠海;果纳芬,默克雪兰诺,瑞士;普丽康,默沙东,美国;注射用尿促性素,丽珠,中国珠海;金塞恒,金塞,中国长春;当经阴道超声监测下,主导卵泡1个直径>18 mm,和(或)>3个卵泡直径>17 mm,且与血清E2结果相符合时,给予人绒毛膜促性腺激素(human chorionic gonadotropin,HCG)8 000~10 000 U,或艾泽(默克雪兰诺,美国)250 μg,或艾泽(默克雪兰诺,美国)及HCG2 000U扳机。
1.3.2 卵子采集及胚胎移植 在扳机后36~38 h内行超声监测下经阴道后穹窿穿刺取卵术,视男方精液情况行IVF/ICSI受精,72 h后根据卵裂球数目,碎片多少,对称性,细胞融合程度将胚胎进行分级。自取卵日起给予常规黄体支持方案,取卵后3 d根据患者及胚胎情况,行胚胎移植术或全胚冷冻。
1.3.3 妊娠诊断 自移植日起第14天,行血清HCG检查,若阳性则可诊断为生化妊娠,移植后第28天,行经阴道超声检查,监测到孕囊,即确诊为临床妊娠,继续给予黄体支持,至妊娠12周。
1.4 统计学方法 应用SPSS21.0统计学软件分析数据。计量资料组间比较采用t检验,非正态性分布组间比较采用Kruskal-Wallis检验,两样本间相关性采用Spearman相关性分析,计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 卵巢反应性的相关性分析 人群基线特征见表1,将符合入组条件的人群通过Spearman相关性分析,分别对年龄、不孕年限、BMI、FSH/LH、基础E2、P、AFC、AMH与OSI关系进行相关性分析。其中年龄(rs=-0.232,P<0.001)、不孕年限(rs=-0.046,P=0.019)、BMI(rs=-0.105,P<0.001)、FSH/LH(rs=-0.174,P<0.001)、AFC(rs=0.317,P<0.001)、AMH(rs=0.450,P<0.001)均与OSI存在相关性(P<0.05)。
表1 人群基线特征
Table 1 Baseline characteristics of the population enrolled
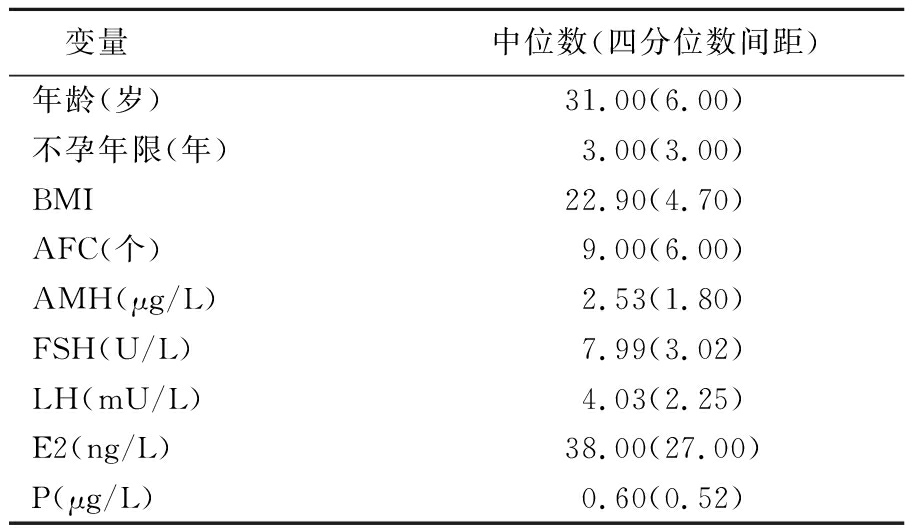
变量中位数(四分位数间距)年龄(岁)31.00(6.00)不孕年限(年)3.00(3.00)BMI22.90(4.70)AFC(个)9.00(6.00)AMH(μg/L)2.53(1.80)FSH(U/L)7.99(3.02)LH(mU/L)4.03(2.25)E2(ng/L)38.00(27.00)P(μg/L)0.60(0.52)
2.2 FSH/LH与卵巢低反应的关系 按AMH<1.1 μg/L(n=1 324)及1.1
在AMH非正常组中,通过平滑曲线拟合发现随FSH/LH增加,对卵巢低反应诊断无明显规律变化(图1)。在AMH正常组中,通过平滑曲线拟合发现,随FSH/LH水平增加,卵巢低反应发生增加,但通过阈值与饱和分析找出最佳饱和点为3.3,FSH/LH<3.3时,卵巢低反应发生随着FSH/LH升而升高,FSH/LH每增加1个单位,卵巢低反应发生的概率增加1.7,95%可信区间为1.4~2.1(P<0.001),FSH/LH≥3.3后达到饱和水平,随FSH/LH的增加,卵巢低反应的发生率不随之增加,FSH/LH每增加1个单位,卵巢低反应发生的概率增加0.8,95%可信区间为0.6~1.1,差异无统计学意义(P=0.213),见图2。
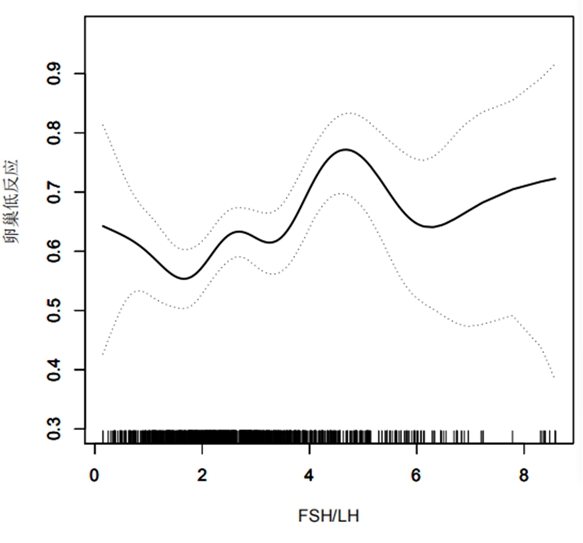
图1 低AMH人群FSH/LH与卵巢低反应的平滑拟合曲线
Figure 1 Smooth curve fitting between FSH/LH and low ovarian response in low AMH population
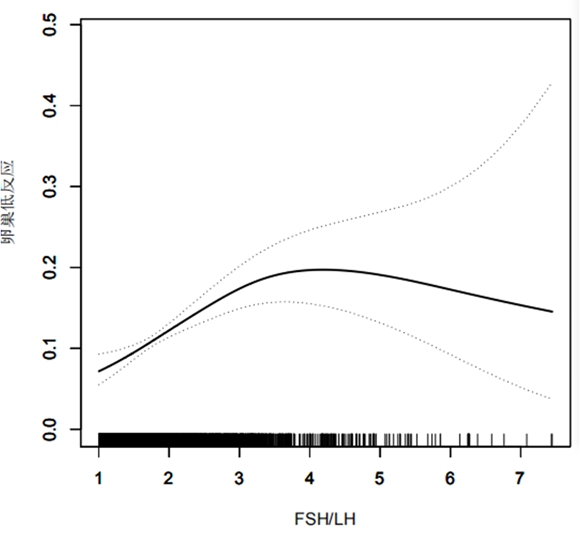
图2 正常AMH人群FSH/LH与卵巢低反应的平滑拟合曲线
Figure 2 Smooth curve fitting between FSH/LH and low ovarian response in normal AMH population
2.3 在AMH正常人群中,根据FSH/LH饱和点3.3分组 FSH<3.3(n=2 788),FSH≥3.3(n=251),对FSH<3.3组进行随机抽样(n=1 000),保证两组间样本差小于4倍,减少统计学误差。
2.3.1 组间一般情况比较 比较两组间年龄、不孕年限、BMI、AFC、AMH、基础FSH、LH、E2、P水平,发现两组间年龄、BMI、AFC、AMH、基础FSH、LH、E2水平差异均有统计学意义,FSH/LH≥3.3组中,年龄、BMI、FSH均高于FSH/LH<3.3组(P<0.05);AFC、AMH、基础LH、E2均低于FSH/LH<3.3组(P<0.05),见表2。
表2 一般情况比较
Table 2 Comparison of general information (M,QR)
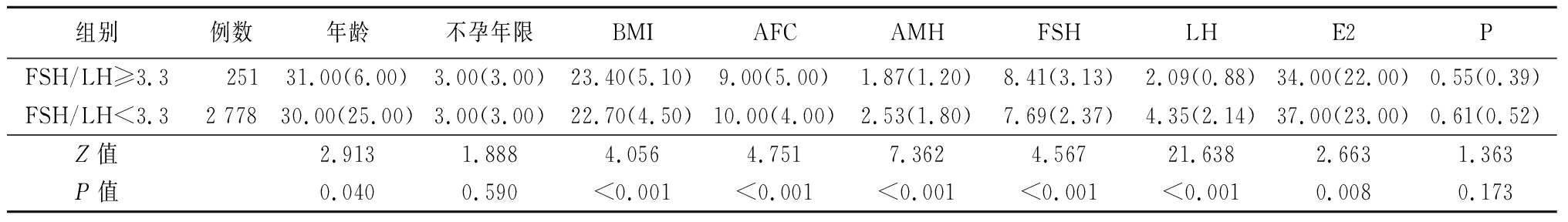
组别例数年龄不孕年限BMIAFCAMHFSHLHE2PFSH/LH≥3.3 25131.00(6.00)3.00(3.00)23.40(5.10)9.00(5.00)1.87(1.20)8.41(3.13)2.09(0.88)34.00(22.00)0.55(0.39)FSH/LH<3.32 77830.00(25.00)3.00(3.00)22.70(4.50)10.00(4.00)2.53(1.80)7.69(2.37)4.35(2.14)37.00(23.00)0.61(0.52)Z值2.9131.8884.0564.7517.3624.56721.6382.6631.363P值0.0400.590<0.001<0.001<0.001<0.001<0.0010.0080.173
2.3.2 周期结局比较 FSH/LH≥3.3组,Gn启动剂量、Gn总剂量均显著高于FSH/LH<3.3组(P<0.05);虽然着床率也显著高于FSH/LH<3.3组,但妊娠率差异无统计学意义,获卵总数、可移植胚胎率、扳机日E2、P水平均低于FSH/LH<3组(P<0.05),见表3。
表3 周期结局比较
Table 3 Comparison of cycle outcome (M,QR)
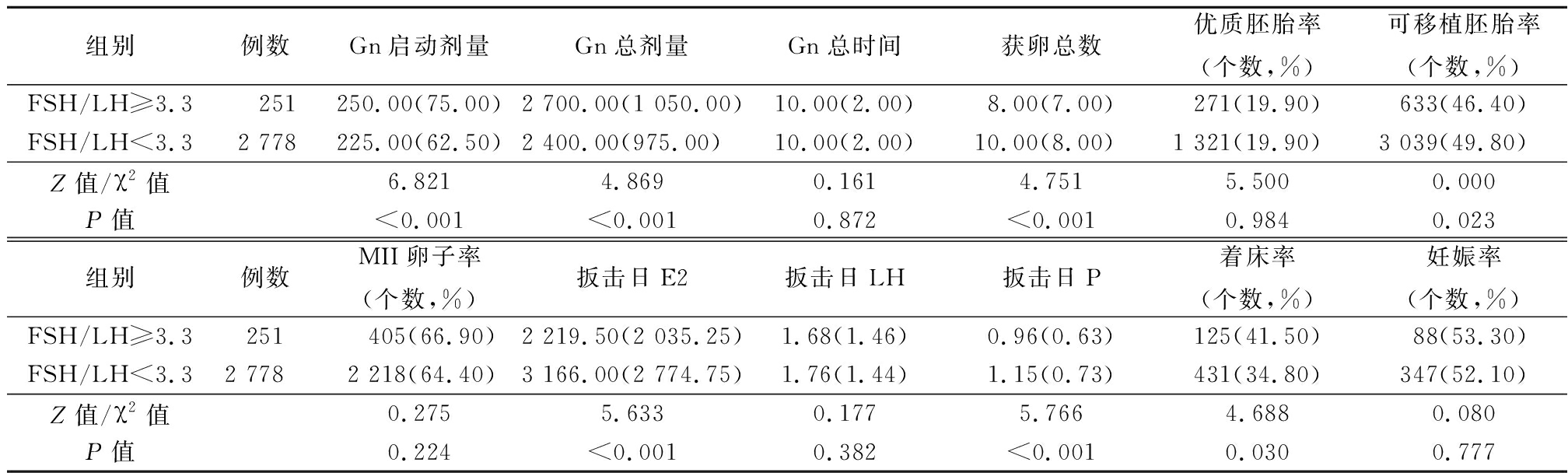
组别例数Gn启动剂量Gn总剂量Gn总时间获卵总数优质胚胎率(个数,%)可移植胚胎率(个数,%)FSH/LH≥3.3 251250.00(75.00)2 700.00(1 050.00)10.00(2.00)8.00(7.00)271(19.90)633(46.40)FSH/LH<3.32 778225.00(62.50)2 400.00(975.00)10.00(2.00)10.00(8.00)1 321(19.90)3 039(49.80)Z值/χ2值6.8214.8690.1614.7515.5000.000P值<0.001<0.0010.872<0.0010.9840.023组别例数MII卵子率(个数,%)扳击日E2扳击日LH扳击日P着床率(个数,%)妊娠率(个数,%)FSH/LH≥3.3251 405(66.90)2 219.50(2 035.25)1.68(1.46)0.96(0.63)125(41.50)88(53.30)FSH/LH<3.32 7782 218(64.40)3 166.00(2 774.75)1.76(1.44)1.15(0.73)431(34.80)347(52.10)Z值/χ2值0.2755.6330.1775.7664.6880.080P值0.224<0.0010.382<0.0010.0300.777
3 讨 论
对于不孕症患者来说,IVF/ICSI-ET是一种有效,但有创且昂贵的治疗方式,在COH过程中卵巢对外源性Gn的反应性可能与患者的预后相关,包括其周期取消的可能性,所需的药物剂量,获得卵母细胞和胚胎的数量,以及最终的妊娠结局。而卵巢反应差是现代IVF治疗中的重要问题,即使给予合适的卵巢刺激仍处于低反应,它是IVF的不良结局[12],与周期成功率显着下降有关。近10%的育龄妇女的生育力下降速度快于预期,对于这部分人群来说,及早识别卵巢低反应状态是非常有价值的,而面对可能存在的卵巢低反应患者,对患者的卵巢反应进行预测,大概率识别存在不良反应高风险的患者,可以帮助临床医生进行个体化的方案制定,并给予患者充分的治疗前知情。
目前卵巢储备降低是卵巢反应差的主要因素,临床评估卵巢储备功能的因子有年龄、AMH、AFC、基础FSH水平等[13], 但一些学者认为,上述指标在临床实践中,并不令人满意,且存在不准确的情况[14]。并提出AMH预测,AFC/TOC比,FSH/LH比是用于预测刺激结果的最新方法[15-16] 。在早期临床,常用基础FSH作为衡量卵巢储备功能的指标,但发现FSH正常患者中也存在卵巢低反应患者[17]。而AFC的评估易受人为因素影响,存在不稳定性。近年来认为AMH,AFC可用于评估卵巢储备能力,单个中心内进行的ROC曲线研究和荟萃分析表明,AFC和AMH二者均可识别出可能对外源促Gn反应不良,正常或反应过激的患者[18],但有研究证明AMH预测卵巢低反应人群的敏感度稍差[8,19]。且目前尚无能独立评价卵巢储备功能和卵巢反应性的特异性标志物,仍需联合应用评估。
近年来基础FSH/LH也一直受到关注,有学者可反应卵巢对外源性Gn的反应性[10],同时与IVF-ET前的月经周期长度相关[20]。研究人员认为,FSH/LH值的增加可以评估卵巢储备降低和周期成功率的降低[21],同时取消周期比非取消周期的FSH/LH值显著增高[22]。但也有研究持相反的观点认为FSH/LH升高人群最终的获卵数,及受精率并没有减少[23]。目前临床中AMH正常但发生低反应的人群仍存在,且易被忽视,本研究通过关注这部分人群发现,在AMH正常人群中,FSH/LH增高,AMH、AFC均降低,年龄增加,就此认为基础FSH/LH值可以在一定程度上反映卵巢的储备功能。且FSH/LH升高的人群Gn启动剂量及Gn总剂量较高,但获卵总数显著少于FSH/LH低的人群,认为FSH/LH值升高的患者对外源性Gn的敏感性下降,卵巢反应性降低。此外,既往研究观察到FSH/LH比增加人群的成熟卵母细胞数减少[13],并且认为FSH/LH升高与最终的妊娠率降低相关[24],也有研究发现FSH/LH的水平与最终周期结局无关[13]。年龄和移植胚胎数量才是最终活产率的独立影响因素[25]。本中心数据分析发现,FSH/LH≥3.3人群卵子成熟度,优质胚胎数,以及最终的妊娠率均未见明显降低,但可移植胚胎数显著低于FSH/LH<3.3组,由此认为,优质胚胎数与卵子质量与FSH/LH的水平无关,最终周期结局无显著性差异可能与优质胚胎数无差异相关,但由于FSH/LH影响可移植胚胎的数量,可进一步随访,统计累计妊娠率,以明确是否受其影响。
本研究中FSH/LH高水平组的基础LH与FSH/LH低水平组相比较低,存在FSH正常,但LH水平下降的情况,进一步推测,卵巢对外源性Gn的反应降低可能与FSH升高相关的同时,也与LH水平的降低相关。有学者认为在基础FSH水平升高前FSH/LH值已经升高,用以解释相同基础FSH水平下,患者对外源性Gn敏感性不同。根据两细胞两促性腺激素理论,卵泡的成长及成熟均需要FSH和LH的参与,主要作用归因于FSH,但有研究认为,垂体持续分泌LH对卵泡募集也是必要的[26],而LH水平的下降可能与垂体功能的紊乱相关。且有研究发现,在月经第3天的基础LH水平下降,会导致获卵数的降低,且OHSS的风险降低[26]。同时,通过大鼠基因水平研究,LH信号不足可能导致窦卵泡减少,这个过程可能与LH可能通过调节配体激活的转录因子芳基烃受体(aryl hydrocarbon receptor,Ahr)在颗粒细胞中的表达相关[27],并且临床研究证实,内源性LH水平在一定程度升高的人群,在COH过程中,对外源性Gn的需求较少,并认为基础LH降低所导致FSH/LH升高的患者,即使外源性添加LH,同时增大Gn的启动剂量,也仍然存在卵巢低反应的风险。
虽然通过以上研究,认为AMH正常人群中,FSH/LH增加会降低卵巢对外源性Gn的反应性,OSI是近些年提出的COH后评估卵巢反应的标志物,优于其他标志物[28],以OSI<1.7为卵巢低反应的诊断标准,本研究通过对FSH/LH与是否发生卵巢低反应进行平滑曲线拟合,以及相应的阈值及饱和分析,发现FSH/LH=3.3是在AMH正常人群中,FSH/LH对诊断为卵巢低反应发生预测的饱和点,FSH/LH≥3.3后卵巢低反应的发生率将不再随其升高而增加,在AMH正常人群中FSH/LH≥3.3的人群中卵巢低反应发生率为23%,虽是FSH/LH<3.3时卵巢低反应发生率9%的两倍,但仍不不属于卵巢低反应预测的敏感指标。再次验证了AMH是临床相对可靠的卵巢反应性预测指标。但对于基础FSH/LH≥3.3的患者,仍需要引起注意,有研究发现在COH过程中仅仅通过增加Gn的日剂量未能改善卵巢低反应人群的周期取消率,所以提前结合临床指标发现卵巢低反应的高危人群,可为该类患者制定更合适的周期方案。
综上所述,在AMH正常人群中FSH/LH升高提示卵巢对外源性Gn反应差,发现FSH/LH预测卵巢低反应的饱和点为3.3,但对卵巢低反应人群的预测率不高为23%,临床中应以AMH为主要预测指标,但同时不要忽视FSH/LH升高的人群,应综合考虑评估。
[1] Chalumeau C,Moreau J,Gatimel N,et al. Establishment and validation of a score to predict ovarian response to stimulation in IVF[J]. Reprod Biomed On-line,2018,36(1):26-31.
[2] Kim SW,Kim YJ,Shin JH,et al. Correlation between ovarian reserve and incidence of ectopic pregnancy after in vitro fertilization and embryo transfer[J]. Yonsei Med J,2019,60(3):285-290.
[3] Saleh BO,Ibraheem WF,Ameen NS. The role of anti-Mulerian hormone and inhibin B in the asesment of metformin therapy in women with polycystic ovarian syndrome[J]. Saudi Med J,2015,36(5):562-567.
[4] Khan HL,Bhatti S,Suhail S,et al. Antral follicle count(AFC) and serum anti-Müllerian hormone(AMH) are the predictors of natural fecundability have similar trends irrespective of fertility status and menstrual characteristics among fertile and infertile women below the age of 40 years[J]. Reprod Biol Endcrin,2019,17(1):20.
[5] Al-Rawi Safana A,Saleh Basil O,Al-Naqqash Manwar A. Serum anti-müllerian hormone levels in evaluation of chemotherapy effect on ovarian reserve in women with breast cancer. A follow-up study[J]. Saudi Med J,2018,39(7):733-735.
[6] Josso N. Anti-Müllerian hormone:a look back and ahead[J]. Reproduction(Cambridge,England),2019,158(6):F81-F89.
[7] Brodin T,Hadziosmanovic N,Berglund L,et al. Comparing four ovarian reserve markers-associations with ovarian response and live births after assisted reproduction[J]. Acta Obstet Gynecol Scand,2015,94(10):1056-1063.
[8] 李肖然,朱小凤.不同指标对IVF-ET患者卵巢反应性的预测价值[J].中国妇幼健康研究,2017,28(12):1688-1691.
[9] 于春梅,戴秀亮,曹芳,等.PPOS方案对基础FSH/LH不同的卵巢功能减退患者IVF-ET结局的研究[J].重庆医学,2019,48(15):2562-2565.
[10] 杨冬梓,何钻玉.卵泡刺激素/黄体生成素比值与卵巢反应性的关系[J].生殖医学杂志,2012,21(2):133-136.
[11] Huber M,Hadziosmanovic N,Berglund L. et al. Using the ovarian sensi-tivity index to define poor,normal,and high response after controlled ovarian hyperstimulation in the long gonadotropin-releasing hormone-agonist protocol:suggestions for a new principle to solve an old problem[J]. Fertil Steril,2013,100(5):1270-1276,e3.
[12] Özkan ZS. Ovarian stimulation modalities in poor responders[J]. Turk J Medi Sci,2019,49(4):959-962.
[13] Arat Ö,Derya D,Özkan ZS,et al. What is the effect of the early follicular phase FSH/LH ratio on the number of mature oocytes and embryo development?[J]. Turk J Med,2020,50(2):420-425.
[14] Zhou SJ,Zhao MJ,Li C,et al. The comparison of evaluative effectiveness between antral follicle count/age ratio and ovarian response prediction index for the ovarian reserve and response functions in infertile women[J]. Medicine,2020,99(36):e21979.
[15] Alviggi C,Conforti A,Esteves SC,et al. Understanding ovarian hypo-response to exogenous gonadotropin in ovarian stimulation and its new proposed marker-the follicle-to-oocyte(FOI) index[J]. Frontiers in Endocrinol,2018,(9):589.
[16] Scheinhardt MO,Lerman T,König IR,et al. Performance of prognostic modelling of high and low ovarian response to ovarian stimulation for IVF[J]. Hum Reprod(Oxford,England),2018,33(8):1499-1505.
[17] Kumbak B,Oral E,Kahraman S,et al. Young patients with diminished ovarian reserve undergoing assisted reproductive treatments:a preliminary report[J]. Reprod Biomed Online,2005,11(3):294-299.
[18] Polyzos NP,Tournaye H,Guzman L,et al. Predictors of ovarian response in women treated with corifollitropin alfa for in vitro fertilization/intracytoplasmic sperm injection[J]. Fertil Steril,2013,100(2):430-437.
[19] Mutlu MF,Erdem M,Erdem A,et al. Antral follicle count determines poor ovarian response better than anti-müllerian hormone but age is the only predictor for live birth in in vitro fertilization cycles[J]. J Assist Reprod Genet,2013,30(5):657-665.
[20] Brodin T,Bergh T,Berglund L,et al. Menstrual cycle length is an age-independent marker of female fertility:results from 6271 treatment cycles of in vitro fertilization[J]. Fertil Steril,2008,90(5):1656-1661.
[21] Kofinas Jason D,Elias Rony T. Follicle-stimulating hormone/luteinizing hormone ratio as an independent predictor of response to controlled ovarian stimulation[J]. Womens Health(Lond),2014,10(5):505-509.
[22] Liang X,Zhuang G,Zhou C. The predication of ovarian response in control ovarian hyperstimulation by the ratio of basal FSH and LH level[J]. Zhonghua Yi Xue Za Zhi,2001,81(13):819-821.
[23] Shaeer E,Maged AM,Shaheen D,et al. FSH/LH ratio as a predictor of the IVF outcome in young women[J]. OJOG,2018,8(10):817-825.
[24] Prasad S,Gupta T,Divya A. Correlation of the day 3 FSH/LH ratio and LH concentration in predicting IVF outcome[J]. J Reprod Infertil,2013,14(1):23-28.
[25] Huang Y,Li JY,Zhang F,et al. Factors affecting the live-birth rate in women with diminished ovarian reserve undergoing IVF-ET[J]. Arch Gynecol Obstet,2018,298(5):1017-1027.
[26] Vicdan K,Isik AZ. Low day 3 luteinizing hormone values are predictive of reduced response to ovarian stimulation[J]. Hum Reprod(Oxford,Eng-land),1999,14(3):863-864.
[27] Matvere A,Teino I,Varik I,et al. FSH/LH-dependent upregulation of ahr in murine granulosa cells is controlled by PKA signaling and involves epigenetic regulation[J]. Int J Mol Sci,2019,20(12):3068.
[28] Selcuk S,Emre BB,Cetin K,et al. Comparison of ovarian responsiveness tests with outcome of assisted reproductive technology-a retrospective analysis[J]. Arch Med Sci,2018,14(4):851-859.