妊娠期高血压属于一种妊娠期特有的疾病,此病的临床症状多表现为在妊娠20周之后患者出现蛋白尿、高血压、水肿等,且严重的威胁着母婴生命安全[1]。目前随着临床上对妊娠期高血压的不断深入研究发现,在此病的发生过程中胎盘功能障碍发挥着重要的作用,在整个妊娠过程中,胎盘滋养细胞增殖、凋亡情况不仅会影响胎盘的生理功能,还在一定程度上影响着整个妊娠过程中母婴安全和妊娠结局[2]。目前临床上对于妊娠期高血压的具体发病机制尚不完全明确,但部分研究认为,此病的发生与微小RNA相关,微小RNA为内源性单链小RNA,其经多种途径参与妊娠期高血压的发生[3]。基于上述研究背景,现分析沉默微小RNA-26b(Micro RNA-26b,miR-26b)对妊娠期高血压胎盘滋养细胞增殖、凋亡及PI3K/Akt通路的影响,旨在为临床上妊娠期高血压的研究提供新方向。
1 材料与方法
1.1 材料 研究细胞:人胎盘滋养细胞株HTR-8/SV-neo购自山东大学齐鲁医院临床基础研究所。本研究经医院伦理委员会批准。
主要试剂:N-硝基-L-精氨酸甲酯(Sigma公司);miR-26b过表达质粒、miR-26b沉默质粒构建(上海吉玛公司);Lipofectamine 2000试剂盒(Invitrogen公司);小鼠抗大鼠PI3K抗体、兔抗大鼠p-PI3K抗体(深圳市豪地华拓生物科技有限公司);兔抗人Akt抗体、兔抗人p-Akt抗体(深圳欣博盛生物科技有限公司);小鼠抗大鼠Bcl-2抗体、兔抗大鼠Bax抗体(武汉益普生物科技有限公司)。
1.2 方法
1.2.1 N-硝基-L-精氨酸甲酯诱导胎盘滋养细胞构建使用N-硝基-L-精氨酸甲酯诱导胎盘滋养细胞模拟妊娠期高血压微环境,将所购买的人胎盘滋养细胞株HTR-8/SV-neo放置于含有10%胎牛血清的RPMI 1640培养基中,在温度为37 ℃、5% CO2的培养箱中进行培养,培养至细胞密度在80%左右时,使用100 μmol/L的N-硝基-L-精氨酸甲酯进行干预,干预培养48 h后收集细胞,做后续试验。
1.2.2 细胞转染 查找miR-26b序列,构建miR-26b过表达质粒、miR-26b沉默质粒,由上海吉玛公司设计并合成,miR-26b过表达质粒引物:5′-UUCAAGUAAUUCAGGAUAGGU-3′,miR-26b沉默质粒引物:5′-ACCUAUCCUGAAUUACU-UGAA-3′。将所培养的细胞分为3组,即为N-硝基-L-精氨酸甲酯诱导胎盘滋养细胞后不做任何处理的空白组、N-硝基-L-精氨酸甲酯诱导胎盘滋养细胞后做miR-26b过表达质粒转染的过表达组、N-硝基-L-精氨酸甲酯诱导胎盘滋养细胞后做miR-26b沉默质粒转染的沉默组,将所构建的miR-26b过表达质粒、miR-26b沉默质粒采用Lipofectamine 2000试剂盒转染至过表达组、沉默组细胞中。转染24 h后观察细胞变化。
1.2.3 细胞增殖的检测 使用MTT比色法测定,将所测定的细胞浓度进行调整,调整浓度为3×104个/mL,上述操作完成后将所测定的细胞在96孔板中接种,每孔中加入200 μL的细胞悬液培养24、48、72 h后(培养环境为37 ℃、5%CO2)将10 μL MTT试剂加入,孵育4 h,使用酶标仪测定OD值,计算增殖率。细胞增殖率=(检测的细胞组OD值/空白组OD值)×100%。重复测量5次,取均值。
1.2.4 细胞凋亡检测细胞凋亡情况 使用TUNEL法测定,将所培养的细胞做洗涤、DAPI染色封片后的细胞核分别呈现为蓝色荧光、绿色荧光,其中蓝色荧光表示阴性细胞数,绿色荧光表示阳性细胞数,使用荧光显微镜观察细胞凋亡情况,细胞凋亡指数=阳性细胞数/总细胞数×100%。重复测量5次,取均值。
1.2.5 细胞PI3K/Akt通路蛋白检测细胞磷酸肌醇3激酶/蛋白激酶B(phosphoinositide-3 kinase/protein kinase B,PI3K/Akt)信号通路蛋白表达情况使用Western Blot法测定,对所培养的细胞做离心、蛋白提取,提取完成后使用BCA做蛋白定量测定,将所提取的50 μg蛋白加入至2×SDS凝胶缓冲液中,做电泳、转膜、取膜、固定、封闭处理,将1∶1 000比例的TBST稀释的PI3K、p-PI3K、Akt、p-Akt、Bcl-2、Bax一抗,在温度为4 ℃的环境下孵育过夜,TBST重复做3次洗膜处理,加入1∶10 000 TBST稀释的二抗,摇动孵育60 min,TBST重复做3次洗膜处理,使用DAB做显色处理,分析蛋白表达情况。以GAPDH蛋白为内参。重复测量5次,取均值。
1.3 统计学方法 应用SPSS 21.0统计软件分析数据,计量资料比较采用单因素方差分析、SNK-q检验,组内不同时间点比较进行重复测量的方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 3组细胞miR-26b表达量比较 与空白组相比过表达组miR-26b表达量升高,沉默组miR-26b表达量降低,差异有统计学意义(P<0.05),说明miR-26b转染成功。见表1。
表1 3组细胞miR-26b表达量比较
Table 1 Comparison of miR-26b expression in three groups ![]()

组别miR-26b表达量空白组 1.25±0.36 过表达组2.29±0.78* 沉默组 0.57±0.10*#F值8.633P值<0.001
*P值<0.05与空白组比较 #P值<0.05与过表达组比较(SNK-q检验)
2.2 3组细胞增殖情况比较 过表达组24 h、48 h、72 h细胞增殖率逐渐降低,沉默组逐渐升高,3组在组间、时点间、组间·时点间差异均有统计学意义(P<0.05)。见表2。
表2 3组细胞增殖情况比较
Table 2 Comparison of cell proliferation in three groups ![]()
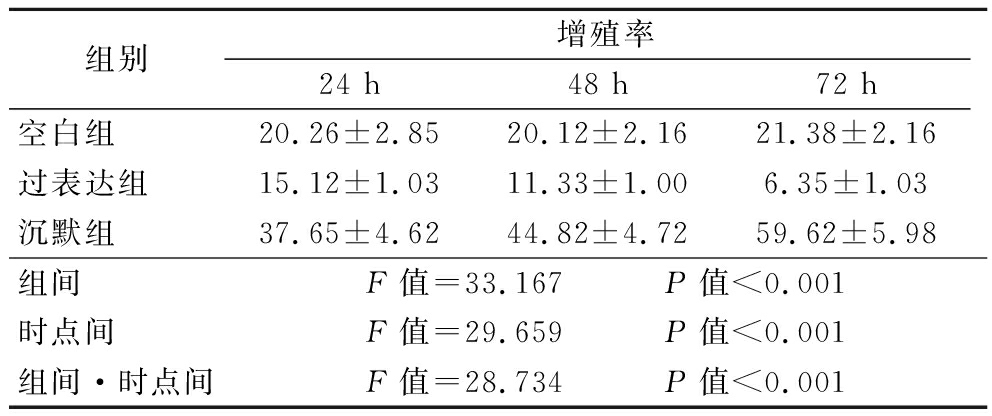
组别增殖率24 h48 h72 h空白组 20.26±2.8520.12±2.1621.38±2.16过表达组 15.12±1.0311.33±1.006.35±1.03沉默组 37.65±4.6244.82±4.7259.62±5.98组间 F值=33.167 P值<0.001时点间 F值=29.659 P值<0.001组间·时点间F值=28.734 P值<0.001
2.3 3组细胞凋亡情况比较 TUNEL法检测细胞凋亡所获得的图像显示,空白组细胞核绿色荧光占比低于蓝色荧光占比,有细胞碎片,细胞存在凋亡现象;过表达组细胞凋亡数量明显升高,其细胞核多为绿色荧光,细胞核破裂,有细胞碎片;沉默组有少量细胞凋亡,细胞核多为蓝色荧光。见图1。与空白组相比,过表达组细胞凋亡率升高,沉默组降低,差异具有统计学意义(P<0.05);与过表达组相比,沉默组细胞凋亡率降低,差异有统计学意义(P<0.05)。见表3。
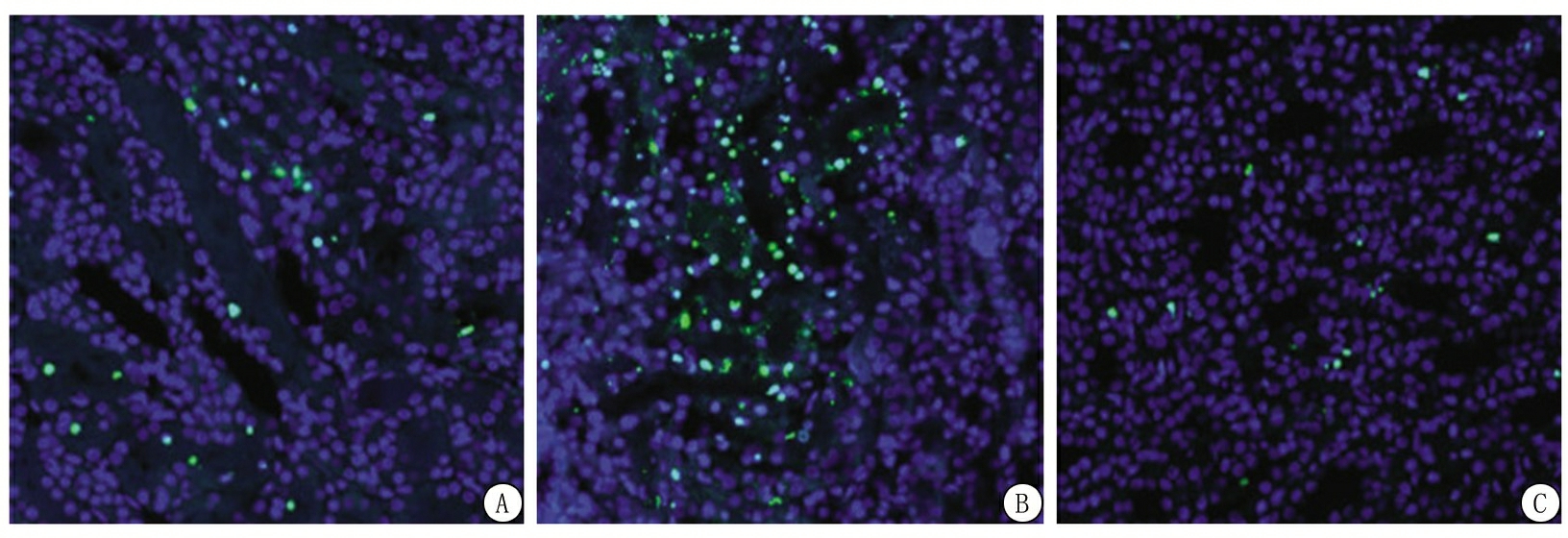
图1 细胞凋亡TUNEL图(× 40)
A.空白组;B.过表达组;C.沉默组
Figure 1 TUNEL of apoptosis(× 40)
表3 3组细胞凋亡情况比较
Table 3 Comparison of apoptosis in three groups ![]()

组别凋亡率空白组 38.36±2.13 过表达组52.59±4.59 沉默组 10.25±1.00*#F值56.666P值<0.001
*P值<0.05与空白组比较 #P值<0.05与过表达组比较(SNK-q检验)
2.4 3组细胞PI3K/Akt通路蛋白表达量比较 与空白组相比,过表达组PI3K、p-PI3K、Akt、p-Akt、Bcl-2蛋白表达量降低,Bax蛋白表达量升高,差异具有统计学意义(P<0.05);与空白组相比,沉默组PI3K、p-PI3K、Akt、p-Akt、Bcl-2蛋白表达量升高,Bax蛋白表达量降低,差异有统计学意义(P<0.05);与过表达组相比,沉默组PI3K、p-PI3K、Akt、p-Akt、Bcl-2蛋白表达量升高,Bax蛋白表达量降低,差异有统计学意义(P<0.05)。见表4,图2。
表4 3组细胞PI3K/Akt通路蛋白表达量比较
Table 4 Comparison of PI3K/Akt pathway protein expression in cells among three groups ![]()

组别PI3Kp-PI3KAktp-AktBcl-2Bax空白组 1.11±0.131.15±0.121.20±0.151.22±0.181.52±0.221.16±0.21过表达组0.52±0.15*0.46±0.10*0.79±0.15*0.63±0.12*0.64±0.13*2.35±0.49*沉默组 2.16±0.28*#1.97±0.21*#2.11±0.34*#2.06±0.29*#2.19±0.58*#0.52±0.11*#F值16.13416.08211.61511.6745.12312.806P值<0.001<0.001<0.001<0.001<0.001<0.001
*P值<0.05与空白组比较 #P值<0.05与过表达组比较(SNK-q检验)
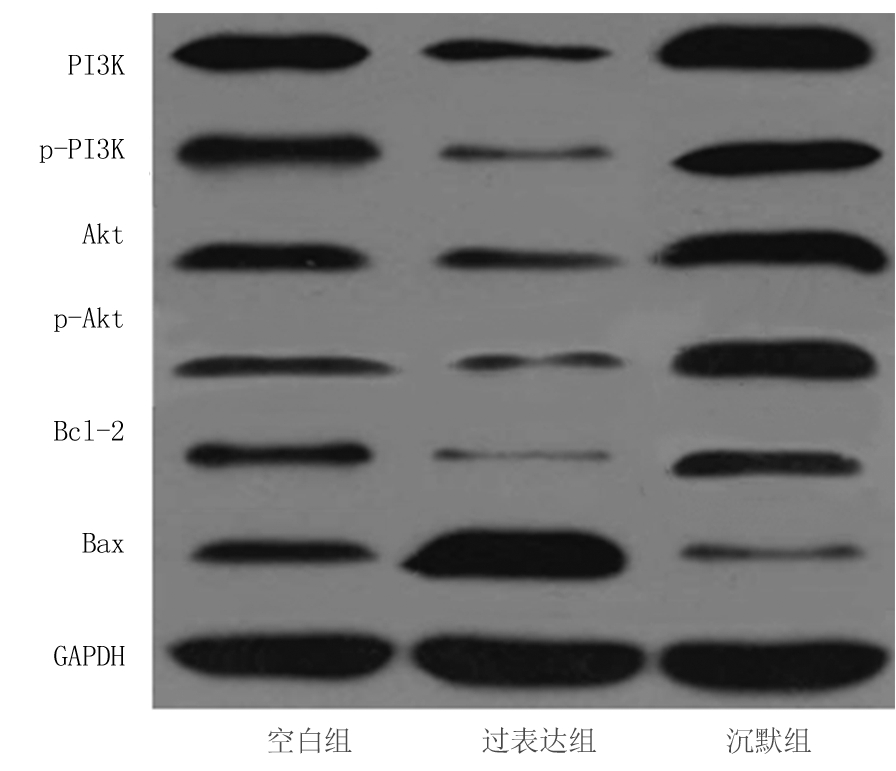
图2 Western Blot法测定PI3K/Akt通路蛋白的Western blot图
Figure 2 Western Blot diagram of PI3K/Akt pathway protein detected by Western blot
3 讨 论
妊娠期高血压在妊娠期较为常见,目前对于此病的确切诱发机制尚不完全明确,但就目前研究来说,此病的发生与多种因素相关,包括血管内皮损伤、机体免疫异常、胰岛素抵抗、胎盘缺血、氧化应激等[4-5]。有研究显示,胎盘滋养细胞增殖、凋亡与胎盘形成、胚胎生长发育密切相关,在胚胎着床后来自于绒毛末端的细胞滋养细胞进行增殖,其经增殖作用所产生的滋养细胞在蜕膜基底层固定后侵入至蜕膜螺旋动脉中,参与血管重塑的过程,最终建立起正常的子宫胎盘血供[6]。但在胎盘滋养细胞出现异常的增殖和凋亡时,会在一定程度上损伤正常的子宫胎盘血供,进而作用于子宫胎盘循环、阻碍胎盘形成,最终导致妊娠期高血压、胎儿生长受限的发生[7-8]。综合上述分析,胎盘滋养细胞增殖、凋亡与妊娠期高血压密切相关,可能改善异常增殖、凋亡来改善妊娠期高血压症状,本研究分析沉默miR-26b对妊娠期高血压胎盘滋养细胞增殖、凋亡及PI3K/Akt通路的影响,以改善胎盘滋养细胞增殖、凋亡异常行为,修复损伤的胎盘组织。
微小RNA是近年来发现的长度大约为22nt的内源性非编码单链小RNA,广泛存在于多种生物体中,经过与靶mRNA的碱基产生特异性配对作用而发挥其降解靶mRNA、抑制翻译的作用,经上述作用后调控基因转录后的表达,参与机体一系列生理病理过程,包括细胞生物学行为(生长、增殖、凋亡)、恶性肿瘤、炎症性疾病、内分泌疾病等[9-10]。miR-26b属于微小RNA家族成员之一,其定位于CTDSP1基因的第4个内含子区域,无独立的启动子,其广泛表达与肿瘤细胞、脂肪细胞、绒毛外滋养层细胞等多种细胞中,目前已经证实miR-26b参与恶性肿瘤发生、子痫前期的发生发展中[11-13]。冀琛[14]在其研究中发现,妊娠期高血压疾病患者血清miR-26b表达量升高。魏娜等[15]均在其研究中发现,miR-26b在妊高症患者胎盘中高表达。基于此,本文研究了沉默miR-26b对胎盘滋养细胞凋亡的影响,结果发现沉默miR-26b后发现胎盘滋养细胞凋亡明显被抑制,而增殖率明显增加,此结果提示着,miR-26b可能经诱导胎盘滋养细胞凋亡、增殖异常发挥促进妊娠期高血压发生的作用,沉默其表达可改变上述异常情况,最终发挥其改善妊娠期高血压症状的作用。
PI3K/Akt通路在临床上被认为是调控细胞增殖、凋亡的经典信号通路之一,PI3K由一个催化亚单位p110和调节亚单位p85所组成的磷脂激酶,其具有脂类激酶活性和蛋白激酶活性。Akt为丝氨酸/苏氨酸蛋白激酶,其与蛋白激酶C、蛋白激酶A具有较高的同源性,在临床上被称为蛋白激酶B[16-18]。PI3K是生长因子所激活的RTKs和GPCRs重要的下游信号分子,当其被活化后会激活Akt,促使磷酸化的Akt生成,而被活化的Akt经一系列的级联结果参与细胞增殖、凋亡过程[19-21]。本研究结果显示,经miR-26b沉默处理的细胞,PI3K、p-PI3K、Akt、p-Akt、Bcl-2蛋白表达量升高,Bax蛋白表达量降低,此结果提示着,miR-26b沉默可能经激活PI3K/Akt通路发挥其抑制妊娠期高血压胎盘滋养细胞凋亡,促进增殖的作用。
综上所述,miR-26b沉默处理的妊娠期高血压胎盘滋养细胞凋亡明显被抑制,增殖率增加,其作用机制可能与激活PI3K/Akt通路相关。
[1] Wisner K. Gestational hypertension and preeclampsia[J]. MCN Am J Matern Child Nurs,2019,44(3):170.
[2] Aoki A,Nakashima A,Kusabiraki T,et al. Trophoblast-specific conditional Atg7 knockout mice develop gestational hypertension[J]. Am J Pathol,2018,188(11):2474-2486.
[3] Murakami Y,Miura K,Sato S,et al. Reference values for circulating pregnancy-associated microRNAs in maternal plasma and their clinical usefulness in uncomplicated pregnancy and hypertensive disorder of pregnancy[J]. J Obstet Gynaecol Res,2018,44(5):840-851.
[4] Hua X,Zhang J,Guo Y,et al. Effect of folic acid supplementation during pregnancy on gestational hypertension/preeclampsia: a systematic review and meta-analysis[J]. Hypertens Pregnancy,2016,35(4):447-460.
[5] Shen M,Smith GN,Rodger M,et al. Comparison of risk factors and outcomes of gestational hypertension and pre-eclampsia[J]. PLoS One,2017,12(4):e0175914.
[6] 陈欣,付振琳,杨菁.植入后胎盘滋养细胞调节的研究进展[J].生殖医学杂志,2020,29(7):963-967.
[7] Huppertz B. Traditional and new routes of trophoblastinvasion and their implications for pregnancy diseases[J]. IntJ Mol Sci,2019,21(1):289.
[8] 王卉菲,郭宇婧,王敏,等.妊娠期高血压疾病胎盘浅着床的研究进展[J].国际妇产科学杂志,2020,47(2):165-168.
[9] Kan C,Cao J,Hou J,et al. Correlation of miR-21 and BNP with pregnancy-induced hypertension complicated with heart failure and the diagnostic value[J]. Exp Ther Med,2019,17(4):3129-3135.
[10] Gao Z,Wang L,Wang J,et al. Molecular mechanism of miR-181b in heart disease due to pregnancy-induced hypertension syndrome[J]. ExpTher Med,2017,14(4):2953-2959.
[11] 王义蓉,孟运莲.子痫前期胎盘中MiR-26b表达的变化趋势及其下游靶基因的研究[J].海南医学院学报,2018,24(2):228-230,234.
[12] 郝葡萄,宋瑜,王晓娟.MiR-26b在子痫前期胎盘中差异表达的临床意义[J].中国妇产科临床杂志,2017,18(3):218-220.
[13] Gonz lez-Arriagada WA,Olivero P,Rodríguez B,et al. Clinicopathological significance of miR-26,miR-107,miR-125b,and miR-203 in head and neck carcinomas[J]. Oral Dis,2018,24(6):930-939.
lez-Arriagada WA,Olivero P,Rodríguez B,et al. Clinicopathological significance of miR-26,miR-107,miR-125b,and miR-203 in head and neck carcinomas[J]. Oral Dis,2018,24(6):930-939.
[14] 冀琛.妊娠期高血压疾病患者血清miR-26b和nesfatin-1的表达及临床意义[J].中国妇幼保健,2018,33(24):5947-5950.
[15] 魏娜,李江丽,宋亚南.妊高症患者胎盘MiR-26b和Nkx2-5的表达水平及临床意义[J].医学研究杂志,2019,48(1):99-102,173.
[16] Li Z,Zhou G,Jiang L,et al. Effect of STOX1 on recurrent spontaneous abortion by regulating trophoblast cell proliferation and migration via the PI3K/AKT signaling pathway[J]. J Cell Biochem,2018,120(5):8291-8299.
[17] Chen J,Yue C,Xu J,et al. Downregulation of receptor tyrosine kinase-like orphan receptor 1 in preeclampsia placenta inhibits human trophoblast cell proliferation,migration,and invasion by PI3K/AKT/mTOR pathway accommodation[J]. Placenta,2019,82:17-24.
[18] Wang R,Wang W,Ao L,et al. Benzo[a]pyrene-7,8-diol-9,10-epoxide suppresses the migration and invasion of human extravilloustrophoblast HTR-8/SVneo cells by down-regulating MMP2 through inhibition of FAK/SRC/PI3K/AKT pathway[J]. Toxicology,2017,386:72-83.
[19] 李琴,谢莹莺.胰岛素生长因子2甲基化对高糖诱导滋养层细胞凋亡及PI3K/Akt通路的影响[J].安徽医科大学学报,2020,55(5):665-670.
[20] 申萌萌,刘雁峰,柳井杜莎,等.PI3K/Akt/eNOS信号通路与胚胎植入和妊娠维持[J].中国生育健康杂志,2017,28(5):489-492.
[21] 张孝丽,车立群,吴红敬,等.FOXO3a通过PI3K/AKT信号通路介导炎症因子TNF-α抑制滋养细胞的增殖、侵袭及促进细胞发生凋亡[J].免疫学杂志,2020,36(6):482-489.