Stevens-Johnson综合征 (Stevens-Johnson syndrome,SJS)和中毒性表皮坏死松解症(toxic epidermal necrolysis,TEN)是免疫介导的严重的皮肤黏膜不良反应,常由药物和感染引起。SJS/TEN被认为是同一疾病的不同阶段,SJS、SJS/TEN重叠和TEN之间的差异由皮肤脱落程度界定[1]:SJS定义为皮肤剥脱面积占体表面积(body surface area,BSA)比例<10%,TEN定义为BSA比例>30%,SJS/TEN重叠定义为BSA比例10%~30%。SJS/TEN虽然罕见,但病死率高,患儿表现为发热(前驱症状)和广泛的表皮坏死、脱落。目前关于SJS和TEN的研究主要集中在成年人,儿童相关数据较少,本研究旨在分析河北省儿童群体中SJS、TEN和SJS/TEN重叠的致敏药物、治疗、并发症以及预后等特点,为早期识别、有效治疗及改善预后提供帮助。
1 资 料 与 方 法
1.1 一般资料 纳入2010年1月—2020年1月河北省儿童医院收治的SJS患儿32例、SJS/TEN重叠患儿28例和TEN患儿25例。纳入标准:①典型皮疹,靶样红斑,扩散融合成片,迅速进展为松弛的水疱,表皮剥脱;②累及2处及以上黏膜组织;③尼氏征阳性;④皮疹不典型者行皮肤活组织检查提示表皮全层坏死。排除标准:①自身免疫性大疱性疾病;②葡萄球菌烫伤皮肤综合征;③其他类型的严重药疹患儿。
1.2 方法 回顾性分析所有患儿的住院病历,从医疗记录中收集性别、入院时年龄、发病至入院时间、受累皮肤面积(包括水疱、部分或完全剥离的皮肤和尼氏征阳性的皮肤,不包括未剥离区域)、可疑药物过敏史、感染病原、入院时合并症、住院后并发症、入院第1~3天的中毒性表皮坏死松解症严重程度评分(severity-of-illness score for toxic epidermal necrolysis,SCORTEN)及治疗情况。
1.3 统计学方法 应用SPSS 21.0统计软件分析数据。计量资料比较采用t检验,计数资料比较采用χ2检验,等级资料比较采用秩和检验。P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料 2010年1月—2020年1月我院确诊的共85例,其中32例符合SJS标准,28例符合SJS/TEN重叠标准,25例符合TEN标准。男性56例(65.9%),女性29例(34.1%),发病年龄2~168个月,平均(59±43)个月,1~12个月龄9例;13~36个月龄 24例;37~72个月龄 25例;73~168个月龄27例;入院时有发热42例(49.4%),黏膜受累和尼氏征阳性者85例(100%),其中以口腔黏膜(89.6%)和眼黏膜(87.1%)最常见,外生殖器及肛周黏膜受累者少见。发病至入院时间为0~8 d,平均(3.0±1.9)d,住院时间2~73 d,平均(15.0±10.6)d,皮肤坏死面积越大,住院时间越长。见表1。
表1 SJS、SJS/TEN和TEN的一般资料
Table 1 General information of SJS, SJS/TEN and TEN
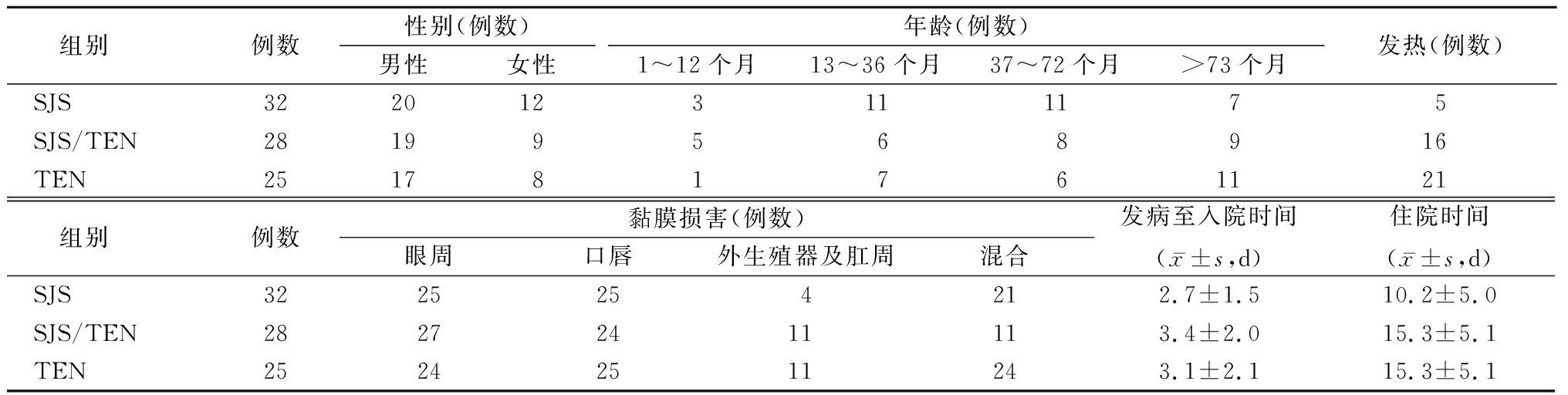
组别例数性别(例数)男性女性年龄(例数)1~12个月13~36个月37~72个月>73个月发热(例数)SJS3220123111175SJS/TEN28199568916TEN251781761121组别例数黏膜损害(例数)眼周口唇外生殖器及肛周混合发病至入院时间(x-±s,d)住院时间(x-±s,d)SJS3225254212.7±1.510.2±5.0SJS/TEN28272411113.4±2.015.3±5.1TEN25242511243.1±2.115.3±5.1
2.2 致敏药物 为了确认药物和皮疹的因果关系,采用了Alden评分[2]。48例存在明确或可疑的致敏药物,以抗生素(27/85,31.7%),中成药(26/85,30.6%),抗惊厥药(12/85,14.1%),非甾体抗炎药(15/85,17.6%)多见,其中29例在发生SJS、TEN前使用2种或2种以上药物。在皮损出现前可疑致敏药物平均使用了13 d(1~45 d),皮损出现到停用可疑药物时间间隔平均为1 d。当致敏药物为抗惊厥药时,患儿在用药平均33 d后出现皮损,而抗生素和非甾体抗炎药引起皮损的平均时间分别为4 d和2 d。抗生素引起的27例中,头孢类药物引起的有15例(17.6%)。12例抗惊厥药中,丙戊酸钠最常见(5例,5.9%)。见表2。
表2 SJS、SJS/TEN和TEN的致敏药物
Table 2 Allergenic drugs for SJS, SJS/TEN and TEN (例数)
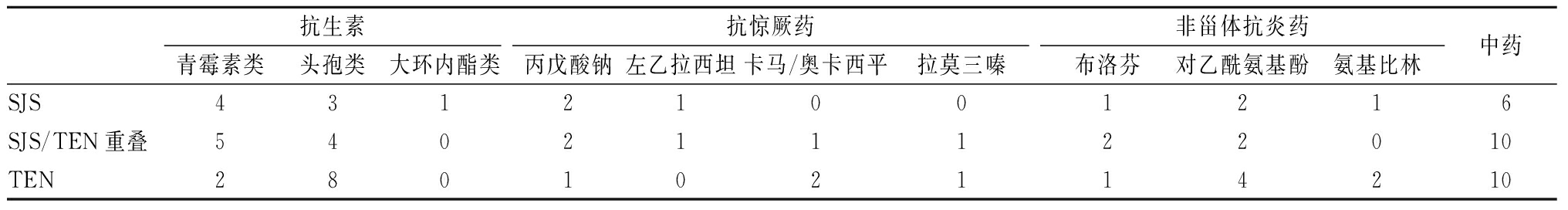
抗生素青霉素类头孢类大环内酯类抗惊厥药丙戊酸钠左乙拉西坦卡马/奥卡西平拉莫三嗪非甾体抗炎药布洛芬对乙酰氨基酚氨基比林中药SJS43121001216SJS/TEN重叠540211122010TEN280102114210
2.3 感染病原 33例排除药物因素,但存在明确的感染,以肺炎支原体(21例,24.7%)为主,疱疹病毒(9例,10.6%)为第二常见病原。
2.4 合并疾病 36例(42.4%)患儿入院时至少合并一种疾病。最常见的疾病是肺炎(28例,32.9%)、水痘(6例,7.1%)、癫痫(12例,14.1%),预后差的患儿多合并血液系统疾病,如白血病(2例,2.4%),淋巴瘤(1例,1.2%)。
2.5 病死率分析 SCORTEN预测的预期病死率使用以下公式计算:p(death)=elogit/(1+elogit),with logit=-4.448+1.237(SCORTEN)[3]。将实际病死率与标准化病死率分析的预测率进行比较。入院第1天和第3天计算SCORTEN评分以判断预后。入院第1天SCORTEN评分为(1.9±1.2)分,总预测病死率为10.9%,实际病死率(8例,9.4%);1例患儿因病情危重,入院后48 h内死亡,对84例患儿计算第3天的SCORTEN评分为(1.6±1.0)分,总预测病死率为7.8%。
2.6 并发症 32例患儿(37.6%)在入院期间至少有一项并发症。最常见的并发症是感染(26例,30.6%),其中皮肤感染(12例,14.1%)和下呼吸道感染(8例,9.4%)和最常见,合并脓毒症或感染性休克(4例,4.7%),尿路感染(2例,2.4%)。其他并发症包括肝损伤(11例,12.9%)、肾损伤(4例,4.7 %)和电解质紊乱(15例,17.6%)。见表3。
表3 SJS、SJS/TEN和TEN并发症
Table 3 Comparison of complications among SJS, SJS/TEN and TEN (例数)

组别 例数感染下呼吸道皮肤脓毒症或感染性休克尿路感染肝损伤肾损伤电解质紊乱SJS320100200SJS/TEN重叠282311405TEN2568315410
2.7 治疗 除了支持性治疗外,主要的全身治疗包括皮质类固醇(corticosteroids,Cs)或静脉注射免疫球蛋白(intravenous immunoglobulin,IVIG)。其中5例水痘患儿存在Cs禁忌,且因为费用问题未使用IVIG。在入院后72例患儿接受甲泼尼松龙琥珀酸钠静脉注射(Cs),疗程的中位数为7 d,总量的中位数为11 mg/kg,其中单纯给予Cs者35例。IVIG 45例,静脉注射丙种球蛋白总剂量1~4 g/kg,持续滴注2~5 d,其中单纯给予IVIG治疗者8例。接受Cs+IVIG联合治疗37例。结果发现,Cs+IVIG组病死率低于单纯Cs组,差异有统计学意义(P<0.05),见表4。开始治疗后,大部分患儿(83.3%)在1~10 d内发生皮损停止进展。
表4 单纯Cs组、单纯IVIG组和Cs+IVIG组预后比较
Table 4 Comparison of prognosis among simple Cs group,IVIG group and Cs+IVIG group (例数)
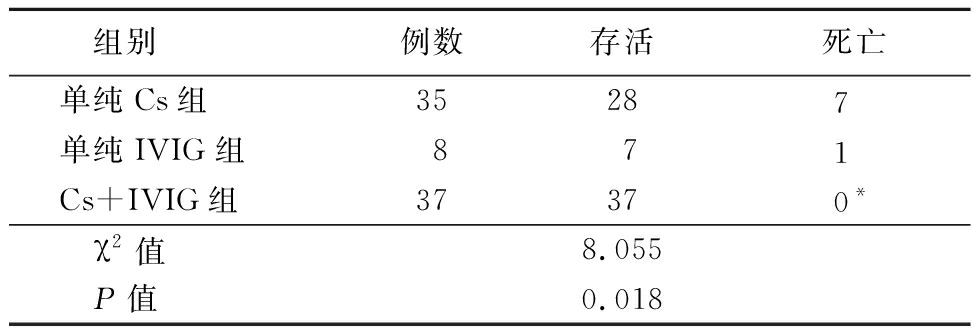
组别例数存活死亡单纯Cs组35287 单纯IVIG组871 Cs+IVIG组37370* χ2值8.055 P值0.018
*P值<0.05与单纯Cs组比较(χ2检验)
2.8 预后 共有77例患儿康复出院,死亡8例(SJS/TEN重叠2例,TEN 6例),病死率为9.4%。死亡者入院第1天SCORTEN评分高于存活者,差异有统计学意义(P<0.05)。见表5。
表5 死亡者和存活者SCORTEN评分比较
Table 5 Comparison of SCORTEN score of survival group and death group ![]() 分)
分)
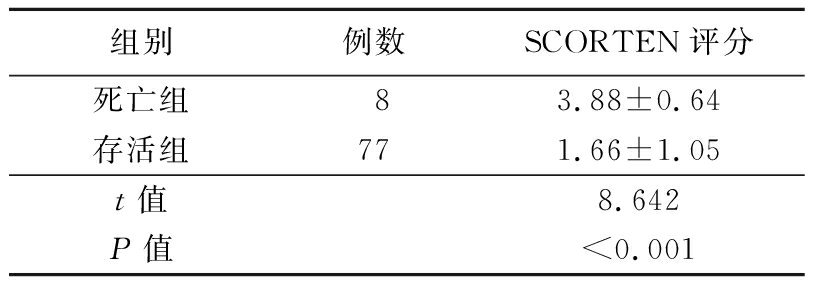
组别例数SCORTEN评分死亡组83.88±0.64存活组771.66±1.05t值8.642P值<0.001
3 讨 论
SJS和TEN是罕见但严重的皮肤黏膜不良反应,代表了同一疾病的不同阶段。据报道,在英国18岁以下儿童发病率为5~6/百万,病死率为5%~10%,幸存者中复发率高达18%[4]。但目前缺乏描述中国儿童SJS、TEN和SJS/TEN重叠患儿临床特征的研究。本研究结果显示,SJS、TEN和SJS/TEN重叠患儿的发病年龄分布广泛,婴儿期患病率最低,幼儿期、学龄前期和青春期儿童患病率差别不大;儿童群体中SJS(32/85)比TEN(25/85)更常见,与成人报道一致[5-6]。
本研究结果显示,药物是引起儿童SJS和TEN的常见原因。常见药物有抗生素、抗惊厥药物及非甾体抗炎药,这同大型成人国内外病例对照研究结果相同[7-8]。虽然导致皮肤损伤的确切机制还不完全清楚,但目前多数研究认为,当暴露于某些类型的药物或药物代谢物时,易患人群对药物组织复合物或感染病原形成的抗原产生免疫反应:细胞毒性CD8+T细胞和自然杀伤细胞被激活,分泌颗粒溶素,诱导角质形成细胞表面Fas配体和Fas凋亡受体相互作用,造成角质形成细胞的凋亡,随后刺激周围组织产生炎症,激活其他免疫细胞产生促炎分子,并下调调节性T细胞,促炎因子及抗炎因子分泌失衡,若炎症反应不断扩大,则引起危及生命的全身效应,导致高病死率。本研究中3例患儿服用卡马/奥卡西平后发生SJS和TEN,与特定人类白细胞抗原(human leukocyte antigen,HLA)等位基因相关的遗传易感性[9]以及免疫受损状态[10]密切相关,与先前文献报道一致[11]。需要警惕的是,由于亚洲人群HLA分型与卡马西平引起皮肤坏死的关系已经明确,新型抗癫痫药及别嘌呤醇将取代卡马西平成为引发的SJS和TEN的常见药物[12]。此外,本研究还发现,中药注射制剂已成为儿童发生SJS和TEN的第二大致敏因素。目前的体外细胞和动物模型已经证实中药注射剂主要通过直接或间接刺激肥大细胞脱颗粒释放组胺、补体系统的激活等致敏[13]。此外中药制剂存在成分复杂、药物制备过程及工艺欠科学、药品内大分子物质超标等本身客观因素,且药物管理不规范,医师使用时不按中医证候辨证施治原则施药、配伍不当、超适应证和超剂量给药[14],以及儿童免疫系统紊乱,代谢器官功能不完善等都是儿童使用中药注射制剂不良反应增加的原因。
为了能够预测表皮坏死松解性疾病的预后,2000年Bastuji-Garin等[3]制定了SCORTEN评分。但是SCORTEN评分是为成年人设计的,包括不适用于儿童的标准,为此Sorrell等[15]设计了儿童SCORTEN评分,界定了不同年龄段儿童异常生命体征范围及化验指标的数值,并以干细胞移植病史替代了年龄这一变量,本研究参照了这一标准。在住院期间,计算患儿第1~3天的SCORTEN评分以评估预后,并帮助决定是否转诊到重症监护病房。18例(21.2%)患儿进入儿童重症监护室,死亡8例(其中SJS/TEN重叠2例,TEN6例),该组病例入院第1天SCORTEN评分均≥3分。这意味着死亡风险为32.4%或更高。SCORTEN评分越高,死亡风险越高。死亡者SCORTEN评分明显高于存活者,差异有统计学意义。认为计算患儿入院72 h内的SCORTEN评分可以指导临床医师做出及时有效的治疗方案及评估预后。
虽然针对SJS和TEN的几种系统治疗方案已经发表,但我国目前尚无标准化的治疗方案。目前临床上应用的药物包括Cs、IVIG和环孢菌素。我科一直将Cs联合IVIG作为SJS和TEN重叠的一线治疗方案,已经证实SJS和TEN患儿体内促炎细胞因子释放增加[16],而Cs通过调节核因子κB的转录,抑制促炎细胞因子的产生[17],此外Cs可以削弱单核/巨噬细胞的功能,减少循环中细胞毒性T淋巴细胞的数量,因此被认为是治疗SJS和TEN过程中必不可少的。IVIG可阻断角质形成细胞的凋亡,已经在SJS和TEN治疗中显示出优势[18]。本研究中,37例Cs+IVIG组;35例单纯Cs组;8例单纯IVIG组,Cs+IVIG组标准化病死率比例最低。此外,单纯Cs组病死率高于Cs+IVIG组,差异有统计学意义,可能与Cs引起的免疫抑制增加后续感染,以及延缓表皮再生有关,故目前Cs的使用仍然存在争议;而单纯IVIG组的存活率与Cs+IVIG组比较差异无统计学意义;表明IVIG的使用与提高存活率有关。
本研究结果显示,12例发生皮肤感染(切口感染率为14.1%),其中SJS 1例,SJS/TEN重叠 3例,TEN 8例,剥脱区皮肤含有坏死皮肤固有成份,对于许多潜在的致病微生物来说,是一个很好的生长介质,带来了切口污染/定植的风险,甚至有可能在脱落区域发展为感染,感染多种病原体,甚至包括耐药的医院菌株,进一步发展为脓毒症甚至脓毒性休克危及生命。
本研究受到2个限制,一是回顾性性质的限制,这阻碍了患儿对进一步并发症的随访。二是本研究仅来自第三级中心,虽然SJS和TEN患病率低,但小样本量限制了分析的广度。
总之,SJS和TEN是罕见且可能致命的皮疹,最常见的原因是药物不良反应,在使用卡马西平或奥卡西平前应常规进行HLA分型检查,尽量避免使用中药注射制剂。及时计算入院72 h内SCORTEN评分对指导治疗和评估预后有重要意义,SCORTEN评分≥3分提示死亡风险增加,建议立即转入重症监护室或者儿童烧伤专科病房,及时给予Cs联合IVIG治疗可降低病死率,加强支持性护理,减少剥脱区皮肤感染等可以有效降低并发症发生率,改善预后。
[1] Bastuji-Garin S,Rzany B,Stern R,et al. Clinical classification of cases of toxic epidermal necrolysis,Stevens-Johnson syndrome,and erythema multiforme[J]. Arch Dermatol,1993,129(1):92-96.
[2] Sassolas B,Haddad C,Mockenhaupt M,et al. ALDEN,an algorithm for assessment of drug causality in Stevens-Johnson Syndrome and toxic epidermal necrolysis:comparison with case-control analysis[J].Clin Pharmacol Ther,2010,88(1):60-68.
[3] Bastuji-Garin S,Fouchard N,Bertocchi M,et al. SCORTEN:a severity-of-illness score for toxic epidermal necrolysis[J]. Invest Dermatol,2000,115(2):149-153.
[4] McPherson T,Exton LS,Biswas S,et al. British association of dermatologists′ guidelines for the management of Stevens-Johnson syndrome/toxic epidermal necrolysis in children and young people,2018[J]. Br J Dermatol,2019,181(1):37-54.
[5] Marxer CA,Frey N,Bodmer M,et al. Survival after Stevens-Johnson syndrome or toxic epidermal necrolysis:a unitedkingdom -based cohort study[J]. J Invest Dermatol,2021,141(5):1349-1351.
[6] Sunaga Y,Kurosawa M,Ochiai H,et al. The nationwide epidemiological survey of Stevens-Johnson syndrome and toxic epidermal necrolysis in Japan,2016-2018[J]. J Dermatol Sci,2020,100(3):175-182.
[7] Yang L,Shou YH,Li F,et al. Retrospective study of 213 cases of Stevens-Johnson syndrome and toxic epidermal necrolysis from China[J]. Burns,2020,46(4):959-969.
[8] Lerch M,Mainetti C,Terziroli Beretta-Piccoli B,et al. Current perspectives on Stevens-Johnson syndrome and toxic epidermal necrolysis[J]. Clin Rev Allergy Immunol,2018,54(1):147-176.
[9] Chang CJ,Chen CB,Hung SI,et al. Pharmacogenetic testing for prevention of severe cutaneous adverse drug reactionsv[J]. Front Pharmacol,2020,11:969.
[10] Tangamornsuksan W,Chanprasert S,Nadee P,et al. HLA genotypes and cold medicine-induced Stevens-Johnson syndrome/toxic epidermal necrolysis with severe ocular complications:a systematic review and meta-analysis[J]. Sci Rep,2020,10(1):10589.
[11] Wang Q,Sun S,Xie M,et al. Association between the HLA-B alleles and carbamazepine-induced SJS/TEN:A meta-analysis[J]. Epilepsy Res,2017,135:19-28.
[12] Bettuzzi T,Ingen-Housz Oro S,Chinchilla Purtillo C,et al. Changing spectrum of suspected drugs of Epidermal Necrolysis:an WHO pharmacovigilance database analysis from 1997 to 2020[J]. J Am Acad Dermatol,2020,17:33007-33013.
[13] 张波,李钦,石晨阳,等.清开灵注射液诱发类过敏反应作用及其机制研究[J].中国现代应用药学,2018,35(7):1031-1035.
[14] 文雯,梁慧慧,余格,等.中药注射剂类过敏反应研究进展[J].湖南中医药大学学报,2020,40(1):117-122.
[15] Sorrell J,Anthony L,Rademaker A,et al. Score of toxic epidermal necrosis predicts the outcomes of pediatric epidermal necrolysis[J]. Pediatr Dermatol,2017,34(4):433-437.
[16] Su SC,Mockenhaupt M,Wolkenstein P,et al. Interleukin-15 is associated with severity and mortality in Stevens-Johnson syndrome/toxic epidermal necrolysis[J]. J Invest Dermatol,2017,137(5):1065-1073.
[17] Cohn LA. Glucocorticosteroids as immunosuppressive agents[J]. Semin Vet Med Surg Small Anim,1997,12(3):150-156.
[18] Emre S. Intravenous immunoglobulin treatment:where do dermatologists stand?[J]. Dermatol Ther,2019,32(3):e12854.