舒适化医疗是近年来研究较热的一个方面,其更为重视对患者整个住院期间的不适感控制,且是临床控制的热点。而老年骨科手术患者作为手术及疾病(创伤)极为突出的一类人群,其疼痛程度相对较高,对患者的围术期生存质量,乃至术后恢复等均极为不利[1-2],因此老年骨科患者围手术期疼痛的控制需求较高。而病房行神经阻滞加术后静脉自控镇痛(patient controlled intravenous analgesia,PCIA)作为更为有效地改善患者围术期舒适度的干预方式,其在老年患者中的应用研究虽可见,但是对于老年骨科手术患者疼痛相关方面及不良应激的影响研究未见。因此,本研究就病房行神经阻滞加术后PCIA对老年骨科患者围手术期疼痛程度及疼痛介质、应激状态的影响进行探究,以为其临床应用提供参考依据,现报告如下。
1 资 料 与 方 法
1.1 一般资料 选取2018年1月—2020年1月老年骨科手术患者90例为研究对象,将其随机分为A组(术后PCIA组)、B组(“鸡尾酒”局部注射镇痛加PCIA组)及C组(病房行神经阻滞加术后PCIA组),每组各30例。A组男性18例,女性12例,年龄为60~75岁,平均(66.3±3.7)岁,手术时间为28~65 min,平均(37.3±5.6)min,其中股骨颈骨折者20例,其他患者10例。B组男性17例,女性13例,年龄61~76岁,平均(66.6±3.6)岁,手术时间29~70 min,平均(38.0±5.5)min,其中股骨颈骨折者21例,其他患者9例。C组男性18例,女性12例,年龄60~77岁,平均(66.5±3.9)岁,手术时间为29~68 min,平均为(37.7±5.3)min,其中股骨颈骨折者20例,其他患者10例。3组一般资料比较差异无统计学意义(P>0.05),具有可比性。
本研究经医院伦理学委员会批准。
纳入标准:男女不限;年龄在60岁及以上者;下肢骨科手术患者;患者和(或)家属对研究知情同意。
排除标准:合并其他部位创伤者;合并代谢性疾病者;精神障碍及认知异常者;凝血障碍者;合并心肝肾等功能异常者。
1.2 方法 3组中同类骨折者的手术方式及麻醉均相同。在此基础上,A组仅于术后进行PCIA,以舒芬太尼100 μg、右美托咪啶100 μg、地塞米松10 mg及托烷司琼10 mg加入生理盐水中,至100 mL,以静脉自控镇痛泵进行术后镇痛;B组进行“鸡尾酒”局部注射镇痛加PCIA,以肾上腺素0.3 mg、酮咯酸30 mg、罗哌卡因400 mg及吗啡5 mg加入70 mL生理盐水中进行局部注射,术后给予PCIA,应用方式与A组相同; C组则进行病房行神经阻滞加术后PCIA,于病房内即进行股神经置管,术前30 min,从置管处注入罗哌卡因(0.2%)15 mL,间隔6 h注入1次,直至术后48 h,另给予PCIA,方式方法与A组相同。
1.3 观察指标 比较3组的术后2 h、4 h、6 h、12 h、24 h及48 h的VAS评分、入院时及术后12 h及48 h血清疼痛介质及应激状态(应激激素及氧化应激)指标。
1.4 检测方法 于入院时及术后12 h、48 h采集3组的外周静脉血,将血标本进行离心,以医用离心机进行离心,离心半径、速度及时间分别为15 cm、3 000 r/min及5min,取血清进行疼痛介质及应激状态(应激激素及氧化应激)指标的检测,其中疼痛介质包括P物质(substance P,SP)及前列腺素E2(prostaglandin E2,PGE2),应激激素包括皮质醇(cortisol,Cor)及血管紧张素Ⅱ(angiotensinⅡ,Ang-Ⅱ),氧化应激指标包括总抗氧化力(total antioxidant capacity,TAC)及超氧化物歧化酶(superoxide dismutase,SOD)。上述方面均采用酶联免疫法试剂盒进行定量检测。
1.5 评价标准 疼痛程度:采用视觉模拟评分法(visual analogue scale,VAS)进行评估,本标准的评分范围为0~10分,其中0分表示无痛,随着分值升高表示疼痛感增强,10分为剧烈疼痛,由患者根据自身的疼痛感受从中选取,其中≤3分、4~6分及7~10分分别表示轻度疼痛、中度疼痛及重度疼痛[3]。
1.6 统计学方法 应用SPSS23.0统计软件分析数据。计量资料比较采用重复测量方差分析、t检验,计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 3组的术后不同时点VAS评分比较 术后2 h、4 h、6 h、12 h、24 h及48 h 3组的VAS评分先升高后降低,且C组的VAS评分显著低于A组及B组,B组则显著低于A组,差异有统计学意义(P<0.05),见表1。
表1 3组的术后2 h、4 h、6 h、12 h、24 h及48h的VAS评分比较
Table 1 Comparison of the VAS scores of three groups at 2 h,4 h,6 h,12 h,24 h and 48 h after operation ![]() 分)
分)
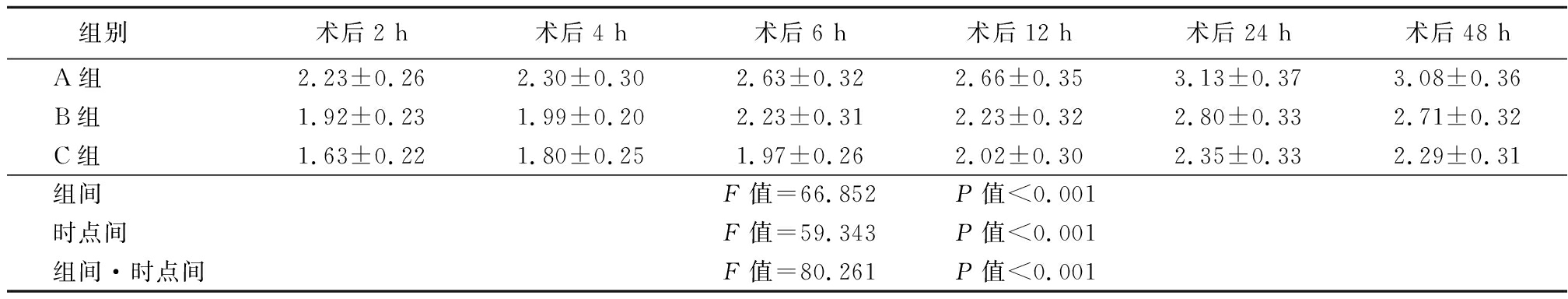
组别 术后2 h术后4 h术后6 h术后12 h术后24 h术后48 hA组 2.23±0.262.30±0.302.63±0.322.66±0.353.13±0.373.08±0.36B组 1.92±0.231.99±0.202.23±0.312.23±0.322.80±0.332.71±0.32C组 1.63±0.221.80±0.251.97±0.262.02±0.302.35±0.332.29±0.31组间 F值=66.852 P值<0.001时点间 F值=59.343 P值<0.001组间·时点间F值=80.261 P值<0.001
2.2 3组入院时及术后12 h及48 h血清疼痛介质指标比较 术后12 h及48 h 3组的血清疼痛介质指标均先升高后降低,且C组的血清疼痛介质指标显著低于A组及B组,B组则显著低于A组。3组组间、时点间、组间·时点间交互作用差异有统计学意义(P<0.05),见表2。
表2 3组入院时及术后12 h及48 h血清疼痛介质指标比较
Table 2 Comparison of the serum pain mediators at admission and 12 h, 48 h after operation ![]()
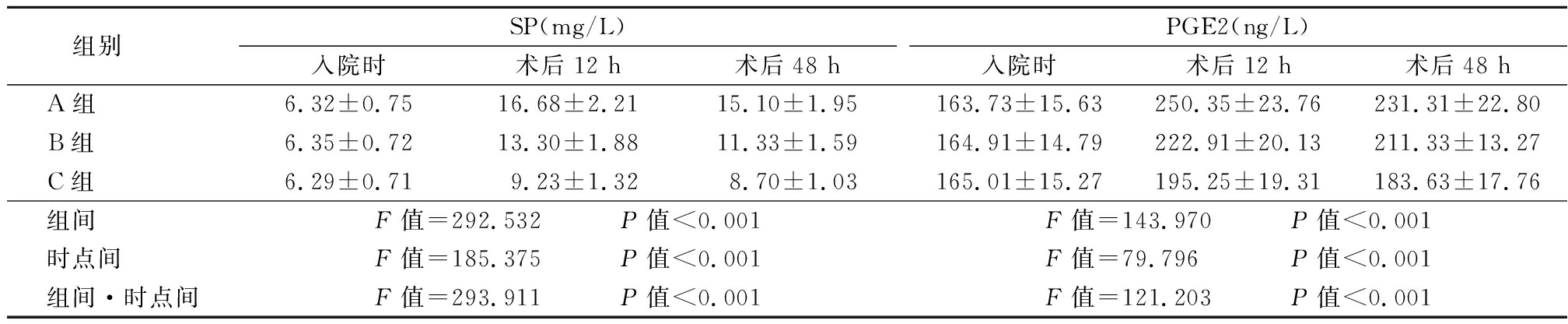
组别 SP(mg/L)入院时术后12 h术后48 hPGE2(ng/L)入院时术后12 h术后48 hA组 6.32±0.7516.68±2.2115.10±1.95163.73±15.63250.35±23.76231.31±22.80B组 6.35±0.7213.30±1.8811.33±1.59164.91±14.79222.91±20.13211.33±13.27C组 6.29±0.719.23±1.328.70±1.03165.01±15.27195.25±19.31183.63±17.76组间 F值=292.532 P值<0.001F值=143.970 P值<0.001时点间 F值=185.375 P值<0.001F值=79.796 P值<0.001组间·时点间F值=293.911 P值<0.001F值=121.203 P值<0.001
2.3 3组入院时及术后12 h及48 h血清应激激素指标比较 术后12 h及48 h 3组的血清应激指标均先升高后降低,且C组的血清应激激素指标显著低于A组及B组,B组则显著低于A组,3组组间、时点间、组间·时点间交互作用差异有统计学意义(P<0.05),见表3。
表3 3组入院时及术后12 h及48 h血清应激激素指标比较
Table 3 Comparison of the serum stress hormones at admission and 12 h,48 h after operation ![]()
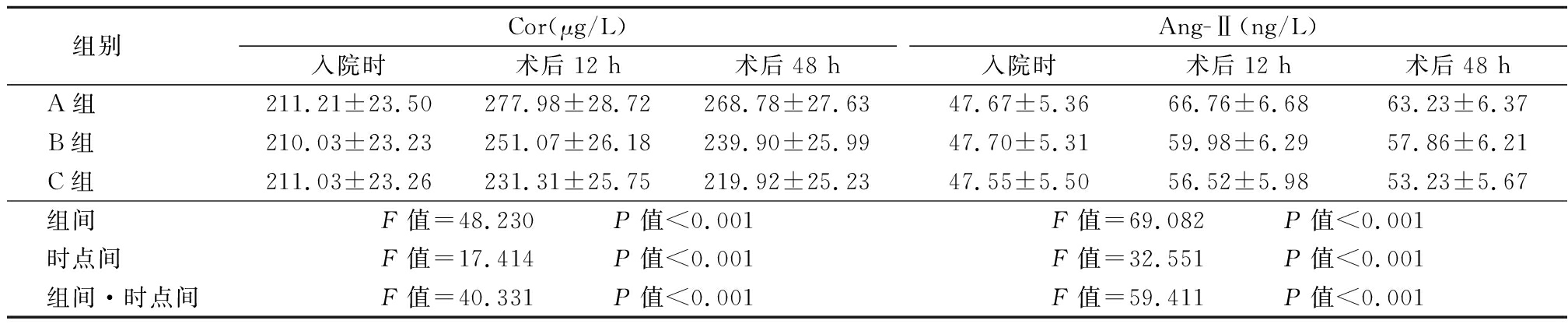
组别 Cor(μg/L)入院时术后12 h术后48 hAng-Ⅱ(ng/L)入院时术后12 h术后48 hA组 211.21±23.50277.98±28.72268.78±27.6347.67±5.3666.76±6.6863.23±6.37B组 210.03±23.23251.07±26.18239.90±25.9947.70±5.3159.98±6.2957.86±6.21C组 211.03±23.26231.31±25.75219.92±25.2347.55±5.5056.52±5.9853.23±5.67组间 F值=48.230 P值<0.001F值=69.082 P值<0.001时点间 F值=17.414 P值<0.001F值=32.551 P值<0.001组间·时点间F值=40.331 P值<0.001F值=59.411 P值<0.001
2.4 3组入院时及术后12 h及48 h血清氧化应激指标比较 入院时、术后12 h及48 h 3组的血清氧化应激指标均先降后升,且C组的血清氧化应激指标显著高于A组及B组,B组则显著高于A组,3组组间、时点间、组间·时点间交互作用差异有统计学意义(P<0.05),见表4。
表4 3组入院时及术后12 h及48 h血清氧化应激指标比较
Table 4 Comparison of the serum oxidative stress indexes at admission and 12 h,48 h after operation ![]()
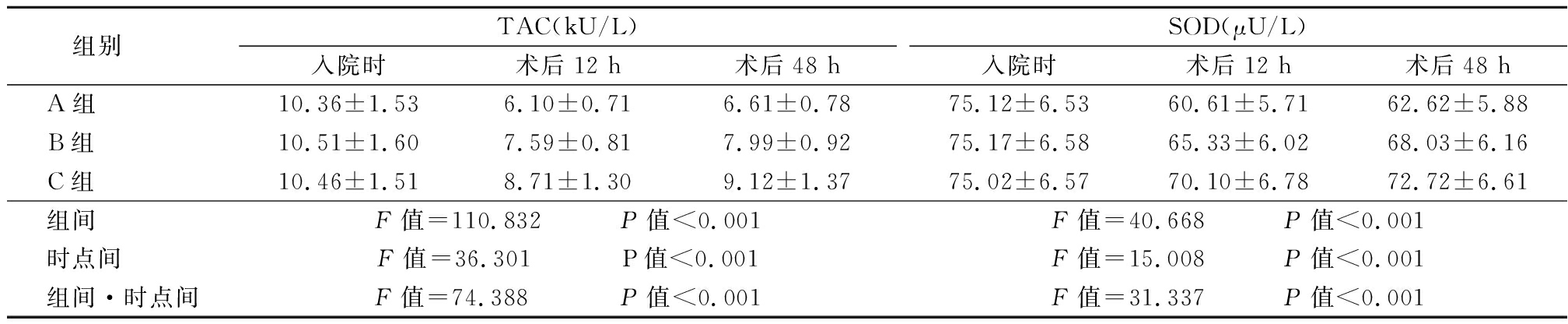
组别 TAC(kU/L)入院时术后12 h术后48 hSOD(μU/L)入院时术后12 h术后48 hA组 10.36±1.536.10±0.716.61±0.7875.12±6.5360.61±5.7162.62±5.88B组 10.51±1.607.59±0.817.99±0.9275.17±6.5865.33±6.0268.03±6.16C组 10.46±1.518.71±1.309.12±1.3775.02±6.5770.10±6.7872.72±6.61组间 F值=110.832 P值<0.001F值=40.668 P值<0.001时点间 F值=36.301 P值<0.001F值=15.008 P值<0.001组间·时点间F值=74.388 P值<0.001F值=31.337 P值<0.001
3 讨 论
骨科患者多存在疼痛突出的情况,且此类不适感贯穿于患者术前及术后较长时间,这对患者的机体及心理均造成显著不良影响,导致其生存质量较差[4-5]。而随着临床对于患者生存质量重视程度的提升,舒适化医疗在骨科中的应用也不断增加,其通过对患者整个就医治疗过程中不适感的控制,达到提升其生存质量的目的。老年骨科患者的疼痛控制是临床研究重点之一,此类患者疼痛感较强的情况下不仅仅影响到生理及心理状态,且对于治疗顺利进行及术后康复效果、康复速度等造成较大不良影响[6-8],因此对于本类老年患者进行舒适化医疗干预的需求相对更高。另外,有研究显示,围术期疼痛感较为强烈时,机体的疼痛介质多呈现显著升高的状态[9-10],而SP及PGE2作为常见的疼痛介质,其在血液中的表达水平相对较高;同时,应激激素及氧化应激状态也受之影响较大,表现为相关指标显著异常的状态,而这与创伤组织的修复等密切相关[11-13],因此对老年骨科手术患者进行舒适化医疗干预的意义较高,患者对疼痛控制的需求也不断提升。
本研究就术后PCIA、“鸡尾酒”局部注射镇痛加PCIA及病房行神经阻滞加术后PCIA对老年骨科患者围手术期疼痛程度及疼痛介质、应激状态的影响进行探究,结果显示,病房行神经阻滞加术后PCIA的应用效果相对更好,表现为术后2 h、4 h、6 h、12 h、24 h及48 h的VAS评分、术后12 h及48 h C组的血清疼痛介质及应激状态指标均相对更低,因此肯定了病房行神经阻滞加术后PCIA在本类老年患者中的综合应用效果。分析原因,术前进行神经阻滞的方式有效保证了患者术前疼痛等不适感的控制,而此类干预呈现延续进行,因此对患者的疼痛干预呈现持续及连续性,而术后加用PCIA强化了镇痛效果,其相对于术后进行镇痛的患者具有更为突出的优势,可能与之术前即进行干预对于疼痛介质等指标的前期表达控制更好有关[14-16],因此相关的机体应激得到有效控制,表现为应激激素及氧化应激指标表达的有效调控[17-20]。综上所述,病房行神经阻滞加术后PCIA可显著控制老年骨科患者围手术期疼痛程度,且对疼痛介质及应激状态的影响相对更好,因此在老年骨科手术患者中的应用价值更高。
[1] 孙振和,刘丹,刘罡.术前股神经阻滞对全身麻醉下全膝关节置换术老年患者的超前镇痛效果观察[J].山西医药杂志,2018,47(1):63-65.
[2] 林荣彬,王劲松,张俊鑫.胸腔镜术前10分钟行肋间神经阻滞联合静脉自控镇痛的可行性[J].中国医药科学,2019,9(10):122-124.
[3] 刘岗,闫博,许立新.术前股神经阻滞对老年髋部骨折病人术后急性疼痛和阿片类药物使用的影响[J].实用老年医学,2018,32(5):458-461.
[4] 刘楠,尹毅青.老年髋部骨折患者的术前神经阻滞镇痛进展[J].中日友好医院学报,2017,31(6):372-374.
[5] 杨曙光,陶红,陈超,等.超声引导髋关节囊周围神经阻滞在老年髋部骨折病人术前镇痛中的应用[J].骨科,2020,11(2):140-142.
[6] Thema N,Mitchell M,Charles G,et al. Multimodal pain management protocol versus patient controlled narcotic analgesia for postoperative pain control after shoulder arthroplasty[J]. Arch Bone Jt Surg,2018,6(3):196-202.
[7] 刘远辉,邱柳基,林晓峰,等.股神经联合坐骨神经阻滞与自控静脉镇痛用于膝关节置换的效果观察[J].河北医科大学学报,2020,41(1):85-88,93.
[8] 周晶,崔金花,张乙,等.不同浓度罗哌卡因肋间神经阻滞联合PCIA对胸腔镜手术患者术后镇痛效果的影响分析[J].中国实用医药,2020,15(4):102-103.
[9] 容青霖,刘丰尧,卓娟如.氟比洛芬酯联合隐神经阻滞的超前镇痛在下肢骨折手术中应用研究[J].中国处方药,2019,17(6):73-74.
[10] 陈晓芳,梅静,赵莉,等.不同镇痛方法对老年膝关节置换术患者术后疼痛和功能恢复的影响[J].中国老年学杂志,2020,40(6):1224-1227.
[11] Eduardo N,Lauryn K,Patrick MC,et al. Local infiltration analgesia compared with epidural and intravenous pca after surgical hip dislocation for the treatment of femoroacetabular impingement in adolescents[J]. J Pediatr Orthop,2018,38(1):9-15.
[12] 李勇,黄天丰,高巨,等.罗哌卡因坐骨神经联合股神经阻滞用于全膝关节置换患者术后镇痛的效果[J].江苏医药,2019,45(9):880-882.
[13] 张晶晶,李侃,杨青.用小剂量不同浓度的罗哌卡因对行上肢手术的患者实施臂丛神经阻滞麻醉的效果对比[J].当代医药论丛,2019,17(4):72-73.
[14] 邱柳基,陈裕强,徐瑶,等.超声引导胸椎旁神经阻滞对自控静脉镇痛质量的影响[J].中国当代医药,2019,26(22):8-14.
[15] Fanglun Z,Yingxun D,Weichun H,et al. The efficacy and safety of early initiation of preoperative analgesia with celecoxib in patients underwent arthroscopic knee surgery:a randomized, controlled study[J]. Medicine(Baltimore),2017,96(42):8234.
[16] Ilfeld BM,Ball ST,Gabriel RA,et al. A feasibility study of percutaneous peripheral nerve stimulation for the treatment of postoperative pain following total knee arthroplasty[J]. Neuromodulation,2019,22(5):653-660.
[17] 王嘉争,肖继,王德明,等.罗哌卡因复合舒芬太尼连续股神经阻滞在全膝关节置换术后镇痛中的应用研究[J].交通医学,2019,33(5):498-500.
[18] 车志新,何丽兴,何文峰,等.探讨布托啡诺对上肢骨科手术超前镇痛肌间沟臂丛神经阻滞麻醉效果[J].中国现代药物应用,2019,13(11):142-144.
[19] 吕培军,张立敬.超前镇痛结合肌间沟神经阻滞用于肩关节镜术后镇痛中的效果分析[J].浙江创伤外科,2018,23(3):612-614.
[20] 王惠娟,王蓉,丁晓梅,等.股神经阻滞超前镇痛复合腰麻在下肢骨折手术中的临床应用效果[J].宁夏医学杂志,2019,41(9):831-833.